Синдром Бурхаве: клиническое наблюдение и обзор литературы
Автор: Андрейченко С.А., Бычинин М.В., Клыпа Т.В., Иванов Ю.В., Сазонов Д.В., Дыминов Р.М., Шабловский О.Р.
Журнал: Клиническая практика @clinpractice
Рубрика: Обзоры
Статья в выпуске: 1 т.9, 2018 года.
Бесплатный доступ
Своевременная диагностика спонтанного нетравматического разрыва пищевода, или синдрома Бурхаве, представляет большие трудности из-за его редкости и разнообразия клинических проявлений. Разрывы пищевода могут симулировать различную патологию со стороны других органов [2], что наиболее часто требует дифференциальной диагностики с перфоративной язвой желудка, инфарктом миокарда, эмболией легочной артерии, расслаивающей аневризмой аорты и острым панкреатитом [16, 17]. Лечение, включающее в себя варианты как консервативной, так и хирургической тактики, сопровождается высокой летальностью (до 35%) [7] и во многом определяется временем, прошедшим с момента разрыва пищевода. Помимо обзора, приводится описание опыта успешного лечения пациента с синдромом Бурхаве в свете обобщенных на сегодняшний день данных мировой медицинской литературы по этой проблеме.
Разрыв пищевода, синдром бурхаве
Короткий адрес: https://sciup.org/143166532
IDR: 143166532 | DOI: 10.17816/clinpract09163-70
Текст научной статьи Синдром Бурхаве: клиническое наблюдение и обзор литературы
Cпонтанный нетравматический разрыв пищевода был впервые описан как комплекс симптомов в 1724 г. голландским врачом H.Boerhaave и в последующем назван его именем. Синдром Бурхаве (СБ) является формой барогенного повреждения пищевода, вызванного быстрым повышением внутрипросветного давления в его дистальном отделе [1-3]. Этот синдром следует отличать от ятрогенной перфорации, которая составляет 85-90% всех случаев разрывов пищевода [11-13].
Классическим клиническим проявлением СБ является триада Маклера: рвота, подкожная эмфизема и боль в нижней части грудной клетки [15]. Тем не менее, ранняя диагностика часто вызывает у клиницистов затруднения, в связи с универсальностью клинических проявлений и необходимостью проведения дифференциальной диагностики [16,17].
Рентгенологические исследования на сегодняшний день широко используютcя для ранней диагностики разрыва пищевода. При рентгенографии и компьютерной томографии (КТ) грудной клетки у ряда пациентов могут выявляться левосторонний гидроторакс, пневмомедиасти-нум или пневмоторакс [18-23]. Однако использование эзофагографии с введением контрастного препарата перорально является наиболее достоверным методом диагностики [19, 24, 25]. По мнению ряда авторов, использование барийсодержащего контраста за счет его большей плотности и медленного пассажа по пищеводу предпочтительнее, чем исследование с водорастворимым контрастом [14, 15, 25]. Фиброэзофаго-гастродуоденоскопия (ФЭГДС) также является ценной диагностической методикой, позволяющей непосредственно визуализировать местоположение и размеры перфорации, но должна выполняться с осторожностью, поскольку может потенциально усугубить разрыв пищевода, увеличив размеры дефекта его стенки [19, 26].
В качестве примера, демонстрирующего сложность своевременной диагностики СБ приводим собственное клиническое наблюдение.
Клиническое наблюдение
Больной Р., 64 лет, был госпитализирован в отделение хирургии 12.09.2017 г. в экстренном порядке с жалобами на боли в верхних отделах живота, многократную тошноту и рвоту. Из анамнеза известно, что пациент длительно злоупотребляет алкоголем. Заболел накануне вече- ром, остро, когда после погрешности в диете и приема алкоголя появились тошнота и многократная рвота, затем возникли выраженные боли в животе. За медицинской помощью не обращался. Через 12 часов тошнота и рвота частично регрессировали, однако, боли в животе сохранялись, в связи с чем вызвал бригаду скорой помощи. Был доставлен в приемное отделение ФГБУ ФНКЦ ФМБА России с направительным диагнозом: «Панкреатит, панкреоне-кроз. Гипертонический криз».
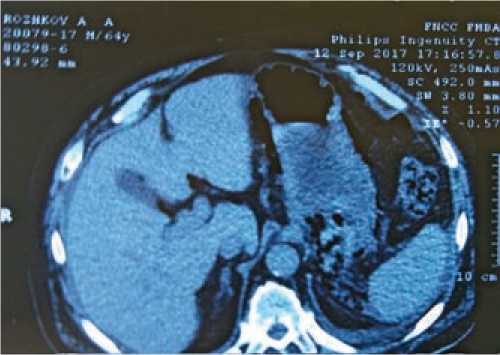
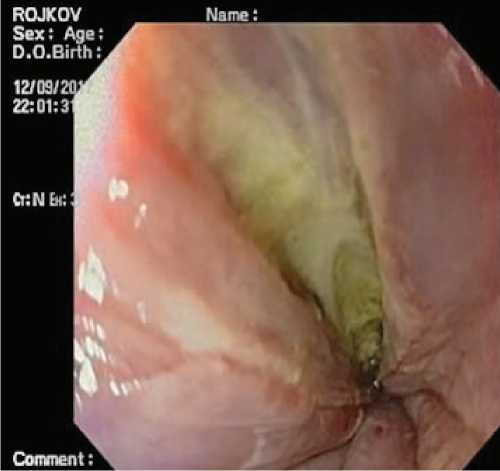
Выполнена верхне-срединная лапаротомия, при повторной тщательной ревизии органов брюшной полости и забрюшинного пространства патологии также не выявлено. Принято решение о выполнении интраоперационной ФЭГДС, во время которой обнаружен дефект слизистой пищевода в нижней трети протяженностью 10 см, с полным разрывом стенки до 2 см (рис. 2).
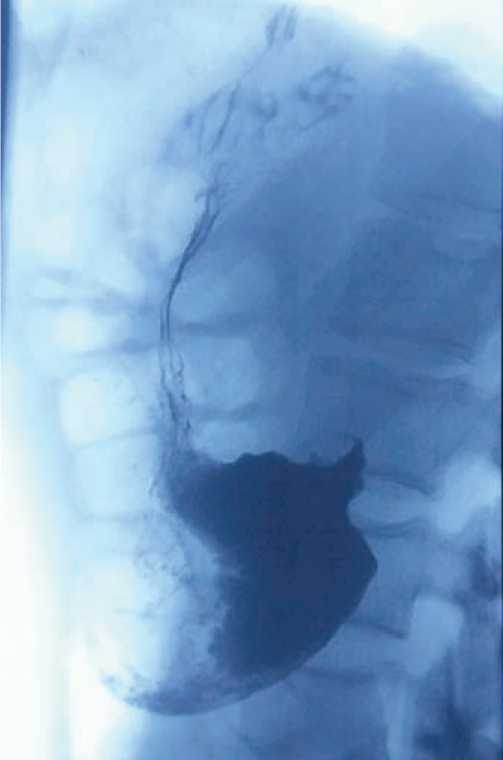
Рис. 2. Эндофото пациента Р. Эндоскопическая картина разрыва переднебоковой стенки нижней трети пищевода слева.
ния гастростомы было решено воздержаться, для декомпрессии и энтерального питания был установлен назогастральный зонд. Брюшная стенка ушита послойно, наглухо отдельными узловыми швами.
С первых суток поступления больного в стационар проводилась эмпирическая антимикробная терапия цефазолином и метронидазолом. Учитывая диагностированный СБ, интраоперационно препараты заменены на имипенем/циластатин. Пациенту проводилась инфузионная терапия, антисекретор-ная терапия ингибиторами протонной помпы, парентеральное питание. В течение первых суток послеоперационного периода у пациента отмечался гастропарез, разрешившийся на 3-и сутки в результате терапии прокинетиками. На 3 сутки после операции у больного отмечена стойкая фебрильная лихорадка, повышение уровней воспалительных маркеров, нарастание лейкоцитоза. Учитывая результаты бактериологического исследования (рост S. aureus в образце отделяемого из брюшной полости), было принято решение добавить к проводимой терапии линезолид. С 4-х суток после операции было начато энтеральное питание через назогастральный зонд. Комбинированная антимикробная терапия продолжалась в течение недели до нормализации уровней лейкоцитов и воспалительных маркеров, после чего пациент был переведен из отделения реанима-
Через 2 недели послеоперационного периода вакуумная аспирация из средостения прекращена, дренажи удалены, сняты швы с кожной раны. На 19 сутки после операции пациент выписан из стационара в стабильном удовлетворительном состоянии с рекомендациями амбулаторного наблюдения хирургом по месту жительства и контрольной ФЭГДС через 1 месяц.
Обсуждение
Диагностика CБ в большинстве наблюдений представляет определенную сложность, так как проявляется универсальными для многих заболеваний симптомами у более чем трети пациентов [27]. Время, прошедшее от начала заболевания, условно позволяет разделить диагностику СБ на раннюю (до 24 часов от появления клинических симптомов) и позднюю (более 24 часов), и во многом определяет последующую лечебную тактику и исход [35].
Условно в лечении СБ выделяют 3 основных подхода: консервативный, эндоскопический и хирургический [7, 52]. Хирургическое лечение в настоящее время считается «золотым стандартом» при разрывах пищевода, диагностированных в течение 24 часов от появления клинических симптомов, и позволяет добиться полного выздоровления в 75% случаев [37, 38]. Это связано с тем, что разрыв возникает в области здоровых тканей с хорошим кровоснабжением, способствующим быстрому заживлению после операции и низкой частоте инфекционных осложнений [36]. Хирургический подход включает в себя дренирование плевральной полости и ушивание перфорированного участка пищевода через открытый торакотомический или лапаротомический доступ [24, 28]. В литературе имеются данные о том, что при поздней диагностике СБ необходимо резецировать перфорированный участок пищевода [7, 39, 41]. Однако, результаты мета-анализа 18 исследований, включавших 227 пациентов с поздней диагностикой СБ, не продемонстрировали статистически значимых различий в инфекционных осложнениях и выживаемости между группами пациентов с резекцией пищевода и его ушиванием [40].
Терапевтические методы лечения СБ, заключающиеся в полном прекращении перорального питания с переходом на полное парентеральное питание, введение антибиотиков широкого спектра действия и ингибиторов протонной помпы, также могут приводить к полному выздоровлению пациентов [28]. Чаще всего консервативное лечение используется в случаях поздней диагностики, при небольших разрывах пищевода без признаков инфекционных осложнений. По мнению Ш.В. Тимербулатова [29] ограничиться консервативными методами лечения без хирургического вмешательства возможно, когда дефект стенки пищевода не превышает 0,5 см, контрастное вещество затекает за его контур не более чем на 2 см и отсутствуют признаки медиастинита. Тем не менее, примерно 20% пациентов, подвергшихся консервативному лечению, в последующем требуется хирургическое лечение [30-33].
За последние два десятилетия появились данные об успешном эндоскопическом лечении пациентов с СБ. Основой данного метода лечения является использование стентов в качестве протезов, которые ранее применялись для восстановления проходимости просвета при стриктурах пищевода [7, 39, 42]. По мнению ряда авторов, данная методика связана с высокой частотой периоперационных осложнений и высокой смертностью [43-45]. Несмотря на то, что эндоскопическое стентирование пищевода является малоинвазивной процедурой, оно не связано с уменьшением частоты повторных хирургических вмешательств [36].
У больных с небольшими дефектами пищевода и без инфекционных осложнений описаны случаи использования эндоскопических клипс [46]. Малый опыт применения данной методики на сегодняшний день делают невозможным оценку ее эффективности, безопасности и широкое внедрение.
Появление в последние годы новых эндоскопических методик лечения СБ представляет для клиницистов большой интерес. Так, например, эндоскопическая вакуумная терапия (ЭВТ), изначально применяемая при лечении параректальных абсцессов после операций на прямой кишке, стала успешно использоваться во всем мире при несостоятельности анастомозов верхних отделов пищеварительного тракта.
Методика ЭВТ заключается во внутрипросветной установке в пищевод вакуумной аспирационной системы со специальной пористой губкой на конце и создании локального разрежения давления. Отрицательное давление в раневом покрытии позволяет удалять раневой секрет, устранять отек тканей, способствует притоку крови, формированию грануляций и заживлению раны [48]. Впервые данную методику у пациентов с СБ применил Loske G. [49] еще в 2010 году. Малоинвазивность, относительная техническая простота, а также эффективность ЭВТ при разрывах пищевода подтверждаются рядом исследований [50, 51], что делает ее выгодной альтернативой уже имеющимся методам лечения.
По данным исследования Tellechea JI. [47], клиническая эффективность различных эндоскопических методик лечения СБ достигает 85%, а выживаемость при их комбинациях с хирургическими методами лечения приближается к 100%.
В литературе описан случай успешного закрытия пищеводно-плеврального свища при СБ с помощью зонда Блэкмора без последующего ушивания дефекта стенки пищевода, однако, такие случаи являются скорее казуистическими [34].
В представленном нами клиническом наблюдении использование КТ органов брюшной полости и забрюшинного пространства с контрастированием позволило заподозрить СБ и избежать возможных осложнений при ФЭГДС как первичной диагностической процедуре.
Несмотря на время, прошедшее от появления у пациента клинических симптомов, хирургическое вмешательство в объеме ушивания дефекта пищевода и неполной фундопликацией с последующим адекватным дренированием и длительной вакуумной аспирацией из средостения в нашем наблюдении оказалось достаточным и эффективным. Потребности в повторных операциях и санациях не было. Использование антибиотиков широкого спектра действия с самого начала диагностики СБ, позволило избежать инфекционных осложнений в послеоперационном периоде. Раннее возобновление энтерального питания в данной ситуации, вероятно, также послужило основой нормализации пассажа по ЖКТ, естественной микрофлоры и быстрому восстановлению трофики тканей в области ушитого дефекта пищевода.
Заключение
Ранняя диагностика и лечение СБ является сложной клинической задачей, поиск решения которой должен осуществляться мульти-дисциплинарной командой (хирург, рентгенолог, эндоскопист, анестезиолог-реаниматолог, физиотерапевт). Специалистам, занимаю- щимся этой проблемой, необходимы совместные усилия для проведения многоцентровых, рандомизированных исследований и разработки клинических рекомендаций, что позволит систематизировать накопленный опыт и улучшить результаты лечения пациентов с данной патологией.
Список литературы Синдром Бурхаве: клиническое наблюдение и обзор литературы
- Singh G.S., Slovis C.M.: ‘Occult’ Boerhaave’s syndrome. J Emerg Med 1988; 6: 13-16.
- Bjerke H.S.: Boerhaave’s syndrome and barogenic injuries of the oesophagus. Chest Surg Clin N Am 1994; 4: 819-825.
- Younes Z., Johnson D.A.: The spectrum of spontaneous and iatrogenic esophageal injury. J Clin Gastroenterol 1999; 29: 306-317.
- Callaghan J.: The Boerhaave syndrome. Br J Surg 1972; 59: 41-50.
- Мирошников Б.И., Лабазанов М.М., Ананьев Н.В., и др. Спонтанный разрыв пищевода (рус.)//Вестник хирургии имени И. И. Грекова. -СПб.: Эскулап, 1998. -Т. 157, № 2. -С. 74-75.
- Ионис Е.Ю., Плечев В.В., Авзалетдинов А.М., и др. Спонтанный разрыв пищевода. Синдром Бурхавэ. Хирургическое лечение//Сборник тезисов V Международного конгресса «Актуальные направления современной кардио-торакальной хирургии». -СПб.: Ассоциация торакальных хирургов России, 2015. -С. 203-204. -224 с. -300 экз.
- De Schipper J.P., Pull ter Gunne A.F., Oostvogel H.J., van Laarhoven C.J. Spontaneous rupture of the oesophagus: Boerhaave's syndrome in 2008. Literature review and treatment algorithm. Dig Surg. 2009. 26(1): 1-6.
- Кочуков В.П. Спонтанный разрыв пищевода (синдром Бурхаве)//Хирургия. Журнал им. Н.И. Пирогова. -М.: Медиа Сфера, 2012. -№ 7. -С. 83-84.
- Юрасов С.Е. Спонтанный разрыв абдоминального отдела пищевода//Хирургия. Журнал им. Н.И. Пирогова. -М.: Медиа Сфера, 1999. -№ 4. -С. 58.
- Kim B.S.M., Li B.T., Engel A., et al. Diagnosis of gastrointestinal bleeding: A practical guide for clinicians. World Journal of Gastrointestinal Pathophysiology. 2014; 5(4): 467-478 DOI: 10.4291/wjgp.v5.i4.467
- Vidarsdottir H., Blondal S., Alfredsson H., et al. Oesophageal perforations in Iceland: a whole population study on incidence, aetiology and surgical outcome. Thorac Cardiovasc Surg. 2010; 58: 476-480 DOI: 10.1055/s-0030-1250347
- Vallbohmer D., Holscher A.H., Holscher M., et al. Options in the management of esophageal perforation: analysis over a 12-year period. Dis Esophagus. 2010; 23: 185-190 DOI: 10.1111/j.1442-2050.2009.01017.x
- Gander J.W., Berdon W.E., Cowles R.A. Iatrogenic esophageal perforation in children. Pediatr Surg Int. 2009; 25: 395-401 DOI: 10.1007/s00383-009-2362-6
- Buecker A., Wein B.B., Neuerburg J.M., Guenther R.W. Esophageal perforation: Comparison of use of aqueous and barium-containing contrast media. Radiology. 1997; 202: 683-6.
- Yagnik V.D. Boerhaave’s syndrome: Spontaneous full thickness esophageal perforation. Lung India: Official Organ of Indian Chest Society. 2012; 29(2): 197 DOI: 10.4103/0970-2113.95350
- Symbas P.N., Hatcher C.R., Harlaftis N.: Spontaneous rupture of the oesophagus. Ann Surg 1978; 187: 634-639.
- Curcij J.J., Horman M.J.: Boerhaave’s syndrome: the importance of early diagnosis and treatment. Ann Surg 1976; 183: 401-408.
- De Lutio Di Castelguidone E., Pinto A., Merola S., et al: Role of spiral and multislice computed tomography in the evaluation of traumatic and spontaneous oesophageal perforation. Our experience Radiol Med (Torino) 2005; 109: 252-259.
- Tamatey M.N., Sereboe L., Tettey M., et al. Boerhaave’s Syndrome: Diagnosis and Successful Primary Repair One Month After the Oesophageal Perforation. Ghana Medical Journal. 2013; 47(1): 53-55.
- Ghanem N., Altehoefer C., Springer O., et al. Radiological findings in Boerhaave's syndrome. Emerg Radiol. 2003; 10: 8-13.
- Soreide J.A., Viste A. Esophageal perforation: Diagnostic work-up and clinical decision-making in the first 24 hours. Scand J Trauma Resusc Emerg Med. 2011; 19: 66.
- Giménez A., Franquet T., Erasmus J.J., et al. Thoracic complications of esophageal disorders. Radiographics. 2002; 22: S247-58. Spec No.
- Young C.A., Menias C.O., Bhalla S., Prasad S.R. CT features of esophageal emergencies. Radiographics. 2008; 28: 1541-53.
- Tonolini M., Bianco R. Spontaneous esophageal perforation (Boerhaave syndrome): Diagnosis with CT-esophagography. Journal of Emergencies, Trauma, and Shock. 2013; 6(1): 58-60 DOI: 10.4103/0974-2700.106329
- Vial C.M., Whyte R.I. Boerhaave's Syndrome: Diagnosis and Treatment, In Surgical Clinics of North America, Volume 85, Issue 3, 2005, Pages 515-524, ISSN 0039-6109.
- Spapen J., De Regt J., Nieboer K., et al. "Boerhaave's Syndrome: Still a Diagnostic and Therapeutic Challenge in the 21st Century," Case Reports in Critical Care, vol. 2013, Article ID 161286, 4 pages, 2013 DOI: 10.1155/2013/161286
- Wise M.P., Salmon J.B., Maynard N.D. Boerhaave syndrome: a diagnostic conundrum. BMJ Case Rep. 2009 DOI: 10.1136/bcr.07.2008.0375
- Misiak P., Jablonski S., Piskorz L., et al.: Oesophageal perforation -therapeutic and diagnostics challenge. Retrospective, single-center case report analysis (2009-2015). Pol Przegl Chir; 2017 Aug 31; 89(4): 1-4.
- Тимербулатов Ш.В., Тимербулатов В.М. Спонтанный разрыв пищевода (синдром Бурхаве)//Эндоскопическая хирургия: статья в журнале -научная статья. -М.: Медиа Сфера, 2009. -№ 6. -С. 48-50.
- Misiak P., Gal^zkowski R., Jablonski S., et al.: Esophageal perforation due to blunt trauma-how to diagnose and how to treat. Emerg. Med. Serv. 2016; 1: 52-53.
- Delos Reyes A.P., Clancy C., Lach J., et al.: Conservative management of esophageal perforation after a fall. Int. J. Surg. Case Rep. 2013; 4: 550-553.
- Lindenmann J., Matzi V., Neuboeck N., et al.: Management of esophageal perforation in 120 consecutive patients: clinical impact of a structured treatment algorithm. J. Gastrointest. Surg. 2013; 17: 1036-1043.
- Kiss J.: Surgical treatment of oesophageal perforation. Br. J. Surg. 2008; 7: 805-806.
- Абрамзон О.М., Мухамадеев М.Б., Скоробогатых Ю.И., Хотян А.Р. Случай успешного закрытия пищеводно-плеврального свища при синдроме Бурхаве с помощью зонда Блэкмора (рус.)//Грудная и сердечно-сосудистая хирургия: статья в журнале -краткое сообщение. -М.: Медицина, 2010. -№ 1. -С. 68.
- Rokicki, M., Rokicki W., Rydel M. (2017). Boerhaave’s Syndrome -Over 290 Yrs of Surgical Experiences. Surgical, Endoscopic and Conservative Treatment. Polish Journal of Surgery, 88(6), pp. 365 -372.
- Ali J.T., Rice R.D., David E.A., et al.: Perforated esophageal intervention focus (PERF) study: a multicenter examination of contemporary treatment, Diseases of the Esophagus, Volume 30, Issue 11, 1 November 2017, Pages 1-8.
- Wang Y., Zhang R., Zhou Y. et al.: Our experience on management of Boerhaave’s syndrome with late presentation. Dis Esophagus 2009; 22: 62 67.
- Khan A.Z., Strauss D., Mason R.C.: Boerhaave’s syndrome: diagnosis and surgical management. Surgeon 2007; 5: 39 44.
- Marinis A., Rizos S.: Boerhaave’s syndrome or spontaneous perforation of the oesophagus. Hellenic J Surg 2011: 83(5): 258 61.
- Kollmar O., Lindermann W., Richter S. et al.: Boerhaave’s syndrome: Primary repair vs resection case reports and meta-analysis of the literature. J Gastyroenterol Surg 2003; 7: 726 34.
- Tsalis K., Vasiliadis K., Tsachalis T. et al.: Management of Boerhaave’s syndrome: report of three causes. J Gastrointestin Liver Dis 2008; 17(1): 8185.
- Haddad R., Lime R.T., Boesquevisque C.H. et al.: Symptomatic mucocele after esophageal exclusion. Thoracic Surg 2008; 7: 74244.
- Griffin S.M., Lamb P.J., Shenfine J. et al.: Spontaneous rupture of the oesophagus. Br J Surg 2008; 95: 11151120.
- Salo J.A., Isolauri J.D., Heikkila L.J.: Management of delayed esophageal perforation with mediastinal sepsis. Esophagectomy or primary repair? J Thorac Cardiovasc Surg 1993; 6: 76467.
- Dasari B.V., Neely D., Kennedy A. et al.: The role of esophageal stents in the management of esophageal anastomotic leaks and benign esophageal perforations. Ann Surg 2014 May; 259(5): 85260.
- Parupadi F.J., Guduru R., Nageshwar D.: Successful closure of spontaneous esophageal perforation (Boerhaave’s syndrome) by endoscopic clipping. Indian J Gastroenterol 2006; 25: 3941.
- Tellechea J.I., Gonzalez J.M., Miranda-Garcia P., et al.: Role of Endoscopy in the Management of Boerhaave Syndrome. Clin Endosc. 2017 Sep 20 DOI: 10.5946/ce.2017.043
- Хатьков И.Е., Шишин К.В., Недолужко И.Ю., и др.: Эндоскопическая вакуумная терапия в лечении несостоятельности анастомозов верхних отделов пищеварительного тракта. Первый опыт и обзор литературы//Раны и раневые инфекции. Журнал имени профессора Б.М. Костюченка., -2016., -№ 3., -С. 32-41.
- Loske G., Schorsch T., Müller C. Endoscopic intracavitary vacuum therapy of Boerhaave's syndrome: a case report. Endoscopy 2010; 42(S02): 144 -145.
- Loske G., Schorsch T., van Ackeren V., et al. Endoscopic vacuum therapy in Boerhaave's syndrome with open-pore polyurethane foam and a new open-pore film drainage. Endoscopy 2015; 47(S01): 410 -411.
- Laukoetter M.G., Mennigen R., Neumann P.A., et al. Successful closure of defects in the upper gastrointestinal tract by endoscopic vacuum therapy (EVT): a prospective cohort study. Surg Endosc. 2016; DOI: 10.1007/s00464-016-5265-3
- Teh E., Edwards J., Duffy J., Beggs D. Boerhaave's syndrome: a review of management and outcome, Interactive CardioVascular and Thoracic Surgery, Volume 6, Issue 5, 1 October 2007, Pages 640-643.


