Синдром хронической абдоминальной ишемии в практике общего хирурга
Автор: Иванов Юрий Викторович, Чупин Андрей Валерьевич, Сазонов Дмитрий Валерьевич, Лебедев Дмитрий Петрович
Журнал: Клиническая практика @clinpractice
Рубрика: Мнение эксперта
Статья в выпуске: 2 (18), 2014 года.
Бесплатный доступ
Одной из возможных причин стойкого болевого абдоминального синдрома является хроническая ишемия кишечника, обусловленная той или иной степенью окклюзии мезентериальных сосудов. В связи с многообразием клинических проявлений, маловыраженной их специфичностью и недостаточной осведомленностью врачей общего профиля своевременная диагностика синдрома хронической абдоминальной ишемии (СХАИ) затруднена. Основными методами диагностики на современном этапе являются: ультразвуковое дуплексное сканирование, спиральная компьютерная томография, магниторезонансная томография в режиме непрямой ангиографии и прямая ангиография. Методом выбора хирургического лечения остается чрескожная транслюминальная ангиопластика и стентирование артерий.
Болевой синдром, окклюзия артерий, ангиография
Короткий адрес: https://sciup.org/14338490
IDR: 14338490
Текст научной статьи Синдром хронической абдоминальной ишемии в практике общего хирурга
Введение. Синдром хронической абдоминальной ишемии (СХАИ) – это заболевание, для которого характерны ишемические расстройства кровообращения органов брюшной полости, вызванные нарушениями проходимости висцеральных артерий вследствие экстра- или интравазальных причин. В общей клинической практике СХАИ диагностируется редко в связи с многообразием клинических проявлений, маловыраженной их специфичностью и недостаточной осведомленностью врачей общего профиля об этом забо- левании. В частности, в терапевтических и гастроэнтерологических стационарах этот диагноз фигурирует лишь у 3,2 % больных [1, 2, 3]. В то же время, по данным вскрытий, патологию непарных висцеральных артерий находят у 19-70% умерших [4]. При аутопсии умерших от атеросклеротического поражения других сосудистых бассейнов (ишемической болезни сердца, церебрального и облитерирующего атеросклероза) поражение брюшного отдела аорты и ее ветвей обнаруживают в 75,5% случаев [5, 6].
Историческая справка. Первое упоминание о поражении непарных висцеральных ветвей брюшной аорты относится к 1834 г., когда немецкий патологоанатом F. Tiedemann на вскрытии обнаружил окклюзию ствола верхней брыжеечной артерии, которая не явилась причиной смерти больного [7]. В начале прошлого столетия появились сообщения, связывающие боли в животе и диспептические расстройства с поражением непарных ветвей брюшной аорты. В 1904 г. G. Bacelli впервые ввел термин angina abdominalis («брюшная ангина»), получивший в дальнейшем большое распространение [8]. Предположение о том, что боли в животе могут быть связаны с поражением мезентериальных артерий и возможна их хирургическая коррекция, впервые высказал E. Klein в 1921 г. [9]. Поворотным этапом в изучении этого заболевания явилось внедрение в клиническую практику метода ангиографии. В 1958 г. W.P. Mikkelsen и J.A. Zaro с помощью ангиографии установили дооперационный диагноз стеноза верхней брыжеечной артерии [10]. Первая реконструктивная операция – трансартериальная тромбэндартерэктомия выполнена R.S. Shaw в 1958 г. [11]. В СССР первая успешная операция на непарных висцеральных ветвях была выполнена в 1962 г. А.В. Покровским [5]. Первое сообщение о применении чрескожной транслюминальной ангиопластики при СХАИ опубликовано J. Furrer, A. Gruntzig и соавт. в 1980 г. [8].
Краткая анатомия и патофизиология висцерального кровообращения . Чревный ствол отходит от аорты на уровне ХII грудного позвонка в области аортального отверстия диафрагмы и делится на 3 ветви: левую желудочную, общую печеночную и селезеночную.
Общая печеночная артерия направляется к воротам печени, где делится на правую и левую ветви. От общей печеночной артерии отходит вниз позади двенадцатиперстной кишки желудочно-двенадцатиперстная артерия, которая делится на две ветви: правую желудочно-сальниковую и верхнюю поджелудочно-двенадцатиперстную.
Верхняя брыжеечная артерия отходит от аорты тотчас ниже чревного ствола, проходит между нижним краем поджелудочной железы и горизонтальной частью двенадцатиперстной кишки, входит в брыжейку тонкой кишки и спускается к правой подвздошной ямке. От нее отходит ряд ветвей. Первая из них – нижняя поджелудочно-двенадцатиперстная артерия направляется вверх позади головки поджелудочной железы до соединения с верхней поджелудочно-двенадцатиперстной артерией. Обе кровоснабжают головку поджелудочной железы и являются основным коллатеральным путем между бассейнами чревного ствола и верхней брыжеечной артерии. Влево от верхней брыжеечной артерии отходят 10-16 ветвей к тощей и подвздошной кишке. Разветвляясь и соединяясь друг с другом, они образуют три ряда дуг вдоль тощей кишки и два ряда – вдоль подвздошной кишки. Вправо от верхней брыжеечной артерии отходит ряд более крупных ветвей. Самая нижняя из них – подвздошноободочная артерия, кровоснабжает терминальный отдел подвздошной кишки и слепую кишку с червеобразным отростком.
Правая ободочная артерия направляется позади брюшины к восходящей кишке и делится на две ветви – восходящую и нисходящую. Они формируют дуги, от которых отходят ветви к восходящей ободочной кишке. Нисходящая ветвь правой ободочной артерии соединяется дугами с ободочной ветвью подвздошноободочной артерии. Выше от верхней брыжеечной артерии отходит средняя ободочная артерия. Она вступает в брыжейку поперечно-ободочной кишки и делится на восходящую (левую) и нисходящую (правую) ветви. Эти ветви анастомозируют соответственно с правой и левой ободочными артериями, формируют дуги и кровоснабжают преимущественно поперечноободочную кишку [4].
Нижняя брыжеечная артерия отходит от аорты на уровне нижнего края III поясничного позвонка, идет позади брюшины вниз и влево к
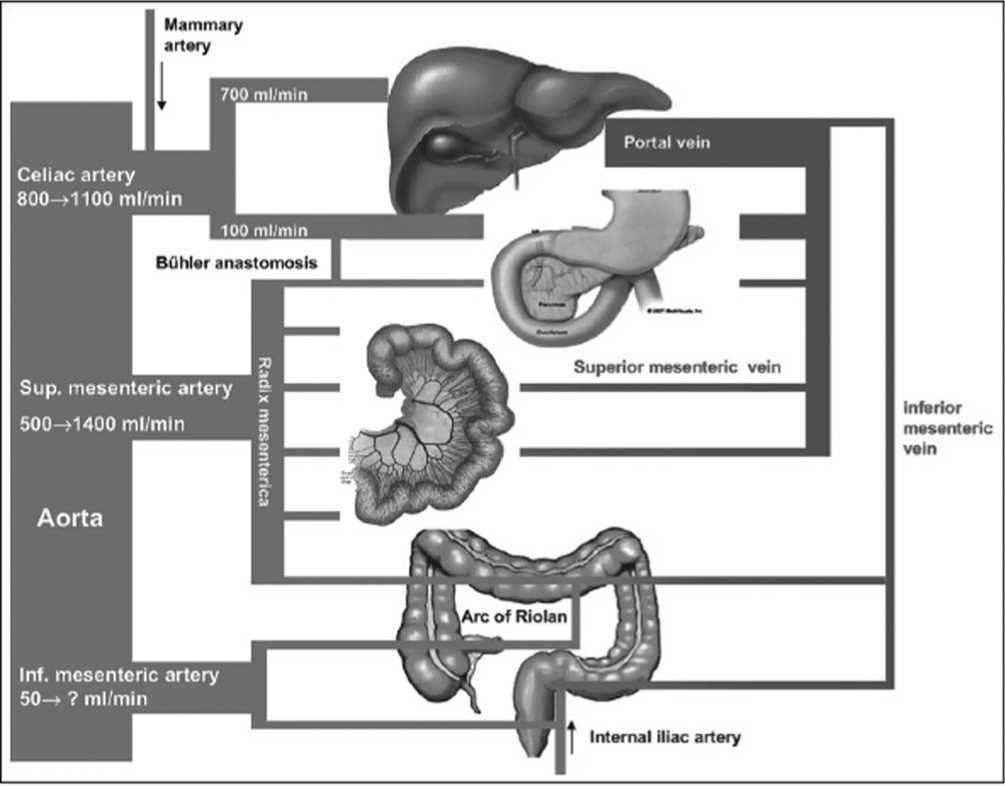
сигмовидной кишке. От нее отходит левая ободочная артерия, которая направляется вверх к левому изгибу и анастомозирует с нисходящей ветвью средней ободочной артерии, формируя дугу Риолана – основной коллатеральный путь между системами верхней и нижней брыжеечных артерий. Вдоль нисходящей ободочной кишки образуется аркада, от которой отходят прямые артерии к кишке. От нижней брыжеечной артерии отходит ряд сигмовидных артерий. Верхняя прямокишечная артерия является прямым продолжением нижней брыжеечной артерии и играет основную роль в кровоснабжении прямой кишки. Она делится на две или три ветви – правую, левую и заднюю. Ветви верхней прямокишечной артерии анастомозируют с ветвями средних прямокишечных артерий из системы внутренних подвздошных артерий [4].
Кровообращение во всех трех висцеральных артериях взаимосвязано и представляет собой как бы единый сосудистый бассейн. При стенозе или окклюзии одной или нескольких артерий меняется направление кровотока по коллатералям. Так, при окклюзии верхней брыжеечной артерии изменяется направление кровотока по поджелудочно-двенадцатиперстным анастомозам и кровь из чревной артерии поступает в систему верхней брыжеечной артерии. При окклюзии чревного ствола компенсация кровотока осуществляется по тем же поджелудочно-двенадцатиперстным анастомозам, но в обратном направлении. При стенозе или окклюзии нижней брыжеечной артерии коллатеральный кровоток осуществляется за счет верхней брыжеечной артерии по дуге Риолана. В случае одновременной окклюзии чревной и верхней брыжеечной артерии компенсация нарушенного кровотока происходит по дуге Риолана из системы нижней брыжеечной артерии в краниальном направлении. Однако компенсация по коллатералям не всегда бывает полноценной. Это зависит от объемной скорости кровотока в висцеральных ветвях, их анатомических особенностей и степени поражения. Пищевая нагрузка требует повышенного объемного кровотока, который коллатерали часто не в состоянии обеспечить [12].
Хроническая окклюзия одной из артерий редко приводит к выраженному нарушению кровоснабжения кишки, однако острая закупорка (эмболия или тромбоз), которая возникает чаще в верхней брыжеечной артерии, сопровождается, как правило, тотальным или сегментарным некрозом кишки [13, 14]. При ишемии в первую очередь страдают слизистый и подслизистый слои желудочно-кишечного тракта (ЖКТ), развивается их дистрофия, что приводит к снижению продукции активных пищеварительных ферментов, возникновению язвенно-некротических изменений, постишемических стенозов [15, 16].
Этиология и классификация хронического нарушения висцерального кровообращения.
СХАИ может быть обусловлен функциональными, органическими и комбинированными причинами. К функциональным причинам относят артериоспазм, гипотензии центрального происхождения, гипогликемию, прием некоторых лекарственных препаратов, полицитемию [15, 17].
Органические причины нарушения висцерального кровообращения многообразны и могут быть врожденного и приобретенного характера. К врожденным факторам относятся аномалии отхождения и положения сосудов, их аплазия или гипоплазия, фиброзно-мышечная дисплазия, врожденные стенозы (коарктация абдоминальной аорты), гемангиомы и артериовенозные свищи. Среди приобретенных факторов наиболее частым является атеросклероз, значительно реже – неспецифический аортоар-териит, облитерирующий тромбангиит, аневризмы висцеральных артерий [18].
В зависимости от локализации патологического процесса различают чревную и брыжеечную формы СХАИ [19]. Чревная форма чаще имеет экстравазальную природу. В силу особенностей анатомического расположения чревный ствол может сдавливаться близлежащими структурами: серповидной связкой и ножками диафрагмы, гипертрофированными ганглиями чревного сплетения и их комиссуральными ветвями, ретроперитонеальным фиброзом, спайками, рубцами и опухолью. Для брыжеечных артерий более характерны эндовазальные поражения. Среди них на первом месте стоит атеросклероз, реже встречаются неспецифический аортоартериит, фиброзно-мышечная дисплазия, аневризмы и облитерирующий тромбангиит. При атеросклерозе процесс локализуется, как правило, в устье артерий; при аортоартериите стеноз более протяженный, располагается в проксимальном отделе артерии и сочетается с поражением брюшной аорты и почечных артерий. Для фиброзно-мышечной дисплазии характерны множественные сужения ствола артерии, при этом участки стеноза чередуются с участками расширения, на ангиограмме артерия имеет вид нитки бус. При облитерирующем тромбангиите в процесс вовлекаются преимущественно периферические отделы артериального русла [12, 15].
Атеросклерозом чаще всего поражается нижняя брыжеечная артерия, но клинически это проявляется редко, т.к. кровоснабжение соответствующих отделов кишечника компенсируется из системы верхней брыжеечной артерии по дуге Риолана. Поскольку атеросклероз и неспецифический аортоартериит являются системными заболеваниями, часто наблюдаются множественные поражения висцеральных ветвей. При этом атеросклероз непарных висцеральных ветвей часто сочетается с атеросклерозом других сосудистых бассейнов, в частности – с поражением аорты и артерий нижних конечностей [20].
Единой принятой классификации синдрома хронической абдоминальной ишемии не существует. Зарубежом обычно разделяют хроническую абдоминальную ишемию на неокклюзивную (синдром обкрадывания) и окклюзивную (одно- и многососудистую, а также синдром внешней окклюзии чревного ствола) [18, 21, 22].
Клиническая картина заболевания
Клиническая картина хронической абдоминальной ишемии отличается большим разнообразием и мало выраженной специфичностью. Эти больные годами ходят к врачам различных специальностей, им проводят многочисленные исследования, диагностируют различные заболевания, которые, возможно, у них есть, но носят вторичный характер. Назначенное лечение не приносит облегчения, вследствие чего у мно- гих больных развивается депрессивный астено-ипохондрический синдром [2, 12].
Еще в 1901 г. Schnitzler систематизировал симптоматику этого заболевания и выделил триаду симптомов: боли в животе, дисфункция кишечника, прогрессирующее похудение [15]. Эти симптомы являются ведущими в клинике заболевания.
Основной жалобой больных при СХАИ является боль в животе, как результат ишемии и гипоксии органов пищеварения. У некоторых больных она возникает при ходьбе или физической нагрузке. При брыжеечной форме боль появляется через 15-30 минут после еды и продолжается 2-2,5 часа, т.е. в течение всего периода пассажа пищи по кишечнику [7, 20].
Боль локализуется преимущественно в эпигастральной области, иногда иррадиирует в спину или правое подреберье (бассейн чревного ствола), может появляться в мезогастрии (бассейн верхней брыжеечной артерии) или левой подвздошной области (бассейн нижней брыжеечной артерии). Болевой синдром уменьшается при резком ограничении приема пищи. В начальной стадии заболевания боль носит периодический характер, появляется после употребления мясной, молочной и другой трудноперевариваемой пищи. По мере прогрессирования заболевания боль усиливается, возникает после приема любой пищи, что заставляет больных резко ограничивать себя в еде. В дальнейшем боль становится постоянной, очень интенсивной, усиливающейся после приема любой пищи в небольшом количестве, больные почти перестают есть.
Третий характерный симптом хронической абдоминальной ишемии – прогрессирующее исхудание [1, 12]. Оно связано с тем, что из-за боли пациенты ограничивают себя в количестве и качестве пищи: принимают ее малыми порциями (синдром мальабсорбции), переходят на малокалорийную, легко усвояемую однообразную диету. Потеря веса у больных за время болезни составляет иногда до 20-30 кг.
Угнетение психоневрологического статуса является неотъемлемым признаком больных с синдромом хронической абдоминальной ишемии. Это выражается в виде астении, депрессии [1, 6].
В течении заболевания выделяют три стадии [14, 23]. Стадия компенсации (бессимптомная) – клинические проявления отсутствуют. Стадия субкомпенсации – характеризуется болями после приема пищи, явлениями диспепсии. Стадия декомпенсации – симптомы постоянны, усиливаются после приема небольшого количества любой пищи.
Диагностика. Многообразие клинической картины и отсутствие специфических симптомов затрудняют раннюю диагностику, в связи с чем больные часто попадают в хирургические отделения с осложнением данного заболевания – острым мезентериальным тромбозом, желудочно-кишечными кровотечениями, перфоративными язвами, кишечной непроходимостью [2, 24]. Поскольку острый мезентериальный тромбоз диагностируется, как правило, тоже поздно, в стадии некроза кишечника и перитонита, спасти таких больных удается редко. Поэтому чрезвычайно важны ранняя диагностика и своевременное оперативное лечение этого заболевания.
Единственным специфическим симптомом данного заболевания является систолический шум в эпигастральной области, однако выслушивается он менее чем у половины больных, так как появляется только при стенозе артерии от 70 до 90 % [5, 6].
Остальные методы исследования (рентгенологические, эндоскопические, радиоизотопные, лабораторные и др.) в диагностике заболевания носят лишь вспомогательный характер [6, 17, 20].
Преимуществом метода ультразвукового дуплексного сканирования является его неин-вазивность, возможность динамического наблюдения. Однако он не дает возможности судить о характере коллатерального кровотока и о состоянии нижней брыжеечной артерии из-за малого ее диаметра. Данное исследование является скрининговым методом для отбора больных на ангиографию [26].
Высокой информативностью также обладают неинвазивные современные методики исследования сосудов – СКТ и МРТ-ангиография. Данные методы позволяют выявить не только окклюзию ВБА (до 92%), но и помогают в дифференциальной диагностике таких заболеваний брюшной полости, как васкулиты и вазоспазм сосудов брыжейки тонкой кишки [26, 27].
Цифровая субтракционная ангиография является заключительным и самым информативным методом исследования висцеральных артерий [29, 30]. Выбор доступа в артериальное русло всегда индивидуален и зависит от распространенности атеросклеротического поражения магистральных сосудов. Для диагностики патологии непарных висцеральных ветвей аортография производится, как правило, в двух проекциях – переднезадней и левой боковой. Обязательным является выполнение аортографии на высоте вдоха и выдоха, что достоверно позволяет исключить/дифференцировать экстра-вазальную компрессию чревного ствола. Современные ангиографические комплексы позволяют выполнить ротационную аортография с автоматическим построением трехмерной реконструкции в режимах 3D DSA и 3D-CT.
Лечение. В большинстве случаев пациентам с СХАИ необходимо выполнение опера- тивного вмешательства. Это прерогатива сосудистых и эндоваскулярных хирургов. Отсутствие лечения у таких пациентов может привести к возникновению острого нарушения висцерального кровообращения, смертность при развитии которого составляет 70 - 90% [12, 13, 22]. Целью хирургического лечения хронической мезентериальной ишемии является восстановление проходимости висцеральных артерий и нормального кровоснабжения кишечника с помощью различных технологий [31].
Консервативное лечение показано пациентам в компенсированной стадии и оперированным больным – с целью реабилитации в послеоперационном периоде. В стадии субкомпенсации при первом обращении к врачу обычно тоже назначают консервативное лечение. Оно может быть продолжено при условии его эффективности. Консервативное лечение синдрома хронической абдоминальной ишемии является симптоматическим и включает диетотерапию, нитраты, антиагреганты и антисекретор-ные препараты. При атеросклеротическом генезе заболевания используют препараты, направленные на нормализацию липидного обмена – статины. При неспецифическом аорто-артериите и облитерирующем тромбангиите в стадии обострения воспалительного процесса проводится противовоспалительное лечение глюкокортикоидами, в т.ч. пульс-терапия их высокими дозами, часто в комбинации с цитостатиками, при необходимости – гемосорбция, плазмаферез [12, 15].
Показания к хирургическому лечению определяются на основании того, что органическое нарушение проходимости висцеральных артерий будет постепенно прогрессировать, и ишемия органов пищеварения приведет сначала к функциональным, а затем и к структурным изменениям заинтересованных органов. В настоящее время для лечения хронической мезентериальной ишемии применяется хирургическая реваскуляризация или чрескожная транслюминальная ангиопластика и стентирование [32, 33, 34].
Открытое хирургическое вмешательство более инвазивно, имеет более высокий риск возникновения осложнений и более длительную госпитализацию по сравнению с ангиопластикой. Смертность при данном методе хирургического лечения достаточно высока и составляет 5 - 15% [11].
Большие возможности в лечении хроничес- кой абдоминальной ишемии открывает эндоваскулярная хирургия – чрескожная транслюминальная ангиопластика и стентирование артерий [35, 36, 37]. Сущность метода ангиопластики состоит в следующем: путем пункции магистральной артерии конечности в сосудистое русло вводится баллонный катетер, баллон устанавливается в месте стеноза и раздувается несколько раз под давлением в 8-12 атмосфер. За счет компрессии бляшки и надрывов в ме-дии происходит дилатация артерии в месте стеноза. Однако выполнение только ангиопластики при этой патологии мало эффективно, та как в ближайшее время наступает рецидив заболевания из-за рестеноза. Значительно лучшие результаты получены при использовании металлических стентов, которые устанавливаются в месте стеноза после дилатации, либо без предварительной дилатации [38, 39, 40]. Преимущество этих методов в малой травматичности, меньшей кровопотере, сокращении срока пребывания в стационаре. Поэтому они идеальны для пациентов с множественными сопутствующими заболеваниями и высокой степенью риска открытых операций. Эндоваскулярные вмешательства показаны при атеросклеротическом поражении чревного ствола и верхней брыжеечной артерии, являясь методом выбора у пациентов с СХАИ [29, 40] и противопоказаны при экстравазальной компрессии чревного ствола серповидной связкой и ножками диафрагмы, дегенеративных изменениях висцеральных артерий (неспецифический аортоартериит, фибромускулярная дисплазия). Метод позволяет избежать необходимости проведения общей анестезии. По данным литературы, технические неудачи в основном, обусловлены трудностями катетеризации и проведения инструментов при недостаточной тыловой поддержке, развитием рестеноза и диссекцией [41, 42]. Данных осложнений можно избежать с помощью имплантации стентов.
Результаты хирургического лечения больных с синдромом хронической абдоминальной ишемии могут быть признаны хорошими, если исчезают боли в животе, дисфункция кишечника, больные начинают быстро прибавлять в весе. По сводным литературным данным, около 90 % оперированных больных избавились от симптомов заболевания [12, 31]. Выживаемость пациентов, которым проведено хирургическое лечение, выше, чем при консервативном лечении. Консервативное лечение синдрома хронической абдоминальной ишемии является малоперспективным и не позволяет добиться компенсации кровообращения висцеральных органов [12, 23].
В качестве примера возможностей своевременной диагностики и эффективного эндоваскулярного лечения СХАИ приводим собственное клиническое наблюдение.
Больной К., 59 лет был госпитализирован в отделение гастроэнтерологии ФНКЦ ФМБА России 13.03.2012 г. с направительным диагнозом: хронический панкреатит. Пациент предъявлял жалобы на боли в животе ноющего характера, слабость, жидкий стул без патологических примесей. Анамнез заболевания около 4 месяцев, 7.03 отметил ухудшение общего состояния: подъем температуры тела до 38,5 °С., интенсивная боль в животе без четкой локализации, одышка. Доставлен в приемное отделение стационара для уточнения диагноза и лечения.
При поступлении общее состояние средней степени тяжести. Кожные покровы обычной окраски, чистые, лимфоузлы, доступные пальпации не увеличены, температура тела 37,1 °С. Частота дыхательных движений 18 в мин. Дыхание везикулярное, хрипов нет. АД 130/80 мм рт. ст., пульс 96 в мин., тоны сердца ритмичные, приглушены. Живот не вздут, мягкий, умеренно болезненный при глубокой пальпации в ме-зогастрии и правой подвздошной области. Симптомов раздражения брюшины нет. Печень и селезенка не увеличены, желчный пузырь не пальпируется. Перистальтика кишечника выслушивается, вялая. Стул 2-3 раза в сутки, водянистый без патологических примесей.
В общем анализе крови (13.03.2012 г.) выраженный лекоцитоз - 27.8 х 10 9 /л, без сдвига лейкоцитарной формулы, остальные показатели в пределах нормы. С-реактивный белок (13.03.2012 г.) значительно повышен – 61.90 мг/л. Общий анализ мочи, биохимический анализ крови, коагулограмма, гликемический профиль при поступлении без патологии.
Пациент с подозрением на кишечную инфекцию был госпитализирован в бокс приемного отделения, в этот же день консультирован инфекционной бригадой – диагноз кишечной инфекции был снят. Больному начата инфузионная (в объеме 2,5 л.), антибактериальная (амоксиклав 2,4 гр/сут + метрогил 0,3 гр/сут) терапия. Для исключения острого панкреатита назначена СКТ органов брюшной полости.
При СКТ органов брюшной полости (14.03.2012 г.) выявлена протяженная (40 мм) окклюзия верхней брыжеечной артерии в проксимальном отделе. Дистальное артериальное русло бассейна верхней брыжеечной артерии не изменено. Также определялась окклюзия дистальных ветвей селезеночной артерии с развитием мелких инфарктов селезенки (рис. 2).
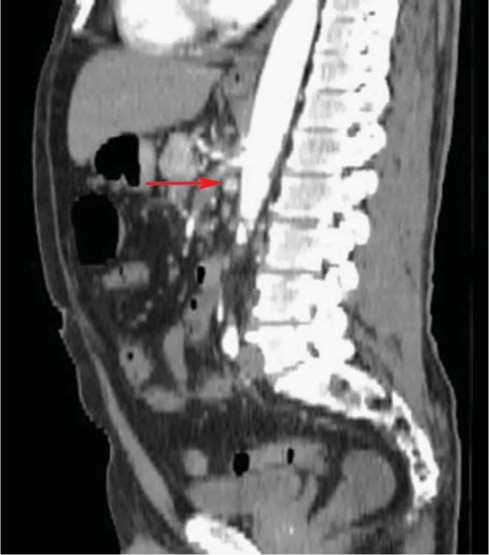
Рис. 2. СКТ – сегментарная окклюзия верхней брыжеечной артерии (стрелкой указана зона окклюзии)
Пациент сразу консультирован хирургом. Учитывая клиническую картину заболевания, данные инструментальных и лабораторных исследований, для исключения острой ишемии и некроза кишечника пациенту было решено выполнить диагностическую лапароскопию в экстренном порядке. На операции (14.03.2012 г.) выявлены косвенные признаки ишемии кишечника, последний вяло перистальтировал, петли тонкой кишки были расширены до 2,5 см, но при этом участков некроза кишечника выявлено не было. По результатам диагностической лапароскопии дополнительно к проводимому лечению больному назначена антикоагулянтная терапия (клексан 0,8/сут).
Для подтверждения хронической ишемии кишечника 15.03.2012 г. пациенту выполнена фиброколоноскопия, при которой в терминальном отделе подвздошной кишки выявлены отек и гиперемия слизистой оболочки, с множественными полигональными эрозиями и язвами, округлой и линейной формы. В слепой, восходящей ободочной, левом изгибе и поперечноободочной кишке складки очагово сглажены, слизистая оболочка очагово отечна и ги-перемирпована в зоне множественных полигональных эрозий и язв, округлой и линейной формы. Визуально изменения в подвздошной кишке необходимо было дифференцировать между ишемическим илеитом и болезнью Крона (рис. 3). С этой целью была взята биопсия из зоны эрозий тонкой кишки и при патологоана-
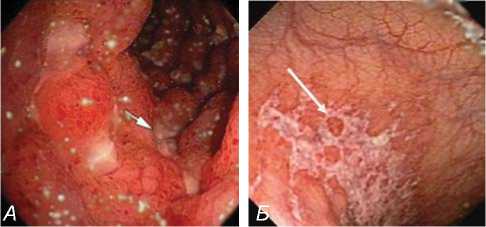
Рис. 3. Фиброколоноскопия.
А – ишемический илеит. Б – ишемический колит (стрелками указаны зоны ишемии слизистой кишки).
томическом исследовании подтвержден ишемический характер выявленных изменений.
На фоне проводимой терапии 16.03.2012 г. отмечена отрицательная динамика, проявившаяся усилением болевого синдрома после приема пищи, повышением температуры тела до 38,7 °С.
Для оценки возможности реканализации или реконструкции верхней брыжеечной артерии в срочном порядке выполнена ангиография, при которой выявлена сегментарная окклюзия верхней брыжеечной артерии в ее проксимальном отделе на небольшом удалении от устья с удовлетворительным ретроградным контрастированием дистального русла из бассейна нижней брыжеечной артерии и чревного ствола (рис. 4).
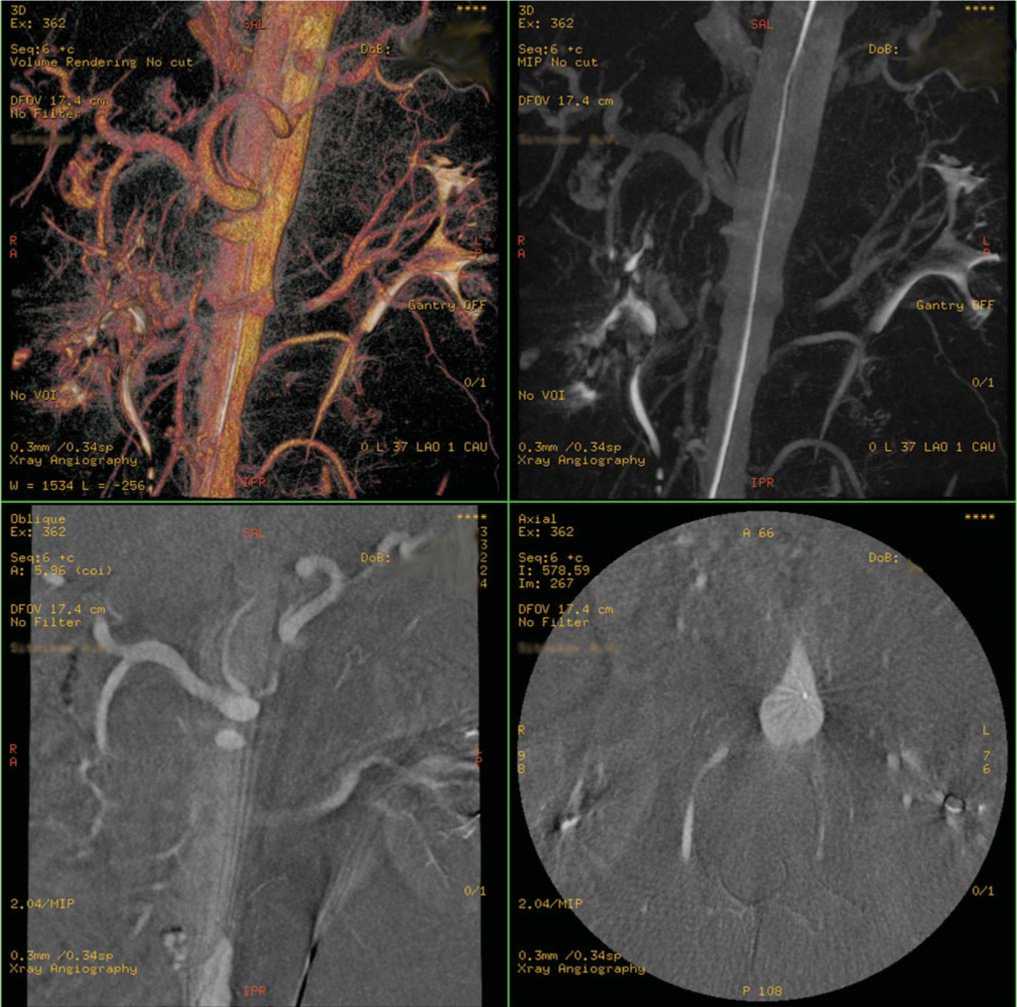
Рис. 4. Брюшная аортограмма, сегментарная окклюзия верхней брыжеечной артерии.
По результатам полученных ангиограмм пациенту решено было выполнить реканализацию и стентирования верхней брыжеечной артерии. С помощью проводника Miracle 3 и баллонного катетера реканализирована верхняя брыжеечная артерия до уровня отхождения a. colica sinistra. Баллонным катетером 2,5 мм выполнена предилятация участка окклюзии с восстановлением антеградного кровотока – во время контрольной ангиографии выявлена вторая окклюзия верхней брыжеечной артерии и мощное антеградное контрастирование ос- новного ствола верхней брыжеечной артерии через аркаду 1-го порядка a.colica sinistra и ретроградно через удвоенный ствол последней. В ствол верхней брыжеечной артерии от уровня отхождения a. colica sinistra проведен и импан-тирован стент ICROS 3.5x18 мм с восстановлением просвета в этой зоне. От аортальной ампулы верхней брыжеечной артерии с перекрытием ранее имплантированного стента проведен и имплантирован стент Hippocampus 5.5x15 мм. При контрольной ангиографии получено полное восстановление просвета прок- симальной трети верхней брыжеечной артерии, a. colica sinistra и через аркады и удвоенный ствол последней, антеградное контрастирование основного ствола верхней брыжеечной артерии и основных ее ветвей удовлетворительных объемных и скоростных показателей (рис. 5).
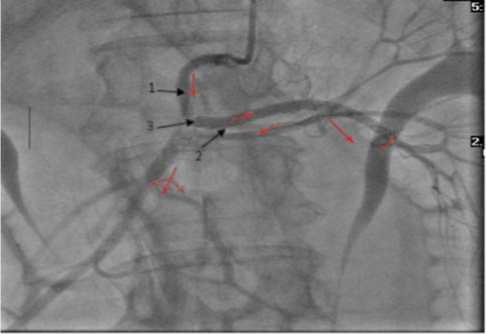
Рис. 5. Брюшная аортограмма, восстановление магистрального кровотока по верхней брыжеечной артерии и её ветвям (1– стент ICROS 3,5x18 мм, 2 – стент Hippocampus 5.5x15 мм, 3 – окклюзия основного ствола верхней брыжеечной артерии)
На 1-е сутки после проведенного оперативного лечения общее состояние пациента значительно улучшилось, болевой синдром практически отсутствовал и не требовал введения анальгетиков, температура тела уменьшились до субфебрильных цифр. В общем анализе крови, уже на 4-е сутки после операции, лейкоцитоз снизился до 12,4 х 10 9 /л. При мультиспи-ральной компьютерной томографии (МСКТ) в проксимальном отделе верхней брыжеечной артерии четко определяются имплантированные стенты с сохраненной проходимостью (рис. 6).
27.03.2012 г. при контрольной фиброколо-носкопии, по сравнению с предыдущим исследованием от 15.03.12 г., получена положительная динамика. Определяются рубцовые изменения слизистой оболочки терминального отдела подвздошной кишки без деформации и стеноза ее просвета (рис. 7).
Пациент выписан из стационара на амбулаторное долечивание 28.03.2012 г.
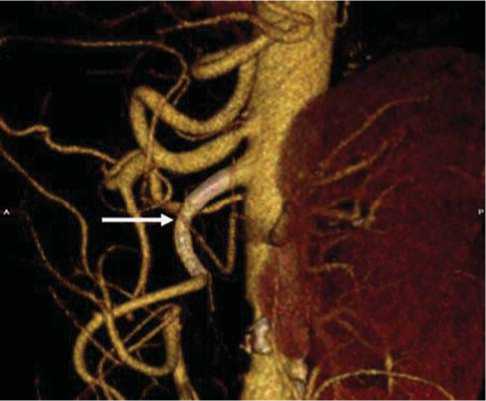
Рис. 6. МCKТ. Общий вид установленных стентов в верхнюю брыжеечную артерию, 3D-реконструкция (стрелкой указано место установки стентов).
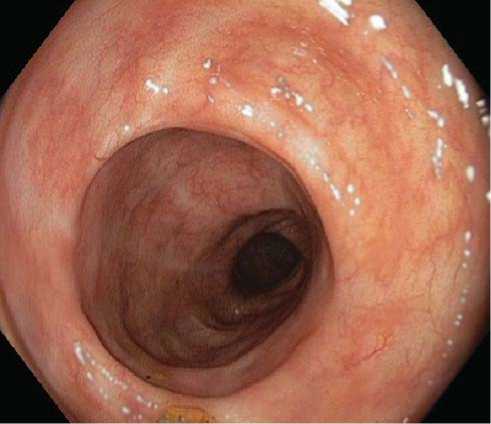
Рис. 7. Фиброколоноскопия. Вид терминального отдела подвздошной кишки через две недели после стентирования верхней брыжеечной артерии.
Таким образом, врачам, занимающимся лечением заболеваний органов брюшной полости (хирурги, терапевты, гастроэнтерологи) необходимо всегда помнить, что одной из возможных причин стойкого болевого абдоминального синдрома может быть хроническая ишемия кишечника, обусловленная той или иной степенью окклюзии мезентериальных сосудов.
Список литературы Синдром хронической абдоминальной ишемии в практике общего хирурга
- Поташов Л.В., Князев М.Д., Игнашев A.M. Ишемическая болезнь органов пищеварения. Л.: Медицина, 1985 с.
- Давыдов Ю.А. Инфаркт кишечника и хроническая мезентериальная ишемия. М: Медицина 1997; 208 с.
- Croft R.J., Menon G.P., Marston A. Does intestinal angina exist? A critical study of obstructed visceral arteries. Br J Surg 1981; 68(5): 316-24.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Медицина, 1989.
- Покровский А.В. Заболевания аорты и ее ветвей. М: Медицина, 1979; 324 с.
- Луканова В.В., Фомина И.Г., Георгадзе З.О. и др. Трудности диагностики острых сосудистых заболеваний брюшной полости. Клин мед 2005; 5: 61-65.
- Hunter G.G., Guernsey J.M. Mesenteric ischemia. Med Clin North Am. 1988; 2: 1091-15.
- Furrer J., Grhntzig A., Kugelmeier J., Goebel N. Treatment of abdominal angina with percutaneous dilatation of an arteria mesenterica superior stenosis. Cardiovasc Intervent Radiol. 1980; 3: 43-4.
- Volteas N., Labropoulos N., Leon M., et al. Detection of superior mesenteric and coeliac artery stenosis with colour flow duplex imaging. Eur J Vasc Surg. 1993; 7: 616-20.
- Рабкин И.Х. Руководство по ангиографии. М.: Медицина, 1977; 279 с.
- Shaws R.S. Maynard E.P. 3rd. Acute and chronic thrombosis of mesenteric arteries associated with malabsorption: a report of two cases successfully treated by thromboendarterectomy. N Engl J Med. 1958; 258: 874-8.
- Ермолов А.С., Попова Т.С., Пахомова Г.В. и др. Синдром кишечной недостаточности в неотложной абдоминальной хирургии (от теории к практике). М: МедЭкспертПресс 2005; 460 c.
- Кашибадзе К.Н. Ретроспективный анализ результатов лечения больных с диагнозом инфаркта кишечника и построение стандарта действия. Анналы хир 2006; 5: 48-53.
- Покровский А.В., Юдин В.И. Острая мезентериальная непроходимость. Клиническая ангиология: руководство. Под ред. А.В. Покровского. В 2-х томах. Том 2. М: Медицина 2004; 626-45.
- American Gastrointestinal Association Medical Position Statement: guidelines on intestinal ischemia. Gastroenterology 2000; 118: 951-53.
- Brandt L.J., Boley S.J. AGA technical review on intestinal ischemia. American Gastrointestinal Association. Gastroenterology 2000; 118: 954-68.
- Park W.M., Gloviczki P., Cherry K.J., et al. Contemporary management of acute mesenteric ischemia: factors associated with survival. J Vasc Surg 2002; 35: 3: 445-52.
- Numan U., Ivancev К., Lindh M., Uher P. Endovascular treatment of chronic mesenteric ischemia: report of five cases. Cardiovasc Intervent Radiol. 1998; 21: 305-18.
- Harward T.R., Smith S., Seeger J.M. Detection of celiac axis and superior mesenteric artery occlusive disease with use of abdominal duplex scanning. J Vasc Surg. 1993; 17: 738-45.
- Dhber C., Whstner M., Diehl S.J., et al. Emergency diagnostic imaging in mesenteric ischemia. Chirurg 2003; 74: 5: 399-406.
- Steinmetz E1, Tatou E, Favier-Blavoux C., et al. Endovascular treatment as first choice in chronic intestinal ischemia. Ann. Vasc. Surg. 2002; 16: 693-99.
- Luther B1, Moussazadeh K, Mhller BT et al. The acute mesenteric ischemia -not understood or incurable? Zentralbl Chir 2002; 127: 8: 674-684.
- Patel В., Widdowson J., Smith R.C. Superior mesenteric artery bypass for chronic mesenteric ischaemia: a DGH experience. J R Coll Surg Edinb. 2000; 45: 285-87.
- Lock G. Acute mesenteric ischemia -frequently overlooked and often fatal. Med Klin (Munich) 2002; 97: 7: 402-9.
- Афанасьева Е.Д. Дуплексное сканирование сосудов брюшной полости. В кн.: Функциональная диагностика в кардиологии. (Под ред. Бокерия Л.А., Голуховой Е.З., Иваницкого А.В.). М.: НЦССХ им. А.Н. Бакулева РАМН. 2002, 2: 246-52.
- Rosow D.E., Sahani D., Strobel O., et al. Imaging of acute mesenteric ischemia using multidetector CT and CT angiography in a porcine model. J Gastrointest Surg 2005; 9: 9: 1262-74; discussion 1274-75.
- Zandrino F., Musante F., Gallesio I., et al. Assessment of patients with acute mesenteric ischemia: multislice computed tomography sings and clinical performance in a group of patients with surgical correlation. Minerva Gastroenterol Dietol 2006; 52: 3: 317-25.
- Freeman A.J., Graham J.C. Damage control surgery and angiography in cases of acute mesenteric ischaemia. ANZ J Surg 2005; 75: 5: 308-14.
- Коков Л.С, Капранов С.А., Долгушин Б.И. и соавт. Сосудистое и внутриорганное стентирование. М.: ГРААЛЬ. 2003.
- Christensen M.G., Lorentsen J.E., Schroeder T.V Revascularisation of atherosclerotic mesenteric arteries:experience in 90 consecutive patients. Eur J Vasc Surg. 1994; 8: 297-302.
- Betzler M. Surgical technical guidelines in intestinal ischemia. Chirurg 1998; 69: 1: 1-7.
- Van Beers B.E., Danse E.M. Vascular lesions of the liver and gastrointestinal tract. Acta Gastroenterol Belg 2002; 65: 4: 226-9.
- Ha H.K., Lee S.H., Rha S.E., et al. Radiologic features of vasculitis involving the gastrointestinal tract. Radiographics 2000; 20: 779-94.
- Jee K.N., Ha H.K., Lee I.J., et al. Radiologic findings of abdominal polyarteritis nodosa. Am J Roentgenol 2000; 174: 1675-79.
- McShane M., Proctor A., Spencer P., Cumberland D., Welsh C. Mesenteric angioplasty for chronic intestinal ischaemia. Eur J Vasc Surg. 1992; 6: 333-6.
- Levy P.J., Haskell L., Gordon R.L. Percutaneous transluminal angioplasty of splanchnic arteries: an alternative method to elective revascularisation in chronic visceral ischaemia. Eur J Radiology. 1987; 7: 239-42.
- Crotch-Harvey M.A., Gould D.A., Green A.T. Case report: percutaneous transluminal angioplasty of the inferior mesenteric artery in the treatment of chronic mesenteric ischaemia. Clin Radiol. 1992; 46(6): 408-9.
- Finch IJ. Use of the Palmaz stent in ostial celiac artery stenosis. J Vasc Interv Radiol. 1992 Nov; 3(4): 633-5; discussion 636-7.
- Busquet J. Intravascular stenting in the superior mesenteric artery for chronic abdominal angina. J Endovasc Surg. 1997; 4: 380-4.
- Mohammed A, Teo N.B, Pickford I.R., Moss J.G. Percutaneous transluminal angioplasty and stenting of coeliac artery stenosis in the treatment of mesenteric angina: a case report and review of therapeutic options. J R Coll Surg Edinb. 2000; 45: 403-7.
- Quadros AS1, Sarmento-Leite R, Moraes CV, Yordi LM. Stent implantation in critical stenosis of the celiac trunk: enlarging the frontiers of percutaneous vascular intervention. Arq Bras Cardiol. 2004 Nov; 83(5): 445-7; 442-4. Epub 2004 Nov 11.
- Sheeran S.R., Murphy Т., Khwaja A. et al. Stent placement for treatment of mesenteric artery stenosis or occlusions. J Vasc Interv Radiol. 1999 Jul-Aug; 10(7): 861-7.


