Синтез и исследование методом хроматомасс-спектрометрии 2-алкенил(пропаргил)тио-4,6-диметилпиримидина
Автор: Шалькова Елена Николаевна, Ким Дмитрий Гымнанович, Фролова Татьяна Владимировна, Фатыхов Рамиль Фаатович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 3 т.9, 2017 года.
Бесплатный доступ
Взаимодействием гидрохлорида 4,6-диметил-2-пиримидинтиона с алкенилгалогенидами и пропаргилбромидом в присутствии гидроксида калия синтезированы 2-алкенилтио-4,6-диметилпиримидины и 2-пропаргилтио-4,6-диметилпиримидин. Методом хроматомасс-спектрометрии выявлены основные направления фрагментации S-производных 4,6-диметил-2-пиримидинтиона.
Гидрохлорид 4, 6-диметил-2-пиримидинтиона, 2-(4-хлорбут-2-енил)тио-4, 6-диметилпиримидин, 2-(4-пентен-ил)тио-4, 2-(3-бутен-1-ил)тио-4, 2-пропаргилтио-4, 2-пренилтио-4, 2-металлилтио-4, 2-аллилтио-4, хроматомасс-спектрометрия
Короткий адрес: https://sciup.org/147160393
IDR: 147160393 | УДК: 547.853.1+543.51 | DOI: 10.14529/chem170303
Текст научной статьи Синтез и исследование методом хроматомасс-спектрометрии 2-алкенил(пропаргил)тио-4,6-диметилпиримидина
Производные пиримидина широко распространены в живой природе, где участвуют во многих важных биологических процессах [1]. В частности, такие производные, как цитозин, тимин, урацил, входят в состав нуклеотидов, являющихся структурными единицами нуклеиновых кислот. Пиримидиновое ядро входит в состав некоторых витаминов группы B, коферментов и антибиотиков. Пиримидиновая структура входит в состав многих лекарственных препаратов, например, барбитуратов, обладающих снотворным, противосудорожным и наркотическим действием [2, 3].
В то же время в литературе практически отсутствуют данные об алкилировании гидрохлорида 4,6-диметил-2-меркаптопиримидина ( 1 ). Целью данной работы является синтез и исследование методом хроматомасс-спектрометрии [4, 5] S-производных 4,6-диметил-2-пиримидинтиона.
Обсуждение результатов
В настоящей работе нами впервые проанализированы масс-спектры 2-аллилтио-4,6-диметилпиримидина ( 2а ), 2-металлилтио-4,6-диметилпиримидина ( 2b ), 2-пренилтио-4,6-диметилпиримидина ( 2с ), 2-(3-хлор-2-пропенил)тио-4,6-диметилпиримидина ( 2d ), 2-(3-бутенил)тио-4,6-диметилпиримидина ( 2e ), 2-(4-пентенил)тио-4,6-диметил-пиримидин ( 2f ), 2-пропаргилтио-4,6-диметилпиримидина ( 2g ).
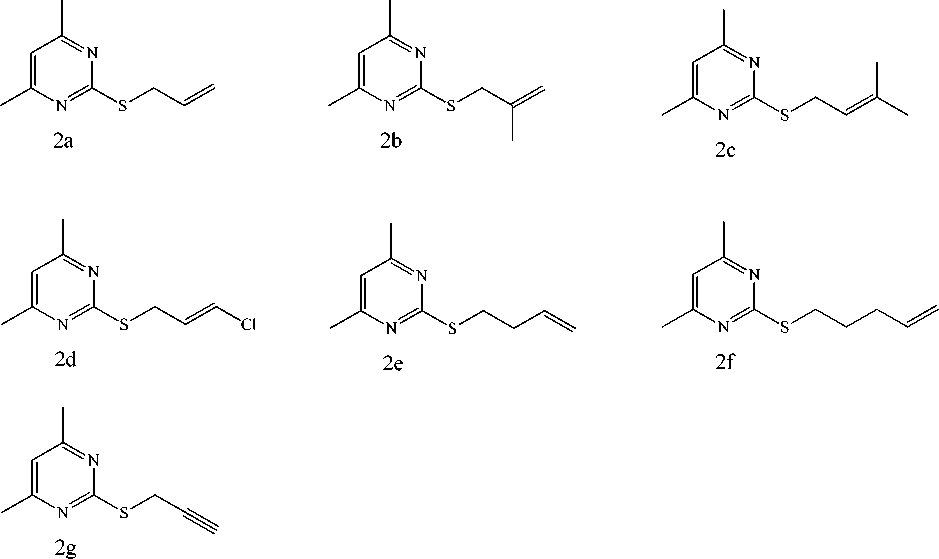
Соединения 2b-g с выходами более 72 % были получены взаимодействием гидрохлорида 1 в 2-пропаноле в присутствии щелочи c 3-хлор-2-метилпропеном, 2-метил-4-бром-2-бутеном, 1,3-дихлорпропеном, 4-бромбутеном, 5-бромпентеном и 3-бромпропином соответственно (схема 1). Соединение 2а получено по методу [6].
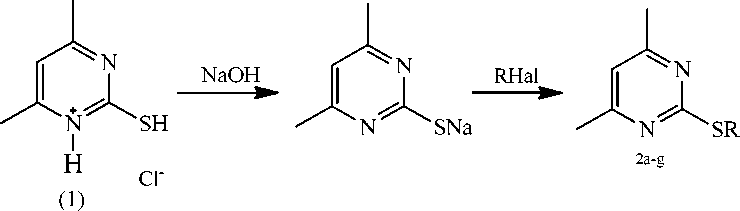
2d R1 -СН2-СН=СН-С1, 2е R1 -(СН2)2-СН=СН2, 2f R1 -(СН2)3-СН=СН2, 2gR1-CH2-C=CH
Схема 1. Алкилирование гидрохлорида 2-меркапто-4,6-диметилпиримидина
Сульфиды 2a-g представляют собой светло-желтые жидкости, растворимые в ацетоне, хлороформе и эфире. В спектре ЯМР 1Н сульфидов 2a-g протоны двух метильных групп эквивалентны и образуют шестипротонный синглет в области 2,34–2,36 м.д. Протоны SCH 2 группы в соединениях 2c,d,g образуют дублет в области 3,8–4,0 м.д., а в соединении 2f образует триплет при 3,1 м.д., что обусловлено более удаленным положением винильной группы.
В масс-спектрах всех сульфидов 2a-g (см. таблицу) имеются пики молекулярных ионов, интенсивность которых составляет от 16 до 39 %.
Данные масс-спектров исследованных соединений
|
Соединение |
Характеристики ионов: m/z (I, %) |
|
2a C 9 H 12 N 2 S |
180 [M]+• (39), 165 [M-CH 3 ]+ (100), 147 [M-SH]+ (78), 108 [M-SAll]+ (35), 93 [C 5 H 7 N 2 ]+ (20), 41 [All]+ (16) |
|
2b C 10 H 14 N 2 S |
194 [M]+• (16), 179 [M-CH 3 ]+ (100), 161 [M- SH]+ (66), 153 [M-All]+ (13), 146 [M-СH 2 S]+ (21), 108 [M-C 4 H 6 S]+ (21), 93 [C 5 H 7 N 2 ]+ (11) |
|
2c C 11 H 16 N 2 S |
208 [M]+• (21), 175 [M- SH]+ (100), 140 [M-C 5 H 9 ]+ (31), 108 [M-C 5 H 9 S]+ (13), 69 [C 5 H 9 ]+ (21), 41 [All]+ (38) |
|
2d C 9 H 11 N 2 SCl* |
214 [M]+• (19), 180 [M- SH]+ (21), 179 [M-Cl]+ (100), 165 [M-CH 2 -Cl]+ (6), 146 [M-SH-Cl]+ (59), 108 [M-C 3 H 7 SCl]+ (33), 93 [C 5 H 7 N 2 ]+ (17), 41 [All]+ (7) |
|
2e C 10 H 14 N 2 S |
194 [M]+• (20), 179 [M-CH 3 ]+ (10), 161 [M-SH]+ (26), 153 [M-All]+ (44), 140 [M-C 4 H 6 ]+ (100), 108 [M-C 4 H 6 S]+ (10) |
|
2f C 11 H 16 N 2 S |
208 [M]+• (14), 193 [M-CH 3 ]+ (6), 175 [M-SH]+ (17), 165 [M- C 3 H 7 ]+ (100), 140 [M-C 3 H 7 S]+ (70), 108 [M-C 5 H 9 S]+ (48), 41 [All]+ (23) |
|
2g C 9 H 10 N 2 S |
178 [M]+• (23), 177 [M-H]+ (100), 145 [M-SH]+ (22), 108 [M- C 3 H 3 S]+ (8), 93 [C 5 H 7 N 2 ]+ (13), 39 [C 5 H 7 ]+ (18) |
Пики интенсивностью менее 5 % не учитывались Примечание . *взят изотоп хлора с меньшей массой.
В масс-спектрах всех сульфидах 2a-g имеется пик с m/z =108, который образуется в результате отрыва тиоальдегида R1СНS, соответствующий катион-радикалу 4,6-диметилпиримидиния, и пик с m/z =93, обусловленный последующим отрывом от него метильной группы с образованием катиона 4-метилпиримидиния (схема 2).
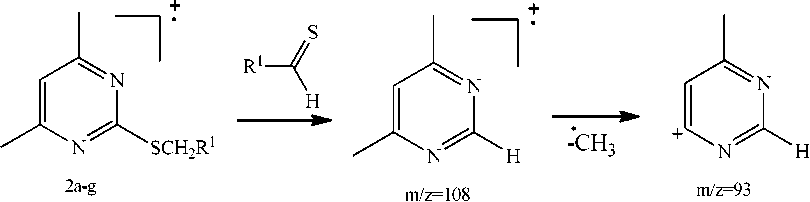
Схема 2. Образование катиона 4-метилпиримидиния
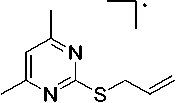
В соединениях 2а и 2b пик [М-CH3]+ является максимальным, что обусловлено образованием устойчивой ароматической системы 5,7-диметилтиазоло[3,2- а ]пиримидиния (схема 3).
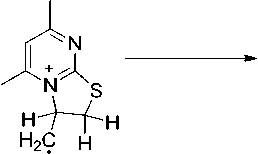
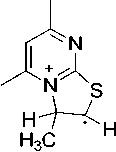
-ипз
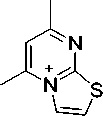
Схема 3. Фрагментация 2-аллилтио-4,6-диметилпиримидина
В соединении 2с максимальным пиком является [М-SH]+, который, по-видимому, обусловлен образованием катиона 3,3,5,7-тетраметил-3 Н -пиролло[1,2- a ]пиримидиния по схеме 4.
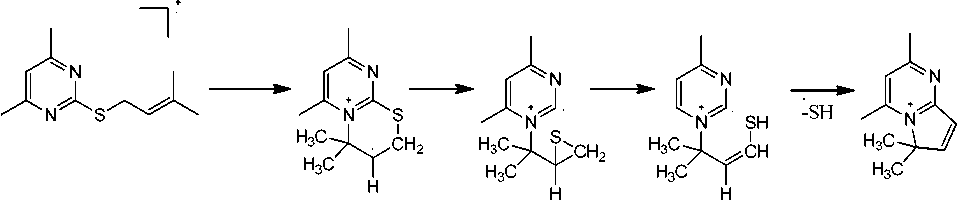
Схема 4. Фрагментация 2-пренилтио-4,6-диметилпиримидина
В соединении 2g максимальным пиком является [M-H]+, который, по-видимому, обусловлен со следующими превращениями (схема 5).
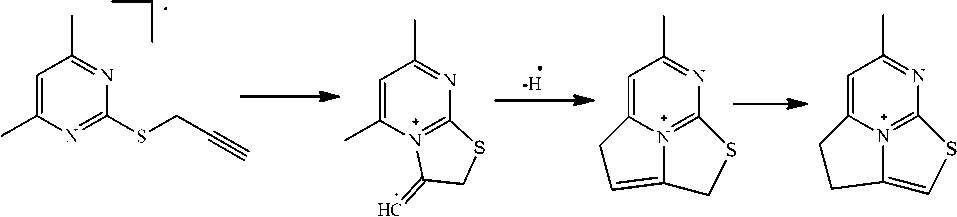
Схема 5. Фрагментация 2-пропаргилтио-4,6-диметилпиримидина
Соединение 2d , по данным ЯМР 1Н, получается в виде смеси цис - и транс -изомеров, но при исследовании методом ХМС проявляется лишь одно соединение. На наш взгляд, это обусловлено тем, что в условиях хроматографирования цис -изомер переходит в транс -изомер.
В масс-спектре хлорсульфида 2d имеются пики [M-Cl]+ с m/z =179, [M-HCl] +•с m/z =178, [M-CH 2 -Cl]+•с m/z =165 и [M-C 3 H 7 SCl]+• с m/z =108 (схема 6).
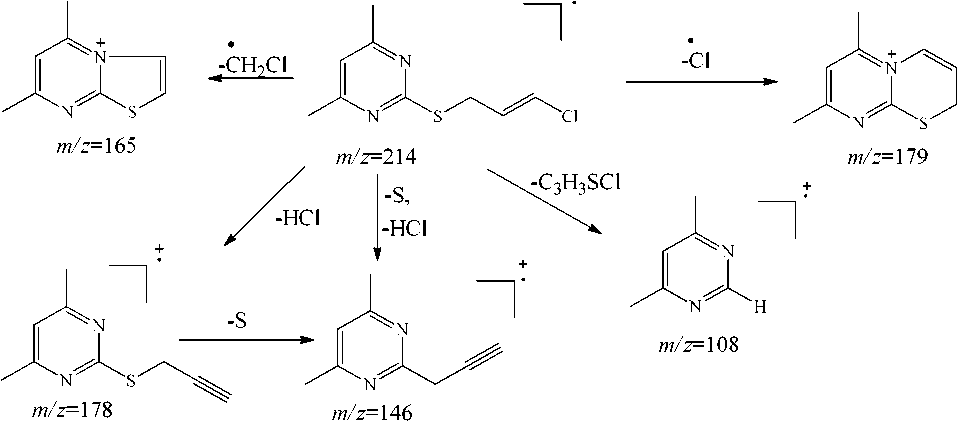
Схема 6. Фрагментация 2-(3-хлор-2-пропенил)тио-4,6-диметилпиримидина
Экспериментальная часть
Масс-спектры электронного удара сняты на хроматомасс-спектрометре ГХ/МС-ЭВМ фирмы Hewlet Packard газовый хроматограф HP-5890, серия II, масс-селективный детектор MSD-5972 при энергии ионизации 70 эВ.
Спектры ЯМР 1Н растворов веществ в ДМСО-d6 получены на спектрометре Bruker (400 МГц), внутренний стандарт ТМС.
Алкилирование 4,6-диметил-2-меркаптопиримидина. В 10 мл изопропилового спирта растворяем 0,24 г (0,006 моль) гидроксида калия при нагревании, затем в горячий раствор добавляем 0,4 г (0,003 моль) гидрохлорида 2-меркапто-4,6-диметилпиримидина. Затем добавляем 0,25 мл (0,003 моль) алкилгалогенида (аллилбромид, металлилхлорид, пренилбромид, 1,3-дихлорпропен, 4-бромбутен, 5-бромпентен, пропаргилбромид ) и кипятим в течении 2 ч, охлаждаем раствор, отфильтровываем и испаряем растворитель.
2-Аллилтио-4,6-диметилпиримидин ( 2а ). Получен по методу [6].
2-Металлилтио-4,6-диметилпиримидин ( 2b ). Выход: 51 %.
2-Пренилтио-4,6-диметилпиримидин ( 2c ). Выход: 69 %. Спектр ЯМР 1Н:2,34 (6Н, с, две CH 3 ), 3,74 (2Н, д, J =7,92 Гц, SCH 2 ), 5,3 (1Н, м, =CH), 6,94 (1Н, с, H-5).
2-(3-Хлор-2-пропенилтио)-4,6-диметилпиримидин ( 2d ). Выход: 38 %. Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , м.д., J /Гц): цис -изомер 2,36 (6Н, с, CH 3 -4,6), 3,89 (2Н, м, SCH 2 ), 6,11 (1Н, м, =CH), 6,43 (1Н, д, J = 6,91Гц, =CHCl,), 6,98 (1Н, с, H-5); транс -изомер 2,36 (6Н, с, CH 3 -4,6), 3,81 (2Н, м, SCH 2 ), 6,09 (1Н, м, =CH), 6,55 (1Н, д, J = 13,14 Гц, =CHCl), 6,98 (1Н, с, H-5).
2-(3-Бутенилтио)-4,6-диметилпиримидин ( 2e ). Выход: 60 %.
2-(4-Пентенилтио)-4,6-диметилпиримидин ( 2f ). Выход: 59 %. Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , м.д., J /Гц): 1,75 (2Н, м, CH 2 ), 2,16 (2Н, м, CH 2 ), 2,34 (6Н, с, две CH 3 -4,6), 3,09 (2Н, д, J = 7,71 Гц, SCH 2 ), 5,00 (2Н, м, =CH 2 ), 5,84 (1Н, м, =CH), 6,94 (1Н, с, H-5).
2-Пропаргилтио-4,6-диметилпиримидин ( 2g ) . Выход: 72 %. Спектр ЯМР 1Н (400 МГц, ДМСО- d 6 , м.д., J /Гц): 2,34 (6Н, с, две CH 3 -4,6), 3,09 (1Н, т, J = 2,62 Гц, CH), 3,96 (2Н, д, J = 2,62 Гц, SCH 2 ), 7,01 (1Н, с, H-5).
Выводы
Алкилированием гидрохлорида 4,6-диметил-2-меркаптопиримидина в присутствии гидроксида калия синтезированы 2-аллилтио-4,6-диметилпиримидин, 2-металлилтио-4,6-диметил-пиримидин, 2-пренилтио-4,6-диметилпиримидин, 2-(3-хлор-2-пропенил)тио-4,6-диметилпири-мидина, 2-(3-бутенил)тио-4,6-диметилпиримидина, 2-(4-пентенил)тио-4,6-диметилпиримидин и 2-пропаргилтио-4,6-диметилпиримидин. В масс-спектрах всех S-производных 2-меркапто-4,6-диметилпиримидина имются пики молекулярных ионов, пик [M-SH]+ и пик, соответствующий элиминированию тиоальдегида. В соединениях 2а и 2b максимальным является пик [М-CH 3 ]+ , в соединении 2с – пик [M-SH]+, в соединении 2g – пик [M-H]+ и в соединении 2d – пик [M-Cl]+ .
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и при финансовой поддержке в рамках государственного задания (номер государственной регистрации 4.9665.2017/БЧ).
Список литературы Синтез и исследование методом хроматомасс-спектрометрии 2-алкенил(пропаргил)тио-4,6-диметилпиримидина
- Солдатенков, А.Т. Основы органической химии лекарственных веществ/А.Т. Солдатенков, Н.М. Колядина, И.В. Шендрик. -М.: Химия, 2001. -192 c.
- Zakrzewski, R. Application of improved iodine-azide procedure for the detection of thiouracils in blood serum and urine with planar chromatography/R. Zakrzewski, W. Ciesielski//Journal of Chromatography. -2003. -V. 784. -P. 283-290.
- Reaction of mercaptopyrimidine derivatives with perfluoro olefins/T.A. Dashevskaya, Yu.A. Fialkov, V.A. Khranovskii, V.M. Cherkasov//Chemistry of Heterocyclic Compounds. -1984. -№ 3. -P. 402-406 DOI: 10.1007/BF00515650
- Вульфсон, Н.С. Масс-спектрометрия органических соединений/Н.С. Вульфсон, В.Т. Залкин, А.И. Микая. -М.: Химия, 1986. -312 c.
- Лебедев, А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев. -М.: БИНОМ. Лаборатория знаний, 2003. -493 c.
- Ким, Д.Г. Синтез галогенидов 5,7-диметил-2,3-дигидротиазолопиримидиния/Д.Г. Ким, Ю.В. Троицкова, М.В. Зарецкая//Изв. вузов. Химия и химическая технология. -1993. -Вып. 3. -С. 113-115.


