Синтез индол 3 уксусной кислоты при совместном культивировании дрожжей и бактерий
Автор: Пронин А.С., Колмыкова Т.С., Лукаткин А.С.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (98) т.85, 2023 года.
Бесплатный доступ
Работа посвящена исследованию штаммов дрожжей и бактерии, которые являются потенциальными компонентами для состава при разработке биопрепаратов для растений. Эксперименты с совместным культивированием бактерий и дрожжей способные к стимуляции роста растений предоставляют основу для разработки комплексных биопрепаратов, которые могут воздействовать на сельскохозяйственные культуры и оцениваться по их фитогормональной активности .В работе дана оценка возможности синтеза индо-3 уксусной кислоты при совместном культивировании бактерии Pseudomonas chlororaphis subsp. auerofaciens B5326 и дрожжей Saccharomyces cerevisiae Y4317. Мы использовали современные методы для оценки метаболитов микроорганизмов такие как, тонкослойная хроматография для оценки аминокислотного состава, и реакцию сальковского для обнаружения индол-3 уксусной кислоты в культуральной жидкости. На первом этапе работы мы показали, что конкурентного взаимодействия между бактериями и грибами не было. Максимальная концентрация колония образующих единиц при совместном культивирование P. chlororaphis и S. Сerevisiae. составила (3 ± 0,2)×108 и (8 ± 0,2)×106 КОЕ/мл. В ходе исследования обнаружили, что микроорганизмы P.chlororaphis и S.cerevisiae при совместном культивировании способны синтезировать индол-3 уксусную кислоту.. В исследованиях с добавлением триптофана обнаружили, что экзогенное введение аминокислоты стимулирует накопление фитогормонов в КЖ только у P.chlororaphis. Таким образом, мы предполагаем, что основным источником триптофана при совместном культивировании микроорганизмов является S. cerevisiae. Полученные данные являются предпосылкой к созданию комплексного биологического препарата для обработки растений и подтверждает нашу гипотезу о возможности совместного культивирвоания микроорганизмов относящихся к различной таксономическим категориям.
Pseudomonas chlororaphis, Saccharomyces cerevisiae, индол 3 уксусная кислота, триптофан, PGBPB, PGPF
Короткий адрес: https://sciup.org/140304454
IDR: 140304454 | УДК: 640 | DOI: 10.20914/2310-1202-2023-4-91-95
Текст научной статьи Синтез индол 3 уксусной кислоты при совместном культивировании дрожжей и бактерий
На сельскохозяйственном мировом рынке наблюдается растущий интерес к использованию биологических средств защиты растений и ростовых стимуляторов. Эта тенденция подчеркнута исследованиями [3]. Производство таких препаратов включает использование различных культур микроорганизмов, таких как ростопромо-тирующие бактерии (PGPB) и грибы (PGPF) [4, 5]. Современные исследования акцентируют внимание на способности PGPB и PGPF к синтезу природных гормонов роста, таких как ауксины, цитокинины и гиберилины [1, 7, 8]. Производство этих веществ микробиологическим путем может привести к экономическому эффекту в сельском хозяйстве. Некоторые исследования демонстрируют, что определенные штаммы Pseudomonas не только обладают фунгицидными свойствами, но и способны синтезировать ауксины [6]. Наши исследования фокусировались на совместном культивировании бактерии Pseudomonas chlororaphis subsp. auerofaciens B 5326 и дрожжей Saccharomyces cerevisiae Y 4317, где мы выявили их способность синтезировать фитогормоны и накапливать их в культуральной жидкости. Эксперименты с совместным культивированием PGPB [13] и PGPF [14, 15] предоставляют основу для разработки комплексных биопрепаратов, которые могут воздействовать на сельскохозяйственные культуры и оцениваться по их фитогормональ-ной активности.
Материалы и методы
Цель исследования: оценка возможности синтеза IAA при совместном культивировании бактерии Pseudomonas chlororaphis subsp . auerofaciens B-5326 и дрожжей Saccharomyces cerevisiae Y-4317.
Задачи: 1) исследование возможности совместного культивирования PGPB и PGPF 2) исследование способности синтезировать IAA P. chlororaphis и S. Сerevisiae в присутствии/ отсутствии L-триптофана 3) Оценка способности S. Сerevisiae синтезировать триптофан.
В качестве посадочного материала использовали штаммы бактерии Pseudomonas chlororaphis subsp. aureofaciens B-5326 и дрожжей Saccharo-myces cerevisiae Y-4317 (Всероссийской коллекции промышленных микроорганизмов НИЦ «Курчатовский институт» – ГосНИИгенетика).
Режимы культивирования микроорганизмов и состав питательной среды. На первом этапе культивирование исследуемых микроорганизмов осуществляли раздельно в колбах объемом 250 мл на шейкере-инкубаторе SPH-2102 (BIORUS, Минск, Беларусь) при температуре 28 °С и частоте перемешивания 130 RPM. Среда для выращивания микроорганизмов содержала глюкозу 10 г/л, NaNO3, (NН4)2SO4, NH4NO3, КН2РО4 – по 0,5 г/л.
дрожжевой экстракт 1 г/л. Спустя 48 ч титр посадочного материала составил 107 и 105 КОЕ/мл для P. chlororaphis и S .сerevisiae , соответственно. На втором этапе из двух колб отбирали по 15 мл культуральной жидкости и переносили в колбу объёмом 500 мл. Состав питательной среды для совместного роста микроорганизмов: свекловичная меласса 25 г/л пептон 0,5 г/л, дрожжевой экстракт 1 г/л, NaNO 3 , (NН 4 ) 2 SO 4 , NH 4 NO 3 , КН 2 РО 4 – по 0,5 г/л.
Определение содержания аминокислот: определяли методом ТСХ. Использовали стандарты 20 аминокислот фирмы Sigma (США). Пробы культуральной жидкости, отбирали по 1,5 мл, центрифугировали на центрифуге MiniSpin® (Eppendorf, Гамбург, Германия) при 6000 об/мин в течение 20 мин. ТСХ-пластинки промывали смесью хлороформ-метанол (1:1 по объему) и активировали в течение 15 мин при 120 °С. Объем наносимых проб – 0,5 мкл. Подвижная фаза состояла из изобутанола, изопропанола, воды и ледяной уксусной кислоты (5:4:3:0.2 по объему), Насыщение камеры – 1,0–1,5 ч. Время разделения 1,5–2 ч.
Количественно аминокислоты определяли на денситометре CS-920 фирмы Shimadzu (Киото, Япония) и TLC Scanner 3 (Camag, Муттенц, Швейцария) при длине волны 500 нм.
Подсчёт клеток микроорганизмов осуществляли на фиксированных окрашенных мазках метод Виноградского-Брида (Теппер, 2004).
Для обнаружения в культуральной жидкости ауксина и определения его концентрации проводили реакцию Сальковского [9]. После прохождения цветной реакции концентрацию IAA определяли фотометрически на спектрофотометре UV-1900 ( Shimadzu, Киото, Япония ) при длине волны 546 нм.
Результаты
На первом этапе работы проводили совместное культивирование P. chlororaphis и S. Сerevisiae . В ходе исследования мы обнаружили активный рост колоний бактерий и дрожжей при совместном культивировании на мелассной среде. Анализируя полученную картину исследования, мы не обнаружили конкурентного взаимодействия между микроорганизмами двух таксономических групп. Это позволило нам предположить, что в КЖ отсутствуют ростингибирующие для данных организмов метаболиты.
Максимальная концентрация при совместном культивирование P. chlororaphis и S. Сerevisiae . составила (3 ± 0,2)×108 и (8 ± 0,2)×106 КОЕ/мл (рисунок 1).
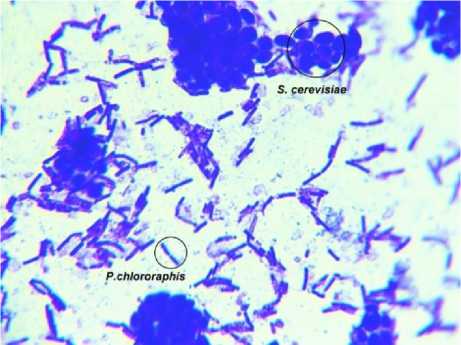
Рисунок 1. Микроскопия P. chlororaphis и S. Сerevisiae при совместном культивирование
Figure 1. Microscopy of P. chlororaphis and S. Cerevisiae during co-cultivation
культивировании P. chlororaphis и S. cerevisiae мы зафиксировали увеличение содержания IAA в культуральной жидкости более чем в два раза, по сравнению с раздельным способом культивирования. Без добавления L-триптофана содержания IAA составило 102 ±5, при добавлении аминокислоты содержание IAA увеличилось незначительно в пределах ошибки (111±7 мкг/мл).
Поэтому на следующем этапе мы экспериментальным методом изучили способность данного штамма дрожжей продуцировать L-триптофан. Методом ТСХА обнаружили, что в ходе роста исследуемого штамма дрожжей в КЖ накапливается аминокислота триптофан в концентрации 44 мкг/мл (рисунок 3).
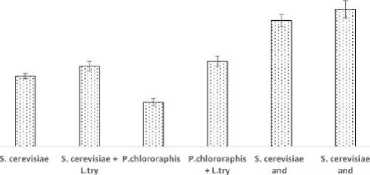
Основным показателем эффективности биопрератов является жизнеспособность клеток микроорганизмов и их способность синтезировать в среду биологически активные вещества, в нашем случае – фитогормоны [17–18]. В нашем исследовании в качестве фитогормонального-маркера в КЖ служила индол 3-уксусная кислота. Мы сравнили способность синтезировать IAA микроорганизмами при раздельном культивировании при добавлении аминокислоты триптофана (100 мкг/мл) и в её отсутствии (контроль) [19–20]
IAA, «J
Hg/ml «
P.chlororaphis P.chlororaphis
Ury
Рисунок 2. Содержание IAA в культуральной жидкости исследуемых микроорганизмов
Figure 2. IAA content in the culture liquid of the studied microorganisms
При раздельном культивировании микроорганизмов содержание IAA в культуральной жидкости S. cerevisiae составило 57±3 мкг/мл и 36±2 мкг/мл в КЖ P. chlororaphis (рисунок 2). Очевидно, что дрожжи являются основным продуцентом IAA. При добавлении в среду для роста клеток аминокислоты L-триптофан, содержание IAA достоверно увеличилось по сравнению со средой без добавления аминокислоты только в вариантах с бактериями P. chlororaphis B-5326. Содержание IAA увеличилось по сравнению с контролем на 78%. В вариантах с дрожжами S. cerevisiae содержание IAA увеличивалось пор сравнению с контролем только на 14%. Мы предположили, что дрожжи способны самостоятельно синтезировать L-триптофан. При совместном val try tyr
Рисунок 3. Хроматограмма аминокислотного состава Saccharomyces cerevisiae Y-4317
Figure 3. Chromatogram of the amino acid composition of Saccharomyces cerevisiae Y 4317
Полученные данные подтверждают, что при совместном росте P. chlororaphis B-5326 и Saccharomyces cerevisiae Y-4317 , последние выделяют в среду достаточно аминокислоты для биосинтеза IAA микроорганизмами. Следовательно, совместное культивирование дрожжей и бактерий позволяет не только повысить жизнеспособность бактерий в логарифмическаю фазу роста, но и накапливать в среде больше IAA за счёт синтеза дрожжами триптофана.
Обсуждение
Известно, что L-триптофан является предшественников индол-3 – уксусной кислоты в метаболизме растений, некоторых бактерий и грибов. Бактерии рода Pseudomonas способны синтезировать IAA по индол-3-ацетамидному пути, где основным компонентом является L-триптофан. Ключевым ферментом при синтезе является индолацетамид гидролаза [2] основным предшественником – L-триптофан. В ранее проведенных исследованиях [3] показано, что бактерии Pseudomonas putida, Pseudomonas sp способны синтезировать IAA в концентрации 16 μg/mL без присутствия экзогенного L-триптофана и 108 μg/mL при его добавлении в среду в концентрации 0,2 g/L [16] Результаты нашего эксперимента согласуются с вышеописанными.
Pronin A.S. et al. Proceedings of VSUET, 2023, vol. 85, no. 4, pp. 91-95
Но в своей работе мы использовали более низкую концентрацию триптофана.
Другие авторы так же отмечают способность некоторых дрожжей таких как Sporobolomyces, Taphrina, Metschnikowia, Aureobasidium синтезировать ауксины [11]. В исследованиях [10], показано, что S. cerevisiae с делециями в двух генах (Ald) не способен конвертировать радиоактивно меченый Trp в IAA, но продуцирует IAA в отсутствие L-Trp и на уровнях выше, чем у дикого типа штамма дрожжей. Эти данные предполагают, что дрожжи могут иметь несколько путей синтеза IAA. Таким образом, при совместном росте с S. cerevisiae и P. chlororaphis увеличение синтеза IAA у последних, можно объяснить способностью накапливать триптофан в культуральной жидкости S. cerevisiae .
Заключение
Настоящая работа посвящена изучению возможности совместного культивирования PGPB и PGPF микроорганизмов. Мы показали,
(8 ± 0,2)×106 КОЕ/мл.
В ходе исследования обнаружили, что микроорганизмы P. chlororaphis и S. cerevisiae при совместном культивировании способны синтезировать IAA в максимальной концентрации 111±7 мкг/мл. В исследованиях с добавлением триптофана обнаружили, что экзогенное введение аминокислоты стимулирует накопление IAA в КЖ только у P. chlororaphis . Таким образом, мы предполагаем, что основным источником триптофана при совместном культивировании микроорганизмов является S. cerevisiae . Полученные данные являются предпосылкой к созданию комплексного биологического препарата для обработки растений и подтверждает нашу гипотезу о возможности совместного культи-вирвоания PGPB и PGPF.
Список литературы Синтез индол 3 уксусной кислоты при совместном культивировании дрожжей и бактерий
- Batabyal B. Plant Growth Promoting Fungi: Mechanisms and Applications for Crop Productivity // International Journal of Pharmacy & Life Sciences. 2021. V. 12. №. 1.
- Duca D.R., Glick B.R. Indole-3-acetic acid biosynthesis and its regulation in plant-associated bacteria // Applied microbiology and biotechnology. 2020. V. 104. P. 8607-8619.
- Kocira S., Hara P., Szparaga A., Czerwińska E. et al. Evaluation of the Effectiveness of the Use of Biopreparations as Seed Dressings // Agriculture. 2020. V. 10. №. 4. P. 90.
- Kumar A., Singh S., Gaurav A.K., Srivastava S. et al. Plant growth-promoting bacteria: biological tools for the mitigation of salinity stress in plants // Frontiers in Microbiology. 2020. V. 11. P. 1216. doi: 10.3389/fmicb.2020.01216
- Li M., Wang J., Yao T., Wang Z. et al. Isolation and characterization of cold-adapted PGPB and their effect on plant growth promotion // Journal of Microbiology and Biotechnology. 2021. V. 31. №. 9. P. 1218. doi: 10.4014/jmb.2105.05012
- McClerklin S.A., Lee S.G., Harper C.P., Nwumeh R. et al. Indole-3-acetaldehyde dehydrogenase-dependent auxin synthesis contributes to virulence of Pseudomonas syringae strain DC3000 // PLoS pathogens. 2018. V. 14. №. 1. P. e1006811.
- Olanrewaju O.S., Glick B.R., Babalola O.O. Mechanisms of action of plant growth promoting bacteria //World Journal of Microbiology and Biotechnology. 2017. V. 33. P. 1-16.
- Oliveira J.T.C., Pereira A., Souza A.J., Silva G.T. et al. Plant growth-promoting mechanisms and genetic diversity of bacteria strains isolated from Brachiaria humidicola and Brachiaria decumbens // Anais da Academia Brasileira de Ciências. 2021. V. 93.
- Patten C.L., Glick B.R. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system // Applied and environmental microbiology. 2002. V. 68. №. 8. P. 3795-3801. doi: 10.1128/AEM.68.8.3795-3801.2002
- Rao R.P., Hunter A., Kashpur O., Normanly J. Aberrant synthesis of indole-3-acetic acid in Saccharomyces cerevisiae triggers morphogenic transition, a virulence trait of pathogenic fungi // Genetics. 2010. V. 185. №. 1. P. 211-220. doi: 10.1534/genetics.109.112854
- Streletskii R.A., Kachalkin A.V., Glushakova A.M., Demin V.V. et al. Quantitative determination of indole-3-acetic acid in yeasts using high performance liquid chromatography—tandem mass spectrometry // Microbiology. 2016. V. 85. P. 727-736.
- Теппер Е.3., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии: учебное пособие для вузов; 5-е изд., перераб. и доп. М.: Дрофа, 2004. Ajijah N., Fiodor A., Pandey A.K., Rana A. et al. Plant Growth-Promoting Bacteria (PGPB) with biofilm-forming ability: A multifaceted agent for sustainable agriculture // Diversity. 2023. V. 15. №. 1. P. 112.
- Wang C., Lin Y., Huang J., Song H. et al. Pseudomonas aeruginosa targeting cascade photodynamic nanoassemblies for efficient antibacterial and anti-inflammatory therapy // Nano Today. 2023. V. 51. P. 101892. doi: 10.1016/j.nantod.2023.101892
- Rabert G.A., Dhivya A., Navaneetha P., Mathivanan S. et al. A study on the impact of Plant Growth Promoting Fungus (PGPF) and Plant Growth Promoting Rhizobacteria (PGPR) as biofertilizers for Abelmoschus esculentus (L.) Moench // Innovations in Agriculture. 2023. V. 4. P. 1-1.
- Onrit N., Boonlue S., Mongkolthanaruk W., Jogloy S. et al. Alternative Nitrogen Source for Producing Crude Extracted IAA and Suitable Method for Enhancing the Germination of Jerusalem Artichoke // Waste and Biomass Valorization. 2023. V. 14. №. 5. P. 1497-1508.
- Завалин А.А., Накаряков А.М. Эффективность применения биопрепаратов в посеве озимой пшеницы на светло-серой лесной почве // Земледелие. 2021. №. 1. С. 27-30.
- Djami-Tchatchou A.T., Harrison G.A., Harper C.P., Wang R. et al. Dual role of auxin in regulating plant defense and bacterial virulence gene expression during Pseudomonas syringae PtoDC3000 pathogenesis // Molecular Plant-Microbe Interactions. 2020. V. 33. №. 8. P. 1059-1071.
- Uzma M., Iqbal A., Hasnain S. Drought tolerance induction and growth promotion by indole acetic acid producing Pseudomonas aeruginosa in Vigna radiata // PloS one. 2022. V. 17. №. 2. P. e0262932. doi: 10.1371/journal.pone.0262932
- Zhang B.X., Li P.S., Wang Y.Y., Wang J.J. et al. Characterization and synthesis of indole-3-acetic acid in plant growth promoting Enterobacter sp // RSC advances. 2021. V. 11. №. 50. P. 31601-31607. doi: 10.1039/D1RA05659J


