Синтез инсулина путем генной инженерии и применение его в медицине
Автор: Балохин С. Д., Гнездилова О. А., Мазовка Д. А., Осинина А. Т.
Рубрика: Сообщения молодых ученых
Статья в выпуске: 4 (16), 2021 года.
Бесплатный доступ
Быстрое увеличение числа больных сахарным диабетом во всем мире и изучение альтернативных методов доставки инсулина, таких как ингаляционный или пероральный путь, которые основаны на более высоких дозах, неизбежно увеличат спрос на рекомбинантный инсулин в ближайшем будущем. Современные технологии производства не смогут удовлетворить растущий спрос на доступный инсулин из-за ограниченности производственных мощностей и высокой себестоимости. Производство терапевтических рекомбинантных белков требует соответствующего организма-хозяина с эффективным оборудованием для посттрансляционных модификаций и рефолдинга белка. Рекомбинантный человеческий инсулин был получен преимущественно с использованием E.coli и Saccharomyces cerevisiae для терапевтического применения у человека. В этом обзоре мы сосредоточимся на различных подходах, которые могут быть использованы для увеличения выработки биологически активного инсулина и его аналогов в кишечной палочке и дрожжах.
Инсулин, диабет, синтез, дрожжи, кишечная палочка, микроорганизмы, гормоны, ген, препараты, глюкоза
Короткий адрес: https://sciup.org/170191362
IDR: 170191362 | УДК: 577.175.722 | DOI: 10.24411/2409-4102-2021-10406
Текст научной статьи Синтез инсулина путем генной инженерии и применение его в медицине
белков, особенно инсулина. В 1963 г. был синтезирован искусственный инсулин [1].
Рекомбинантный человеческий инсулин был впервые произведен в E. coli компанией Genentech в 1978 г. с использованием подхода, который требовал экспрессии химически синтезированной кДНК, кодирующей цепи α и β инсулина отдельно в E. coli. После независимой экспрессии две цепи очищают и совместно инкубируют в оптимальных условиях реакции, которые способствовали образованию интактного и биоактивного инсулина за счет образования дисульфидной связи.
Первый коммерческий рекомбинантный инсулин был разработан для терапевтического применения у человека с помощью этой двухцепочечной комбинированной процедуры. Другой подход включает экспрессию единственной химически синтезированной кДНК, кодирующей проинсулин человека, в E. coli, с последующей очисткой и последующим удалением С-пептида протеолитическим расщеплением. Этот подход был более эффективным и удобным для крупномасштабного производства терапевтического инсулина по сравнению с подходом с двухцепочечной комбинацией и коммерчески использовался с 1986 г. Eli Lilly использовала эту технологию для производства хумулина, первого рекомбинантного инсулина, одобренного в 1982 г. для лечения пациентов с диабетом. Эти рекомбинантные инсулины первого поколения имеют аминокислотную последовательность, идентичную нативному человеческому инсулину, и предпочтительнее, чем продукты инсулина животного происхождения. Однако прогресс в области генной инженерии и разработка технологий химического синтеза генов с измененной нуклеотидной последовательностью облегчили разработку аналогов инсулина с измененной аминокислотной последовательностью [3].
Было замечено, что нативный инсулин в коммерческих препаратах обычно существует в олигомерной форме, как цинксодержащий гексамер из-за очень высокой концентрации, но в крови биологически активный инсулин находится в мономерной форме. Следовательно, этот олигомерный комплекс должен диссоциировать, чтобы инсулин мог абсорбироваться из места инъекции в кровь. Из-за этого рекомбинантный инсулин, вводимый подкожно, обычно имеет медленное начало с максимальной концентрацией в плазме после 2 часов с момента инъекции и большей продолжительностью действия, которая длится 6—8 часов.
Следовательно, для разработки быстродействующего аналога инсулина потребовалось модифицировать аминокислотные остатки, боковые цепи которых участвуют в образовании димера или олигомера [1].
Lispro, разработанный Eli Lilly, был первым аналогом инсулина быстрого действия, получившим разрешение регулирующих органов в 1996 г. для терапевтического использования. Инсулин Lispro разработан таким образом, что он имеет аминокислотную последовательность, аналогичную природному инсулину, но имеет инверсию пролин-лизиновой последовательности в положениях 28 и 29 B-цепи, что приводит к снижению гидрофобных взаимодействий и, таким образом, предотвращает образование димеров.
Для коммерческого производства инсулина Lispro синтетическая кДНК, кодирующая про-инсулин Lys B28 — Pro B29 человека, была экспрессирована в E. coli, и инсулин Lispro был протеолитически вырезан из проинсулина обработкой трипсином и карбоксипептидазой. Другой аналог инсулина быстрого действия, продуцируемый E. coli. представляет собой глу-лизин (Apidra), который был разработан Aventis Pharmaceuticals и одобрен регулирующими органами США в 2004 г. Инсулин Глулизин был получен путем замены аспарагина B3 на лизин и лизина B29 на глутаминовую кислоту [3].
Чтобы избежать многократных инъекций, также были созданы аналоги инсулина пролонгированного действия с увеличенной продолжительностью действия. Инсулин Гларгин — один из таких аналогов инсулина длительного действия, который был разработан Aventis Pharmaceuticals и одобрен регулирующими органами США и ЕС в 2000 г. Инсулин Гларгин был получен путем замены С-концевого аспарагина А-цепи остатком глицина и C-конец B-цепи был модифицирован путем добавления двух остатков аргинина. Эти модификации привели к увеличению изоэлектрической точки (pI) с 5,4 до нейтральных значений. Гларгин продуцируется в виде проинсулина и экспрессируется в E. coli, и, наконец, был составлен при pH 4 в растворимой форме. Однако после подкожного введения он выпадал в осадок из-за нейтрального pH в подкожной клетчатке. Ресолюбилизация инсулина происходит медленно, что увеличивает продолжительность его высвобождения в кровь [5].
Система экспрессии дрожжей для производства инсулина
Дрожжи являются очень привлекательный системой экспрессии, позволяющей сочетать дешевизну прокариотического культивирования с эукариотическим процессингом белков. Дрожжи являются одноклеточным организмом, генетика и физиология которого детально изучены и который можно выращивать как в небольших лабораторных колбах, так и в промышленных культиваторах [7].
Для эффективной экспрессии и секреции рекомбинантного проинсулина в дрожжах была сконструирована конструкция инсулина, содержащая нативную α-цепь и β-цепь, лишенную C-концевого треонина B30, либо непосредственно слитого, либо связанного через короткий синтетический C-пептид (например, AAK). Последовательность кДНК, кодирующая эту конструкцию, была слита с сигнальной последовательностью α-фактора Saccharomyces cerevisiae для секретируемой экспрессии проинсулина, которая дала выход до 80 мг/мл инсулина. Одноцепочечный проинсулин очищали и превращали в активный инсулин с помощью реакции транс-пептидации, опосредованной трипсином, в присутствии эфира треонина.
Помимо природного рекомбинантного инсулина, в S. cerevisiae также производятся различные аналоги инсулина [2].
Инсулин Аспарт — аналог инсулина быстрого действия, который был произведен в S. cerevisiae, разработанный Novo Nordisk и одобренный FDA США в 2001 г. для терапевтического использования у человека. Инсулин Аспарт получали заменой остатка пролина в положении 28 на аспарагиновую кислоту в β-цепи. Эта генетическая модификация привела к увеличению отталкивания межцепочечных зарядов, снижению самоассоциации и, таким образом, к быстрому проникновению в кровь из места подкожной инъекции [4].
Инсулин Детемир — рекомбинантный аналог инсулина длительного действия, коммерчески производимый в S. cerevisiae, разработанный Novo Nordisk и одобренный для терапевтического использования у человека в 2004 г. европейскими регулирующими органами.
Рекомбинантный Детемир был получен путем удаления остатка треонина в положении 30 β-цепи и цепи жирной кислоты C14, ковалентно присоединенной к остатку лизина в положении 29 β-цепи. Эти генетические изменения привели к связыванию инсулина с альбумином в плазме, что обеспечивало медленное и постоянное высвобождение инсулина и, таким образом, увеличивало продолжительность его действия до 24 часов [4].
Одна из основных проблем, связанных с получением терапевтического гликопротеина для применения человеком, заключается в том, что дрожжевое N-гликозилирование относится к типу высокоманнозного, что обеспечивает короткий период полужизни в пробирке и гипериммуногенность и, таким образом, снижает эффективность терапевтического гликопротеина.
Система экспрессии кишечной палочки для производства инсулина
E. coli является предпочтительным микроорганизмом для крупномасштабного производства инсулина [9].
Инсулин — это пептидный гормон поджелудочной железы, который состоит из 51 аминокислотного остатка и двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсу-лин из 86 аминокислотных остатков, в котором А- и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин [2].
Ген, синтезирующий человеческий проинсулин (INS), находится в 11 хромосоме.
Путем комплементарной ДНК получили копию INS-гена. Он состоит из комплементарных цепей и «липких концов» (комплементарная последовательность оснований). Полученный ген подстраивается к 3’-концу β-галактозидазы и вводится в раскрытую (разрезанную) ферментом (эндонуклеаза рестрикции), оставляющим «липкие концы», плазмиду PBR322 (рис. 1) [11].
«Липкие концы» чужеродной ДНК и плазмиды PBR322 взаимодействуют друг с другом, образуя комплементарные пары оснований. Затем плазмида замыкается, встраивая в себя новый ген. Фермент ДНК-лигаза окончательно запечатывает плазмиду [6].
Такая рекомбинантная ДНК встраивается в тело E. Coli, в которой плазмида ведет себя как вектор (переносчик) нового гена. В результате, такой вид гена будет реплицироваться в новом поколении E. Coli [8].
В результате жизнедеятельности, такие генно-модифицированные бактерии, осуществляют синтез проинсулина человека, от которого после частичного протеолиза отщепляется С-пептид, превращая его в инсулин.
Полученный инсулин очищают.
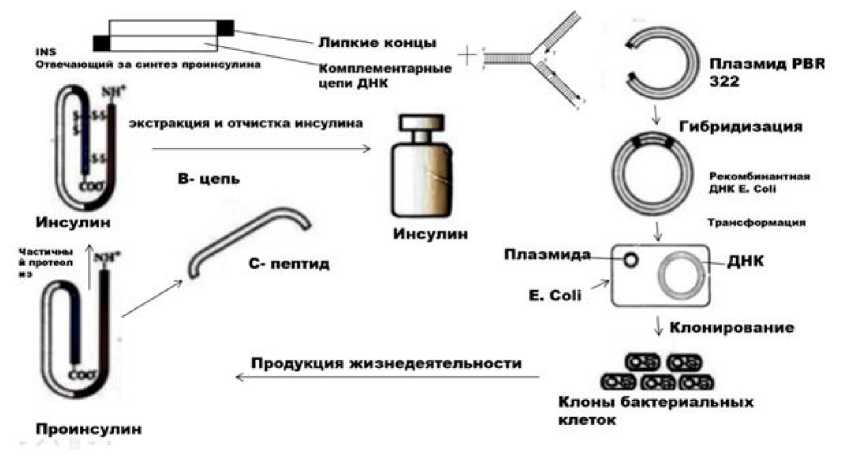
Рис 1. Схема искусственного получения инсулина
Инсулинотерапия при сахарном диабете 1 типа
Интенсивная инсулинотерапия (ИКТ) и инсулиновая помповая терапия (непрерывная подкожная инфузия инсулина; ППИ) являются наиболее распространенными методами инсулиновой терапии для людей с диабетом 1 типа. Обычная инсулино-терапия (КТ) с двумя ежедневными инъекциями предварительно смешанного инсулина используется у людей с диабетом 1 типа только в исключительных случаях [5].
Инсулиновая помпа — это небольшое компьютеризированное устройство, которое непрерывно подает небольшие дозы инсулина для удовлетворения базовых потребностей (почасовая базальная скорость) [10]. Согласно действующим руководствам, интенсивная инсулинотерапия считается золотым стандартом лечения людей с диабетом 1 типа. Помповую инсулинотерапию (ППИИ) назначают только для определенных условий, таких как очень низкая потребность в инсулине. Нет явных преимуществ в пользу того или иного способа применения инсулина при диабете 1 типа. Тем не менее есть некоторые очевидные медицинские причины для использования непрерывной подкожной инфузии инсулина, такие как очень низкая потребность в инсулине или ярко выраженный феномен рассвета. В большинстве случаев столь однозначных причин в пользу непрерывной подкожной инфузии инсулина не существует. Помповая инсулиновая терапия сложна и подходит не всем [5].
Вывод
Проанализировав научные работы, можно сделать вывод, что последние разработки были сосредоточены на сочетании генетической и химической инженерии с фармацевтической оптимизацией для создания аналогов инсулина сверхбыстрого и сверхдлительного действия, научные усилия в области молекулярной инженерии включали реализацию мечты о доставке инсулина, реагирующего на глюкозу. Рекомбинантный человеческий инсулин производится преимущественно с использованием E. coli и Saccharomyces cerevisiae для терапевтического применения у человека. Тем не менее существует острая необходимость в увеличении в несколько раз производства биологически активного инсулина и его аналогов из кишечной палочки и дрожжей с использованием новейших эффективных технологий. Еще одна стратегия с использованием другого экспрессирующего хозяина, отличного от E. coli и Saccharomyces cerevisiae. Системы экспрессии на основе растений обладают огромным потенциалом для высокопроизводительного производства инсулина очень рентабельным способом. Разработанные методики синтеза инсулина предоставили возможность стабилизировать состояние пациентов с сахарным диабетом. Текущие производственные технологии не смогут удовлетворить растущий спрос на инсулин из-за ограниченных производственных мощностей и высокой стоимости производства.
Список литературы Синтез инсулина путем генной инженерии и применение его в медицине
- Практическая эндокринология / под ред. Г. А. Мельниченко. — Москва : Практическая медицина, 2009. — 351 с.
- Baeshen, N. A. Cell factories for insulin production / N. A. Baeshen, M. N. Baeshen, A. Sheikh [et al.] // Microb Cell Fact. — 2014. — Vol. 13. — № 141. — https://doi.org/10.1186/s12934-014-0141-0.
- Актуальные вопросы эндокринологии в терапевтической практике : рук.для врачей / М. Н. Ка-линкин, Л. В. Шпак, Ю. А. Волкова, Е. И. Березина [и др.] ; под ред. М. Н. Калинкин, Л. В. Шпак. — Тверь : Фактор и К, 2014 . — 698 с.
- Ajlouni K. Metabolic syndrome amongst adults in Jordan: prevalence, trend, and its association with socio-demographic characteristics / K. Ajlouni, Y. Khader, M. Alyousfi [et al.] // Diabetol Metab Syndr. — 2020. — Vol. 12. — № 100. — https://doi.org/10.1186/s13098-020-00610-7
- Сахарный диабет и нарушения углеводного обмена / Г. М. Кроненберг, Ш. Мелмед, К. С. Полон-ски : пер. с англ. ; под ред. И. И. Дедова, Г. А. Мельниченко. — Москва : Рид Элсивер, 2010. — 437 с.
- Balbas, P. Back to basics: pBR322 and protein expression systems in E. coli / P. Balbas, F. Bolivar // Methods Mol Biol. — 2004. — Vol. 267. — P. 77-90. doi: 10.1385/1-59259-774-2:077.
- Baeshen, M. N. Production of Biopharmaceuticals in E. coli: Current Scenario and Future Perspectives / A. M. Al-Hejin, R. S. Bora, M. M. Ahmed [et al.] // J Microbiol Biotechnol. — 2015. — Vol. 25. — № 7. — P. 953—962. DOI: 10.4014/jmb.1412.12079.
- Thomason LC, Recombineering: genetic engineering in bacteria using homologous recombination / L. C. Thomason, J. A. Sawitzke, X. Li [et al.] // Curr Protoc Mol Biol. — 2014. — Vol. 106. — P. 1.16.1— 1.16.39. DOI: 10.1002/0471142727.mb0116s106.
- Sawitzke, J. A. Recombineering: in vivo genetic engineering in E. coli, S. enterica, and beyond / J. A. Sawitzke, L. C. Thomason, N. Costantino, M. Bubunenko [et al.] // Methods Enzymol. — 2007. — Vol. 421. — P. 171—199. DOI: 10.1016/S0076-6879(06)21015-2.
- Nimri, R. Insulin Pump Therapy / R. Nimri, J. Nir, M. Phillip // Am J Ther. — 2020. — Vol. 27. — № 1. — P. e30—e41. DOI: 10.1097/MJT.0000000000001097.
- Balbas, P. The plasmid, pBR322 / P. Balbas, X. Soberon, F. Bolivar, R. L. Rodriguez // Biotechnology. — 1988. — Vol. 10. — P. 5—41. DOI: 10.1016/b978-0-409-90042-2.50007-6.


