Синтез комплексных солей 4-гидроксипролина щелочных и щелочноземельных металлов
Автор: Кабиров Г.Ф., Кадырова Р.Г., Муллахметов Р.Р.
Рубрика: Зоотехния
Статья в выпуске: 1 т.225, 2016 года.
Бесплатный доступ
Способ получения солей отличается технологичностью, что позволяет приготовить их в необходимых количествах для изучения токсикологических и фармакологических свойств.
4-гидроксипролин, соли лития, натрия, магния
Короткий адрес: https://sciup.org/14288748
IDR: 14288748 | УДК: 547.461.4
Текст научной статьи Синтез комплексных солей 4-гидроксипролина щелочных и щелочноземельных металлов
4-Гидроксипролин (оптический изомер L-гидроксипролин) по кислотноосновным свойствам относится к нейтральным гетероциклическим а- аминокислотам (4-гидроксипирролидин-2-карбоновая кислота). Изоэлектрическая точка pl 5.83. а-Аминокислотный фрагмент входит в состав пирролидинового цикла.
Остатки L-гидроксипролина входят преимущественно в состав белков соединительной ткани – коллагена (до 13%), а также эластина. L-гидроксипролин – заменимая некодируемая аминокислота, не включается в пептидную цепь при биосинтезе, а образуется при ферментативном гидроксилировании остатков пролина. Продукты метаболизма гидроксипролина в организме – пиррол-2-карбоновая и глутаминовая кислоты [Химик. ru-оксипролин. Химическая энциклопедия; Гидроксипролин. Материал из Википедии, сайт «О химии»; АК-студопедия-html]. 4-Гидроксипролин и его соли используются в качестве компонентов терапевтических средств жаропонижающего, противовоспалительного и анальгетического действия [1, 2]/
Известно, что органически связанные макро-, микроэлементы с а- аминокислотами (хелаты) имеют высокую биологическую доступность, значительно легче усваиваются организмом, чем неорганические соединения [3].
Например, аминокислотный хелат магния, в состав которого входит глицин (15%), магний (5 %), вода (до 100 %) используется в качестве источника макроэлемента магния для птиц и всех видов животных с целью повышения их продуктивности. Магний – важный внутриклеточный катион, участвует в регуляции клеточной проницаемости и нервно-мышечной передачи [Kronoc-agro com ua > . „ Products... Chelates.. .MgLiguid. php]. Создан препарат Chela-MgB6Forte. Препарат награжден Золотой медалью ALBlON. Содержит самую легкую усвояемую форму магния: аминокислотный хелат – бис-глицинат магния и обогащен витамином В6, который совместно с магнием принимает участие в метаболических процессах. Препарат оказывает успокоительное действие, повышает адаптационные способности организма. Эта первая пищевая добавка в мире, содержащая хорошо усваиваемую жидкую форму магния в форме аминокислотного хелата ALBlON(R). Магний – элемент жизни и энергии. Этот минерал поддерживает функцию сердца и всей сердечнососудистой системы. Однако главная функция магния заключается в участие его в синтезе и транспортировки энергии в организме (АТР) [Chela-MgB6Forte Olimp bodybuilding - shop. ru > importnoe vitaminy / olimp–…]. Препараты магния а-аминокислот применяют в кардиологии, например, панангин, который содержит аспарагинаты калия и магния.
Магниевые и кальциевые соли глутаминовой кислоты в медицине используют при лечении многих психических и нервных расстройств и заболеваний. Натриевую соль глутаминовой кислоты применяют в пищевой промышленности для улучшения ценности и вкусовых качеств продуктов [3]. Перспективными лекарственными средствами являются соли лития аминокислот. Они обладают способностью купировать острое маниакальное возбуждение у психических больных и предупреждать аффективные приступы [4].
Предложено фармацевтическое средство, содержащее глицинат и аспарагинат лития, которое используется для профилактики и лечения цереброваскулярных заболеваний [5]. На основе солей лития получена иммуностимулирующая и антиоксидантная композиция, содержащая аскорбат и аспарагинат лития в соотношении 50 : 50 [6].
Из анализа литературных сведений следует, что комплексные соли аминокислот щелочных и щелочноземельных металлов являются соединениями широкого спектра биологического действия.
В этом плане значительный интерес представляют соли лития, натрия магния 4-гидроксипролина – «строительного блока» коллагена. Однако в доступной литературе отсутствуют данные о методах их синтеза и физико-химических характеристиках. С целью изучения токсикологических и фармакологических свойств солей 4-гидроксипролина нами проведены экспериментальные исследования по разработке способов их получения и изучению физико-химических свойств.
Материалы и методы . Для синтеза солей лития, натрия, магния 4-гидроксипролина были использованы следующие реактивы: trans-4-Hydroxy-L-proline, содержание основного вещества 99,0%. New Jersey, USA: 1-800-ACROS-01; гидроксиды лития, натрия, магния марки
«хч».
-
1. Синтез литиевой соли 4-гидроксипролина. К раствору 1 г (0,0076 моль) гидроксипролина в 10 мл воды (рН 5) прибавляют 0,32 г (0,0076 моль) гидроксида лития, LiOH • H 2 O при перемешивании до полного растворения. Гомогенную реакционную смесь нагревают при 45-50 ° С в течение 35 минут (рН 9) и выдерживают при комнатной температуре 2 часа. Гомогенный раствор упаривают, остаток кристаллизуют, обрабатывают этанолом и сушат при комнатной температуре. Получают 1,09 г (92,37 %) моногидрата литиевой соли [C5H 8 O 3 N] Li • H 2 O. Содержание азота (%): найдено – 8,85; вычислено – 9,00. Литиевая соль 4-гидроксипролина белый кристаллический продукт, хорошо растворяется в воде, не растворяется в спирте, ацетоне. Водный раствор имеет рН 8. При температуре 220 ° С обугливается.
-
2. Синтез натриевой соли 4-гидроксиролина. К раствору 1 г (0,0076 моль) гидроксипролина в 10 мл воды прибавляют 0,3 г (0,0076 моль) гидроксида натрия, NaOH и перемешивают до полного растворения. Гомогенную реакционную смесь нагревают при 45-50 ° С 35-40 минут (рН 10) и выдерживают при комнатной температуре 2 часа. Гомогенный раствор упаривают, остаток кристаллизуют, промывают этанолом несколько раз и сушат. Получают 1,33 г (92,36 %) дигидрата натриевой соли 4-гидроксипролина, [C 5 H 8 O3N]Na • 2H 2 O.]. Содержание азота (%):найдено – 7,29; вычислено –7,40. Натриевая соль 4-гидроксипролина белый кристаллический продукт, хорошо растворяется в воде, не растворяется в спирте, ацетоне. Водный раствор имеет рН 8. При температуре 74-76 ° С плавится, 145150 ° С - обугливается.
-
3. Синтез магниевой соли 4-гидроксипролина. К раствору 1 г (0,0076 моль) гидроксипролина в 10 мл воды прибавляют 0,22 г (0,0038 моль) гидроксида магния, Mg(OH) 2 и перемешивают до полного растворения (10 минут) (рН 8). Гомогенную реакционную смесь нагревают при 50-55 ° С в течение 35-40 минут (рН 9), выдерживают при комнатной температуре 2 часа и упаривают. Кристаллический остаток промывают несколько раз этанолом и сушат
-
4. Взаимодействие натриевой соли 4-гидроксипролина с сульфатом меди. К раствору 0,5 г (0,0033 моль) натриевой соли 4-гидроксипролина в 10 мл воды (рН 8) прибавляют 0,41 г (0,00165 моль) сульфата меди, CuSO 4 • 5H 2 O. Реакционную смесь темно-синего цвета нагревают при 50-55 ° С в течение 35 минут. При этом наблюдается выпадение небольшого количества осадка голубого цвета, Cu(OH) 2 .который фильтруют. Гомогенный фильтрат
при комнатной температуре. Получают 1,15 г (94,0 %) дигидрата магниевой соли 4-гидроксипролина, [C5H8O 3 N] 2 Mg • 2H 2 O. Содержание азота (%):найдено – 8,60; вычислено –8,75.
Натриевая соль – блестящие белые кристаллы, хорошо растворяются в воде (рН 8 водного раствора). Не растворяется в спирте, ацетоне. При температуре 174-176 ° С плавится, 195-198 ° С - обугливается.
упаривают, кристаллический остаток темно-синего цвета прмывают спиртом и сушат. Получают 0,44 (66,0%) пентагидрата комплексоната меди (II), [C5H8O3N]2Cu • 5H2O. Комплексонат меди (II) хорошо растворяется в воде, не растворяется в спирте. При температуре 168-170 ° С обугливается.
Комплексонат меди (II) 4-гидроксипролина дает качественные реакции: на аминогруппу – с хлоридом железа (III), образуется хелат красного цвета; на ионы Cu2+ – c K 4 [Fe(CN) 6 ] образуется осадок Cu 2 [Fe(CN) 6 ] – краснобурого цвета.
Результаты исследований. Соли лития, натрия, магния получают взаимодействием 4-гидроксипролина с гидроксидами соответствующих металлов: Реакции протекают по схемам (I и II):
I.
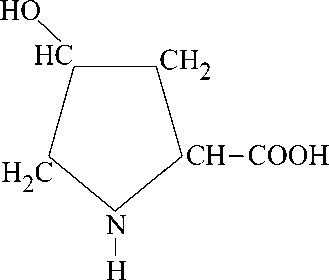
+ MeOH
( _ H2O)
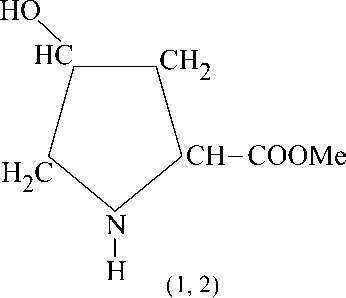
где Me = Li (1); Na(2).
II.
НССН2
+ Mg(OH)2
СН _ СООН (_ 2Н2О)
NH
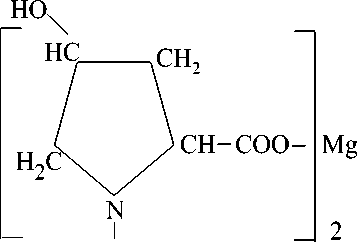
H
Способ получения солей (1-3)
основан на классической реакции нейтрализации. В результате хорошей растворимости 4-гидроксипролина в воде
(36 г / 100г воды) и высокой степени его ионизации в щелочной среде (рН 9-10) реакции протекают в гомогенной фазе. Целевые продукты получают с высокими выходами (более 90 %). Ранее [3] нами был разработан способ получения комплексных солей а -аминокислот d- биогенных металлов действием на реакционную смесь аминокислоты и гидроксида натрия в водной среде (рН 9-10) сульфатом соответствующего металла без выделения промежуточной Na-соли. Реакция протекает в гомогенной фазе с высокими выходами целевых продуктов. Для подтверждения схемы реакции по данному способу через Na-соль субстрата нами исследована реакция взаимодействия Na-соли 4-гидроксипролина с сульфатом меди (II). При действии на раствор Na-соли 4-гидроксипролина в водной среде (рН 8) сульфатом меди (II) (в соотношении 2 : 1 в молях) наблюдается выпадение небольшого осадка Cu(OH)2. В этих условиях гомогенность процесса нарушается так как гидроксид меди (II) растворяется в водной среде при рН 9-10 в результате образования куприта Na 2 [Cu(OH) 4 ]. Выход комплексоната меди (II) 4-гидроксипролина в данном случае составляет 66,0 %. Без выделения Na-соли субстрата – выход комплексоната меди (II) 96,87 %.
Для подтверждения структуры полученных солей (1-3) проведены качественные реакции. Соединения (1-3) дают качественные реакции: на аминогруппу – с хлоридом железа (III) образуются хелаты красного цвета; с сульфатом меди (II) с добавлением ацетата натрия – хелаты ярко синего цвета; с нингидрином растворы окрашиваются первоначально в желтый цвет, который через 30 минут переходит в фиолетовый.
Заключение. Синтезированы новые соединения – соли лития, натрия, магния 4-гидроксипролина взаимодействием с гидроксидами соответствующих металлов. В оптимальных условиях (рН 9-10 реакции, гомогенность реакционной смеси) целевые продукты получают с высокими выходами. Изучены их физико-химические свойства. Способ получения солей отличается технологичностью, что позволяет приготовить их в необходимых количествах для изучения токсикологических и фармакологических свойств.
Резюме
Способ получения солей отличается технологичностью, что позволяет приготовить их в необходимых количествах для изучения токсикологических и фармакологических свойств.
Список литературы Синтез комплексных солей 4-гидроксипролина щелочных и щелочноземельных металлов
- Пат. BV 11422. С 1.12.30.2008. Беларусь. Способ получения N-ацетил-4-гидрокси-L-пролина/З.И. Куваева, Д.В. Лопатик, Т.А. Николаева.
- Пат. США 5827874, 27.10.1998/Meyer Hans.
- Кадырова Р.Г., Кабиров Г.Ф., Муллахметов Р.Р.Биологические свойства и синтез комплексных солей a-аминокислот биогенных металлов. -Казань: Казан. гос.энерг. ун-т, 2014 -108 с.
- Машковский М.Д. Лекарственные средства. -М.: «Новая волна», 2000. -т.1, с. 122-126.
- Пат. RU 2367427. 20.09.2009. Литий-содержащее средство для профилактики и лечения цереброваскулярных заболеваний и способ применения данного средства./О.А. Громова, И.Ю. Торшин, А.А. Никонова, И.В. Гоголева.
- Пат RU 237081. 10.11.2009. Композиция, обладающая иммуностимулирующей и антиоксидантной активностью./Е.Ю. Плотников, В.М. Плотников.


