Синтез производных 6- {[метил(фенил)амино]метил}-2-тиоурацила как новых потенциальных ингибиторов обратной транскриптазы ВИЧ-1
Автор: Гейсман А.Н., Лысенко К.Н., Озеров А.А., Новиков М.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология, токсикология
Статья в выпуске: 1 (57), 2018 года.
Бесплатный доступ
Синтезирован ряд новых производных 2-тиоурацила, содержащих у атома серы арилметильные и фенацильный фрагменты, а в положении 6 - [метил(фенил)амино]метильную группу. Изучены физико-химические и спектральные свойства полученных веществ. Данные соединения рассматриваются в качестве новой группы ненуклеозидных ингибиторов обратной транскриптазы ВИЧ-1.
Синтез, 2-тиоурацил, вич-1, обратная транскриптаза
Короткий адрес: https://sciup.org/142216655
IDR: 142216655 | УДК: 615.3:547.854.4
Текст научной статьи Синтез производных 6- {[метил(фенил)амино]метил}-2-тиоурацила как новых потенциальных ингибиторов обратной транскриптазы ВИЧ-1
Структура 2-тиоксо-2,3-дигидропиримидин-4(1H)-она (2-тиоурацила) лежит в основе разнообразных соединений, обладающих противовирусным действием [1, 2, 10].
Одной из наиболее интенсивно разрабатываемых в последние годы групп S-замещенных 2-тиоурацилов являются ингибиторы обратной транскриптазы (ОТ) ВИЧ-1 ненуклеозидной природы, известные под общим названием дигидро-алкилтио-бензил-оксопиримидины (S-DABO, 1) [5, 9]. Различными исследованиями показано, что ключевыми факторами для наличия высокой противовирусной активности данных веществ является присутствие бензильного или арилкарбонилме- тильного заместителя у атома серы, необходимого для взаимодействия с боковой цепью остатка Pro236 ОТ ВИЧ-1, а также ароматического фрагмента в положении 6, играющего ключевую роль во взаимодействии с гидрофобной аминокислотной триадой фермента (Tyr181, Tyr188 и Trp229) [9].
На сегодняшний день в схемах высокоактивной антиретровирусной терапии (ВААРТ) используются ингибиторы обратной транскриптазы, принадлежащие к другому обширному классу соединений – производных диарилпи-римидина (DAPY). К таким веществам относятся, в частности, этравирин (2) [6] и рилпивирин (3) [8].
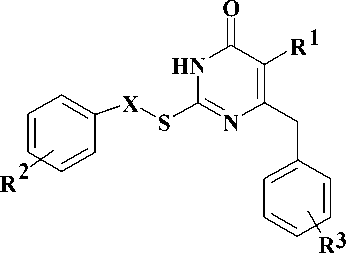
1 X = CH2, (CO)CH2
Одним из перспективных направлений дизайна DAPY является изменение структуры линкера между ароматическим циклом в положении 6 и центральным пиримидиновым фраг- ментом. Данная линия модификации новых ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) направлена на увеличение конформационной адаптивности структуры ингибитора к мутациям гидрофобного кармана ОТ ВИЧ [4]. В рамках концепции фрагмент-
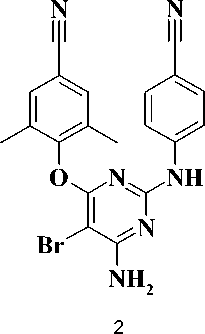
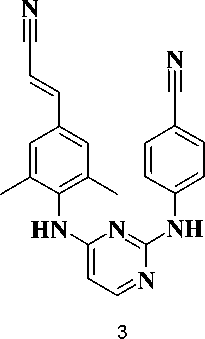
ориентированного поиска лекарств и стратегии молекулярной гибридизации интерес представляет разработка химерных структур, объединяющих признаки классов DAPY и S-DABO.
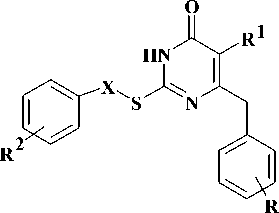
В настоящей работе представлен подход к поиску новых ННИОТ на основе удобного и доступного метода получения производных 2-тиоурацила, содержащих в положении 6 гетероцикла [метил(арил)амино]-метильную группу (рис. 1).
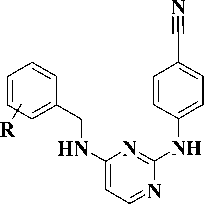
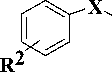
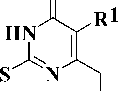
Рис. 1. Стратегия поиска новых ННИОТ
ЦЕЛЬ РАБОТЫ
Синтез ряда новых структурных аналогов S-DABO, содержащих в положении 6 [ме-тил(фенил)амино]метильную группу и арилметильный, а также фенацильный радикалы у атома серы.
МЕТОДИКА ИССЛЕДОВАНИЯ
Спектры ЯМР 1Н- и 13С-регистрировали на спектрометре Bruker Avance-400 (400 для 1Н- и 100 МГц для 13С) в ДМСО-d6, внутренний стандарт ТМС. Интерпретацию спектров осуществляли с помощью лицензионной программы ACD/HNMR Predictor Pro 3.0 фирмы Advanced Chemistry Development (Канада).
Тонкослойную хроматографию выполняли на пластинах Merck TLC Silicagel 60 F254 (Германия), проявление в УФ-свете с помощью УФ-лампы VL-6.LC (Франция). Температуры плавления измеряли в стеклянных ка- пиллярах на приборе Mel-Temp 3.0 (Laboratory Devices Inc., США).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Синтез соединений данного ряда был проведён в несколько этапов (рис. 2).
Реагенты и условия: a – NaHCO3, ДМФА, 80 °C, 16 ч, 75-90 %; b – тиомочевина, NaOCH3, CH3OH, 15 ч, 55–58 %; c – 11–15 или 16, ДМФА, K2CO3, 12 ч, 70–78 %.
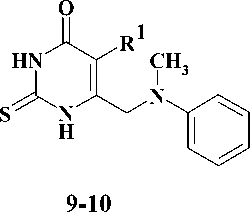
Первая стадия заключалась во взаимодей-ствиии N-метиланилина (4) с 4-галогензаме-щенными кетоэфирами 5–6 в среде N,N-диметил-формамида (ДМФА) в присутствии гидрокарбоната натрия [12]. Выходы полученных производных этил-4-[метил(фенил)амино]-3-оксобу-таноата 7–8 составили 75–90 %. На следующей стадии синтеза кетоэфиры подвергали циклоконденсации с тиомочевиной в безводном ме- таноле в присутствии в качестве основания метилата натрия [3], что приводило к образованию производных 6-{[метил(фенил)амино]метил}-2-тиоурацила 9–10 с выходами 55–58 %. На заключительной стадии синтеза S-алкилированием полученных 2-тиоурацилов 9–10 арил-метилгалогенидами 11–15 и альфа-бромацетофеноном (16) в безводном ДМФА в присутствии карбоната калия [7, 11] получали соответствующие целевые производные 6-{[метил(фенил)ами-но]метил}-2-тиоксо-2,3-дигидропиримидин-4(1H)-она 17–23 с выходами 70–78 %.
Чистота и индивидуальность полученных соединений устанавливалась методом тонкослойной хроматографии, структуры – ЯМР спектроскопии.
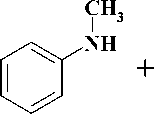
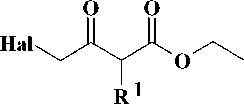
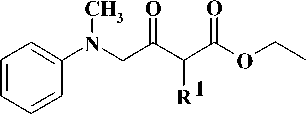
b
5-6
7-8
R Cl
11-15
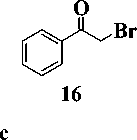
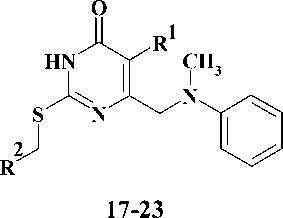
R1= H, CH3;
R2 = C6H5, 2-Cl-C6H4, 3-Cl-C6H4, 4-Cl-C6H4, 4-Py, C6H5-CO; Hal = Cl, Br
Рис. 2. Схема синтеза 6-{[метил(фенил)амино]метил}производных 2-тиоурацила
ЗАКЛЮЧЕНИЕ
Осуществлен синтез 7 новых, не описанных ранее в литературе S- производных 2-тиоурацила, содержащих в положении 6 [ме-тил(фенил)амино]метильную группу. Изучены их спектральные и физико-химические свойства. Полученные соединения рассматриваются как кандидаты в высокоэффективные противовирусные агенты.
Работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 15-44-02651 р_поволжье_а.
Список литературы Синтез производных 6- {[метил(фенил)амино]метил}-2-тиоурацила как новых потенциальных ингибиторов обратной транскриптазы ВИЧ-1
- Botta M. //Bioorg. Med. Chem. -1999. -Vol. 7, № 9. -P. 1925-1931.
- Ding Y. //Bioorg. Chem. -2006. -Vol. 34, № 1. -P. 26-38.
- Geisman A. N. //Bioorg. Med. Chem. -2016. -Vol. 24, № 11. -P. 2476-2485.
- Gu S.-X. //Bioorg. Med. Chem. -2015. -Vol. 23, № 20. -P. 6587-6593.
- Li W. //Chem. Biol. Drug Des. -2016. -Vol. 88, № 3. -P. 380-385.
- Ludovici D. W. //Bioorg. Med. Chem. Lett. -2001. -Vol. 11, № 17. -P. 2235-2239.
- Mai A. //J. Med. Chem. -1997. -Vol. 40, № 10. -P. 1447-1454.
- Mordant C. //Eur. J. Med. Chem. -2007. -Vol. 42, № 5. -P. 567-579.
- Mugnaini C. //J. Med. Chem. -2007. -Vol. 50, № 26. -P. 6580-6595.
- Ramajayam R. //Bioorg. Med. Chem. Lett. -2010. -Vol. 20, № 12. -P. 3569-3572.
- Zhang L. //Molecules. -2014. -Vol. 19, № 6. -P. 7104-7121.
- Zhang Y.//J. Org. Chem. -2012. -Vol. 77, № 7. -P. 3462-3467.

![Синтез производных 6- {[метил(фенил)амино]метил}-2-тиоурацила как новых потенциальных ингибиторов обратной транскриптазы ВИЧ-1 Синтез производных 6- {[метил(фенил)амино]метил}-2-тиоурацила как новых потенциальных ингибиторов обратной транскриптазы ВИЧ-1](/file/cover/142216655/sintez-proizvodnyh-6-metil-fenil-amino-metil-2-tiouracila-kak-novyh.png)
