Скрининг штаммов антагонистов возбудителя белой гнили рапса
Автор: Маслиенко Л.В., Курилова Д.А., Шипиевская Е.Ю.
Рубрика: Защита и иммунитет
Статья в выпуске: 2 (151-152), 2012 года.
Бесплатный доступ
С целью разработки микробиологических мер борьбы с белой гнилью рапса проведён скрининг штаммов грибов и бактерий из коллекции антагонистов возбудителей болезней масличных культур лаборатории биометода ВНИИМК. В результате первичного скрининга выделено 11 штаммов грибов, относящихся к родам Trichoderma, Penicillium, Trichothecium, Talaramyces и Chaetomium и 15 перспективных штаммов бактерий, относящихся к родам Bacillus и Pseudomonas и обладающих различным механизмом подавления возбудителя белой гнили рапса. В результате ступенчатого скрининга отобраны штаммы гриба Xk-1-4 Chaetomium olivaceum и бактерии Б-12 Bacillus licheniformis, разлагающие склероции белой гнили на 80-100 % и обладающие ростостимулирующей активностью к культуре рапса.
Рапс, белая гниль, скрининг, штаммы антагонисты, антагонистическая активность, жизнеспособность склероциев, микробиопрепараты
Короткий адрес: https://sciup.org/142151086
IDR: 142151086 | УДК: 632.4:633.853.494
Текст научной статьи Скрининг штаммов антагонистов возбудителя белой гнили рапса
Введение. В России массовое распространение получили передоваемые через почву болезни экономически значимых сельскохозяйственных культур. В отношении их возбудителей фунгициды малоэффективны, сорта и гибриды с группогрупповой устойчивостью практически отсутствуют.
Особую опасность для многих сельскохозяйственных культур, в том числе и масличных (подсолнечника, рапса и сои) представляет белая гниль Sclerotinia scle-rotiorum (Lib.) De Bary. В последние годы в регионе Северного Кавказа белая гниль особенно вредоносна на озимом рапсе – распространённость составляет 30–70 %, с высокой степенью поражения растений (3–4 балла). Вредоносность белой гнили выражается в преждевременном усыхании растений, снижении урожая и ухудшении его качества. Основной запас инфекционного начала возбудителя болезни сохраняется на растительных остатках и в почве в виде склероциев. Наиболее приемлемый путь решения проблемы – целенаправленное заселение почвы и растительных остатков поражённых растений антагонистами, обладающими, кроме фунгицидных свойств, ещё и целлюлозоразрушающей активностью
Усилия учёных многих стран в течение нескольких десятилетий были направлены на поиски мер борьбы с белой гнилью, или склеротиниозом, на подсолнечнике. В связи с тем, что основной запас инфекции возбудителя сохраняется в почве и на растительных остатках в виде склероци-ев, биологические меры борьбы направлены на уменьшение потенциала почвенной инфекции путём интродукции в почву антагонистов. Большинство работ во многих странах посвящено изучению эффективного гиперпаразита на склеро-циях белой гнили Coniothyrium minitans Campbell – в Канаде [1; 2], Румынии [3], Молдавии [4, 5], Украине [6]. Проводился поиск и других антагонистов, перспективных для разработки биологического метода борьбы с белой гнилью на подсолнечнике. Лидирующее положение во всех странах занимают грибы-антагонисты из рода Trichoderma (T. harzianum, T. viri- de, T. koningii, T. hamatum) и из рода Glio-cladium (G. roseum, G. catenulatum, G. virens). В качестве антагонистов выделены также грибы из рода Fusarium, Spo-ridesmium, Mucor, Verticillium, Aspergillus, Trichothecium, Talaromyces, Penicillium, Chaetomium и бактерии из рода Bacillus [7-23].
Таким образом, в мировой литературе представлено большое количество работ, авторы которых сообщают о коммерческих штаммах микробов-антагонистов, проявляющих высокую активность в отношении возбудителя белой гнили, однако готовых и эффективных препаратов, защищающих растения, а особенно, снижающих запас инфекционного начала болезни, крайне недостаточно. Кроме того, исследования антагонистической активности ( in vitro и или in vivo ) микроорганизмов к возбудителю белой гнили проводились в основном на подсолнечнике. Сведения о проведении таких исследований на озимом рапсе отсутствуют.
Материалы и методы. Скрининг штаммов антагонистов из коллекции лаборатории биометода к возбудителю белой гнили на рапсе проводили in vitro, затем во влажной камере в лабораторных условиях. Активные штаммы оценивали на фитотоксичность и ростостимулирующую активность к растениям озимого рапса.
Определение антагонистической активности штаммов in vitro осуществляли методом двойных или встречных культур [24]. Культуры антагонистов и возбудителя болезни выращивали отдельно в течение 5 дней на агаризованной питательной среде. Сверлом, предварительно простерилизованным, вырезали блоки с мицелием антагониста и патогена и помещали в одну чашку Петри на расстоянии 6 см. Контролем служили культуры антагонистов и патогенов, посеянные порознь. Учёты проводили на пятые, десятые, пятнадцатые и тридцатые сутки культивирования. Отмечали рост патогена и антагониста и характер их взаимодействия.
В лабораторных условиях во влажной камере определяли влияние антагонистов на жизнеспособность склероциев методом инфекционной капли [25]. Белую гниль выращивали на твёрдой питательной среде в течение 30 дней при температуре 18-20 оС. Выращенные склероции помещали во влажную камеру в чашки Петри и пипеткой наносили на склероции суспензию спор антагонистов с титром не менее 1*107 КОЕ/мл. Затем склероции поддерживали во влажном состоянии в течение 60 дней. Для определения жизнеспособности склероциев их разрезали и пересевали на агаризированную питательную среду. Контролем служили склероции, помещённые во влажную камеру без антагониста.
Исследование активных штаммов на возможное патогенное или токсичное действие на культуру озимого рапса проводили методом замачивания семян и 7-дневных проростков в суспензии антагонистов. Для этого культуры активных штаммов антагонистов выращивали на агаризированных питательных средах при температуре 25 °С в течение 10 суток. Семена озимого рапса замачивали на 2 ч в суспензии антагонистов и ставили на проращивание в рулоны из фильтровальной бумаги. Контроль - семена, замоченные в стерильной воде. Учёты проводили через 7 дней. По количеству проросших семян в вариантах и в контроле судили о фитотоксичности выделенных антагонистов, а по длине корней и стеблей и по весу корней по сравнению с контролем судили об их ростостимулирующей активности. С целью установления влияния перспективных штаммов на увядание проростков озимого рапса в суспензию антагонистов помещали здоровые 7-дневные проростки. Контроль - стерильная вода. По количеству увядших растений в контроле и в вариантах судили о патогенности отобранных штаммов.
Результаты и обсуждение. В основе разработанной нами концепции целенаправленного создания микробиопрепаратов для защиты подсолнечника и других сельскохозяйственных культур от болезней, лежит поиск штаммов антагонистов, безопасных для человека, нефитотоксич-ных, проявляющих высокую активность в широко варьируемых условиях против комплекса возбудителей заболеваний, обладающих полифункциональным типом действия [23]. В результате многолетних исследований в лаборатории биометода ВНИИМК создана коллекция перспективных штаммов грибов и бактерий-антагонистов широкого круга патогенов, поражающих масличные культуры.
Первичным этапом скрининга было определение антагонистической активности штаммов грибов и бактерий антагонистов из коллекции лаборатории к возбудителю белой гнили озимого рапса методом двойных культур (табл. 1, 2, 3).
При определении антагонистической активности грибных штаммов методом двойных культур их взаимоотношения с возбудителем белой гнили сводились к нескольким типам:
-
1 тип – разрастание колонии антагониста, которая занимала максимальную поверхность питательной среды, не давая расти колонии патогена. Данное взаимоотношение с патогеном характерно для грибов из родов Trichoderma , Penicillium, Sordaria. Эти грибы отличались быстрым ростом в чистой культуре;
-
2 тип – замедление роста колонии патогена на некотором расстоянии от колонии антагониста (антибиотическая зона). Такая зона отмечена при взаимодействии Sclerotinia sclerotiorum с грибами из родов Penicillium, Trichoderma, Trichothe-cium ;
-
3 тип – более интенсивный рост патогена в начальный период (30–60 % поверхности питательной среды) с последующим нарастанием колонии антагониста на колонию патогена, в которой происходило изменение окраски, струк-
- туры и гибель мицелия. Такой тип взаимоотношений характерен для возбудителя белой гнили и антагонистов из класса Basidiomycetes и рода Chae-tomium. Кроме того, у представителей рода Chaetomium образовавшиеся склероции белой гнили покрывались плодовыми телами антагониста.
Максимальную антагонистическую активность к возбудителю белой гнили проявили штаммы грибов из рода Trichoderma (Т-1, Т-2, Т-3). Площадь зарастания поверхности питательной среды в чашке Петри в двойных культурах составляла 100 % (1 тип) (рис. 1).
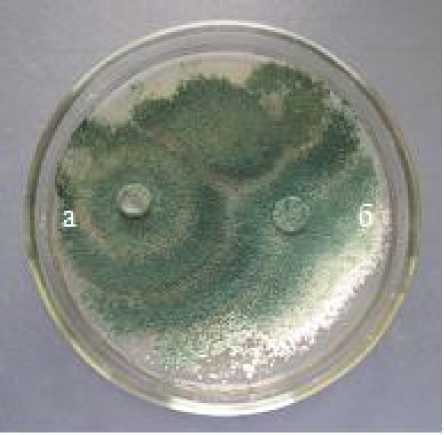
Рисунок 1 – Антагонистическая активность штамма Т-1 Trichoderma sp. к возбудителю белой гнили
Sclerotinia sclerotiorum (ориг.): а – антагонист, б – патоген.
Высокую антагонистическую активность к возбудителю белой гнили при одновременном посеве в чашки Петри проявили грибы из рода Penicillium и штамм Sm-1 Sordaria macrospora . Особенно выделялись грибы Pr-1 Penicillium rugulosum и Pk-1-3 Penicillium vermicu-latum, когда мицелий патогена успевал обрасти только посевной блок и полностью подавлялся антагонистом.
Антагонистическая активность штаммов грибов-антагонистов к возбудителю белой гнили рапса Sclerotinia sclerotiorum, на 10-е сутки культивирования
Краснодар, ВНИИМК, 2011 г.
|
Вариант |
Площадь зарастания поверхности питательной среды |
Зона нарастания антагониста (а), патогена (п) |
Размер анти-биотической зоны, мм |
||||||
|
контроль |
антагонистом |
патогеном |
|||||||
|
% |
см² |
% |
см² |
% |
см² |
% |
см² |
||
|
Sclerotinia scleroti- orum |
100 |
66,4 |
- |
- |
- |
- |
- |
- |
- |
|
Tv-1 Trichoderma viride |
85,0 |
56,4 |
75,0 |
49,8 |
25,0 |
16,6 |
20,5 |
а 13,6 |
2,0 |
|
T-1 Trichoderma sp. |
100 |
66,4 |
100 |
66,4 |
0 |
0 |
0 |
0 |
0 |
|
T-2 Trichoderma sp. |
100 |
66,4 |
100 |
66,4 |
0 |
0 |
0 |
0 |
0 |
|
T-3 Trichoderma sp. |
100 |
66,4 |
100 |
66,4 |
0 |
0 |
0 |
0 |
0 |
|
T-4 Trichoderma sp. |
90,0 |
59,8 |
98,0 |
65,1 |
2,0 |
1,3 |
2,0 |
а 1,3 |
0 |
|
Pk-1-3 Penicillium vermiculatum |
100 |
66,4 |
96,3 |
63,9 |
3,7 |
2,9 |
3,7 |
а 2,9 |
0 |
|
M-24 P. vermiculatum |
95 |
63,1 |
70,0 |
48,5 |
10,0 |
6,6 |
0 |
0 |
1,0 |
|
Pv-3 P. verrucosum |
100 |
66,4 |
80,0 |
53,1 |
20,0 |
13,3 |
0 |
0 |
3,0 |
|
Pf-1 P. funiculosum |
100 |
66,4 |
60,0 |
39,8 |
4,0 |
2,7 |
0 |
0 |
0 |
|
Pbc-1 P. brevi- compactum |
100 |
66,4 |
95,0 |
63,1 |
2,5 |
3,3 |
0 |
0 |
0 |
|
Pr-1 P. rugulosum |
100 |
66,4 |
100 |
66,4 |
0 |
0 |
0 |
0 |
0 |
|
Pp-1 P. purpurescens |
100 |
66,4 |
70,0 |
46,5 |
7,5 |
5,0 |
0 |
0 |
4,0 |
|
Tr-1 Trichothecium roseum |
60,0 |
39,8 |
47,5 |
31,5 |
52,5 |
34,9 |
0 |
0 |
7,5 |
|
Xk-1 Chaetomium olivaceum |
40,0 |
26,6 |
30,0 |
19,9 |
50,0 |
33,2 |
4,0 |
а 2,7 |
0 |
|
Xk-1-4 Ch. olivaceum |
40,0 |
26,6 |
40,0 |
26,6 |
45,0 |
29,9 |
7,0 |
а 4,7 |
0 |
|
Хк-2 Ch. globosum |
60,0 |
39,8 |
50,0 |
33,2 |
15,0 |
10,0 |
4,0 |
а 2,7 |
0 |
|
Sm-1 Sordaria macrospora |
100 |
66,4 |
100 |
66,4 |
0 |
0 |
0 |
0 |
0 |
|
Tt-1 Talaramyces trachispermus |
20,0 |
13,3 |
20,0 |
13,3 |
36,5 |
64,7 |
0 |
0 |
7,0 |
|
A-1 Basidiomycetes |
100 |
66,4 |
92,5 |
61,4 |
7,5 |
5,0 |
8,5 |
5,6 |
0 |
|
И-3 Basidiomycetes |
95,0 |
63,1 |
45,0 |
29,9 |
55,0 |
36,5 |
9,5 |
п 6,3 |
0 |
Антагонисты Tr-1 Trichotecium roseum и Tt-1 Talaramyces trachispermus не занимали большую поверхность площади питания, но образовывали максимальную антибиотическую зону – 7,0–7,5 мм (2 тип).
Грибы из рода Chaetomium (Xk-1, Xk-1-4 Chaetomium olivaceum и Хk-2 Chаetomium globosum ) не отличались быстрым ростом и занимали в двойных культурах с возбудителем белой гнили 40,0–50,0 % поверхности питательной среды (рис. 2), но на 15–20-й день совместного культивирования образовавшиеся склероции патогена полностью покрывались плодовыми телами антагонистов (3 тип).
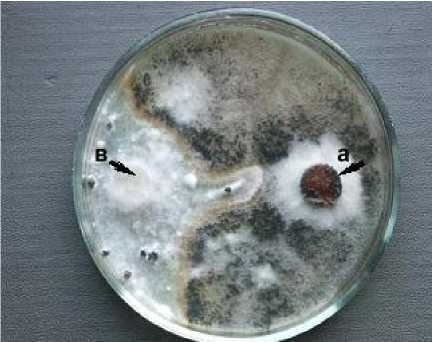
Рисунок 2 – Антагонистическая активность штамма Хk-1-4 Chaetomium olivacеum к возбудителю белой гнили
Sclerotinia sclerotiorum (ориг.): а – антагонист, в – патоген.
Таким образом, из коллекции грибов антагонистов выделились 11 штаммов с различным механизмом подавления возбудителя белой гнили: T-1, T-2, T-3
Trichoderma sp., Pk-1-3 P. vermiculatum, Pr-1 P. rugulosum, Tr-1 Trichotecium roseum , Tt-1 Tal. trachispermus, Xk-1, Xk-1-4 Ch. olivaceum и ХК-2 Ch. globo-sum .
Штаммы бактерий по механизму антагонистического действия на возбудителя белой гнили разделены на две группы:
-
- штаммы, образующие стерильную зону антагонистического действия (табл. 2);
-
- штаммы, ингибирующие развитие патогена, занимая бόльшую площадь питательной среды ЧП (табл. 3).
Таблица 2
Антагонистическая активность бактериальных штаммов, образующих стерильную зону в отношении гриба Sclerotinia sclerotiorum
Краснодар, ВНИИМК, 2011 г.
|
Штамм |
Диаметр зоны ингибирования, мм |
|
|
инкубация, сутки |
||
|
5- е |
7- е |
|
|
Sgc-1 Pseudomonas sp. |
0 |
0 |
|
12-2 Pseudomonas sp. |
18,5±4,5 |
21,0±3,0 |
|
13-2 Pseudomonas sp. |
0 |
0 |
|
15-1 Pseudomonas sp. |
0 |
0 |
|
Sgrc-1 P. Fluorescens |
0 |
0 |
|
14-3 P . chlororaphis |
18,5±0,5 |
19,5±0,5 |
|
14-4 Pseudomonas sp. |
13,5±0,5 |
17,5±2,5 |
|
16-2 Pseudomonas sp. |
0 |
0 |
|
Oif 2-1 Pseudomonas sp. |
0 |
0 |
|
D 1-3 Bacillus sp . |
1,0±1,0 |
8,5±3,5 |
|
3-1 Bacillus sp . |
4,5±1,5 |
0 |
|
3-2 Bacillus sp . |
3,0±1,0 |
0 |
|
3-3 Bacillus sp . |
8,0±1,0 |
0 |
|
1а B. polymyxa |
7,0±1,0 |
0 |
|
К1-1 B. subtilis |
15,0±1,0 |
14,5±0,5 |
|
Р-9 B. polymyxa |
21,0±1,0 |
30,0±2,0 |
|
11-1 Bacillus sp . |
28,0±2,0 |
0 |
|
11-3 Bacillus sp . |
31,0±2,0 |
0 |
|
ВВ(С) B. subtilis |
7,0±1,0 |
0 |
|
5Б-1 B. subtilis |
8,0±0 |
0 |
Установлено, что максимальную стерильную зону антагонистического действия с возбудителем белой гнили образовывали штаммы бактерий из рода Pseudomonas (12-2 Pseudomonas sp., 14-3 P. chlororaphis и 14-4 Pseudomonas sp. ) – 17,5–21,0 мм. Из бактерий рода Bacillus выделились штаммы К1-1 B. subtilis, D 1-3 Bacillus sp ., и Р-9 B. polymyxa , образующие зоны ингибирования 8,5–30,0 мм.
Из бактериальных штаммов рода Bacillus выделилось 9 штаммов, обладающих высоким показателем подвижности в отношении гриба S. sclerotiorum (табл. 3).
Таблица 3
Антагонистическая активность бактериальных штаммов рода Bacillus , обладающих высоким показателем подвижности, в отношении гриба Sclero-tinia sclerotiorum
Краснодар, ВНИИМК, 2011 г.
|
Штамм |
Рост мицелия патогена от посевного блока, мм |
|
|
инкубация, сутки |
||
|
5-е |
7-е |
|
|
Контроль |
8,0±0,7 |
74,0±1,4 |
|
01 корf Bacillus sp . |
1,5±0,5 |
1,5±0,5 |
|
D 10 Bacillus sp . |
0 |
0 |
|
D 1-1 Bacillus sp . |
0 |
0 |
|
Fa 4-1 B. subtilis |
4,0±1,0 |
3,0±1,0 |
|
Fa 4-2 Bacillus sp . |
0 |
0 |
|
Far 8 Bacillus sp . |
0 |
0 |
|
5-3 Bacillus sp . |
0 |
0 |
|
D 7-1 B. subtilis |
0 |
3,0±0,5 |
|
D 7-3 Bacillus sp . |
0 |
0 |
|
Р-8 B. polymyxa |
27,5±2,5 |
27,5±2,5 |
|
Fz 9 Bacillus sp . |
0 |
0 |
|
Б (2-1) B. licheniformis |
4,0±2,0 |
4,0±2,0 |
|
Б-2 B. circulans |
15,0±15,0 |
17,0±17,0 |
|
Б-4 B. circulans |
2,0±1,0 |
42,0±2,0 |
|
Б-5 B. licheniformis |
0 |
0 |
|
Б-12 B. licheniformis |
0 |
0 |
Максимальную ингибирующую активность по отношению к S. sclerotiorum проявили штаммы D 1-1 Bacillus sp ., D 10 Bacillus sp ., Fa 4-2 Bacillus sp ., Far 8 Bacillus sp ., 5-3 Bacillus sp ., D 7-3 Bacillus sp ., Fz 9 Bacillus sp ., Б-5 и Б-12 B. licheni-formis, которые занимали всю площадь питательной среды ЧП, блокируя развитие патогена (рис. 3).
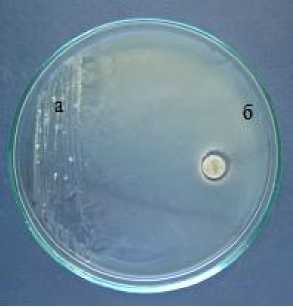
Рисунок 3 – Антагонистическая активность штамма Б-12 Bacillus licheniformis к возбудителю белой гнили Sclerotinia scle-rotiorum (ориг.): а – антагонист, б – патоген.
Таким образом, из коллекции бактерий-антагонистов выделились 15 штаммов с различным механизмом подавления возбудителя белой гнили:12-2 Pseudomonas sp., 14-3 P. chlororaphis, 14-4 Pseudomonas sp., К1-1 B. subtilis, D 1-3 Bacillus sp ., Р-9 B. polymyxa, D 1-1 Bacillus sp ., D 10 Bacillus sp ., Fa 4-2 Bacillus sp ., Far 8 Bacillus sp ., 5-3 Bacillus sp ., D 7-3 Bacillus sp ., Fz 9 Bacillus sp ., Б-5и Б-12 B. licheni-formis.
Следующим этапом скрининга было определение влияния выделенных перспективных штаммов грибов и бактерий-антагонистов на жизнеспособность скле-роциев белой гнили методом инфекционной капли (табл. 4).
Таблица 4
Влияние перспективных штаммов грибов-антагонистов на жизнеспособность склероциев белой гнили (метод инфекционной капли)
Краснодар, ВНИИМК, 2011, 2012 гг.
|
Штамм |
Титр, КОЕ/г |
Жизнеспособность склероциев, % |
|
Контроль |
- |
90,0 |
|
T-1 Trichoderma sp. |
4,8 x 109 |
20,0 |
|
T-2 Trichoderma sp. |
5,2 x 109 |
30,0 |
|
T-3 Trichoderma sp. |
2,8 x 109 |
40,0 |
|
PK-1-3 Penicillium vermiculatum |
2,0 х 109 |
40,0 |
|
Pr-1 P.rugulosum |
2,8 х 109 |
30,0 |
|
Tr-1 Trichothecium roseum |
2,8 х 109 |
60,0 |
|
Sm-1 Sordaria macrospora |
1,8 x 108 |
40,0 |
|
Xk-1 Chaetomium olivaceum |
1,7 x 108 |
30,0 |
|
Xk-1-4 Ch.olivaceum |
1,8 x108 |
0 |
|
Xk-2 Ch .globosum |
2,0 x108 |
30,0 |
|
Tt-1 Talaramyces trachispermus |
2,0 х 109 |
60,0 |
При испытании грибов-антагонистов склероции полностью разлагались за 60 дней в варианте с грибом Xk-1-4 Ch. oliva-ceum (рис 4). Ha 80,0 % снижалась жизнеспособность склероциев при нанесении суспензии гриба T-1 Trichoderma sp., на 70,0 % – Xk-1 Ch. olivaceum , Xk-2 Ch. globosum и, на 60,0 % – T-3 Trichoder-ma sp., Pk-1-3 P. vermiculatum и Sm-1 Sor-daria macrospora.
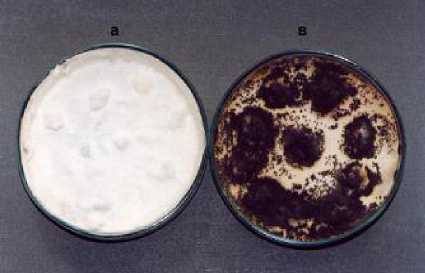
Рисунок 4 – Подавление жизнеспособности склероциев белой гнили Sclerotinia scleroti-orum штаммом Хk-1-4 Chaetomium olivacеum (ориг.):
а – контроль, в – вариант.
При смачивании склероциев суспензиями бактерий и дальнейшем содержании их во влажной камере жизнеспособность склероциев снижалась меньше (табл. 5).
Таблица 5
Влияние перспективных штаммов бактерий-антагонистов на жизнеспособность склероциев белой гнили (метод инфекционной капли)
Краснодар, ВНИИМК, 2011, 2012 гг.
|
Штамм |
Титр, КОЕ/мл |
Жизнеспособность склеро-циев, % |
|
Контроль |
- |
90,0 |
|
Б-5 Bacillus licheniformis |
1,0 х 1010 |
20,0 |
|
Б-12 B. licheniformis |
1,2 х 1010 |
20,0 |
|
К -1-1 Bacillus subtilis |
1,8 х 1010 |
50,0 |
|
D1-3 Bacillus sp. |
1,8 х 1010 |
90,0 |
|
5-3 Bacillus sp. |
1,5 х 1010 |
50,0 |
|
D-1-1 Bacillus sp. |
1,0 х 1010 |
50,0 |
|
D 10 Bacillus sp . |
1,3 х 1010 |
80,0 |
|
Fa 4-2 Bacillus sp . |
1,0 х 1010 |
80,0 |
|
Far 8 Bacillus sp . |
1,6 х 1010 |
70,0 |
|
D 7-3 Bacillus sp . |
1,2 х 1010 |
70,0 |
|
Fz 9 Bacillus sp |
1,4 х 1010 |
60,0 |
|
Р-9 B. polymyxa |
1,5 х 1010 |
70,0 |
|
12-2 Pseudomonas sp. |
1,8 х 1012 |
80,0 |
|
14-3 P. chlororaphis |
1,5 х 1012 |
80,0 |
|
14-4 Pseudomonas sp. |
1,0 х 1012 |
80,0 |
На 80,0 % разлагались склероции в вариантах с бактериями Б-5 и Б-12 B. licheniformis, на 50,0 % – в вариантах со штаммами К-1-1 B. subtilis, 5-3 Bacillus sp . и D 1-1 Bacillus sp.
При замачивании склероциев суспензиями бактерий рода Pseudomonas , и дальнейшем содержании их во влажной каме-камере жизнеспособными оставались 80,0 % склероциев.
Таким образом, в результате скрининга выделились штаммы грибов Xk-1-4 Ch. olivaceum, T-1 Trichoderma sp., и бактерии Б-5 и Б-12 B. licheniformis, разлагающие склероции белой гнили на 80–100 %.
Дальнейший этап скрининга включал исследование активных штаммов грибов и бактерий-антагонистов на возможное токсическое, патогенное воздействие на культуру рапса (табл. 6).
Таблица 6
Фитотоксичность перспективных штаммов антагонистов к культуре рапса, сорт Миот
Краснодар, ВНИИМК, 2011, 2012 гг.
|
Вариант |
Обработка семян |
Погружение корней проростков в суспензию |
|
всхожесть, % |
увядание, % |
|
|
Контроль |
92,0 |
0 |
|
Б-5 Bacillus licheniformis |
97,0 |
0 |
|
Б-12 Bacillus licheniformis |
98,0 |
0 |
|
Tk-1 Trichoderma sp. |
98,0 |
0 |
|
Xk-1-4 Chaetomium olivaceum |
98,0 |
0 |
Анализ данных показал, что тестируемые штаммы не оказывают негативного влияния на всхожесть семян, а также не вызывают увядания проростков рапса.
Далее было исследовано влияние перспективных штаммов антагонистов на культуру озимого рапса с целью установления их ростостимулирующего действия (табл. 7).
Установлено, что перспективные штаммы антагонистов обладали ростостимулирующей активностью, оказывая наибольшее влияние на длину и массу корня рапса (118,1–246,1 и 133,3–266,7 % соответственно). Максимальное увеличение этих показателей установлено у штаммов Xk-1-4 Chaetomium olivaceum и Б-12 B. liche-niformis. Кроме того, штамм Xk-1-4
Ch. olivaceum значительно увеличивал длину и массу побега (42,2–50,0 %).
Таблица 7
Влияние активных штаммов антагонистов на рост и развитие проростков озимого рапса, сорт Миот
|
Вариант |
Длина корня |
Длина побега |
Масса корня |
Масса побега |
||||
|
см |
в % к конт-ролю |
см |
в % к конт-ролю |
г |
в % к конт-ролю |
г |
в % к конт-ролю |
|
|
Контроль |
3,04 |
- |
2,87 |
- |
0,006 |
- |
0,022 |
- |
|
XK-1-4 Chaeto-mium olivaceum |
6,63 |
118,1 |
4,08 |
42,2 |
0,017 |
183,3 |
0,033 |
50,0 |
|
T-1 Tricho-derma sp. |
6,94 |
128,2 |
2,82 |
0 |
0,014 |
133,3 |
0,021 |
0 |
|
Б-5 Bacillus lichenifor-mis |
10,45 |
243,8 |
2,96 |
3,1 |
0,018 |
200,0 |
0,018 |
0 |
|
Б-12 Bacillus lichenifor-mis |
10,52 |
246,1 |
3,00 |
4,5 |
0,022 |
266,7 |
0,21 |
0 |
Выводы. 1. Из коллекции грибов-антагонистов выделены 11 штаммов, с различным механизмом подавления возбудителя белой гнили: T-1, T-2, T-3 Trichoderma sp., Pk-1-3 Penicillium vermiculatum, Pr-1 Penicillium rugulosum, Tr-1 Trichothecium roseum , Tt-1 Talaramyces trachispermus, Xk-1, Xk-1-4 Chaetomium olivaceum и Хk-2 Chаetomium globosum .
-
2. Из коллекции бактерий-антагонистов выделены 15 штаммов с различным механизмом подавления возбудителя белой гнили: 12-2 Pseudomonas sp., 14-3 Pseudomonas chlororaphis, 14-4 Pseudomonas sp., К1-1 B. subtilis, D 1-3 Bacillus sp ., Р-9 B. polymyxa, D 1-1 Bacillus sp ., D 10 Bacillus sp ., Fa 4-2 Bacillus sp ., Far 8 Bacillus sp ., 5-3 Bacillus sp ., D 7-3 Bacillus sp ., Fz 9 Bacillus sp ., Б-5 B. licheniformis и Б-12 B. licheniformis.
-
3. В результате ступенчатого скрининга отобраны штаммы гриба Xk-1-4 Chaetomium olivaceum и бактерии Б-12 Bacillus licheniformis, разлагающие склероции белой гнили на 80–100 % и обладающие ростостимулирующей активностью к культуре рапса.
Исследования выполнены при финансовой поддержке РФФИ, грант 11-08-96512.


