Случай применения аллогенных мезенхимных стволовых клеток адипогенного происхождения в ветеринарной медицине
Автор: Закирова Е.Ю., Азизова Д.А., Хафизов Р.Г., Багманов М.А., Хафизова Ф.А., Сергеев М.А., Гюнтер В.Э., Ризванов А.А.
Статья в выпуске: 4 т.224, 2015 года.
Бесплатный доступ
Аллогенные МСК, выделенные из жировой ткани собаки, имели фибробластоподобную морфологию и сохраняли ее на протяжении всего культивирования клеток. В процессе остеогенной дифференцировки наблюдали изменение формы клеток с веретеновидной на кубоидальную, свойственную остеобластам. Реакция Von Kossa выявила наличие значительных минеральных отложений в культуре МСК, подвергнутой остеогенной дифференцировке. Культивирование МСК в хондрогенной среде стимулировало образование сферических уплотненных структур характерных для клеток хрящевой ткани, которые интенсивно окрашивались Alcian Blue,. Результатом проведенного оперативного вмешательства стало полное закрытие ороантрального свища у собаки.
Аллогенные мезенхимные клетки, стромальные клетки, порошок из никелида титана, направленная костная регенерация, пластика ороантрального свища
Короткий адрес: https://sciup.org/14288731
IDR: 14288731 | УДК: 619:591.8.05
Текст научной статьи Случай применения аллогенных мезенхимных стволовых клеток адипогенного происхождения в ветеринарной медицине
В настоящее время активно проводятся биоинженерные исследования по изучению свойств стволовых клеток и их возможному использованию в репаративной медицине [1]. Мезенхимные стволовые клетки (МСК) способны трансформироваться почти в любой вид клеток, имеющийся в организме [2]. В последние время особый интерес биологов и врачей вызывают стволовые клетки, получаемые из жировой ткани (СКЖТ).
Популяция свежевыделенных клеток жировой ткани гетерогенна и характеризуется высоким содержанием клеток, экспрессирующих антиген CD34. В процессе культивирования наблюдается обогащение популяции клетками, несущими маркеры, идентичные МСК костного мозга (КМ), — CD29, CD44, CD71, CD90, CD105, CD106, CD166 . Поэтому в ряде случаев СКЖТ могут представлять собой альтернативу МСК из КМ, получение которых связано с определенными техническими и медицинскими проблемами [3].
СКЖТ способны дифференцироваться в клетки костной, хрящевой, жировой, мышечной, нервной ткани, в клетки сосудистой стенки (эндотелиальные и перициты) [4]. В исследованиях последних лет показано, что СКЖТ обладают выраженной ангиогенной активностью, в основном - за счет секреции ряда ключевых ангиогенных факторов роста: фактора роста эндотелия сосудов (VEGF), фактора роста гепатоцитов (HGF), фактора роста фибробластов 2-го типа (FGF2) и др. [5].
На сегодняшний день интерес вызывает возможность стромальных клеток дифференцироваться в клетки костной ткани.
Применение стромальных клеток в стоматологии открывает широкие возможности для использования клеточных технологий в челюстно-лицевой хирургии, пародонтологии и имплантологии [6]. Известно большое количество способов пластики костных дефектов альвеолярного отростка челюстей, однако применяемые материалы не всегда удовлетворяют предъявляемым к ним требованиям.
Известно, что стромально-васкулярная фракция жировой ткани содержит истинные «покоящиеся» мезенхимальные стволовые клетки, которые имеют характеристики, аналогичные свойствам стромальных клеток костного мозга: обладают высокой пролиферативной активностью, способны к самоподдержанию и мультилинейной (в том числе, остеогенной) дифференцировке [7].
Сложность применения суспензии МСК, заключается в том, что в отсутствии какого-либо инкубатора-носителя она растекается в окружающие ткани. Созданные в НИИ медицинских материалов и имплантатов с памятью формы (г.Томск) объемные пористо-проницаемые инкубаторы из никелида титана обладают уникальными свойствами: имеют пористопроницаемую структуру с высокой степенью открытостью пор, обладают удивительной смачиваемостью с тканевыми жидкостями, высокой биологической, биомеханической и биохимической совместимостью на клеточном уровне [8].
В данном случае в качестве «поставщика-носителя» клеток используются биосовместимый мелкогранулированный пористый никелид титана с размерами пор от 0,1-1000 мкм, полученный методом самораспространяющегося высокотемпературного синтеза. Структура инкубатора из пористого проницаемого никелида титана представляет собой трехмерное поровое пространство, морфологическое строение которого типично для высокопористых материалов. Пористый материал имеет большую удельную поверхность, обусловленную наличием в нем системы открытых и взаимосвязанных пор. Поверхность стенок пор очень развита, она рельефная и шероховато-микропористая [9]. Метод костной регенерации, основанный на уникальных титановых гранулах с пористой структурой, позволяет сохранять и регенерировать костную ткань, Под воздействием капиллярного эффекта гранулы склеиваются между собой, вступая в контакт с кровью или слюной пациента. Титановая поверхность обладает высоким тромбогенным эффектом, что способствует формированию устойчивого сгустка крови вокруг гранул. Оптимальный пористый эффект в комбинации с максимизированной структурой поверхности предельно соответствует свойствам кости человека и, тем самым, создает естественные предпосылки для быстрого и здорового роста костной ткани. Улучшается также остеоинтеграция за счет колонизации костеобразующей клетки. Гранулы обеспечивают быструю механическую стабильность и не рассасываются. Таким образом, пористый проницаемый инкубатор применения в хирургической стоматологии и челюстно-лицевой хирургии аллогенных МСК из жировой ткани при закрытии ороантрального свища у собак.
Материалы и методы. Половозрелая сука, порода немецкая овчарка, возраст 3 года. Около 1,5 года назад после удаления постоянного зуба (клыка) по поводу осложненного кариеса справа на верхней челюсти образовался ороантральный свищ. Были жалобы на попадание пищи в носовую полость, появился гнилостный запах. После курса противовоспалительной терапии (промывание пазухи через из никелида титана является уникальным биосовместимым носителем клеточных культур тканей организма и может использоваться для создания искусственных тканеинженерных конструкций[10]. Использование никелид-
свищевой ход антибиотикотерапия цефтриаксоном, неоднократно была свища мягкими
антисептиками, линкомицином, гентамицином) проведена пластика тканями. Однако
титановых гранул, насыщенных стволовыми клетками - одно из наиболее новых и перспективных направлений современной стоматологии и медицины.
хирургические вмешательства результата не дали, у собаки наблюдался рецедив свищевого хода по переходной складке справа на верхней челюсти длиной около 1 см и шириной 0,2см. Перед проведением
Цель нашего экспериментально целесообразность и
исследования
-
эксперимента сделали рентгеновский снимок челюсти собаки. (рис 1).
обосновать эффективность
А)
В)
С)
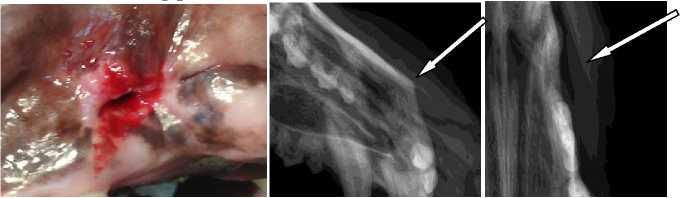
Рис.1. Альвеолярный отросток правой верхней челюсти собаки со сформированным ороантральным свищем до операции направленной тканевой регенерации:
А). Наружное отверстие свищевого хода в полости рта у собаки;
В). На рентгеновском снимке в боковой проекции свищевой ход прослеживается в виде тени в области отсутствующего клыка (стрелка);
С). Рентгеновский снимок в прямой проекции – стрелкой указана область свищевого хода.
Нами было предложено проведение операции по направленной тканевой регенерации в области ороантрального свища с одномоментной пластикой мягкими тканями. В качестве остеоиндуктивного материала использовали аллогенные мезенхимные стволовые клетки в комбинации с никелид-титановыми гранулами (нитигран).
Аллогенные мезенхимные клетки адипогенного происхождения были получены от половозрелой суки, породы чау-чау. Осуществляли ежедневное прижизненное наблюдение за культурами клеток с помощью инвертированного микроскопа AxioObserver Z1 (Carl Zeiss, Германия) методом световой микроскопии. Питательные среды меняли 2 раза в неделю.
Для исследования способности МСК к дифференцировке в остеогенном и хондрогенном направлениях, полученные клеточные культуры инкубировали специальных средах.
Для установления факта дифференцировки в выбранных направлениях на 21 день инкубации со специальными средами культуры клеток фиксировали и проводили окрашивание. Для определения минерализации, являющейся признаком остеогенной дифференцировки, использовали реакцию Von Kossa. Для выявления хондрогенной дифференцировки проводили окрашивание на кислые мукополисахариды, являющиеся маркером хондрообразования красителем Alcian Blue.
Клеточно-терапевтический препарат готовили непосредственно перед трансплантацией. В качестве матрикса для удержания клеток локально использовали никелид-титановые гранулы. Клетки 4 пассажа трипсинизировали, подсчитали, тщательно отмывали от остатков трипсина и питательной среды методом центрифугирования.
Операция проводилась под потенцированной общей анестезией в стерильных условиях. Режущим инструментом было проведено иссечение измененной слизистой в области свищевого хода, вылущены грануляции из полости пазухи, многократно промыли полость пазухи растворами антисептиков, обработали фрезами поверхность костной ткани по всей длине свищевого хода и
дефект заполнили никелид-титановыми гранулами, насыщенными аллогенными мезенхимными стволовыми клетками, сверху накрыли коллагеновой мембраной. Далее провели пластику области свища мягкими тканями, края раны ушили викрилом, дополнительно покрыли фибриновым клеем Тиссуколом (БАКСТЕР АГ, Австрия), смешанным с МСК. Собаке была назначена антибиотикотерапия препаратом максипим 250 мг внутримышечно 1 раз в день в течение 5 дней. Общее количество МСК, введенных собаке, составило 6000000.
В последствии проводилось динамическое рентгенологическое обследование животного и внешний осмотр.
Результаты исследований.
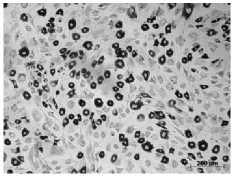
Аллогенные МСК, выделенные из жировой ткани собаки, имели фибробластоподобную морфологию и сохраняли ее на протяжении всего культивирования клеток.
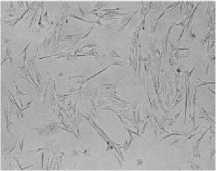
В процессе остеогенной дифференцировки наблюдали изменение формы клеток с веретеновидной на кубоидальную, свойственную остеобластам. Реакция Von Kossa выявила наличие значительных минеральных отложений в культуре МСК, подвергнутой остеогенной дифференцировке (рис. 2а), в то время как в культурах, инкубировавшихся в контрольной среде, таковых не наблюдалось (рис.2в).
С)
D)
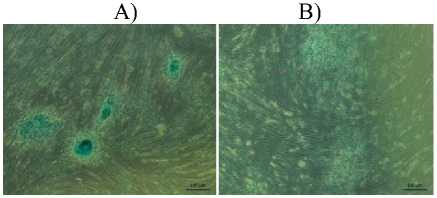
Рис.2. Дифференцировочный потенциал МСК собаки, адипогенного происхожения, световая
микроскопия:
Остеогенная дифференцировка: A) эксперимент, B) контроль; Хондрогенная дифференцировка: C) эксперимент; D) контроль;
Культивирование МСК в хондрогенной среде стимулировало образование сферических уплотненных структур, которые интенсивно окрашивались Alcian Blue. Это протеогликансульфатов, характерных для клеток хрящевой ткани (рис. 2 с,d).
Результатом проведенного оперативного вмешательства стало полное закрытие ороантрального свища у собаки свидетельствует о присутствии в матриксе
(рис.3).
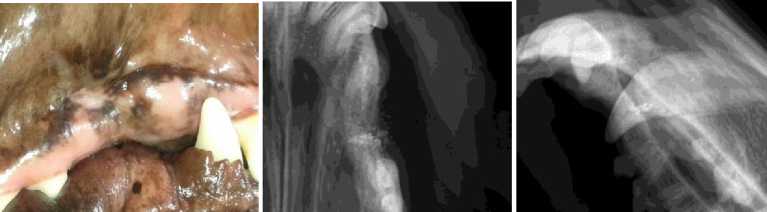
A)
B) C)
Рис.3. Альвеолярный отросток правой верхней челюсти собаки через 1 мес после операции
направленной тканевой регенерации:
-
A) . В полости рта у собаки наружное отверстие свищевого хода полностью закрыто;
-
B) . Рентгеновский снимок в боковой проекции – по проекции свищевого хода определяются
никелид-титановые гранулы;
-
C) . На рентгеновском снимке видно закрытие свищевого хода никелид-титановыми гранулами, насыщенными МСК.
Выводы . Таким образом, полученные результаты демонстрируют целесообразность применения предлагаемого способа костной пластики для устранения дефектов кости. Способ характеризуется малой инвазивностью, иммунологической безупречностью, онкогенной безопасностью, не требует существенных материальных затрат и может быть применен в практической медицине.
Аллогенные МСК, выделенные из жировой ткани собаки, имели фибробластоподобную морфологию и сохраняли ее на протяжении всего культивирования клеток.
В процессе остеогенной дифференцировки наблюдали изменение формы клеток с веретеновидной на кубоидальную, свойственную остеобластам. Реакция Von Kossa выявила наличие значительных минеральных отложений в культуре МСК, подвергнутой остеогенной дифференцировке.
Культивирование МСК в хондрогенной среде стимулировало образование сферических уплотненных структур характерных для клеток хрящевой ткани, которые интенсивно окрашивались Alcian Blue,.
Результатом проведенного оперативного вмешательства стало полное закрытие ороантрального свища у собаки.
Список литературы Случай применения аллогенных мезенхимных стволовых клеток адипогенного происхождения в ветеринарной медицине
- Азизова, Д.А. Экспериментально-клиническое обоснование применения пористых материалов на основе сплава никелида титана для наращивания объема костной ткани в зонах дентальной имплантации: Автореф…диссерт.. канд. мед. наук.-Казань, 2012.
- Грудянов, А.И. Клеточные технологии в пародонтологии./А.И. Грядов, В.Л. Зорин, А.И. Зорина, И.И. Степанова//Стоматология.-2009.-№1.-С.71-73.
- Корочкин, Л.И. Стволовые клетки в биологии и медицине./Л.И. Корочкин//Вестник эстетической медицины.-Казань, 2005.-№1.-С.9-18.
- Кулаков, А.А. Устранение критических костных дефектов с помощью биоинженерной конструкции на нерезорбируемой полимерной основе с использованием аутогенных мультипотентных стромальных клеток из жировой ткани./А.А. Кулаков, А.С. Григорян, Е.В. Киселева и др.//Стоматология.-2010.-№3.-С.9-12.
- Петровский, Я.Л. Сравнительная характеристика мезенхимальных стромальных клеток костного мозга, жировой ткани и плаценты человека: Автореф… диссерт. … канд. мед. наук.-Новосибирск, 2009.
- Фролова, Е.Н. Заживление костного дефекта в челюсти кроликов под влиянием ксеногенных мезенхимальных стволовых клеток костного мозга, культивированных на титановых носителях./Е.Н. Фролова, Н.Н. Мальгинов, А.С.Григорьян, Е.В. Киселева, А.А. Докторов, В.Н. Матвеева, А.И. Воложин//Российский стоматологический журнал.-2008.-№3.-С.12-14.
- Хафизов, Р.Г. Особенности восстановления сегментарного дефекта альвеолярной части нижней челюсти у собак/Р.Г. Хафизов, М.З. Миргазизов, Д.А. Азизова, А.И. Фролова и др.//Ученые записки КГАВМ им. Н.Э. Баумана.-Казань, 2012.Т.209.-С.335-339.
- Шумаков, В.И. Клеточная трансплантация в современной медицине./В.И. Шумаков, Н.А. Онищенко//Патологическая физиология и экспериментальная медицина.-2004.-№4.-С.23-25.
- Lee, R.H. Characterization and expression analysis of mesenchymal stem cells from human bone marrow and adipose tissue./Lee R.H., Kim B.C., Choi I.S. et al.//Cell Physiol Biochem, 2004.-№14.-С.311-324.


