Случай рН-положительного хронического миелоидного лейкоза с вариантной транслокацией Т(7;9;22)
Автор: Каримов Х.Я., Бобоев К.Т., Ассесорова Ю.Ю., Алланазарова Б.Р., Мустафина Л.К.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.13, 2017 года.
Бесплатный доступ
Хромосомные перестройки, приводящие к появлению атипичной Ph-хромосомы, выявляются у 5-10 % пациентов с ХМЛ. Вариантные транслокации возникают в результате вовлеченияв перестройку не только хромосом 9 и 22,но и других хромосом. Проведение стандартного цитогенетического исследования у больных ХМЛ дает возможность выявлять атипичные реаранжирокви, которые могут являться не только диагностическими маркерами, но и обуславливать вариант течения заболевания. Представленный случай наблюдения описывает новую вариантную транслокацию t(7,9,22)(q22; q34; qll)у больного ХМЛ в хронической стадии. Кроме того, показана значимость метода стандартного цитогенетического исследования для выявления атипичных реаранжировок и определения цитогенетических регионов разрывов.
Хронический миелолейкоз, ph-хромосома, вариантная транслокация
Короткий адрес: https://sciup.org/170171601
IDR: 170171601
Текст научной статьи Случай рН-положительного хронического миелоидного лейкоза с вариантной транслокацией Т(7;9;22)
Введение. Развитие хронического миелоидного лейкоза (ХМЛ) обусловлено реципрокной транслокацией t(9;22)(q34; qll.2), приводящей к образованию химерного гена BCR-ABL. Цитогенетическим проявлением данной транслокации является дериватная хромосома 22, называемая филадельфийской (Ph) хромосомой. Стандартным цитогенетическим исследованием (СЦИ) Ph-хромосому находят примерно у 90% больных ХМЛ. Однако у 5-10% пациентов дериват хромосомы 22 отличается от классической Ph-хромосомы и часто не обнаруживается методом СЦИ [1]. При этом молекулярно-генетические исследования, как правило, подтверждают наличие BCR-ABL [2,3]. Атипичность Ph-хромосомы обусловлена вовлечением в транслокацию не только хромосом 9и22,ноидругиххромосом. В литературе описано множество случаев дополнительного участия в патогенетической мутации ХМЛ от одной до трех дополнительных хромосом [4,5,6,1]. Каждый описанный случай является уникальным генетическим событием, приводящим к структурно-функциональным изменениям ряда генов. В зависимости от функции вовлеченных генов и молекулярных точек разрывов, такие мутации могут не иметь последствий, но также могут стать причиной изменения течения заболевания и ухудшения прогноза. В настоящее время среди исследователей нет единого мнения о прогностической значимости вариантных транслокаций t(V;9;22). Ряд авторов считает, что при вовлечении в транслокацию дополнительных хромосом прогноз остается таким же, как и при классической 1(9;22) [1,7]. Другие исследователи полагают, что вариантные транслокации обуславливают худший прогноз [6]. Накопление данных о вариантных перестройках с вовлечением хромосом 9 и 22, встречающихся при ХМЛ, позволит понять патогенетические механизмы течения гемобластоза и проводить прогностическую оценку в каждом конкретном нетипичном случае заболевания.
В настоящем исследовании нами представлен случай хронического миелоидного лейкоза с новой вариантной транслокацией t(7,9,22)(q22; q34; qll).
Материалы и методы исследования. Хромосомный анализ проводили методом стандартного цитогенетического исследования (СЦИ) с использованием рутинного окрашивания красителем Гимза и GTG-бэндинга с разрешением до 350 бэндов на кариотип. Для комплексной оценки кариотипа с целью выявления хромосомных изменений, ассоциированных с ХМЛ, анализировали метафазные пластинки, полученные из костного мозга больного. Культивирование ядерных клеток костного мозга проводили в краткосрочной культуре (24 часа) при температуре 37°C на питательной среде, содержащей RPMI-1640 с глутамином и 20% телячьей эмбриональной сыворотки (Компания «ПанЭко»). Остановку клеточного деления на стадии метафазы производили с помощью колхицина (0,01%), который вносили в среду в количестве 4 мкл при посадке. Гипотонизацию клеток раствором хлорида калия (0,55%) проводили в течение 25 мин при температуре 37 °C. Фиксацию клеток осуществляли трехкратным проведением через охлажденный до -4 °C фиксатор (этанол/ледяная уксусная кислота — 2,5:1). Хромосомные препараты готовили раскапыванием суспензии ядерных фрагментов клеток на влажные охлажденные предметные стекла. Полученные препараты высушивали при температуре 25 °C, окрашивали по методу Гимза с предварительной обработкой 0,25 % раствором трипсина и микроскопировали (микроскоп АХЮ Scope. А1, «Zeiss»). Поиск метафаз осуществляли при увеличении 200 (окуляры PI 10х/23 Zeiss, объектив ЕС Plan-NEOFLUAR20x/05 Ph2 оо/0,17), анализ метафазных пластинок — при увеличении 1000 (окуляры PI 10х/23 Zeiss, объектив С Plan-NEOFLUAR100x/l,3 Oil оо/0,17).
Было проанализировано 35 метафазных пластинок. Идентификацию хромосом проводили в соответствии с международной системой цитогенетической номенклатуры ISCN2009 [8].
Результаты и обсуждение. Клиническое наблюдение. Больному Ш., 1976 г. р., поступившему в состоянии средней тяжести в НИИ гематологии и переливания крови Минздрава РУз (НИИГ и ПК, Ташкент), в июле 2017 года был поставлен диагноз хронического миелоидного лейкоза. До обращения в специализированное учреждение при случайном медицинском обследовании у пациента были выявлены изменения в общем анализе крови. Общий анализ крови больного при поступлении в гематологическое отделение института показал: гемоглобин—126 г/л, эритроциты— 3,9Т012/л, цветной показатель — 0,9, тромбоциты — 404,0-109/л., лейкоциты — 95,0-109/л, бласты — 2 %, миелоциты — 5 %, метамиелобласты — 8 %, палочкоядерные клетки — 11%, сегментоядерные — 66 %, эозинофилы — 2 %, базофилы — 2 %, лимфоциты — 1 %, моноциты — 3 %, СОЭ — 23 мм/ч. Изучение цитологического состава костного мозга показало многоклеточность, бласты—1,8%, лимфоциты — 5,6 %, лейко-эритроцитарный индекс — 9:1, мегакариоциты — в достаточном количестве.
Цитогенетический анализ, проведенный в НИИГиПК М3 РУз, показал, что в 85% [30/35] клеток костного мозга больного присутствовала дериватная хромосома 22 (Ph-хромосома) (Рис. 1А.). Кроме того, при анализе метафазных пластинок были выявлены еще две дериватные хромосомы, одна из которых была идентифицирована как der(9), а другая — как der(7). При классической транслокации 1(9 ;22) дериватная хромосома 9 характеризуется визуальным увеличением светлой эухроматиновой зоны на конце длинного плеча за счет перемещения на него большей части q-плеча хромосомы 22. В случае описываемой нами перестройки q-плечо хромосомы 9 было на 25 % длиннее, чем у ее нормального гомолога вследствие перенесения на него части q-плеча хромосомы 7. Изменение хромосомы 7 цитогенетически определялось как отсутствие крупного терминального фрагмента q-плеча (Рис. 1Б.).
Я •
А.
7 der7 9 der9 It ■ # е I *11
____________________________________________ Б.
I S| | । • 1 l i i
1 2 3 45
. ■ ®. He » # .• • wit Л—Л в в
1II11111
6 7 8 ^9^ 10 1112
TV w w vv w w
13 14
19 20
^Ph
17 1S
Y В.
Puc. 1. A. Kapuomun больного ХМЛ с тремя дериватными хромосомами.
Б. Нормальные и дериватные хромосомы 7 и 9. В. Идеограмма, выполненная с помощью программы ВидеоТесТ-Карио-3.1. Вовлеченные в перестройку хромосомы и их дериваты обозначены стрелками. (Увеличение ><1000)
Относительный размер длины р- и q-плечей дериватов 9-й и 7-й хромосом и их гомологов, не затронутых перестройкой, размер трансло-цированных фрагментов, а также расположение бэндов позволило ориентировочно определить регионы разрывов в хромосомах, участвующих в вариантной транслокации t(7,9,22) (Рис. 2). Локусы разрывов на хромосомах 9 и 22 (соответственно, q34 и ql 1.2) хорошо известны и описаны в литературе. На 7-й хромосоме точка разрыва лежала в области эухроматиновой зоны, расположенной между двумя темноокрашенны-ми гетерохроматиновыми бэндами и идентифицируемой по системе ISCN2009, как локус q22. Анализ метафазных пластинок с помощью программы ВидеоТесТ-Карио-3.1 подтвердил наличие цитогенетической перестройки с вовлечением и 7-й, 9-й и 22-й хромосом — t(7,9,22)(q22; q34; qll) (Рис. IB.).
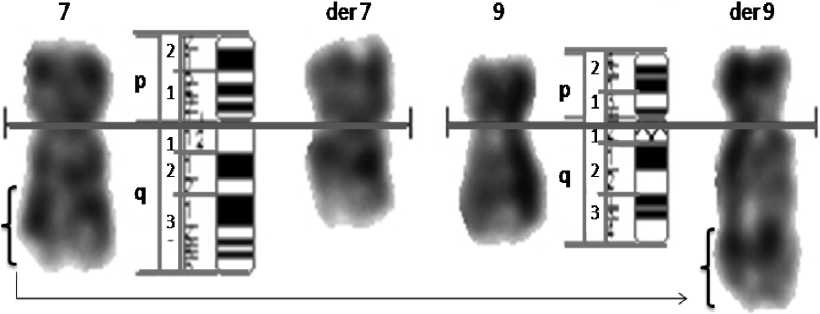
Рис. 2. Идентификация локусов разрывов и транслоцируемых фрагментов на хромосомах 7 и 9, вовлеченных в транслокацию t(7,9,22)(q22; q34; qll) (ISCN2009). (Увеличение xlOOO).
Таким образом, кариотипирование методом СЦИ костного мозга больного ХМЛ в хронической стадии позволило выявить вариантную транслокацию с вовлечением трех хромосом: 7, 9 и 22.
Во всех случаях перестроек с участием хромосом 9 и 22 происходит формирование химерного гена BCR-ABL, кодирующего белок с повышенной тирозинкиназной активностью, который играет ключевую роль в патогенезе ХМЛ. В отличие от дополнительных хромосомных аномалий, возникающих по мере развития ХМЛ и являющихся свидетельством наступления бластного криза, классическая транслокация t(9;22) и вариантные реаранжировки с участием хромосом 9 и 22 являются относительно стабильными хромосомными аномалиями, регистрируемыми при первичной диагностике и сохраняющимися цитогенетически неизмененными в течение заболевания. Однако вопрос о прогностической значимости вариантных транслокаций остается спорным. Возможно, течение заболевания, восприимчивость к терапии и прогноз зависят от степени сбалансированности комплексной вариантной мутации, что связано с потерей или дополнительным внесением генетического материала, а также со структурно-функциональным изменением генов, лежащих в локусах разрывов и отвечающих за пролиферацию и дифференцировку гемопоэтических клеток. Дисбаланс в функционировании генов, как правило, усиливает злокачественные свойства опухолевых клеток. Это выражается в интенсификации передачи опухолевым клеткам сигналов к пролиферации или в ослаблении супрессирующих сигналов, подавлении дифференцировки и апоптоза, приобретении резистентности к противоопухолевым препаратам и других проявлениях.
Новая вариантная реаранжировка 1(7,9,22) (q22; q34; ql 1) была выявлена нами у больного
ХМЛ в хронической стадии на фоне гиперлейкоцитоза, высокого содержания бластных клеток, низкой концентрации лимфоцитов. При этом, несмотря на прием гидреа (1000 мг/д), цитоге-матологические показатели и общее состояние больного продолжали ухудшаться. Ответ на вопрос о прогностической значимости подобных реаранжировок может быть получен при накоплении и систематизации данных по вариантным транслокациям с вовлечением хромосом 9 и 22. Однако анализ данных осложняется уникальностью каждого случая, обусловленной индивидуальным комплексом вовлеченных хромосом и локусов разрывов. Стандартное цитогенетическое исследование, оценивая состояние всего кариотипа, позволяет не только выявлять маркерные и атипичные реаранжирокви, но и определять цитогенетические регионы разрывов, приводящих к мутациям. Выявление данных локусов позволяет предполагать спектр генов, вовлеченных в формирование патогенетического лейкозного клона и, в дальнейшем, сузить поиск молекулярно-генетических маркеров, ассоциированных с вариантом течения ХМЛ и прогнозом.
Заключение. Клинический случай представляет интерес по следующим аспектам. У больного хроническим миелоидным лейкозом описана новая вариантная транслокация с вовлечением хромосом 7, 9 и 22. Хромосомная перестройка t(7,9,22)(q22; q34; qll) выявлена при первичной диагностике у пациента с заболеванием, находящимся в хронической стадии, что позволяет отнести ее к патогенетическим реаранжировкам, ассоциированным с хроническим миелоидным лейкозом. Проведение стандартного цитогенетического исследования при первичной диагностике и в динамике гемобластоза дает возможность выявлять атипичные реаранжирокви, которые могут являться не только диагностическими маркерами, но и обуславливать вариант течения заболевания.
Список литературы Случай рН-положительного хронического миелоидного лейкоза с вариантной транслокацией Т(7;9;22)
- Yokota S., Nakamura Y., Bessho M. A novel five-way translocation t(7;ll;9;22;9)(q22; ql3; q34; ql 1.2; q34) involving Ph chromosome in a patient of chronic myeloid leukemia: a case report // Mol Cytogenet. -2012 May 1,-5(1). -P.20.
- Sessarego M., Fugazza G., Bruzzone R., et al. Complex chromosome rearrangements may locate the bcr/abl fusion gene sites other than 22qll // Haematologica. 2000 Jan. 85(1). P.35-39.
- Batista D. A., Hawkins A., Murphy К. M., Griffin C. A. BCR/ABL rearrangement in two cases of Philadelphia chromosome negative chronic myeloid leukemia: deletion on the derivative chromosome 9 may or not be present // Cancer Genet Cytogenet. 2005 Dec. 163(2). P. 164-167.
- ALAchkar W., Wafa A., Nweder M. S. A complex translocation t(5;9;22) in Philadelphia cells involving the short arm of chromosome 5 in a case of chronic myelogenous leukemia // J Exp Clin Cancer Res. 2007 Sep. 26(3). P.411-415.
- Ikuta K., Torimoto Y, Jimbo J., et al. A novel five-way chromosomal translocation observed in chronic myelogenous leukemia // Cancer Genet Cytogenet. 2008 May. 183(1). P.69-71.
- Kuru D., Tarkan Argiiden Y, Ar M. C., et al. Variant Philadelphia translocations with different breakpoints in six chronic myeloid leukemiapatients // Turk J Haematol. 2011 Sep 5. 28(3). P.186-92.
- Bennour A., Bellaaj H., Ben Youssef Y, et al. Molecular cytogenetic characterization of Philadelphia-negative rearrangements in chronic myeloid leukemia patients // J Cancer Res Clin Oncol. 2011 Sep. 137(9). P.1329- 1336.
- Shaffer L.G., Slovak M.L., Campbell L. J., KargerS., eds. ISCN, 2009. An international systeme for human cytogenetic nomenclature. Basel; 2009.


