Содержание белка теплового шока HSP70 в нейронах теменной коры и гиппокампа крыс с церебральной ишемией различной степени тяжести
Автор: Бонь Е.И., Максимович Н.Е., Карнюшко О.А., Зиматкин С.М., Белоконь С.С., Петухов З.А.
Журнал: Владикавказский математический журнал @vmj-ru
Статья в выпуске: 3 т.26, 2024 года.
Бесплатный доступ
В работе поднимается вопрос повышения резистентности организма к недостатку кислорода и энергодефициту в условиях церебральной ишемии различной степени тяжести. Адаптация к данным условиям представлена повышением выработки в нейронах головного мозга белков теплового шока. Их экспрессия повышается при уменьшении в крови количества кислорода. Цель - оценить содержание HSP70 в головном мозге крыс с ишемией головного мозга различной степени тяжести.
Белок теплового шока, нейроны, церебральная ишемия
Короткий адрес: https://sciup.org/143183193
IDR: 143183193 | УДК: 616.831.31-005.4.-092.913:618.33 | DOI: 10.34014/2227-1848-2024-3-117-125
Текст научной статьи Содержание белка теплового шока HSP70 в нейронах теменной коры и гиппокампа крыс с церебральной ишемией различной степени тяжести
Введение. Белки теплового шока (англ. HSP, heat shock proteins) – это класс функционально сходных белков, экспрессия которых возрастает при повышении температуры или при других стресс-воздействиях на клетку, в т.ч. при ишемии [1, 2].
Белки теплового шока являются универсальными молекулярными шаперонами (от англ. chaperon – сопровождать), т.е. белками, связывающимися с другими молекулами и в таком комплексе выполняющими определенные функции.
Основной функцией HSP считается контроль образования новых белков и формирование их третичной структуры (фолдинг). Связываясь с растущими пептидными цепями на рибосоме, HSP предотвращают их неспецифическую агрегацию, предохраняют от преждевременного протеолитического распада и способствуют правильному и своевременному сворачиванию полипептида в третичную структуру. HSP также связывают измененные белки или белки, третичная структура которых уже сформировалась неправильно, защищая клетку от их воздействия [1].
При воздействии стрессорных факторов активность HSP резко возрастает. Они интенсивно связываются с денатурированными белками и поддерживают их в состоянии, при котором они способны к последующему восстановлению. HSP присутствуют в цитоплазме в комплексе со специальным транскрипционным фактором HSF (от англ. heat shock factor – фактор теплового шока). При стрессорном воздействии HSF отделяется от HSP, приобретает ДНК-связывающую активность и накапливается в ядре, где активирует транскрипцию новых шаперонов и подавляет транскрипцию других генов. По окончании стрессорного воздействия освободившиеся HSP связывают HSF и переходят в исходное состояние [9–10].
Мигрируя в ядро и связываясь с хроматином и ядрышком, HSP предохраняют появление мутаций и обеспечивают условия для восстановления повреждений ДНК [11–14].
Взаимодействуя с микротрубочками и микрофиламентами, HSP стабилизируют цитоскелет, что увеличивает устойчивость клетки к механическому повреждению, денатурации и агрегации белков клетки.
Цель исследования. Оценить содержание HSP70 в головном мозге крыс с ишемией головного мозга различной степени тяжести.
Материалы и методы. Исследование проведено на 27 белых беспородных крысах-самцах массой 267±16 г. Животных кормили сухим кормом со сбалансированным содержанием белков, жиров, углеводов, минералов и витаминов. Все крысы содержались в индивидуальных клетках, что позволило минимизировать травматизацию животных после операции. Хирургическое вмешательство проводили исключительно в условиях наркотизации, для чего использовали тиопентал натрия (44 мг/кг внутривенно).
Были использованы следующие модели: частичная церебральная ишемия (част. ЦИ), пошаговое девяностопроцентное выключение кровотока (ПДВК), единовременное девяностопроцентное выключение кровотока (ЕДКВ) и полная (ПЦИ) ишемия головного мозга [2].
Част. ЦИ моделировали лигированием одной arteria carotis communis (ACC).
ПДВК моделировали поэтапным лигированием обеих ACC. Крыс делили на 3 подгруппы в зависимости от интервала между перевязками артерий (первая подгруппа – 7 сут, вторая – 3 сут, третья – 1 сут).
ЕДКВ моделировали единовременным лигированием обеих ACC.
ПЦИ подразумевала декапитацию животного.
Забор головного мозга для определения содержания HSP70 осуществляли спустя 1 ч после декапитации.
Определение содержания HSP70 осуществлялось иммуногистохимическим методом с использованием моноклональных антител. С этой целью после декапитации у крыс быстро извлекали головной мозг, кусочки коры больших полушарий последовательно погружали в фиксаторы (спирты, ксилол и парафин).
Далее орган нарезали с помощью микротома. Для определения иммунореактивности молекулярного маркера HSP70 применяли первичные поликлональные кроличьи антитела Anti-HSP70 antibody (Abcam, Великобритания, ab 181606) в разведении 1:1000 при +4 ºС. Экспозиция осуществлялась в течение 20 ч во влажной камере [4]. Для выявления связавшихся первичных антител использовали набор EXPOSE Mouse and Rabbit specific HRP/DAB detection IHC kit (Abcam, Великобритания, ab. 80436). Содержание Anti-HSP70 изучали в цитоплазме нейронов пятого слоя теменной коры и нейронов поля СА1 гиппокампа в иммуногистохимических препаратах на основе величины оптической плотности осадка хромогена с помощью микроскопа Axioscop 2 plus (Zeiss, Германия), цифровой видеокамеры (Leica DFC 320, Германия) и программы анализа изображения Image Warp (Bitflow, США).
Для предотвращения систематической ошибки измерений образцы головного мозга сравниваемых контрольной и опытных групп животных изучали в одинаковых условиях.
В результате исследований получены количественные непрерывные данные. Так как в эксперименте использованы малые выборки, которые имели ненормальное распределение, анализ проводили методами непараметрической статистики с помощью лицензионной компьютерной программы Statistica 10.0 для
Windows (StatSoft, Inc., США). Данные представлены в виде Me (LQ; UQ), где Me – медиана, LQ – значение нижнего квартиля; UQ – значение верхнего квартиля. Различия между группами считали достоверными при р<0,05 (тест Краскелла – Уоллиса с поправкой Бон-феррони).
Результаты и обсуждение. У крыс с част. ЦИ не было выявлено изменения содержания HSP70 по отношению к уровню контрольной группы (р>0,05) (табл. 1, рис. 1, 2).
Таблица 1
Table 1
Содержание HSP70 в цитоплазме пирамидных нейронов теменной коры и поля СА1 гиппокампа головного мозга крыс при ишемии головного мозга, Me (LQ; UQ)
HSP70 content in the cytoplasm of pyramidal neurons of parietal cortex and CA1 field of hippocampal brain of ischemic rat brains
|
Группа Group |
Теменная кора Parietal cortex |
Гиппокамп Hippocampus |
|
|
Контроль Control |
0,161 (0,158; 0,163) |
0,152 (0,148; 0,159) |
|
|
Част. ЦИ partial ischaemia |
0,160 (0,159; 0,162) |
0,151 (0,146; 0,159) |
|
|
о C >i о h ^ C ft ”0 О О 55 ,2 |
1-я подгруппа subgroup |
0,214(0,183;0,248)* |
0,173(0,161;0,182) |
|
2-я подгруппа subgroup |
0,158 (0,156; 0,162) |
0,139 (0,124; 0,152) |
|
|
3-я подгруппа subgroup |
0,148 (0,148; 0,160) |
0,134 (0,117; 0,144) |
|
|
ЕДВК One-time 90 % blood flow shutdown |
0,114 (0,113; 0,117)* |
0,124 (0,116; 0,136)* |
|
|
ПЦИ Complete cerebral ischemia |
0,105 (0,093; 0,119)* |
0,097 (0,091; 0,100)* |
|
Примечание. * – р<0,05 по сравнению с группой контроля.
Note. * – p<0,05 the differences are significant compared with the control.
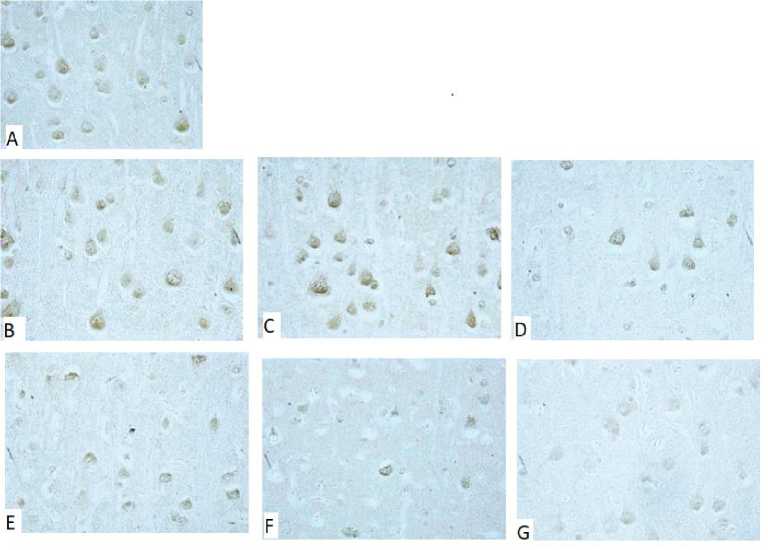
Рис. 1. Содержание HSP70 в цитоплазме пирамидных нейронов теменной коры крыс: A – контроль; B – част. ЦИ; C, D, E – ПДВК, F – ЕДВК, G – ПЦИ. Цифровая микрофотография, × 40
Fig. 1. HSP70 content in the cytoplasm of rat parietal cortex pyramidal neurons. Control (A), partial cerebral ischemia (B), step-by-step 90 % blood flow shutdown (C, D, E), one-time 90 % blood flow shutdown (F), complete cerebral ischemia (G). Digital microphotography, ×40
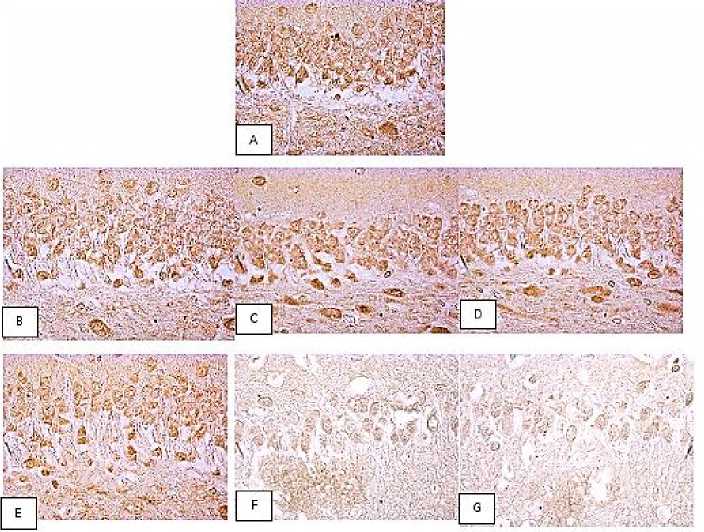
Рис. 2. Содержание HSP70 в цитоплазме пирамидных нейронов поля СА 1 гиппокампа крыс: A – контроль, B – част. ЦИ, C, D, E – ПДВК, F – ЕДВК, G – ПЦИ
Fig. 2. HSP70 content in the cytoplasm of pyramidal neurons of field CA1 in rat hippocampus. Control (A), partial cerebral ischemia (B), step-by-step 90 % blood flow shutdown (C, D, E), one-time 90 % blood flow shutdown (F), complete cerebral ischemia (G)
По сравнению с контрольной группой в 1-й подгруппе ПДВК (7 сут между перевязками) происходило увеличение содержания HSP70 на 25 % в теменной коре (р<0,05), тогда как в гиппокампе его концентрация не изменилась (р>0,05). Во 2-й и 3-й подгруппах ПДВК (3 сут и 1 сут между перевязками) содержание HSP70 по сравнению с контрольной группой не изменялось ни в одном из изучаемых отделов (р>0,05), а по сравнению с 1-й подгруппой было меньше во 2-й подгруппе на 26 % в теменной коре (р<0,05) и на 20 % в гиппокампе (р<0,05), в 3-й подгруппе – на 30 % (р<0,05) и на 23 % (р<0,05) соответственно. Различий в содержании HSP70 между 2-й и 3-й подгруппами выявлено не было (р>0,05).
Таким образом, в 1-й подгруппе ПДВК наблюдалось увеличение содержания HSP70, в то время как во 2-й и 3-й подгруппах данный показатель не отличался от уровня контрольной группы.
По сравнению с контролем в группе ЕДВК содержание HSP70 уменьшилось на 29 % в теменной коре (р<0,05) и на 18 % в гиппокампе (р<0,05) и не имело отличий от содержания HSP70 во 2-й и 3-й подгруппах ПДВК в гиппокампе, в то время как в теменной коре содержание HSP70 во 2-й подгруппе, по сравнению с ЕДВК, было больше на 28 % (р<0,05), а в 3-й подгруппе – на 23 % (р<0,05).
При тотальной церебральной ишемии отмечено наиболее значимое уменьшение содержания HSP70 по сравнению с контролем – на 35 % в теменной коре (р<0,05) и на 36 % в гиппокампе (р<0,05).
Заключение. Таким образом, в 1-й подгруппе с максимальным интервалом между перевязками содержание HSP70 увеличивалось, свидетельствуя об активации механизмов компенсации при гипоксии путем предохранения белков от преждевременного протеолитического распада и способствуя правильному сворачиванию полипептида в третичную структуру, в то время как по мере сокращения временного интервала между перевязками его содержание не изменялось, указывая на недостаточное включение механизмов компенсации при более тяжелых формах ишемии головного мозга.
Снижение HSP70 отмечалось при тотальной ишемии головного мозга как отражение деградации белка.
Синтез белков теплового шока является универсальным ответом на стресс и играет важную роль в защите клеток от негативных воздействий. Белки теплового шока принимают участие в реализации фундаментальных клеточных процессов, и изменение их экспрессии может служить важным диагностическим маркером реакции клетки на повреждения [7–14]. Поиск лекарственных веществ, выступающих в роли индукторов или ингибиторов их синтеза, является актуальным направлением в экспериментальной фармакологии, поскольку они позволяют не только регулировать процессы адаптации к гипоксии, но более эффективно лечить цереброваскулярные, сердечно-сосудистые и другие заболевания, в генезе которых ведущую роль играет кислородная недостаточность.
Список литературы Содержание белка теплового шока HSP70 в нейронах теменной коры и гиппокампа крыс с церебральной ишемией различной степени тяжести
- Беленичев И.Ф. Нейропротекция и нейропластичность: монография. К.: ООО «Полиграф плюс»; 2014. 512.
- Бонь Е.И., Максимович Н.Е. Способы моделирования и морфофункциональные маркеры ишемии головного мозга. Биомедицина. 2018; 2: 59-71.
- Бонь Е.И., Максимович Н.Е. Сравнительный анализ морфологических нарушений нейронов теменной коры и гиппокампа крыс при различных видах экспериментальной ишемии головного мозга. Оренбургский медицинский вестник. 2021; 2: 29-36.
- Коржевский Д.Э., Гилерович Е.Г., Кирик О.В. Иммуногистохимическое исследование головного мозга. Санкт-Петербург: СпецЛит; 2016. 143.
- Максимович Н.Е., Бонь Е.И., Зиматкин С.М. Головной мозг крысы и его реакция на ишемию: монография. Гродно: ГрГМУ; 2020. 240.
- Clemens J.A. Cerebral ischemia: gene activation, neuronal injury, and the protective role of antioxidants. Free Radic. Biol. Med. 2000; 28: 1526-1531.
- Максимович Н.Е., Бонь Е.И. Белки теплового шока. Свойства. Роль в адаптации. Методические подходы к определению. Биомедицина. 2020; 2: 60-67.
- Maksimovich N. Ye., Bon I.L. The Role of Heat Shock Proteins in Cell Metabolism. J Med Clin Case Stud. 2023; 1 (1): 1-8.
- Cui Y., Wang M., Yin X., Xu G., Song S., Li M., Liu K., Xia X. OsMSR3, a Small Heat Shock Protein, Confers Enhanced Tolerance to Copper Stress in Arabidopsis thaliana. Int J Mol Sci. 2019; 3: 20-23.
- FabczakH., Osinka A. Role of the Novel Hsp90 Co-Chaperones in Dynein Arms' Preassembly. Int J Mol Sci. 2019; 20: 24-29.
- Gupta A., Bansal A., Hashimoto-Torii K. HSP70 and HSP90 in neurodegenerative diseases. Neurosci Lett. 2020; 18: 716-720.
- Min H.J., Choe J.W., Chang M.Y., Kim K.S., Lee S.Y., Mun S.K. The expression and correlation of Hsp 70 and Hsp 27 in serous middle ear effusion fluids of pediatric patients-a preliminary. Int J Pediatr Otorhinolaryngol. 2017; 101: 145-149.
- Mo Z.T., Li W.N., Zhai Y.R., Gao S.Y. The effects of icariin on the expression of HIF-1a, HSP-60 and HSP-70 in PC12 cells suffered from oxygen-glucose deprivation-induced injury. Pharm Biol. 2017; 55: 848-852.
- Oh E., Lee B., Choi Y.M. Associations of Heat-Shock Protein Expression with Meat Quality and Sensory Quality Characteristics in Highly Marbled Longissimus Thoracis Muscle from Hanwoo Steers Categorized by Warner-Bratzler Shear Force Value. Foods. 2019; 8: 12-18.


