Содержание ядерной ДНК у регенерантов риса (Oryza sativa L.), полученных в культуре пыльников in vitro
Автор: Илюшко М.В., Скапцов М.В., Ромашова М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 3 т.53, 2018 года.
Бесплатный доступ
Рис - одна из важнейших продовольственных культур юга Дальнего Востока, поэтому необходимо выведение новых сортов с повышенной урожайностью и качеством зерна. В рисосеющих странах мира, в том числе в России, для ускорения селекционного процесса и создания нового исходного материала успешно применяется культура пыльников in vitro. В ней используют метод проточной цитометрии для разделения фракций регенерантов на гаплоидые, дигаплоидные и полиплоидные растения. Цитологические исследования растений в культуре клеток и тканей in vitro свидетельствуют о существовании не только геномных изменений от гаплоидов до гексаплоидов, но и хромосомных, приводящих к анэуплоидии и эндополиплоидии. В этом случае размер генома не может быть постоянной величиной. Цель работы заключалась в характеристике популяции регенерантов риса, полученных в культуре пыльников in vitro, по содержанию ядерной ДНК методом проточной цитометрии и оценке эффективности сочетания методов культуры тканей и проточной цитометрии в селекционной работе с рисом...
Культура пыльников invitro, проточная цитометрия, гаплоид, дигаплоид, тетраплоид
Короткий адрес: https://sciup.org/142216555
IDR: 142216555 | УДК: 633.18:631.527:581.143.6:575.2 | DOI: 10.15389/agrobiology.2018.3.531ru
Текст научной статьи Содержание ядерной ДНК у регенерантов риса (Oryza sativa L.), полученных в культуре пыльников in vitro
Рис — одна из важнейших продовольственных культур на юге Дальнего Востока России (1). Почвенно-климатические условия здесь отличаются от условий юга России, где находятся основные посевные площади риса. Ближайшие соседние провинции Китая, достигшие значительных успехов в селекции риса, применяют рассадные технологии с существенной долей ручного труда, что отличает их от технологии возделывания риса, принятой в России (2). Из-за этого и сорта западных регионов России, и китайские трудно позаимствовать для выращивания в Приморском крае. В Государственном реестре селекционных достижений РФ по 12-й зоне представлены только сорта риса дальневосточных селекционеров ,
Работа частично поддержана грантом «Программа фундаментальных исследований ДВО РАН «Дальний Восток» ¹ 15-I-6-005.
поэтому реализацию программ по сознанию сортов риса для Дальнего Востока России необходимо продолжать.
Для ускорения селекционного процесса и создания нового исходного материала успешно применяется культура пыльников in vitro (3, 4). Ряд сортов риса выведен этим методом в нашей стране (5). Методы биотехнологии в селекции риса использовались и на Дальнем Востоке (6), в том числе проводятся исследования с целью создания сортов риса с применением культуры пыльников in vitro, в частности отработаны основные элементы технологии андроклинной гаплоидии для дальневосточных сортов и гибридов риса (7). По разным оценкам, 29-72 % регенерантов риса, полученных в культуре пыльников in vitro, оказываются продуктивными дигаплоидами (3, 8-10). Именно они представляют селекционную ценность. Остальные (до 60 %) — бессемянные регенеранты, чаще гаплоиды, которые либо отбраковываются, либо нуждаются в манипуляциях по удвоению хромосомных наборов. Для идентификации типа регенеранта в основном используют морфологические признаки: гаплоидные растения риса характеризуются меньшими размерами вегетативных органов, повышенной кустистостью, мелкими цветками и стерильностью (11). Перед идентификацией проводят рутинную процедуру выращивания регенерантов, доведения до стадии цветения и созревания семян.
Метод проточной цитометрии в исследовании растений получил широкое распространение относительно недавно (12). В культуре пыльников in vitro его используют главным образом для разделения фракций регенерантов на гаплоидые, дигаплоидные, триплоидные растения и т.д. (13). Приводятся данные о четком кратном увеличении наборов хромосом, значение пика каждого из наборов рассматривается как константная величина (13-16). Цитологические исследования растений в культуре клеток и тканей in vitro свидетельствуют о существовании не только геномных вариаций от галоидов до гексаплоидов (3, 4, 11, 17, 18), но и хромосомных изменений, приводящих к анэуплоидии (3, 12, 18, 19) и эндополиплоидии (12, 20). В этом случае размер генома не может быть постоянной величиной.
В настоящей работе впервые описаны параметры изменчивости содержания ядерной ДНК в различных группах регенерантов риса посевного, полученных в культуре пыльников in vitro (гаплоидов, удвоенных гаплоидов, тетраплоидов и негаплоидных бессемянных форм).
Цель работы заключалась в характеристике популяции регенерантов риса, полученных в культуре пыльников in vitro, по содержанию ядер-ной ДНК методом проточной цитометрии и оценке эффективности сочетания этих приемов в селекционной работе с рисом.
Методика. Гибрид F2 (УкрНИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato), полученный в Приморском НИИСХ, выращивали на вегетационной площадке в 2014 году.
Перед введением в культуру in vitro пыльники риса подвергали воздействию низких положительных температур (5 °С) в течение 7 сут, поместив метелку в цилиндр с водой. Затем пыльники помещали на индукционную питательную среду N 6 (21) c 2,4-дихлорфеноксиуксуной кислотой (2,0 мг/л) и культивировали в темноте при температуре 25-27 °С до образования каллусов размером 1-5 мм. Для вторичной дифференцировки побегов каллусы переносили на среду N 6 с сахарозой (6 %), 6-бензилами-нопурином и кинетином (по 1 мг/л) и культивировали при освещенности 4000 лк, температуре 22-25 °С и фотопериоде 16/8 ч. Для укоренения регенерантов использовали среду Мурасиге-Скуга (MS) с половинным минеральным составом макросолей в вариации Ю.К. Гончаровой (18).
Регенеранты с развитой корневой системой высаживали в горшочки и продолжали выращивать в условиях культуральной комнаты (4000 лк, температуре 22-25 °С и фотопериоде 16/8 ч) до образования семян. По морфологическим признакам все регенеранты разделяли на пять групп: гаплоиды (стерильные растения с очень мелкими цветками); дигаплоиды (растения с семенами); тетраплоиды (растения с очень крупными немногочисленными семенами, выраженным килем и ребристостью на цветочной чешуе); растения без семян (формировали цветки нормального размера, но не образовывали семена на двух и более метелках); растения, погибшие на ранних этапах роста и развития. Листья подвергали лиофильной сушке и хранили в морозильной камере при температуре -80 °С.
Содержание ДНК определяли с помощью проточной цитометрии. Использовали от одного до четырех гаплоидных и дигаплоидных растений от каждой каллусной линии, 52 бессемянных растения, не относящихся к гаплоидам, и 10 тетраплодов — всего 176 растений. Лиофильно высушенные листья (1-2 см2) измельчали при помощи лезвия в чашке Петри с 1 мл охлажденного Tрис-MgCl2 буфера, содержащего 0,2 M Tрис-основание, 4 мM MgCl2•6Н2О (Россия) и 0,5 % Triton X-100 с добавлением β -меркаптоэта-нола (1 мкл/мл) («Serva», Германия), 50 мкг/мл йодида пропидия («Biotium», США) и 50 мкг/мл РНКазы («Синтол», Россия) (22). Образцы фильтровали через нейлоновую мембрану CellTrics с размером пор 50 мкм («Sysmex Europe GmbH», Германия). В качестве внешнего стандарта использовали изолированные с помощью Tрис-MgCl2 буфера ядра Ficus benjamina L. с известным содержанием ДНК 2С = 1,07 пг (23). Среднее значение ( М )
пика стандарта регистрировали трижды в день исследования, затем усредняли для дальнейших расчетов. Среднее значение ( М ) пика образца регистрировали в одной повторности при одинаковых для образца и стандарта настройках цитофлуориметра (напряжения на фотоумножителе), использовали пики не менее чем с 1000 детектируемых частиц. Данные флуоресценции изолированных ядер регистрировали на проточном цитофлуориметре Partec CyFlow PA («Partec GmbH», Германия) с лазерным источником излучения (X = 532 нм). Сигналы записывали в логарифмическом представлении результатов флуоресценции (логарифмическая шкала) (24).
Данные обрабатывали в программе Statistica 10.0 («StatSoft, Inc.», США). В таблицах представлены средние ( M ) и стандартные ошибки средних (±SEM). Гистограммы относительного содержания ДНК строили с использованием программного обеспечения Flowing Software 2 («Perttu Terho», Финляндия) при стандартных настройках с определением количества событий (ядер), коэффициента вариации ( Cv , %), среднего значения ( M ) и медианы пика ( Me ). Для определения достоверности различий между средними значениями содержания ядерной ДНК в группах использован t -критерий Стьюдента, коэффициент корреляции и t -критерий рассчитывали при уровне значимости 5 %.
1. Каллусообразование и регенерация в культуре пыльников у растений F2 (УкрНИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato) in vitro
|
Показатель |
Значение |
|
Число инокулированных пыльников, шт. |
240 |
|
Каллусообразование, % |
37,5 |
|
Число высаженных каллусов, шт. |
90 |
|
Каллусы с регенерантами, шт/% |
72/80 |
|
Каллусы с зелеными регенерантами, шт/% |
39,0/43,3 |
|
Число зеленых регенерантов на каллус, шт. |
14,9 |
Результаты. Частота каллусообразования в культуре пыльников у изученного гибрида составляла 37,5 % (табл. 1). Некоторые пыльники начинали формировать каллус очень рано — через 18 сут после инокуляции. При еженедельном
переносе каллусных агрегатов на регенерационную среду за 6 нед получалось до пяти-шести пассажей. Все они рассматривались в нашем опыте как единый каллус. Однако на некоторых пассажах каллуса, например на первом и третьем, иногда не формировались зеленые почки, а на других образовывались зеленые регенеранты. При этом на каллусе одного пассажа могли быть только гаплоидные регенеранты, на другом — удвоенные гаплоиды. Чаще всего встречались каллусные агрегаты с разным сочетанием зеленых регенерантов: дигаплоиды и гаплоиды; дигаплоиды, тетрапло-иды и погибшие растения.
2. Характеристика групп регенерантов, полученных у растений F2 (УкрНИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato) в культуре пыльников in vitro
|
Показатель |
Гаплоиды |
Дигаплоиды |
Тетраплоиды |
Растения без семян |
Погибшие растения |
|
Всего, шт. |
348 |
494 |
10 |
58 |
189 |
|
Число регенерантов на каллус, шт. M |
9,2 |
13,0 |
0,3 |
1,5 |
5,0 |
|
±SEM |
12,1 |
26,5 |
0,7 |
4,0 |
6,6 |
|
Доля от общего числа регенератов, % |
31,7 |
45,0 |
0,9 |
5,3 |
17,2 |
|
Максимальное число регенерантов на каллус, шт. |
45 |
126 |
3 |
22 |
32 |
Каллусы сформировали 1099 зеленых регенерантов (табл. 2). После определения содержания ядерной ДНК оказалось, что у трех растений, отнесенных к дигаплоидам, оно соответствовало характерному для тетра-плоидам (3,78; 3,83; 3,86). Также были обнаружены два бессемянных растения с маленьким геномом, как у гаплоидов (1,34; 1,05), и три гаплоида с содержанием ДНК, близким к таковому у диплоидных растений (2,13; 2,16; 2,05). Для характеристики популяции регенератов риса эти растения были отнесены соответственно к тетраплоидам, гаплоидам и бессемянным растениям. Ошибка при отнесении регенерантов к нужной фракции растений по морфологическим признакам составила 4,5 %.
3. Содержание ядерной ДНК в популяции регенерантов риса, полученных у растений F2 (УкрНИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato) в культуре пыльников in vitro
|
Показатель |
Гаплоиды |
Дигаплоиды |
Тетраплоиды |
Растения без семян |
|
Число растений, шт. |
61 |
50 |
13 |
52 |
|
Содержание ДНК, пг: |
||||
|
M |
0,887 |
1,881 |
3,752 |
3,046 |
|
±SEM |
0,033 |
0,028 |
0,055 |
0,135 |
|
min |
0,606 |
1,438 |
3,442 |
1,717 |
|
max |
1,636 |
2,188 |
4,197 |
4,380 |
|
Cv , % |
29,0 |
10,5 |
5,30 |
32,0 |
|
Относительно среднего |
||||
|
значения у гаплоидов |
2,12 |
4,23 |
3,43 |
|
Примечание. Cv — коэффициент вариации; 1 пг ДНК = 978 млн п.н. (29). Различия между средними значениями содержания ядерной ДНК в группах достоверны при p = 0,05.
Группа растений без семян характеризовалась высокой вариабельностью по содержанию ДНК в ядрах клеток ( Cv = 32 %) (табл. 3). Сюда, вероятно, вошли растения с двойным набором хромосом, триплоиды, тет-раплоиды и пентаплоиды (рис. 1). В этой группе регенерантов наблюдалась эндополиплоидия (рис. 2, В), которая характеризуется пиком диплоидных ядер (2х), пиком тетраплоидных ядер (4 х ), совмещенных с пиком G2 стадии митоза диплоидных ядер и пиком G2 стадии митоза тетрапло-идных ядер (25, 26). При детекции изолированных ядер пять растений имели двувершинность в зонах гаплоидов и диплоидов (см. рис. 2), 23 растения — набор хромосом, близкий к таковому у дигаплоидных регене-534
рантов (в среднем 2,00). Явление анеуплоидии, характерное для культуры пыльников риса in vitro (18), привело к некратному изменению в хромосомных наборах регенерантов, что не позволило растениям сформировать семена. В группах дигаплоидов и тетраплоидов варьирование было незначительным (см. табл. 3). Среди дигаплоидов обнаружили один эндополип-лоидный регенерант. В целом наши данные сопоставимы с результатами других авторов, согласно которым содержание ядерной ДНК в основном наборе хромосом у риса O. sativa варьирует от 0,91 до 1,00 пг (27, 28).
Гаплоидные растения характеризовались высокой изменчивостью по содержанию ядерной ДНК ( Cv = 29 %). Максимальные значения у гаплоидов были выше минимальных значений у дигаплоидов. С.И. Малецкий с соавт. (29), изучая изменчивость растений сахарной свеклы ( Beta vulgaris L.), тоже обнаружили более высокую эпипластомную и эпигеномную нестабильность у гаплоидных геномов по сравнению с дигаплоидами.
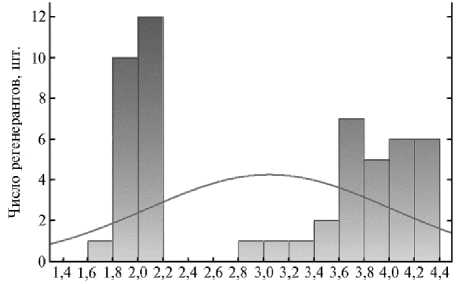
Содержание ядерной ДПК, пг
Рис. 1. Содержание ядерной ДНК у бессемянных негаплоидных регенерантов, полученных у растений F 2 (Укр-НИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato) в культуре пыльников in vitro. Кривая — нормальное распределение.
Гаплоидные растения, полученные из одной каллу-сной линии, различались га-битуально. Вначале формировались сильные, высокие растения с крупными метелками и значительным числом стерильных цветков. Последние сформированные растения были карликовыми с единичными цветками на короткой метелке.
В культуре пыльников in vitro жизнеспособность гаплоидов и дигаплоидов объясняется количеством «вредных» генов, которые им достались в результате мейоза
(30). Хромосомные изменения, происходящие при культивировании in vitro каллусов и регенерантов (3, 18-20), приводят к изменениям в морфотипе растений и их жизнеспособности. Погибшие на ранних стадиях развития растения были, вероятно, гаплоидами, в генотипе которых содержалось много леталей, полулеталей и субвиталей (30). Отношение средних значений содержания ядерной ДНК у дигаплоидов и гаплоидов не было кратно двум (см. табл. 3). Это может косвенно свидетельствовать о потере неко- торых участков хромосом у гаплоидов в процессе культивирования, которая приводила к изменениям в морфотипе регенерантов.
Мы не обнаружили зависимости между продолжительностью культивирования (до 6 мес) и отклонением от среднего количества ядерной ДНК у гаплоидов (r = -0,09 при р = 0,05). Отношение средних значений содержания ядерной ДНК татраплоидов и дигаплоидов равнялось двум. Вероятно, продуктивные тетраплоиды возникали посредством кратного увеличения числа хромосом основного набора, но даже в этом случае формировали небольшое число семян — от одного до пяти. По данным С.С. Гученко (персональное сообщение), все тетраплоиды R1 взошли, развились, два из них образовали метелку, но были стерильны. Среди бессемянных растений 23 имели содержание ДНК, характерное для тетраплои-дов (см. рис. 1), но при этом оказались стерильными. Низкая фертиль- ность пыльцы связана со значительными цитологическими изменениями у аутотетраплоидного риса (31).
Как показано в нашей работе и некоторых зарубежных публикациях, метод проточной цитометрии достаточно точен для выявления ане-уплоидных растений. Тем не менее, исследованные анеуплоидные растения в основном имели значительный размер генома с крупными хромосомами (22, 32). У большинства цитофлуориметров стандартная ошибка измерения — 2,5-5,0 %. Средний размер хромосомы для O. sativa ∼ 0,04 пг, что находится в пределах ошибки цитофлуориметров, тогда как, например, для Triticum aestivum L. средний размер — ∼ 0,82 пг, для Lolium peren-ne L. — ∼ 0,39 пг (33, 34). Следовательно, в дополнение к технике проточной цитометрии при изучении анеуплоидии растений с небольшими геномами лучше применять методы микроскопии.

Б В
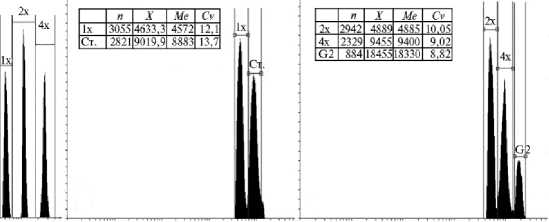
Относительная флуоресценция
Рис 2. Образцы гистограмм, построенных при исследовании плоидности и относительного содержания ДНК у регенерантов, полученных у растений F 2 (УкрНИИС 3435 ½ Укр 96) риса посевного ( Oryza sativa L. ssp. japonica Kato) в культуре пыльников in vitro: А — консенсусная гистограмма регенерантов с плоидностью 1½, 2½ и 4½, Б — гистограмма, содержащая пики регенеранта с плоидностью 1½ и стандарта (Ст.), В — образец гистограммы эндополиплоид-ного регенеранта; n — число событий, M — среднее пика, Me — медиана пика, Cv — коэффициент вариации, %.
Таким образом, у групп стерильных растений риса (гаплоиды и бессемянные негаплоиды), полученных в культуре пыльников in vitro, содержание ядерной ДНК варьирует в значительных пределах, тогда как у фертильных регенерантов (дигаплоиды и тетраплоиды) оно стабильно. Метод проточной цитометрии в совокупности с оценкой продуктивности можно использовать в селекции риса для выявления тетраплоидных регенерантов, а также с целью выбраковки гаплоидов, чтобы исключить этап выращивания бесперспективных форм в условиях ex vitro.
Авторы выражают глубокую признательность специалистам лаборатории селекции риса ФГБНУ Приморский НИИСХ за предоставленный гибридный материал.
Список литературы Содержание ядерной ДНК у регенерантов риса (Oryza sativa L.), полученных в культуре пыльников in vitro
- Чайка А.К. Становление и развитие аграрной науки на Дальнем Востоке. В сб.: Дальневосточная наука -агропромышленному производству региона. Владивосток, 2008: 37-54.
- Сахно А.Л., Илюшко М.В. Изучение китайской технологии выращивания риса в Хорольском районе Приморского края. Мат. Межвузовской науч.-практ. конференции «Молодые ученые -агропромышленному комплексу Дальнего Востока». Уссурийск, 2011, вып. 11: 44-52.
- Datta S.K. Androgenic haploids: factors controlling development and its application in crop improvement. Current Science, 2005, 89: 1870-1878.
- Dunwell J.M. Haploids in flowering plants: origins and exploitation. Plant Biotechnol. J., 2010, 8: 377-424 ( ) DOI: 10.1111/j.1467-7652.2009.00498.x
- Каталог сортов риса и овощебахчевых культур кубанской селекции (справочно-методическое издание). Краснодар, 2016.
- Змеева В.Н. Тенденции изменчивости некоторых хозяйственно полезных признаков в популяциях сомаклонов и андрогенных дигаплоидов риса Oryza sativa L. Автореф. канд. дис. Владивосток, 1995.
- Илюшко М.В. Создание исходного материала для селекции риса методом культуры пыльников in vitro на российском Дальнем Востоке. Мат. науч.-практ. конф. «Роль аграрной науки в обеспечении продовольственной безопасности дальневосточного региона: (к 40-летию Приморского НИИСХ)». Владивосток, 2016: 75-79.
- Yamamoto T., Soeda Y., Nishikawa A., Hirohara H. A study of somaclonal variation for rice improvement induced by three kinds of anther-derived cell culture techniques. Plant Tissue Culture Letters, 1994, 11: 116-121 ( ) DOI: 10.5511/plantbiotechnology1984.11.116
- Кучеренко Л.А., Харченко П.Н., Ковалева Е.Н. Использование методов биотехнологии в селекции риса. Мат. Всес. конф. «Состояние и перспективы развития сельскохозяйственной биотехнологии». Л., 1986: 92-96.
- Илюшко М.В. Получение регенерантов риса в культуре пыльников in vitro одноступенчатым методом. Вестник Российской сельскохозяйственной науки, 2016, 5: 20-22.
- Кучеренко Л.А., Харченко П.Н. Использование метода культуры тканей в селекции риса. Сельское хозяйство за рубежом, 1975, 11: 20-21.
- Ochatt S.J. Flow Cytometry in plant breeding. Cytometry, 2008, 73A: 581-598 ( ) DOI: 10.1002/cyto.a.20562
- Murovec J., Bohanec B. Haploid and double haploids in Plant breeding. In: Plant breeding. Rijeka, Croatia, 2012, Ch. 5: 87-106.
- Xu L., Najeeb U., Tang G.H. Haploid and doubled haploid technology. Adv. Bot. Res., 2007, 45: 181-216 ( ) DOI: 10.1016/S0065-2296(07)45007-8
- Li Y., Li H., Chen Z., Ji L.-X., Ye M.-X., Wang J., Wang L., An X.-M. Haploid plants from anther culture of poplar (Populus ½ beijingensis). Plant Cell Tiss. Org., 2013, 114: 39-48 ( ) DOI: 10.1007/s11240-013-0303-5
- Sood S., Dwivedi S., Reddy T.V., Prasanna P.S., Sharma N. Improving androgenesis-mediated doubled haploid production efficiency of FCV tobacco (Nicotiana tabacum L.) through in vitro colchicines application. Plant Breeding, 2013, 132: 764-771 ( ) DOI: 10.1111/pbr.12114
- Germana M.A. Gametic embryogenesis and haploid technology as valuable support to plant breeding. Plant Cell. Rep., 2011, 30: 839-857 ( ) DOI: 10.1007/s00299-011-1061-7
- Гончарова Ю.К. Использование метода культуры пыльников в селекции риса. Краснодар, 2012.
- Горбунова В.Ю. Андрогенез in vitro у яровой мягкой пшеницы. Автореф. канд. дис. СПб, 2000.
- Barow M., Jovtchev G. Endopolyploidy in plants and its analysis by flow cytometry. In: Flow cytometry with plant cell/J. Dolezel, J. Greilhuber, J. Suda (eds.). Wiley-VCH Verlag, Weinheim, 2007: 349-372 ( ) DOI: 10.1002/9783527610921.ch15
- Chu C. The N6 medium and its applications to anther culture of cereal crops. Proc. Simposium on Plant Tissue Culture. Peking, 1978: 43-50.
- Pfosser M., Amon A., Lelley T., Heberle-Bors E. Evaluation of sensitivity of flow Cytometry in detecting aneuploidy in wheat using disomic and ditelosomic wheat-rye addition lines. Cytometry, 1995, 21(4): 387-393 ( ) DOI: 10.1002/cyto.990210412
- Скапцов М.В., Смирнов С.В., Куцев М.Г., Шмаков А.И. Проблемы стандартизации в проточной цитометрии растений. Turczaninowia, 2016, 19(3): 120-122.
- Скапцов М.В., Смирнов С.В., Куцев М.Г. Содержание ядерной ДНК в некоторых сортах растений, используемых в качестве внешних стандартов в проточной цитометрии. Turczaninowia, 2014, 17: 72-78 ( ) DOI: 10.14258/turczaninowia.17.3.8
- Skaptsov M.V., Lomonosova M.N., Kutsev M.G., Smirnov S.V., Shmakov A.I. The phenomenon of endopolyploidy in some species of the Chenopodioideae (Amaranthaceae). Botany Letters, 2017, 164(1): 47-53 ( ) DOI: 10.1080/23818107.2016.1276475
- Barow M. Endopolyploidy in seed plants. BioEssays, 2006, 28: 271-281 ( ) DOI: 10.1002/bies.20371
- Bai C.K., Alverson W.S., Follansbee A., Waller M.D. New reports of nuclear DNA content for 407 vascular plant taxa from the United States. Annals of Botany, 2012, 110: 1623-1629 ( ) DOI: 10.1093/aob/mcs222
- Bennett M.D., Smit J.B. Nuclear DNA amounts in angiosperms. Phil. Trans. R. Soc. Lond. B, 1991, 334: 309-345 ( ) DOI: 10.1098/rstb.1991.0120
- Малецкий С.И., Юданова С.С., Малецкая Е.И. Эпигеномная и эпипластомная изменчивость у гаплоидных и дигаплоидных растений сахарной свеклы (Beta vulgaris L.). Сельскохозяйственная биология, 2015, 50: 579-589 ( ) DOI: 10.15389/agrobiology.2015.5.579rus
- Гончарова Ю.К. Селективная элиминация аллелей при получении дигаплоидных линий в культуре пыльников риса. Генетика, 2013, 49: 196-203 ( ) DOI: 10.7868/S0016675812100025
- Luan L., Wang X., Long W.B., Liu Y.H., Tu S.B., Xiao X.Y., Kong F.L. A comparative cytogenetic study of the rice (Oryza sativa L.) autotetraploid restorers and hybrids. Генетика, 2009, 45: 1225-1233.
- Barker R.E., Kilgore J.A., Cook R.L., Garay A.E., Warnke S.E. Use of flow cytometry to determine ploidy level of ryegrass. Seed Sci. Technol., 2001, 29: 493-502.
- Smarda P., Bures P., Horova L., Foggi B., Rossi G. Genome size and GC content evolution of Festuca: Ancestral expansion and subsequent reduction. Annals of Botany, 2008, 101: 421-433 ( ) DOI: 10.1093/aob/mcm307
- Bennett M.D., Smith J.B. Nuclear DNA amounts in angiosperms. Philos. T. Roy. Soc. B, 1976, 274: 227-274 ( ) DOI: 10.1098/rstb.1976.0044


