Состав микробиоценоза рубца и микроструктура стенки тощей кишки у эдильбаевских баранчиков (Ovis aries L.) специального откорма
Автор: Гиро Т.М., Ильина Л.А., Куликовский А.В., Зирук И.В., Гиро А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Технологии кормления
Статья в выпуске: 2 т.59, 2024 года.
Бесплатный доступ
Кормление без учета фундаментальных механизмов реализации пищеварительной функции (в особенности у жвачных животных) приводит к нежелательным изменениям микробиоценоза, что становится причиной снижения продуктивности, возникновения ряда заболеваний вследствие нарушения процессов пищеварения, в том числе из-за гистологических изменений в кишечнике, влияющих на его функцию. Нами получены новые фундаментальные данные о влиянии рационов с кормовыми добавками в виде жмыха на основе растительного кремния и белково-углеводного комплекса на микробиоценоз рубца баранчиков. Определена таксономическая принадлежность микроорганизмов до рода, выявлены представители нормальной микрофлоры, условно-патогенной, патогенной, некультивируемой и транзитной микрофлоры. Проведены гистологические исследования тонкого кишечника (тощей кишки) баранчиков эдильбаевской породы с применением световой микроскопии. Мы исследовали содержимое рубца и тонкий кишечник баранчиков ( Ovis aries L.) эдильбаевской породы в возрасте 7 мес, получавших кормовые добавки на основе растительного кремния и белково-углеводного комплекса. Были сформированы четыре группы по 10 животных в каждой. Детальный анализ состава рубцовой микробиоты на уровне родов микроорганизмов проведен с использованием NGS-секвенирования; микроструктурные исследования тонкого отдела кишечника выполнены с применением световой микроскопии. Оценка влияния рационов, обогащенных эссенциальными микроэлементами (I, Zn, Se), на рубцовую микробиоту баранчиков показала, что доля представителей нормальной микрофлоры в целом была высокой во всех образцах, а доля условно-патогенной и патогенной микрофлоры - достаточно низкой. Гистологические исследования слизистой оболочки тощей кишки баранчиков не выявили значительных различий при изменении рационов. При анализе микробиома рубца баранчиков выявлено, что использованные кормовые добавки влияют на состав микробного сообщества, модулируя соотношение численности различных микроорганизмов. Во всех опытных группах отмечено достоверное (p ≤ 0,05) увеличение представленности целлюлозолитических бактерий филума Bacteroidetes . Одновременно при введении в рацион животных кормовой добавки Йоддар-Zn достоверно повышалась доля лактат-ферментирующих бактерий Selenomonadales , бифидобактерий Bifidobacteriales и метаногенных архей, а также в рубце снижалось число представителей порядка Clostridiales . При применении ДАФС-25, помимо повышения доли представителей филума Bacteroidetes отмечено достоверно большее (p ≤ 0,05) число бацилл порядка Bacillales . Достоверных различий по обилию и составу патогенной и условно-патогенной микробиоты между опытными и контрольной группами мы не выявили. Учет динамики живой массы показал, что в возрасте 7 мес абсолютный средний прирост в опытных группах составил от 3,45 кг до 4,49 кг, в контрольной - 3,1 кг, наибольший прирост живой массы отмечен в IV группе, получавшей обе кормовые добавки. Установлено, что IV группа имела наибольший коэффициент мясности, равный 3,9, площадь сечения m. Longissimus dorsi составила 13,61 см2. Выявлены микроструктурные особенности тонкого кишечника у баранчиков эдильбаевской породы в возрасте 7 мес, выращенных с использованием рационов, обогащенных йодом и селеном. В целом морфологическая структура тонкой кишки во всех случаях применения исследуемых кормовых добавок и основного рациона при откорме соответствовала морфологическим характеристикам для этого вида животных указанной возрастной категории, без существенных различий между изучаемыми группами, хотя необходимо отметить более четкую микрокартину стенки тонкой кишки в IV группе, выращенных с применением комплекса добавок Йоддар-Zn + Дафс-25. Наибольший прирост живой массы наблюдался у животных из IV группы, рационы которых были обогащены обеими добавками. Превышение относительно контроля составило 10,48 % (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Баранчики, рубец, микробиоценоз, рацион, кормовые добавки, эссенциальные микроэлементы, тощая кишка, микроструктура
Короткий адрес: https://sciup.org/142242444
IDR: 142242444 | УДК: 636.32/.38:591.132.6:577.2 | DOI: 10.15389/agrobiology.2024.2.258rus
Текст научной статьи Состав микробиоценоза рубца и микроструктура стенки тощей кишки у эдильбаевских баранчиков (Ovis aries L.) специального откорма
Известно, что состав кормов непосредственно влияет на состояние микробного сообщества желудочно-кишечного тракта (1). Кормление без учета фундаментальных механизмов реализации пищеварительной функции (в особенности у жвачных животных) приводит к нежелательным изменениям микробиоценоза, что становится причиной снижения продуктивности и возникновения ряда заболеваний вследствие нарушения процессов пищеварения (2-4).
Первые сведения о составе и роли микробиоты рубцового содержимого, а также тонкого кишечника у мелкого рогатого скота были получены с помощью классических методов микробиологии. Их существенные ограничения обусловлены невозможностью подобрать среды для культивирования всех микроорганизмов, входящих в сообщество. Современные молекулярно-генетические подходы делают доступным изучение разнообразия микроорганизмов, минуя стадию культивирования (5). Технология секвенирования нового поколения (NGS-секвенирование, next generation sequencing) — одна из наиболее перспективных на сегодняшний день. Она во много раз результативнее секвенирования по Сэнгеру, так как позволяет проводить метагеномные исследования сложных микробных сообществ с большим объемом прочтенных нуклеотидных последовательностей. При этом возможно точное определение филогенетической принадлежности микроорганизмов до вида (6).
Значение кормовых добавок, содержащих эссенциальные микроэлементы, определяется исключительной ролью таких микроэлементов в обеспечении жизнедеятельности организма (11). Йод как эссенциальный микроэлемент участвует в регуляции белкового, жирового, минерального обмена, входит в состав гормона щитовидной железы (12). Одно из проявлений дефицита йода — формирование зоба (13, 14). Цинк участвует в процессах обмена веществ, тканевом дыхании, в кроветворении, влияет на защитные механизмы (15). Селен стимулирует рост и развитие животных, участвует в различных биохимических реакциях в организме, в антиоксидантном и иммунном ответе (16, 17).
При разработке регламентов применения кормовых добавок обязательно определение их безопасности и воздействие на кишечную микробиоту, в особенности у жвачных животных.
Выполненная нами в настоящей работе оценка влияния рационов, обогащенных эссенциальными микроэлементами (I, Zn, Se; кормовые добавки на основе Йоддар-Zn и ДАФС-25), на микробиоту желудочно- кишечного тракта баранчиков показала, что доля представителей нормальной микрофлоры в рубце баранчиков в целом была высокой во всех группах, а доля условно-патогенной и патогенной микрофлоры — достаточно низкой. Отмечены изменения состава микробиоты, которые потенциально указывает на повышение ее активности, что повлияло на показатели продуктивности животных. Гистологические исследования слизистой оболочки тощей кишки животных не выявили значительных различий при изменении рационов, а динамика живой массы отражала ее наибольший прирост в группе, получавшей обе кормовые добавки.
Целью работы была оценка влияния рационов, включающих кормовые добавки на основе Йоддар-Zn и ДАФС-25 на фоне растительного кремния и белково-углеводного комплекса, на микробиоценоз содержимого рубца, микроструктуру стенки тощей кишки и рост у баранчиков эдильбаев-ской породы.
Методика . Для научно-хозяйственного опыта (УПП «Экспериментальное животноводство», Краснокутский филиал ФГБОУ ВО Саратовский государственный аграрный университет им. Н.И. Вавилова, Саратовская обл., 2020-2021 годы) из 4-месячных баранчиков эдильбаевской породы при отъеме от овцематок, используя метод пар-аналогов, сформировали 4 группы по 10 гол. в каждой.
Согласно прилагаемым инструкциям, кормовые добавки на основе Йоддар-Zn (ТУ 10.91.10-252-10514645-2019) и ДАФС-25 (ТУ 10.91.10-25310514645-2019) вносили в основной рацион (Йоддар-Zn — 0,01 кг/100 кг добавки; ДАФС-25 — 0,00016 кг/100 кг добавки; Йоддар-Zn добавляли в концентраты из расчета 100 г/т, ДАФС-25 — 1,6 мг/кг корма в составе премиксов). В препарате Йоддар-Zn содержание йода — 3 мг/100 г (связанного йода 33±3,3 мкг/1000 мг добавки), кремния — не менее 1,0 %, цинка — 12,5±1,25 мкг/1000 мг добавки, в ДАФС-25 селена — 0,04 мг/100, кремния — не менее 0,75 %.
Основной рацион (ОР) с ячменной дертью соответствовал принятому в хозяйстве, также использовали стандартизированный комбикорм ОК-81-2 для кормления молодняка коз и овец старше 4 мес («Тосненский комбикормовый завод», Россия). В I (контрольной) группе животные получали дополнительно к основному рациону (ОР) только комбикорм (300 г/гол. в сутки); во II группе — ОР + комбикорм + Йоддар-Zn (300 мг/гол. в сутки); в III группе — ОР + комбикорм + ДАФС-25 (0,5 мг/гол. в сутки); в IV группе — ОР + комбикорм + Йоддар-Zn + ДАФС-25 (дозировки те же, что и во II и III группах). В соответствии с ТУ 10.91.10-252-10514645-2019 и ТУ 10.91.10-253-10514645-2019 (ФГБНУ Поволжский НИИ производства и переработки мясомолочной продукции, г. Волгоград), вместе с Йодда-ром-Zn и ДАФС-25 к корму во II-IV группах также добавляли Коретрон (1,0 % от массы корма) и жмых тыквенный холодного прессования (бел-ково-углеводный компонент, 20,0 % от массы корма). Тыквенный жмых содержит сырого протеина — 22-37 %, сырого жира — 21,15 %, сырой клетчатки — 11,18 %, незаменимые аминокислоты (в том числе — до 3,28 % от общего белка), макро- и микроэлементы (селен — до 3 мг/кг), каротиноиды и витамин Е.
Остальные условия выращивания были одинаковыми во всех группах. Продолжительность эксперимента — 105 сут, в течение которых ежесуточно наблюдали за клиническим состоянием животных.
По завершении эксперимента и достижении возраста 7 мес баранчиков взвешивали. Также был проведен контрольный убой (убойный пункт 260
УПП «Экспериментальное животноводство») в соответствии с требованиями Технического регламента Таможенного Союза о безопасности мяса и мясной продукции ТР ТС 034/2013. Перед убоем все животные подвергались 24-часовой голодной выдержке.
Для анализа состава микробиоты сразу после убоя отбирали образцы содержимого рубца (10-20 мл) в стерильные контейнеры (НПП «ПанЭко», Россия). Также для гистологического анализа отбирали образцы тощей кишки размером 1½1½1 см согласно описанию (18).
Для анализа состава бактериального сообщества рубцового содержимого методом NGS-секвенирования из образцов выделяли тотальную ДНК, используя набор Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно рекомендациям производителя. Конечную концентрацию тотальной ДНК в растворе измеряли на флуориметре Qubit («Thermo Fisher Scientific», США) с наборами Qubit dsDNA BR Assay Kit («Thermo Fisher Scientific», США) в соответствии с рекомендациями производителя.
NGS-секвенирование проводили на платформе второго поколения MiSeq («Illumina, Inc.», США) с праймерами для региона V3-V4 16S рРНК; прямой праймер 5´-TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGC-CTACGGGNGGCWGCAG-3´; обратный праймер 5´-GTCTCGTGGGCTC-GGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTAATCC-3´ (8). Условия ПЦР: 3 мин при 95 ºС; 30 с при 95 ºС, 30 с при 55 ºС, 30 с при 72 ºС (необходимо для удлинения последовательности) (25 циклов); 5 мин при 72 ºС (окончательная элонгация). Для приготовления библиотек использовали Nextera® XT IndexKit («Illumina, Inc.», США), для очистки ПЦР-про-дуктов — Agencourt AMPure XP («Illumina, Inc.», США), для проведения секвенирования — MiSeq® ReagentKit v2 (500 cycle) («Illumina, Inc.», США). Обработку полученных ридов (перекрывание, фильтрация по качеству Q30, триммирование праймеров) выполняли с помощью биоинформати-ческой платформы Illumina («Illumina, Inc.», США). Контроль качества, оценку таксономического состава бактерий проводили в программе QIIME2 v.2019.10 с использованием базы данных GreenGenes версии 13.5 .
Фрагменты тощей кишки промывали и препарировали, далее фиксировали в 10 % водном растворе нейтрального формалина (100 мл 40 % формальдегида, 900 мл воды, карбонат кальция в избытке) (18). Продолжительность фиксации при комнатной температуре — 2 сут. Затем образцы промывались проточной водой в течение 2 сут. Для обезвоживания образцы проводили через спирты восходящей концентрации (с 50 до 96 %) и заливали в парафиновые блоки. С помощью санного микротома МС-2 («ООО СпектроЛаб», Россия) делали срезы толщиной 5-8 мкм, которые депарафинировали и окрашивали гематоксилином Эрлиха (основной краситель) и эозином Y (спиртовой кислый краситель) (18). Препараты просматривали под микроскопом Levenhuk MED PRO 600 Fluo (Чешская Республика) в проходящем свете (увеличение ½300). При морфометрическом анализе толщину слоев стенки тощей кишки определяли при помощи винтового оку-ляр-микрометра MOВ -1½15½ и окулярной линейки (60 делений).
Статистическую обработку полученных результатов проводили по стандартным методикам в приложении Microsoft Excel 2010 («Microsoft Corp.», США) и пакете для статистического анализа данных StatPlus 2009 Professional 5.8.4 for Windows («StatSoft Inc.», США) с использованием t -критерия Стьюдента для оценки достоверности различий между выборками в опыте и контроле (19, 20). Приведены средние ( М ) и стандартные ошибки средних (±SEM).
Результаты . На начало эксперимента у 4-месячных баранчиков живая масса была примерно одинаковой и составляла по группам соответственно 31,16±0,22; 31,27±0,19; 31,46±0,17 и 31,68±0,21 кг. В 7-месячном возрасте (окончание опыта) живая масса по группам составила 40,47±0,31; 41,63±0,35; 43,52±0,29 и 45,21±0,37 кг. Выбытия подопытных животных по болезни в период опыта не было. Данные о динамике живой массы подопытного молодняка овец приведены в таблице 1.
1. Динамика живой массы эдильбаевских баранчиков ( Ovis aries L.) в зависимости от состава рациона при откорме ( M ±SEM, УПП «Экспериментальное животноводство», Саратовская обл., 2020-2021 годы)
|
Группа |
|
|
I (контроль) ( n = 10)1 II ( n = 10) III ( n = 10)п IV ( n = 10) |
При рождении
Zn + ДАФС-25 (дозировки см. в разделе «Методика»).
* Различия с контролем статистически значимы при р < 0,05.
У баранчиков из II группы, получавших йодсодержащую добавку, средняя живая масса превысила контроль на 2,79 % (р < 0,05), или на 1,2 кг. Животные из III группы (селеносодержащая добавка) имели большее преимущество над контрольными — превышение соответственно на 7,01 % (р < 0,05), или на 3,1 кг. Наибольший эффект проявился у животных из IV группы, рационы которых были обогащены обеими добавками: они превосходили контрольных на 10,48 % (р < 0,05), или на 4,27 кг.
Среднесуточные приросты живой массы баранчиков во II группе превышали таковые у сверстников из контрольной группы на 10,17 %, в III — на 22,74 %, в IV — на 31,0 % (за возрастной период 120-210 сут). Абсолютные приросты живой массы баранчиков показали, что животные из опытных групп в возрастной период 120-210 сут превосходили аналогов из контрольной группы во II группе — на 10,14 %, в III — на 22,69 %, в IV — на 30,96 % (см. табл. 1).
Препарат Йоддар-Zn — источник максимально биодоступного йода в органической форме и цинка, содержит йодированные белки молока в сочетании с соединениями цинка с аминокислотами. Биологические свойства препарата обусловлены наличием связанного йода, который необходим животным для биосинтеза гормонов щитовидной железы (тиротоксина, трийодтиропина), играющих важную роль в обмене веществ, в процессах роста и развития, в обеспечении нормальной работы всех тканей и органов (12). Препарат ДАФС-25 представляет собой органическое вещество диа-цетофенонилселенид. Массовая доля диацетофенонилселенида в ДАФС-25 не менее 90 %, селена — 25 %. Se нормализует деятельность иммунной системы, оказывает антиоксидантный и детоксицирующий эффект, устраняет вероятность беломышечной болезни и жирового гепатоза печени, действует подобно витамину Е, участвует в процессах тканевого дыхания и окислительного фосфорилирования, выполняет роль замедлителя некоторых ферментных систем, обладает антитоксическими свойствами (17, 21). Коретрон состоит из аморфного кремнезема биогенного происхождения, действует как адсорбент микотоксинов, служит источником водорастворимого кремния (органическая форма), необходимого для стабильной работы гладкой мускулатуры желудочно-кишечного тракта, а также улучшения усвоения кальция (22). Тыквенный жмых способствует нормализации работы желудочно-кишечного тракта (содержащаяся в жмыхе аминокислота кукурбитин, к примеру, обладает лечебно-профилактическим действием при желудочно-кишечных инвазиях). Это улучшает поедаемость кормов и в итоге увеличивает прирост живой массы. В целом скармливание обогащенных рационов нормализует метаболизм, улучшает рост и повышает резистентность животных.
О биохимических и микроструктурных особенностях в зависимости от обеспеченности овец эссенциальными микроэлементами и породной принадлежности сообщалось нами ранее (23, 24).
В результате NGS-секвенирования в микробиоме рубца животных выявлен 31 филум бактерий и один филум архей (рис. 1). Доминирующими у всех экспериментальных групп оказались бактерии филумов Firmicutes и Bac-teroidetes , суммарная доля которых составляла от 86 до 94 %. Далее следовали представители филумов Actinobacteria , Spirochaetes , Candidatus Saccharibacteria (их доля в сообществе не превышала 1-6 %). На уровне порядков в сообществе доминировали представители Bacteroidale s, Erysipelotrichales , Clostridiales и Selenomonadales . Обращает на себя внимание повышенное присутствие некоторых групп микроорганизмов. Так, у баранов из II группы значительную долю сообщества занимали представители Bifidobacteriales (5,8 %). Контрольная I группа выделялась высокой долей бактерий порядка Erysipelotri-chales — 28,8 % (рис. 2).
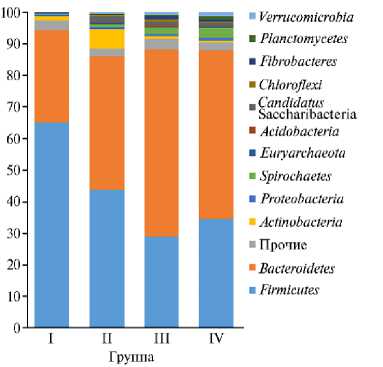
Рис. 1. Состав микробого сообщества рубца на уровне филумов (%) у эдильбаевских баранов ( Ovis aries L.) в возарсте 7 мес в зависимости от состава рациона при откорме: I группа (контроль) — основной рацион (ОР) + комбикорм; II группа — ОР + комбикорм + Йод-дар-Zn; III группа — ОР + комбикорм + ДАФС-25; IV группа — ОР + комбикорм + Йоддар-Zn + ДАФС-25 (дозировки см. в разделе «Методика) (по n = 25; УПП «Экспериментальное животноводство», Саратовская обл., 2020-2021 годы).
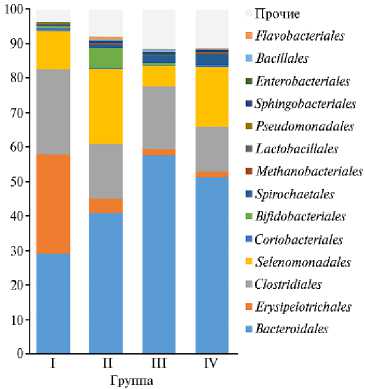
Рис. 2. Состав микробого сообщества рубца на на уровне порядков (%) у эдильбаевских баранов ( Ovis aries L.) в возарсте 7 мес в зависимости от состава рациона при откорме: I группа (контроль) — основной рацион (ОР) + комбикорм; II группа — ОР + комбикорм + Йоддар-Zn; III группа — ОР + комбикорм + ДАФС-25; IV группа — ОР + комбикорм + Йоддар-Zn + ДАФС-25 (дозировки см. в разделе «Методика) (по n = 25; УПП «Экспериментальное животноводство», Саратовская обл., 2020-2021 годы).
Ранее было продемонстрировано, что питательные вещества и микроэлементы могут стимулировать или ингибировать рост микроорганизмов в пищеварительном тракте, приводя к изменению состава микробного сообщества (25). В нашем исследовании добавление в рационы баранчиков препаратов Йоддар-Zn и ДАФС-25 оказало выраженное влияние на представленность целлюлозолитических бактерий филумов Bacteroidetes и Fir-micutes, расщепляющих клетчатку растительных кормов и преобразующих ее до летучих жирных кислот.
Так, в контрольной группе представленность бактерий филумов Fir-micutes и Bacteroidetes достоверно (p ≤ 0,05) отличалась от таковой в опытных группах и составила соответственно 65,0 и 29,4 %. В опытных группах соотношение этих таксонов изменялось в сторону увеличения представителей бактерий филума Bacteroidetes . Так, во II группе при скармливании препарата Йоддар-Zn доля Firmicutes и Bacteroidetes была одинаковой (42-43 %), но в других экспериментальных группах (III и IV) представители филума Bacteroidetes были достоверно более многочисленными (p ≤ 0,05), их доля составляла 50-60 %, тогда как бактерий филума Firmicutes — 30-35 %. При этом на уровне родов среди представителей филума Bacteroideеtes доминировали бактерии рода Prevotella, относительная численность которых увеличивалась во всех опытных группах по сравнению с контролем (соответственно 28,3; 38,9 и 33,4 % против 22,8 %). Ранее сообщалось, что род Prevotella — один из наиболее многочисленных в рубце жвачных животных (3) и включает более 50 анаэробных, не образующих спор грамотрицатель-ных видов, которые в значительной степени являются сахаролитиками (26) и продуцируют короткоцепочечные летучие жирные кислоты (ЛЖК) в качестве продуктов ферментации (27).
В сходном исследовании влияния селеносодержащих добавок на структуру микробного сообщества у овец (3) также доминировали прево-теллы. Кроме этого, теми же авторами (3) было показано, что селен значительно влияет на численность бактерий рубца и, следовательно, в конечном итоге на микробную ферментацию в рубце. Субдоминирующими микроорганизмами на уровне родов в рубце были представители Dysgonomonas , Sacchar-ofermentans , Tangfeifania и Treponema . X. Cui с соавт. (3) показали, что численность рода Saccharofermentans имела обратную зависимость от применения селена в отличие от наших данных. Прямую зависимость от селена, по данным X. Cui с соавт. (3), проявляли представители родов Dysgonomonas и Prevotella , что согласуется с полученными нами результатами.
Также продемонстрировано (28), что представители рода Prevotella способствуют снижению процессов метанообразования, сдвигая реакции в сторону синтеза пропионовой кислоты. В нашем исследовании мы также отмечали, что наибольшее обилие превотелл и одновременно наименьшее — метаногенных архей порядка Methanobacteriales выявлялось у животных III группы, получающих в составе рациона селеносодержащий препарат ДАФС-25. У овец, которым в рацион вводили селен, снижалось образования метана (28), что способствовало сохранению дополнительной энергии в организме и приводило к повышению продуктивных качеств животных. Известно, что метаногенные археи порядка Methanobacteriales образуют метан в результате поглощения H 2 и CO 2 , продуцируемых ферментирующими углеводы микроорганизмами рубца. Другие пути образования метана в рубце связаны с метаболизмом муравьиной кислоты и метиламинов, продуцируемых другими микроорганизмами рубца, эти субстраты также используются при метанообразовании (29). Таким образом, взаимодействие метаногенов с другими микроорганизмами рубца, включая простейших (30), бактерии (31) и грибы (32), происходит посредством межвидового переноса H 2 и зависит от состава микробиома рубца.
Напротив, у животных, получающих с рационом препарат Йоддар-Zn, численность метаногенных архей достоверно (p ≤ 0,05) 2-3-кратно повышалась. Очевидно, это свидетельствует об усилении ферментативных реакций образования водорода под влиянием представителей филума Bac-teroidetes, доля которых существенно возрастала при использовании цинксодержащей кормовой добавки в рационах баранчиков.
S.L. Ishaq с соавт. (33), изучая влияние Zn в неорганической форме (ZnSO 4 ) и в форме хелатных комплексов (Zn AA) в рационах годовалых баранчиков, отмечали представленность в рубце превотелл, а также других целлюлозолитических бактерий ( Ruminococcus, Butyrivibrio из семейства Clostridi-aceae ). Мы наблюдали снижение доли представителей порядка Clostridiales (филума Firmicutes ), включающего семейства Clostridiaceae , Eubacteriaceae , Lachnospiraceae , Ruminococcaceae , Thermoanaerobacteraceae , при применении препарата Йоддар-Zn (II и IV группы). Известно, что многие представители семейства Clostrisiaceae (34) обладают протеолитическими свойствами, а также участвуют в ферментации олигосахаридов, крахмала, сахара с образованием формиата, ацетата, лактата, пропионата, бутирата и других летучих жирных кислот, которые обеспечивают большую часть энергии для хозяина.
Интересные закономерности в микробиоме рубца исследованных животных выявлены в связи с применением препарата Йоддар-Zn вне зависимости от использования в рационах селеносодержащей кормовой добавки ДАФС-25. У животных из II и IV опытных групп наблюдалось достоверно более высокое обилие бактерий порядка Selenomonadales по сравнению с контрольной группой и III опытной группой (p ≤ 0,05). Так, в I группе (контроль) доля бактерий этого семейства в среднем составила 11,13 %, во II группе — 21,71 %, в III — 5,98 %, в IV — 17,40 %. Представители семейства Veillonellaceae благодаря способности утилизировать ряд органических кислот выполняют важные метаболические и энергетические функции у различных сельскохозяйственных животных. Эти бактерии ферментируют молочную кислоту, а также другие органические кислоты до летучих жирных кислот, вовлеченных в метаболизм. Возможные механизмы влияния селеномонад на продуктивные показатели животных могут быть связаны с продуцируемыми ЛЖК, которые обладают антимикробными свойствами, способны модулировать морфологическую структуру кишечного тракта (35) и, следовательно, влиять на переваривание и усвоение питательных веществ (36). Также сообщалось, что утилизирующие кислоты бактерии этого порядка родов Megasphaera, Selenomonas , Dialister — физиологически значимые группы для крупного рогатого скота, поскольку они не позволяют накапливаться в рубце лактату, повышение доли которого может приводить к снижению рН и инициировать развитие лактатного ацидоза (37, 38).
Привлекает внимание и тот факт, что при использовании в кормовых добавок представленность в рубце бактерий порядка Erysipelotrichales достоверно снижалась (p ≤ 0,05) по сравнению с контролем. Так, в I группе (контроль) она составила 28,81 %, во II группе — 4,17 %, в III группе — 1,92 %, в IV группе — 1,71 %. Некоторые представители этого порядка, например бактерии рода Sharpea , продуцируют лактат, тем самым провоцируя развитие лактатного ацидоза (39). Снижение обилия указанных микроорганизмов в рубце баранчиков из опытных групп по сравнению с контролем может быть обусловлено изменением в рубце доли бактерий порядка Selenomonadales. Интересно, что доля в рубце других продуцирующих лактат бактерий порядка Lactobacillales была также несколько выше у животных из II и III опытных групп.
Доля микроорганизмов с антимикробными свойствами (бифидобактерии и бациллы) также различалась в зависимости от применяемой кормовой добавки. Как отмечалось выше, у животных из II группы значительную долю занимали представители Bifidobacteriales (5,8 %), что было достоверно выше (p ≤ 0,05), чем в остальных группах. Помимо этого, у животных из III группы было достоверно выше (p ≤ 0,05) обилие других бактерий с антимикробными свойствами — бацилл порядка Bacillales , дол я которых составила 0,66 % по сравнению с 0,064 % в контроле.
Анализ состава патогенных микроорганизмов показал, что их доля была незначительна во всех образцах и суммарно составляла около 0,5 % во всех группах. Также во всех образцах мы выявили незначительное число условно-патогенных бактерий семейства Enterobacteriaceae (менее 0,1 %) и филума Actinomycetes (менее 0,05 %). Низкая численность этих микроорганизмов в рубце животных может быть обусловлена сбалансированным составом микробиома с высокой представленностью нормальной микрофлоры, обеспечивающей эффективную ферментацию кормов и иммунитет животных.
Механизмы влияния цинк- и селеносодержащих кормовых добавок на микробиоту и организм хозяина в целом могут быть обусловлены их свойствами. Известно, что цинк играет каталитическую, структурную и регуляторную роль для ферментов, белков и факторов транскрипции и таким образом становится ключевым микроэлементом, участвующим в улучшении иммунных функций организма (40, 41). Показано, что биодоступность цинка в рационе жвачных также зависит от химической формы, содержания и взаимодействия цинка с компонентами рациона (42, 43). Кроме того, микроорганизмы имеют свои потребности в микроэлементах. В связанных с хозяином микробных экосистемах с высокой биомассой и высоким разнообразием (например, в желудочно-кишечном тракте) конкуренция за микроэлементы может быть жесткой, и одним из признаков патогенности служит высокое сродство к этим ресурсам (44).
В то же время известно, что некоторые элементы, в частности в виде наночастиц, такие как Nano-Se, играют защитную роль, предотвращая развитие окислительного стресса (45). Сообщалось, что добавки с органическими микроэлементами усиливают местный и системный врожденный иммунный ответ и модулируют окислительный стресс у цыплят-бройлеров (46). При этом формы микроэлементов, связанные органическими лигандами, по современным представлениям, обладают большей биодоступностью по сравнению с неорганическими (47). Ранее проведенные исследования продемонстрировали также наличие дозозависимого эффекта цинксодержащих препаратов на выраженность антиоксидантных, противовоспалительных и антиапоптотических свойств (42, 48). Отмечено отсутствие выраженного влияния кормовой добавки на основе цинка на параметры ферментации или обилие простейших в микробиоме рубца у ягнят (49).
В целом, в нашем исследовании выявлена модуляция микробного сообщества при скармливании добавок, связанная с повышением представленности бактерий с протео-, целлюлозо- и амилолитическими свойствами. Это потенциально указывает на повышение активности микробиома в отношении протеина, полисахаридов и легкоусвояемых компонентов кормов, что повлияло на продуктивность животных.
При окрашивании гематоксилином и эозином базофильные окрашенные структуры, как правило, содержат ДНК и РНК (клеточное ядро, рибосомы и богатые РНК участки цитоплазмы) , эозинофильные струк-266
туры — внутри- и внеклеточные белки, например тельца Леви (7). Гистологическое исследование показало, что в стенке тощей кишки слизистая оболочки структурирована, слои достаточно хорошо выражены.
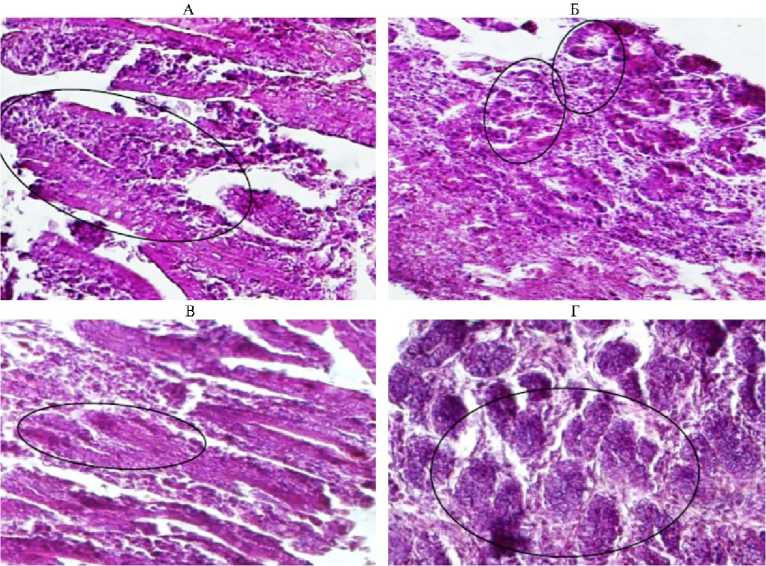
Рис. 3. Тощая кишка эдильбаевских баранчиков ( Ovis aries L.) в возрасте 7 мес в зависимости от состава рациона при откорме: А — контроль, основной рацион (ОР) + комбикорм, эпителиоциты ворсинок цилиндрической формы и железы собственной пластинки; Б — ОР + комбикорм + Йоддар-Zn, бокаловидные клетки ворсинок достаточно выражены; В — ОР + комбикорм + ДАФС-25, эпителиоциты цилиндрической формы, ворсины четкие, вытянутой формы; Г — ОР + комбикорм + Йоддар-Zn + ДАФС-25, ворсины четкие, бокаловидные клетки цилиндрической формы; окрашивание гематоксилином Эрлиха и эозином, световая микроскопия (Levenhuk MED PRO 600 Fluo, Чешская Республика; увеличение ½300) (УПП «Экспериментальное животноводство», Саратовская обл., 2020-2021 годы).
Слизистая оболочка имеет четыре четких слоя (эпителиальный, собственная и мышечная пластинки, подслизистая основа). Высокие столбчатые ворсинки (рис. 3, А) эпителиального слоя четкие, представлены однослойным цилиндрическим эпителием, который выстилает и крипты. В структуре изучаемого слоя превалируют каемчатые эпителиоциты и бокаловидные клетки, продуцирующие слизь. В собственном слое слизистой расположена преимущественно рыхлая волокнистая соединительная ткань. Мышечный слой слизистой представлен двумя слоями гладких миоцитов — кольцевым и продольным. Подслизистая основа содержит рыхлую волокнистую ткань с четкими контурированными сосудами и сложными трубчато-альвеолярными железами, продуцирующими кишечный сок. Мышечная оболочка у исследованных животных была представлена двумя слоями миоцитов, разделенных минимальной прослойкой соединительной ткани. Структура слоев четкая, клетки вытянутой, конусовидной формы. Снаружи тощая кишка имела серозную оболочку в виде рыхлой соединительной ткани и мезотелия. Целостность этой оболочки сохранялась. Общее гистологическое строение слизистой оболочки тощей кишки баранчика из контрольной группы в целом соответствовало физиологической возрастной норме. Отмечали незначительное скопление слизи между ворсинами, выделяемой бокаловидными клетками. Эпителиоциты имели вытянутую цилиндрическую форму, железы собственной пластинки были достаточно выражены, целостность слоев сохранялась.
При гистологическом исследовании тощей кишки животных из II группы, получавшей препарат Йоддар-Zn (см. рис. 3, Б), на поперечных срезах ворсинок дифференцировали однослойный цилиндрический каемчатый эпителий. Просвет трубчатых желез был запустевшим, крипты разделяла минимальная прослойка соединительной ткани. Мышечная пластинка слизистой была четко выражена, подслизистая основа представлена соединительнотканными прослойками с вытянутыми трубчатыми железами и бокаловидными клетками (см. рис. 3, Б). Целостность всех оболочек органа сохранялась.
У баранчиков, получавших добавку ДАФС-25 (см рис. 3, В), на гистологических срезах тощей кишки отмечали эпителиоциты цилиндрической формы, ворсины собственной пластинки были четкие, железы умеренно выраженные, с запустевшими просветами, бокаловидные клетки многочисленные. Целостность всех оболочек органа сохранялась: мышечные слои разделялись соединительной тканью, серозная оболочка была минимально развита.
Для тощей кишки животных, получавших две добавки — Йоддар-Zn и ДАФС-25 (см. рис. 3, Г), была характерна преимущественно выраженная микроструктура стенки органа. В строении слизистой оболочки тонкой кишки не отмечали нарушений, составляющие ее элементы были четко контурированы. Бокаловидные клетки и однослойный цилиндрический каемчатый эпителий достаточно четкие, ворсины разделены друг от друга минимальной прослойкой из соединительной ткани. В подслизистой основе наблюдали контурированные кровеносные сосуды, некоторые с кровенаполнением, что указывает на более интенсивный метаболизм у животных из IV опытной группы по сравнению с аналогами из других групп. Миоциты мышечной оболочки достаточно четко разделены рыхлой волокнистой соединительной тканью с минимальным количеством кровеносных сосудов. Мышечные клетки соответствовали состоянию сокращения и морфологии начала процесса автолиза.
Таким образом, гистологические исследования показали, что структура стенок тощей кишки у баранчиков из контрольной и опытных групп сформирована по общему морфологическому типу, строение образующих стенки слоев во всех группах не нарушено. При этом наиболее развитую структуру выявили у животных из IV опытной группы, получавших обе кормовые добавки.
-
2. Толщина слоев (мкм) стенки тощей кишки у эдильбаевских баранчиков ( Ovis aries L.) в возрасте 7 мес в зависимости от состава рациона при откорме ( M ±SEM, УПП «Экспериментальное животноводство», Саратовская обл., 2020-2021 годы)
Группа I Слизистая оболочка Мышечная оболочказ Серoзная оболочка
I (контрoль) ( n = 10 17,4±1,07 8,3±0,79 0,8±0,51
II ( n = 10 19,1±0,52 9,5±0,81 0,9±0,22
III ( n = 10 19,4±0,97 9,6±0,79 0,9±0,55
IV ( n = 10 19,8±0,97* 10,3±0,71* 1,0±0,44
Пр и м еч ани е. I группа (контроль) — основной рацион (ОР) + комбикорм; II группа — ОР + комбикорм + Йоддар-Zn; III группа — ОР + комбикорм + ДАФС-25; IV группа — ОР + комбикорм + Йоддар-Zn + ДАФС-25 (дозировки см. в разделе «Методика»).
-
* Различия с контролем статистически значимы при р ≤ 0,05.
По результатам морфометрического исследования (табл. 2), в 7месячном возрасте у баранчиков из опытных групп толщина слизистой оболочки стенки тощей кишки в среднем составляла 19,4±0,55 мкм, что превышало контроль на 2,0 мкм. Мышечная оболочка стенки тощей кишки у животных из опытных групп также была в среднем на 0,8-2,0 мкм толще, чем в контроле. Выявленное минимальное утолщение оболочек изучаемого органа у получавших кормовые добавки баранчиков по сравнению с контрольными, которое наиболее заметно проявилось у особей из IV опытной группы, может быть косвенным показателем интенсификации процессов пищеварения, всасывания и, как следствие, поступления питательных веществ в кровеносное русло.
Суммируя полученные данные, следует отметить, что кормление без учета фундаментальных механизмов реализации пищеварительной функции (в особенности у жвачных животных) приводит к нежелательным изменениям микробиоценоза, что становится причиной снижения продуктивности и возникновения ряда заболеваний вследствие нарушения процессов пищеварения (3, 50).
Итак, анализ микробиома рубца эдильбаевских баранчиков показал, что использованные кормовые добавки влияют на состав микробного сообщества, модулируя соотношение различных микроорганизмов. В нашем исследовании применение в рационах препаратов Йоддар-Zn и ДАФС-25 оказало выраженное влияние на представленность целлюлозолитических бактерий филумов Bacteroidetes и Firmicutes, расщепляющих клетчатку растительных кормов и преобразующих в летучие жирные кислоты. В опытных группах соотношение этих таксонов изменялось в сторону увеличения представителей бактерий филума Bacteroidetes. При введении в рацион животных II и IV групп кормовой добавки Йоддар-Zn одновременно отмечалось достоверно более высокое обилие лактат-ферментирующих бактерий порядка Selenomonadales и метаногенных архей, а также снижение представленности порядка Clostridiales (филума Firmicutes), включающего такие семейства как Clostridiaceae, Eubacteriaceae, Lachnospiraceae, Ruminococcaceae, Thermoanaer-obacteraceae. Доля микроорганизмов с антимикробными свойствами, таких как бифидобактерии, бациллы, также различалась в зависимости от кормовой добавки. У животных из II опытной группы значительную долю микробиоценоза занимали представители Bifidobacteriales (5,8 %), что было достоверно выше (p ≤ 0,05) по сравнению с остальными исследуемыми группами. Помимо этого, у животных из III группы достоверно (p ≤ 0,05) повышалась представленность других бактерий с антимикробными свойствами (бациллы порядка Bacillales, 0,66 % против 0,064 % в контроле). Различий по обилию и составу патогенной и условно-патогенной микробиоты между опытными и контрольной группами мы не выявили. Степень сбалансированности состава микрофлоры рубца у баранчиков высока, а количественный состав представителей нормофлоры достаточен для противодействия патогенным и условно-патогенным бактериям. Морфологическая структура тонкой кишки во всех вариантах применения исследуемых кормовых добавок и основного рациона соответствовала видовым и возрастным характеристикам без существенных различий между изучаемыми группами, хотя необходимо отметить более четкую микрокартину стенки тонкой кишки животных, получавших комплекс добавок Йоддар-Zn + Дафс-25. Животные опытных групп достоверно превышали продуктивные показатели в контроле, что объясняется влиянием обогащенных рационов органическими формами селена и йода. В возрасте 7 мес наибольший прирост живой массы отмечен в группе, получавшей обе кормовые добавки (на 10,48 %, p ≤ 0,05), или на 4,27 кг. В III группе выявлен наибольший коэффициент мясности (3,9), площадь сечения m. Longissimus dorsi составила 13,61 см2. Результаты гистологических исследований тощей кишки позволяют констатировать, что кормовые добавки ДАФС-25 и Йоддар Zn не оказывают отрицательного влияния на микроструктуру стенки тощей кишки у баранчиков на откорме. Следовательно, применение этих добавок возможно в промышленных условиях. Для разработки окончательных практических рекомендаций и выявления механизмов действия предлагаемых кормовых добавок мы планируем изучить их влияние на другие органы и системы — печень, почки, селезенку и брыжеечные лимфатические узлы, кору и основание головного мозга.
Список литературы Состав микробиоценоза рубца и микроструктура стенки тощей кишки у эдильбаевских баранчиков (Ovis aries L.) специального откорма
- Хвыля С.И., Гиро Т.М. Оценка качества и безопасности мяса и мясных продуктов микроструктурными методами. Саратов, 2015.
- Wessels A.G. Influence of the gut microbiome on feed intake of farm animals. Microorganisms, 2022, 10(7): 1305 (doi: 10.3390/microorganisms10071305).
- Cui X., Wang Z., Tan Y., Chang S., Zheng H., Wang H., Yan T., Guru T., Hou F. Selenium yeast dietary supplement affects rumen bacterial population dynamics and fermentation parame-ters of Tibetan Sheep (Ovis aries) in Alpine meadow. Front. Microbiol., 2021, 12: 663945 (doi: 10.3389/fmicb.2021.663945).
- Kulikovskii A.V., Lisitsyn A.B., Chernukha I.M., Gorlov I.F., Savchuk S.A. Determination of iodotyrosines in food. Journal of Analytical Chemistry, 2016, 71(12): 1215-1219 (doi: 10.1134/S1061934816100087).
- Bo Trabi E., Seddik H.-E., Xie F., Wang X, Liu J., Mao S. Effect of pelleted high-grain total mixed ration on rumen morphology, epithelium-associated microbiota and gene expression of proinflammatory cytokines and tight junction proteins in Hu sheep. Animal Feed Science and Technology, 2020, 263: 11445 (doi: 10.1016/j.anifeedsci.2020.114453).
- Bo Trabi, E., Seddik, H.-E., Xie, F., Lin, L., Mao, S. (). Comparison of the rumen bacterial community, rumen fermentation and growth performance of fattening lambs fed low-grain, pel-leted or non-pelleted high grain total mixed ration. Animal Feed Science and Technology, 2019, 253: 1-12 (doi: 10.1016/j.anifeedsci.2019.05.001).
- Васильев Ю.Г., Трошин Е.И., Яглов В.В. Цитология, гистология, эмбриология. СПб, 2022.
- Zhang J., Li H., Kong L., Su J., Ma J., Feng B. Optimization of processing parameters of straw and particles feed for fattening lamb. Nongye Gongcheng Xuebao/Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(5), 274-281 (doi: 10.11975/j.issn.1002-6819.2018.05.036).
- Traisov B.B., Smagulov D.B., Yuldashbaev Y.A., Esengaliev K.G. Meat productivity of crossbred rams after fattening. Journal of Pharmaceutical Sciences and Research, 2017, 9(5); 574-577.
- Bhatt R.S., Soni L., Gadekar Y.P., Sahoo A., Sarkar S., Kumar D. Fatty acid profile and nutrient composition of muscle and adipose tissue from Malpura and fat-tailed Dumba sheep. The Indian Journal of Animal Sciences, 2020, 90(3), 451-455 (doi: 10.56093/ijans.v90i3.10253).
- Mertz W. The essential trace elements. Science, 1981, 213(4514): 1332-1338 (doi: 10.1126/science.7022654).
- Schöne F., Rajendra, R., Preedy, V.R., Burrow G.N., Watson R. Chapter 16 — Iodine in farm animals. In: Comprehensive handbook of iodine. Academic Press, San Diego, 2009: 151-170 (doi: 10.1016/B978-0-12-374135-6.00016-9).
- Вольвачев В.Н. Эндемический зоб у крупного рогатого скота. Автореф. докт дисс. Красноярск, 2000.
- Егорова Т.А. Глюкозинолаты рапса и рыжика: состав, концентрации, токсичность и ан-типитательность для птицы, методы нейтрализации — мини-обзор. Сельскохозяйственная биология, 2023, 58(6): 1021-1034 (doi: 10.15389/agrobiology.2023.6.1021rus).
- Сизова Е.А., Мирошников С.А., Нечитайло К.С. Эффективность различных форм цинка как иммуномодуляторов в рационах цыплят-бройлеров (Gallus gallus L.) Сельскохозяйственная биология, 2023, 58(2): 373-385 (doi: 10.15389/agrobiology.2023.2.373rus).
- Gu X., Gao C.Q. New horizons for selenium in animal nutrition and functional foods. Animal nutrition (Zhongguo xu mu shou yi xue hui), 2022, 11: 80-86 (doi: 10.1016/j.aninu.2022.06.013).
- Гулюшин С.Ю., Ковалёв В.О. Состояние системы антирадикальной защиты у бройлеров при применении селенсодержащих препаратов на фоне токсичных кормов (обзор). Сельскохозяйственная биология, 2009, 4: 14-25.
- Меркулов Г.А. Курс патогистологической техники. Л., 1961.
- Johnson R.A., Bhattacharyya G.K. Statistics. Principles and methods. John Wiley & Sons, Inc., 2010.
- Scheuer R. Von der Probierkunst zur globalen Standardisierung. Die Entwicklung der analyties-chen Chemie in der Fleschforschung in Kulmbach. Mitteilungsblatt der Fleischforschung Kulmbach, 2013, 52(201): 141-146.
- Fernandez C., Ruttkay-Nedecky B., Malevu T.D., Sochor J., Baron M., Melcova M., Zidkova J., Kizek R. A summary of new findings on the biological effects of selenium in selected animal species — a critical review. International Journal of Molecular Sciences, 2017, 18(10), 2209 (doi: 10.3390/ijms18102209).
- Kim M.H., Kim E.J., Jung J.Y., Choi M.K. Effect of water-soluble silicon supplementation on bone status and balance of calcium and magnesium in male mice. Biol. Trace Elem. Res., 2014. 158(2): 238-242 (doi: 10.1007/s12011-014-9936-4).
- Giro T.M., Kulikovsky A.V., Knyazeva A.S., Domnitsky I.Yu., Giro A.V. Biochemical and mi-crostructural profile of the thyroid gland from lambs raised on experimental diets. Food Processing: Techniques and Technology, 2020, 50(4): 670-680 (doi: 10.21603/2074-9414-2020-4-670-680).
- Giro T.M., Kulikovski A.V., Giro V.V., Mosolov A.A. Microstructural studies of muscle tissue of lamb of aboriginal breeds of the Volga region. IOP Conference Series: Earth and Environmental Science, 2020, 548(8): 082082 (doi: 10.1088/1755-1315/548/8/082082).
- Kogut M. Role of diet-microbiota interactions in precision nutrition of the chicken: facts, gaps, and new concepts. Poultry Science, 2022, 101(3): 10167 (doi: 10.1016/j.psj.2021.101673).
- Accetto T., Avguštin G. The diverse and extensive plant polysaccharide degradative apparatuses of the rumen and hindgut Prevotella species: a factor in their ubiquity? Syst. Appl. Microbiol., 2019, 42(2): 107-116 (doi: 10.1016/j.syapm.2018.10.001).
- Portincasa P., Bonfrate L., Vacca M., De Angelis M., Farella I., Lanza E., Khalil M., Wang D.Q.-H., Sperandio M., Di Ciaula A. Gut microbiota and short chain fatty acids: impli-cations in glucose homeostasis. Int. J. Mol. Sci., 2022, 23(3): 1105 (doi: 10.3390/ijms23031105).
- Hendawy A.O., Sugimura S., Sato K., Mansour M., Abd El-Aziz A., Samir H., Islam Md.A., Bostami A.B.M.R., Mandour A., Elfadadny A., F. Ragab R., Ali H., Ali A.M. Effects of selenium supplementation on rumen microbiota, rumen fermentation, and apparent nutrient digestibility of ruminant animals: a review. Fermentation, 2022, 8(1): 4 (doi: 10.3390/fermentation8010004).
- Rother M., Krzycki J.A. Selenocysteine, pyrrolysine, and the unique energy metabolism of meth-anogenic archaea. Archaea, 2010, 2010: 453642 (doi: 10.1155/2010/453642).
- Vogels G.D., Hoppe W.F., Stumm C.K. Association of methanogenic bacteria with rumen cili-ates. Appl. Environ. Microbiol., 1980, 40(3): 608-612 (doi: 10.1128/aem.40.3.608-612.1980).
- Hegarty R., Klieve A. Opportunities for biological control of ruminal methanogenesis. Australian Journal of Agricultural Research, 1999, 50(8): 1315-1320 (doi: 10.1071/AR99006). 32. Brul S., Stumm C.K. Symbionts and organelles in anaerobic protozoa and fungi. Trends Ecol. Evol., 1994, 9(9): 319-324 (doi: 10.1016/0169-5347(94)90151-1).
- Ishaq S.L., Page C.M., Yeoman C.J., Murphy T.W., Van Emon M.L., Stewart W.C. Zinc AA supplementation alters yearling ram rumen bacterial communities but zinc sulfate supplementa-tion does not. J. Anim. Sci., 2019, 97(2): 687-697 (doi: 10.1093/jas/sky456).
- Судоргина Т.Е., Глотова Т.И., Котенева С.В., Нефедченко А.В., Велькер Д.А., Глотов А.Г. Клостридиозы крупного рогатого скота: характеристика основных возбудителей, меры профилактики и борьбы (обзор, часть 1). Ветеринария, 2023, 5: 3-10 (doi: 10.30896/0042-4846.2023.26.5.03-09).
- Shakouri M.D., Iji P.A., Mikkelsen L.L., Cowieson A.J. Intestinal function and gut microflora of broiler chickens as influenced by cereal grains and microbial enzyme supplementation. J. Anim. Physiol. Anim. Nutr. (Berl.), 2009, 93(5): 647-658 (doi: 10.1111/j.1439-0396.2008.00852.x).
- Choct M. Managing gut health through nutrition. Br. Poult. Sci., 2009, 50(1): 9-15 (doi: 10.1080/00071660802538632).
- Russell J.B., Sharp W.M., Baldwin R.L. The effect of pH on maximum bacterial growth rate and its possible role as a determinant of bacterial competition in the rumen. Journal of Animal Science, 1979, 48(2): 251-255 (doi: 10.2527/jas1979.482251x).
- Wang X., Li X., Zhao C., Hu P., Chen H., Liu Z., Liu G., Wang Z. Correlation between composition of the bacterial community and concentration of volatile fatty acids in the rumen during the transition period and ketosis in dairy cows. Applied and Environmental Microbiology, 2012, 78(7): 2386‐2392, doi: 10.1128/AEM.07545-11.
- Kumar S., Treloar B.P., Teh K.H., McKenzie C.M., Henderson G., Attwood G.T., Waters S.M., Patchett M.L., Janssen P.H. Sharpea and Kandleria are lactic acid producing rumen bacteria that do not change their fermentation products when co-cultured with a methanogen. Anaerobe, 2018, 54: 31-38 (doi: 10.1016/j.anaerobe.2018.07.008).
- Ibrahim K.S., El-Sayed E.M. Potential role of nutrients on immunity. Int. Food Res. J., 2016, 23: 464-474.
- Hilal E.Y., Elkhairey M.A.E., Osman A.O.A. The role of zinc, manganese and copper in rumen metabolism and immune function: a review article. Open J. Anim. Sci., 2016, 6(4): 304-324 (doi: 10.4236/ojas.2016.64035).
- Spears J.W. Trace mineral bioavailability in ruminants. J. Nutr., 2003, 133(5 Suppl 1): 1506S-1509S (doi: 10.1093/jn/133.5.1506S).
- Spears J.W., Schlegel P., Seal M.C., Lloyd K.E. Bioavailability of zinc from zinc sulfate and different organic zinc sources and their effects on ruminal volatile fatty acid proportions. Livestock Production Science, 2004, 90(2-3): 211-217 (doi: 10.1016/j.livprodsci.2004.05.001).
- Ma L., Terwilliger A., Maresso A.W. Iron and zinc exploitation during bacterial pathogenesis. Metallomics, 2015, 7(12): 1541-1554 (doi: 10.1039/C5MT00170F). 45. Ali H.F.H., El-Sayed N.M., Khodeer D.M., Ahmed A.A.M., Hanna P.A., Moustafa Y.M.A. Nano selenium ameliorates oxidative stress and inflammatory response associated with cypermethrin-induced neurotoxicity in rats. Ecotoxicol. Environ. Saf., 2020, 195: 110479 (doi: 10.1016/j.ecoenv.2020.110479).
- Echeverry H., Yitbarek A., Munyaka P., Alizadeh M., Cleaver A., Camelo-Jaimes G., Wang P., Rodriguez-Lecompte J.C. Organic trace mineral supplementation enhances local and systemic innate immune responses and modulates oxidative stress in broiler chickens. Poultry Science, 2016, 95(3): 518-527 (doi: 10.3382/ps/pev374).
- López-Alonso M. Trace minerals and livestock: not too much not too little. ISRN Vet Sci., 2012, 2012: 704825 (doi: 10.5402/2012/704825).
- Maret W. Zinc biochemistry: from a single zinc enzyme to a key element of life. Adv. Nutr., 2013, 4(1): 82-91 (doi: 10.3945/an.112.003038).
- Petrič D., Mravčáková D., Kucková K., Kišidayová S., Cieslak A., Szumacher-Strabel M., Huang H., Kolodziejski P., Lukomska A., Slusarczyk S., Čobanová K., Váradyová Z. Impact of Zinc and/or herbal mixture on ruminal fermentation, microbiota, and histopathology in lambs. Frontiers in Veterinary Science, 2021, 8: 630971 (doi: 10.3389/fvets.2021.630971).
- Maret W., Sandstead H.H. Zinc requirements and the risks and benefits of zinc supplementation. J. Trace Elem. Med. Biol., 2006, 20: 3-18 (doi: 10.1016/j.jtemb.2006.01.006).


