Состояние костной ткани у больных с впервые выявленным гипотиреозом
Автор: Ночевная Л.Б., Павленко О.А., Килина О.Ю., Столярова В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4-2 т.26, 2011 года.
Бесплатный доступ
Проведен анализ метаболизма и прочности костной ткани у больных с впервые выявленным гипотиреозом. Доказана возможность использования скринингового метода ультразвуковой остеометрии пяточной кости для выявления снижения костной прочности. Зарегистрировано изменение костной прочности в периферическом отделе скелета (пяточной кости). Снижение прочности кости обусловлено снижением скорости ремоделирования костной ткани, проявившемся как в снижении уровня маркера костной резорбции, так и снижении маркера формирования кости. Выявлено влияние тяжести гипотиреоза на частоту встречаемости остеопенического синдрома и снижение показателей ультразвуковой остеометрии пяточной кости у данной категории больных.
Прочность костной ткани, гипотиреоз, остеопенический синдром, показатели прочности кости, маркеры костной резорбции, маркеры формирования кости
Короткий адрес: https://sciup.org/14919641
IDR: 14919641 | УДК: 616.441-008.64-021.3:616.71
Текст научной статьи Состояние костной ткани у больных с впервые выявленным гипотиреозом
Распространенность манифестного первичного гипотиреоза в популяции составляет 0,2–2,0% [4, 5, 10], субклинического – до 10–12% [12].
При дефиците тиреоидных гормонов, являющихся небходимыми для формирования и функционирования организма человека, развиваются тяжелые изменения всех органов и систем, в том числе и со стороны костной системы.
У пациентов с гипотиреозом замедлено костное ремоделирование – в 2–3 раза снижена скорость обеих составляющих ремоделирующего цикла – костной резорбции и костного формирования [1, 11].
Е.И. Марова и соавт. отмечают, что у женщин репродуктивного возраста при нелеченном первичном гипотиреозе обнаруживаются признаки замедления костеобразования и костной резорбции при отсутствии изменений минеральной плотности костной ткани (МПКТ) [3]. Однако D.C. Buer и соавт. сообщают, что у больных с не- леченным гипотиреозом происходит утолщение поверхностного слоя подвздошной кости, уплотнение свода основания черепа с исчезновением губчатого вещества [8]. У женщин на снижение МПКТ влияет наличие первичного гипотиреоза [2].
Р. Флетчер, С. Флетчер, Э. Вагнер показали, что у женщин репродуктивного возраста с нелеченным гипотиреозом прослеживались признаки снижения как костеобразования, так и костной резорбции при отсутствии признаков остеопении в позвоночнике и в проксимальных отделах бедра [6].
С помощью унифицированной анкеты проанализированы 23 фактора риска остеопороза, установлены значимые факторы риска развития вторичного остеопороза у женщин с первичным гипотиреозом: масса тела менее 60 кг, индекс массы тела (ИМТ) менее 27,5 кг/мІ, доза принимаемого левотироксина более 75 мкг в сутки, длительность приема тиреоидных гормонов более 5 лет, компенсация гипотиреоза [7].
Данные литературы показывают, что вопрос о влиянии гипотиреоза на состояние костной ткани изучен недостаточно ввиду малого числа исследований. Продемонстрировать влияние сниженной функции щитовидной железы на состояние прочности кости нелегко в связи с тем, что эти больные, как правило, пожилого возраста и имеют много дополнительных факторов, предрасполагающих к остеопорозу. Цель исследования: оценить состояние костного метаболизма у больных с впервые выявленным гипотиреозом по данным лабораторного и инструментального методов исследования, а также обосновать целесообразность внедрения скринингового исследования костной ткани методом ультразвуковой остеометрии (УЗО) для диагностики остеопенического синдрома (ОПС) у этой категории больных.
Материал и методы
В исследовании приняли участие 40 женщин с впервые выявленной тиреоидной патологией в состоянии гипотиреоза в возрасте от 18 до 45 лет. По нозологическим формам заболеваний щитовидной железы группа была представлена следующим образом: 5 пациенток с диффузно-узловым зобом, 7 – с узловыми формами зоба и 28 человек – с аутоиммунным тиреоидитом.
Возраст больных с впервые выявленным гипотиреозом – 38,40±5,98 лет, представителей контрольной группы (n=30) – 34,36±7,56 лет. Данное различие понятно, так как гипотиреоз чаще развивается у людей старшего возраста.
Средняя масса тела и ИМТ больных не отличались от соответствующих показателей представителей контрольной группы – 65,44±9,28 кг (р=0,51), 24,89±3,92 кг/мІ (р=0,66).
Характеристика функционального состояния щитовидной железы в исследуемой группе соответствовала манифестному гипотиреозу: уровень тиреотропного гормона (ТТГ) 10,40±4,33 мкМЕ/мл (р<0,001), а уровень св. Т4 10,29±3,50 пмоль/л (р<0,001) в сравнении с соответствующими показателями лиц группы контроля. Для уточнения влияния тяжести гипотиреоза общую группу боль- ных мы разделили на две подгруппы, которые составляли 20 пациентов с субклиническим (ТТГ 8,80±3,42 мкМЕ/ мл (р<0,001), св. Т4 13,05±2,24 пмоль/л (р=0,03)) и 20 – с манифестным гипотиреозом (ТТГ 12,01±4,61 мкМЕ/мл (р<0,001), св. Т4 7,49±1,97 пмоль/л (р<0,001).
Функциональное состояние щитовидной железы оценивали с помощью определения базальных концентраций тиреотропного гормона, трийодтиронина (Т3) и свободной фракции тироксина (св. Т4). Количественное определение концентрации ТТГ, св. Т4, общего Т3 и антитела к тиреопероксидазе в сыворотке крови проводили методом “твердофазного иммунноферментного анализа”. Определение ТТГ, св. Т4 и общего Т3 проводилось на анализаторе Personal LAB™, предназначенном для автоматического проведения иммуноферментного анализа фирмы “ADALTIS”. Нормальные значения ТТГ соответствовали (0,23–3,0) мкМЕ/мл, св. Т4 (10,2–23,2) пмоль/л, общего Т3 (0,82–2,8) нмоль/л.
Для уточнения влияния возраста на состояние прочности кости в группе больных были выделены две подгруппы. Критерием разделения служил показатель возраста достижения пика костной массы [9]. В первую подгруппу вошли больные от 18 до 30 лет (n=20), во вторую – лица от 31 до 45 лет (n=20).
О состоянии костного метаболизма судили по концентрации в сыворотке крови биохимического маркера костной резорбции – пиридинолина и маркеров костного формирования – остеокальцина и щелочной фосфатазы (ЩФ). Определение уровня пиридинолина и остеокальцина определяли иммуноферментным набором N-MID™ Osteocalcin One Step ELISA KIT в сыворотке на анализаторе “Personal LAB™” (нормальные величины 45– 1035 мг/моль, 11–24 нг/моль), а активность общей щелочной фосфатазы проводили с помощью набора реактивов в сыворотке крови “Новофосфал (В-8010)” на биохимическом анализаторе SAPPHIRE-400 (нормальные величины 50–250 Е/л).
Концентрацию неорганического фосфора в сыворотке крови определяли с помощью набора реагентов на биохимическом реагенте, используя спектрофотометрический метод без депротеинизации (нормальные значения 2,7–4,5 мг/100 мл (0,67–1,80 ммоль/л)). Определение содержания общего кальция в моче проводили калориметрическим методом с о-крезолфталеином на полностью автоматизированном биохимическом многопараметро-вом анализаторе открытого типа “EOS Bravo” (норма – 2,50–7,75 ммоль/сут). Определение общего кальция в крови проводилось на полностью автоматизированном биохимическом многопараметровом анализаторе открытого типа “EOS Bravo” калориметрическим методом с о-крезолфталеином (норма – 2,2–2,6 ммоль/л).
Для оценки состояния прочности костной ткани использовался метод УЗО на ультразвуковом остеометре “Achilles Express” (Lunar, США) с частотой датчиков 500 кГц на базе консультативного центра ГБОУ ВПО СибГМУ Росздрава (Томск). Измерения проводились в проекции пяточной кости.
В соответствии с рекомендациями ВОЗ диагностика нормы, остеопении и остеопороза осуществляется при помощи Т-критерия. При значениях STI выше 87,0 (Т- критерий до –1,0 SD) результат трактуется как норма. При STI ниже или равно 87,0, но выше 67,0 (т.е. при Т-крите-рии от –1,0 SD до –2,4 SD) полученный результат будет отнесен к остеопении. Значение STI ниже или равно 67,0 (Т-критерий от -2,5 SD) характеризуется как остеопороз. Статистическая обработка полученных результатов проводилась с использованием программ SPSS 11,5. Достоверность различий показателей между сравниваемыми группами устанавливали с помощью непараметрического критерия Манна–Уитни, t-критерия Стьюдента, предварительно проверив нормальность распределения показателей путем использования критерия Шапиро–Уилка. Корреляционный анализ проводили по методу Пирсона. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимали <0,05.
Результаты и обсуждение
Проведенное исследование показало увеличение встречаемости ОПС у больных с впервые выявленным манифестным гипотиреозом (р=0,01) в сравнении с частотой развития ОПС условно здоровых лиц. Остеопения встречалась в 30% случаев, в 20% – остеопороз, у 50% пациентов прочность кости сохранялась (рис. 1). У пациентов же с субклиническим гипотиреозом ОПС по данным УЗО встречался только в 30% случаев, проявившемся в снижении прочности кости до состояния остеопении (р=0,12); рисунок 1.
Подтверждением неблагоприятного воздействия недостаточной продукции тиреоидных гормонов на костную ткань периферического отдела скелета при гипоти-
Контрольная группа (n=30)
Группа с манифестным гипотиреозом (п-20)
Группа с субклшпнеским гипотиреозом (п-20)

□норма ■ остеопения □ остеопороз
Рис. 1. Прочность костной ткани у пациентов с впервые выявленным манифестным и субклиническим гипотиреозом методом УЗО
реозе может служить анализ показателей прочности кости. У пациентов с манифестным гипотиреозом показатели костной прочности соответствовали значениям нижней границы нормы: SOS – 1558,75±36,30 м/с, BUA 105,45±14,19 дБ/мГц, STI-T – 87,80±17,20%, STI-Z – 96,30±19,16%, Т-критерий – –0,95±1,34 SD, Z-критерий – –0,19±1,33 SD – и отличались от аналогичных показателей группы контроля: SOS (р=0,01), BUA (р=0,007), STI-T (р=0,006), STI-Z (р=0,02), Т-критерий (р=0,03) и Z-критерий (р=0,01), таблица.
В группе больных с субклиническим гипотиреозом показатели прочности кости были в пределах нормальных значений: SOS – 1571,50±27,16 м/с, BUA – 112,40±13,55 дБ/мГц, STI-Z – 106,05±14,74%, STI-T – 94,95±12,83%, Т-критерий – –0,34±0,97 SD, Z-критерий – 0,44±1,07 SD, и не отличались от аналогичных показателей группы контроля: SOS (р=0,15), BUA (р=0,25), STI-T (р=0,14), Т-критерий (р=0,51), STI-Z (р=0,51) и Z-критерий (р=0,95); таблица.
Проведя сравнительный анализ показателей прочности костной ткани у больных с манифестным и субклиническим гипотиреозом, выявлены статистически достоверные отличия по всем показателям (р=0,20; р=0,12, р=0,14; р=0,08; р=0,15; р=0,16).
У больных с впервые выявленным гипотиреозом показатели костной прочности не зависят от возраста: SOS (r=–0,15; р=0,36), BUA (r=0,08; р=0,60), STI-Т (r=–0,01; р=0,94), Т-критерий (r=–0,04; р=0,82), STI-Z (r=0,18; р=0,27) и Z-критерий (r=0,21; p=0,19).
Для исследования патогенетического аспекта формирования ОПС у пациентов с впервые выявленным гипотиреозом проведено аналогичное исследование содержания уровня маркеров костного ремоделирования.
Среди больных с манифестным гипотиреозом остеокластическая активность, выраженная в уровне маркера костной резорбции – пиридино-лина, была снижена (р=0,03) в 1,60 раза, а у пациентов с субклиническим гипотиреозом уровень пиридинолина в моче не изменился (р=0,11). Нами не установлена отрицательная линейная зависимость между уровнем ТТГ и резорбционной активностью (r=–0,46; р=0,07). Сопоставление результатов уровня пиридинолина у больных с субклиническим и манифестным гипотиреозом не выявило статистически значимых отличий
Таблица
Характеристика показателей прочности костной ткани у пациентов с впервые выявленным манифестным и субклиническим гипотиреозом в сравнении с группой контроля, М±SD, р-уровень
|
Показатели УЗО, м/с Б/мГц, % SD |
Группа |
||
|
Группа пациентов с манифестным гипотиреозом (n=20) |
Группа пациентов с субклиническим гипотиреозом (n=20) |
Контрольная группа (n=30) |
|
|
SOS |
1558,75±36,30, р=0,01 |
1571,50±27,16, р=0,15 |
1582,36±23,05 |
|
BUA |
105,45±14,19, р=0,007 |
112,40±13,55, р=0,25 |
116,96±12,78 |
|
STI-T |
87,80±17,20, р=0,006 |
94,95±12,83, р=0,14 |
100,80±12,83 |
|
STI-Z |
96,30±19,16, р=0,006 |
106,05±14,74, р=051 |
108,88±15,31 |
|
Т-критерий |
–0,95±1,34, р=0,006 |
–0,95±1,34, р=0,51 |
–0,21±0,92 |
|
Z-критерий |
–0,19±1,33, р=0,01 |
–0,19±1,33, р=0,95 |
0,33±0,85 |
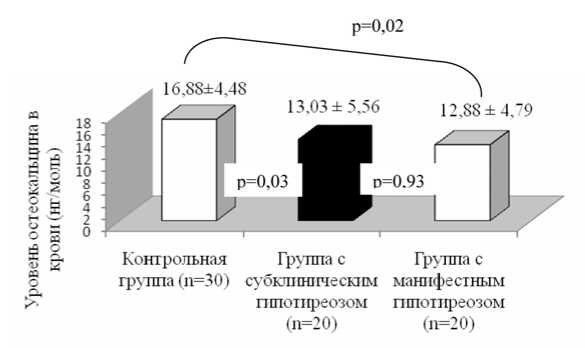
Рис. 2. Показатели остеокальцина у пациентов с манифестным и субклиническим гипотиреозом
сти у 18 пациентов манифестным гипотиреозом в возрасте 31–45 лет соответствовали значениям нижней границы нормы: SOS – 1556,94±38,46 м/с, BUA 104,47±15,12 дБ/мГц, STI-Т – 88,24±18,40%, Т-критерий – –0,91±1,39 SD, STI-Z – 97,88±20,20%, Z-критерий – –0,06±1,39 SD.
Была выявлена отрицательная линейная зависимость показателей прочности кости от уровня ТТГ у больных манифестным гипотиреозом: SOS (r=–0,64; p=0,004), Т - критерий (r=–0,62; р=0,006), STI-Т (r=–0,66; р=0,003), STI-Z (r=–0,64; р=0,004) и Z-критерий (r= –0,69; p=0,001).
У 18 пациентов с субклиническим гипотиреозом в возрасте 31–45 лет данные УЗО по Z-критерию показали сохранение прочности кости в 94,4% (n=17) и снижение костной прочности до состояния остеопении в 5,6%
(р=0,59).
С нашей точки зрения, полученные результаты исследования формирования кости позволяют сделать вывод о том, что недостаточная функция щитовидной железы снижает остеобластическую активность в 1,31 раза у больных с манифестным гипотиреозом (р=0,02), а также способствует ее снижению у больных с субклиническим гипотиреозом (р=0,03) в сравнении с группой контроля (рис. 2).
Другой маркер костного формирования – щелочная фосфатаза (ЩФ) – как у больных с манифестным (р=0,59), так и субклиническим (р=0,28) гипотиреозом по сравнению с группой контроля не изменился. Уровень значений ЩФ в этих группах не имел статистических различий (р=0,59). Недостаточная функция щитовидной железы в нашем исследовании не привела к какому-либо изменению кальциевого и фосфорного баланса. Содержание кальция и фосфора в крови у больных с манифестным (р=0,32; р=0,40) и субклиническим гипотиреозом (р=0,36; р=0,44) не изменилось в сравнении с аналогичными показателями группы контроля. Недостаточная выработка тиреоидных гормонов не вызвала колебаний в экскреции кальция с мочой у больных с манифестным (р=0,66) и субклиническим гипотиреозом (р=0,48).
Уточняя влияние возрастного фактора на костный метаболизм, мы выявили снижение прочности кости относительно пика костной прочности. Так, у больных с манифестным гипотиреозом ОПС, по данным УЗО, относительно пика костной прочности был выявлен чаще, чем относительно данного возраста и пола. Данные УЗО по Z-критерию у 17 пациентов с манифестным гипотиреозом в возрасте 31–45 лет показали снижение прочности до состояния остеопении у 29,4% (n=5) пациентов, а в 70,6% (n=12) случаев прочность кости сохранялась. Снижение прочности пяточной кости по Т-крите-рию до уровня остеопении наблюдалось у 23,5% (n=4), до состояния остеопороза – в 23,5% (n=4) случаев. Прочность кости была сохранена у 53% (n=9) больных. Частота формирования ОПС у больных с манифестным гипотиреозом не зависела от возраста (r=0,22; р=0,36). Исследование установило, что показатели костной прочно-
(n=1) случаях, по Т-критерию выявлено снижение костной прочности до уровня остеопении в 33,3% (n=6), а в 66,7% (n=12) прочность кости сохранялась.
Результаты исследования свидетельствуют, что показатели костной прочности у 18 пациентов с субклиническим гипотиреозом в возрасте 31–45 лет соответствуют значениям нормы: SOS – 1575,28±25,92 м/с, BUA 111,28±13,83 дБ/мГц, STI-Z – 106,61±15,44%, Z-критерий – 0,38±1,03 SD, STI-Т–95,22±15,44%, Т-критерий – –0,38±1,08SD и не зависят от возрастного фактора: SOS (r=0,24; p=0,35), BUA (r=0,35; p=0,16), STI-Т (r=0,12; р=0,64), Т - критерий (r=0,17; р=0,47), STI-Z (r=0,12; р=0,64) и Z-критерий (r=0,25; p=0,32).
Полученные результаты показали отсутствие остеок-ластической и остеобластической зависимости (уровня пиридинолина, остеокальцина и ЩФ), а также биохимических показателей (кальциемии, фосфоремии, кальци-урии) от возраста у пациентов с манифестным и субклиническим гипотиреозом (r=–0,05, p=0,87; r=–0,03, p=0,92; r=–0,05, p=0,83), (r=–0,05, p=0,85; r=0,03, p=0,91; r=–0,25, p=0,29) и (r=–0,07, p=0,76; r=0,37, p=0,11; r=0,31, p=0,20), (r=–0,15, p=0,53; r=0,08, p=0,73; r=–0,09, p=0,71) соответственно.
Выводы
-
1. Скрининговый метод УЗО пяточной кости у больных с впервые выявленным гипотиреозом доказал клиническую эффективность в диагностике остеопенического синдрома.
-
2. Остеопенический синдром у больных манифестным гипотиреозом формируется чаще по сравнению с условно здоровыми лицами и пациентами с субклиническим гипотиреозом.
-
3. Усугубление тяжести гипотиреоза способствует как увеличению частоты встречаемости остеопенического синдрома, так и снижению показателей УЗО пяточной кости.
-
4. У больных манифестным гипотиреозом выявлена отрицательная линейная зависимость показателей прочности кости от уровня тиреотропного гормона.
-
5. Среди пациентов с впервые выявленным манифестным гипотиреозом отмечается снижение скорости ремоделирования кости, которое проявилось в снижении уровня маркеров костной резорбции (пиридино-лина) в 1,6 раза и маркеров костного формирования (остеокальцина) в 1,31 раза в сравнении с условно здоровыми лицами.
-
6. У больных репродуктивного возраста с впервые выявленным гипотиреозом возрастной фактор не оказывает влияния на скорость ремоделирования костной ткани.
Список литературы Состояние костной ткани у больных с впервые выявленным гипотиреозом
- Аметов А.С., Доскина Е.В. Заболевания эндокринной системы и остеопороз//Рус. мед. журн. 2004. -Т. 12, № 17. -С. 1022-1028.
- Бондарь И.А., Плотникова Ю.А. Изучение частоты встречаемости и факторов риска развития остеопороза у женщин г. Новосибирска и Новосибирской области//Тезисы докл. Российского конгресса по остеопорозу с международным участием. -Екатеринбург, 2008 -С. 50-51.
- Марова Е.И., Ахкунбекова Н.К., Рожинская Л.Я. и др. Кальций фосфорный обмен и костный метаболизм у больных с первичным гипотиреозом//Остеопороз и остеопатии. -2000. -№ 3. -С. 13-16.
- Петунина Н.А., Трухина Л.В. Гипотиреоз//Рус. мед. журн. -2007. -Т. 15, № 1. -С. 1-4.
- Фадеев В.В., Мельниченко Г.А. Гипотиреоз: руководство для врачей. -М.: РКИ Соверо-пресс. -2002. -168 с.
- Флетчер Р., Флетчер С., Вагнер Э. Клиническая эпидемиология. -М.: Медиа Сфера, 2004. -352 с.
- Щеголева О.А., Меньшикова Л.В. Анализ факторов риска остеопороза у больных первичным гипотиреозом//Тезисы Российского конгресса по остеопорозу, 20-22 октября 2003. -М., 2003. -С. 67.
- Buer D., Gluer C., Cauley J. et al. Broadband ultrasound attenuation predicts fractures strongly and independently of densitometry in older women//Archiv Int. Med. -1997. -Vol. 157, No. 24. -P. 629-634.
- Cimaz R., Guez S. Diagnostic et triatment de I'osteoporose yavenile//Actives de pediatrie. -2005. -No. 12. -Р. 585-593.
- Hollowell J.G., Staehling N.W. et al. Serum TSH, T (4), and thyroid antibodies in the United States population (1988 to 1994) National Health and Nutrition Examination Survey (NHANES -II)//J. Clin. Endocrinol. Metabol. -2002. -Vol. 87. -Р. 489-499.
- Schwartz A.V., Sellmeyer D.E., Strotmeyer E.S. et. аl. Bone turnover markers in hypothyroid patients//J. Bone Miner. Res. -Vol. 20 (4). -Р. 596-603.
- Vanderpump M.P., Tunbridge W.M., French J.M. et al. The incidence of thyroid disorders in the community: a twenty year follow up of the Whickham Survey//Clin. Endocrinol. -1995. -Vol. 43, Issue 1. -P. 55-68.


