Состояние окислительного метаболизма крови крыс с термической травмой при одновременном применении нескольких источников NO
Автор: Мартусевич А.К., Соловьева А.Г., Каримова Р.Г., Плеханова А.Д.
Статья в выпуске: 3 т.223, 2015 года.
Бесплатный доступ
Целью работы явилось изучение состояния про- и антиоксидантных систем плазмы крови крыс с термической травмой при одновременном проведении курсов ингаляций оксида азота и введения его депонированной формы - ДНКЖ. Исследование проведено на 30 крысах линии Вистар, 10 из них были включены в интактную группу, остальным наносили термическую травму. Животным контрольной группы (n=10) лечение осуществляли ежедневными инфузиями физиологического раствора. Крысы основной группы (n=10) получали ДНКЖ в физиологическом растворе (1:9). На 10 сутки в крови определяли интенсивность процессов липопероксидации и общую антиоксидантную активность плазмы, а также уровень малонового диальдегида в ней. Установлено положительное действие комбинации «ингаляции NO - ДНКЖ» на восстановление баланса про- и антиоксидантных систем крови при термической травме.
Окислительный стресс, коррекция, оксид азота, динитрозильные комплексы железа
Короткий адрес: https://sciup.org/14288598
IDR: 14288598 | УДК: 533.92:537.525
Текст научной статьи Состояние окислительного метаболизма крови крыс с термической травмой при одновременном применении нескольких источников NO
Бурное развитие биологии оксида азота, сопровождающееся раскрытием его многогранной биологической роли и участия в функционировании практически всех систем организма [4-8], предполагает целесообразность изучения возможностей экзогенного влияния на уровень соединения [6, 8]. Этот тезис эмпирически подтвержден расшифровкой вазодилятирующего эффекта органических нитратов, обусловленного высвобождением монооксида азота [7]. Наши предшествующие исследования позволили продемонстрировать модифицирующее действие как экзогенного свободного (газообразного) оксида азота [2, 3], так и его физиологического депонирующего соединения – динитрозильных комплексов железа (ДНКЖ) [3] на функциональнометаболический статус организма крыс. В то же время особенности их сочетанного влияния не изучены. Поэтому целью работы явилось изучение состояния про- и антиоксидантных систем плазмы крови крыс с термической травмой при одновременном проведении курсов ингаляций оксида азота и введения его депонированной формы - ДНКЖ.
Материал и методы исследования.
Исследование проводили на 30 половозрелых крысах-самцах линии Вистар массой 220-250 г., разделенных на 3 группы равной численности: интактную (никаких манипуляций не проводили, выполняли лишь однократный забор крови), контрольную (воспроизводили термическую травму и применяли стандартное лечение) и основную (аналогична контрольной с дополнительным применением ингаляций оксида азота и внутрибрюшинного введения ДНКЖ).
Животным контрольной и основной групп комбинированную травму наносили по собственной методике, включающей контактный термический ожог кожи спины (площадь – 20% поверхности тела) в сочетании с термоингаляционной травмой. Содержание животных, экспериментальные вмешательства осуществляли согласно приказу Минздрава СССР №775 от 12.08.1977 г. Травму наносили под комбинированным наркозом («золетил» + «ксила»). Животным контрольной группы с первых суток после моделирования термической травмы проводили ежедневные внутрибрюшинные инфузии физиологического раствора (3 мл), раны обрабатывали левомеколем. Крысы основной группы ежедневно получали ингаляции NO-содержащей воздушной смеси (концентрация оксида азота – 20 ppm) и ДНКЖ в физиологическом растворе внутрибрюшинно (1 : 9 (по объему) – суммарно 3 мл; в течение 10 суток). Местное лечение аналогично проводимому в контрольной группе.
Для синтеза газообразного оксида азота использовали экспериментальный NO-генератор, созданный в Российском федеральном ядерном центре – РФЯЦ [1]. ДНКЖ синтезировали по методике А.Ф. Ванина [4, 8].
В образцах определяли интенсивность процессов липопероксидации, общую антиоксидантную активность плазмы крови методом Fe-индуцированной биохемилюминесценции на аппарате БХЛ-06. Уровень малонового диальдегида (МДА) в плазме крови оценивали по методу В.Г. Сидоркина, И.А. Чулошниковой (1993).
Данные были обработаны статистически с помощью Statistica 6.0.
Результаты исследования.
Проведенные исследования четко подтвердили формирование выраженного окислительного стресса у животных с комбинированной термической травмой даже с учетом получения ими базисного лечения (рис. 1), о чем свидетельствовало нарастание интенсивности процессов липопероксидации в плазме крови у представителей контрольной группы в 1,67 раза по сравнению с интактными крысами (p<0,05), а также падение общей антиоксидантной емкости крови в 1,9 раза (p<0,05).
Принципиально иная динамика была зарегистрирована у животных, в схему лечения которых включали комбинированное применение ингаляций оксида азота и внутрибрюшинное введение ДНКЖ (рис. 1). Так, у крыс данной группы имело место практически полное сближение интенсивности перекисного окисления липидов с физиологическим уровнем. Интересно, что у этих животных антиоксидантный потенциал даже превышал значения, зафиксированные у здоровых особей на 23% (p<0,05), что косвенно указывает на повышение их адаптационного потенциала. Следует отметить, что по обоим приведенным показателям были выявлены статистически значимые различия между основной и контрольной группами (p<0,05 для интенсивности липопероксидации и общей антиоксидантной активности).
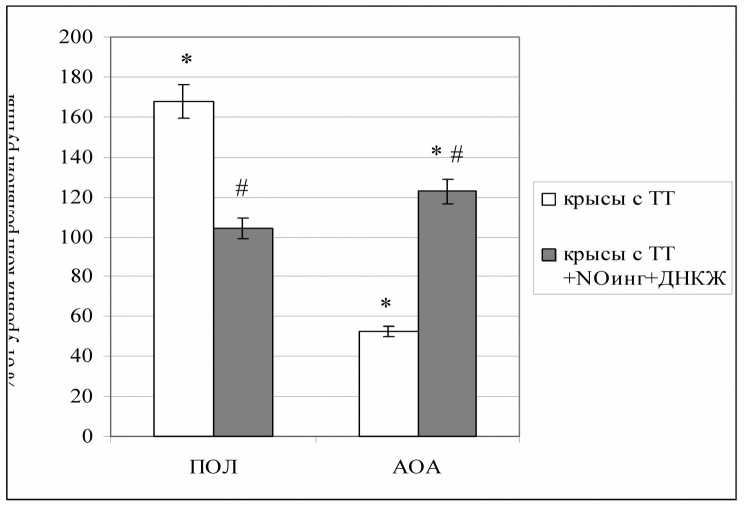
Рис. 1. Интенсивность перекисного окисления липидов (ПОЛ) и общая антиоксидантная активность (АОА) плазмы крови крыс при различных вариантах лечения термической травмы (в % от уровня, характерного для здоровых крыс, принятого за 100%; * - статистическая значимость различий с уровнем у интактных животных p<0,05; # - статистическая значимость
различий с уровнем у животных с термической травмой и стандартным лечением p<0,05)
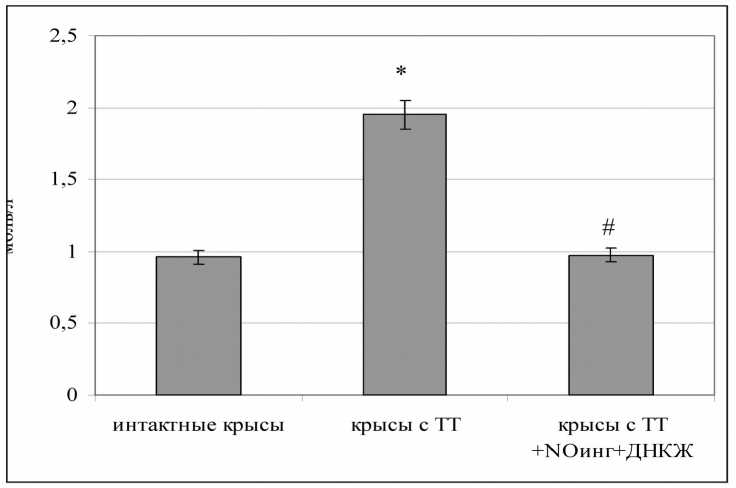
Рис. 2. Уровень малонового диальдегида плазмы крови крыс при различных вариантах лечения термической травмы (* - статистическая значимость различий с уровнем у интактных животных p<0,05; # - статистическая значимость различий с уровнем у животных с термической травмой и стандартным лечением p<0,05)
Тенденции, аналогичные выявленным с помощью биохемилюминесцентного анализа плазмы крови животных, были подтверждены при оценке динамики концентрации малонового диальдегида в биологической жидкости (рис. 2). В частности, у крыс контрольной группы отмечали выраженное нарастание уровня малонового диальдегида в плазме крови (в 2,03 раза по сравнению с интактными животными; p<0,05). В то же время при проведении курса комбинированной NO-терапии наблюдали сохранение значения параметра на физиологическом уровне. При этом он был существенно ниже, установленного в контрольной группе животных (в 2 раза; p<0,05).
В совокупности состояние окислительного метаболизма плазмы крови животных контрольной и основной групп, рассмотренное на основании биохемилюминесцентных и биохимических показателей, однозначно свидетельствует о нормализующем действии сочетанного
ЛИТЕРАТУРА: 1. Карелин В.И., Буранов С.Н., Пименов О.А. с соавт. Плазмохимическая установка для NO-терапии // Медиаль. 2013. №4. С. 46. 2. 2. Мартусевич А.К., Соловьева А.Г., Ашихмин С.П., Перетягин С.П. Влияние ингаляций оксида азота на состояние окислительного и энергетического метаболизма крови крыс // Российский физиологический журнал им. И.М. Сеченова. 2015. Т. 101, №2. С. 180-188. 3. Мартусевич А.К., Соловьева А.Г., Перетягин С.П., Ванин А.Ф. Сравнительный анализ действия свободного и депонированного NO на состояние про- и антиоксидантных систем крови // Биофизика. – 2015. – Т. 60, вып. 2. – С. 348-354. 4.
(ингаляционного и внутрибрюшинного) применения оксида азота в условиях экспериментальной термической травмы.
Заключение. Установлено положительное действие комбинации «ингаляции NO – ДНКЖ» на восстановление баланса про- и антиоксидантных систем плазмы крови крыс с экспериментальной термической травмой. Оно реализовалось в форме купирования признаков окислительного стресса (нормализации интенсивности перекисного окисления липидов, выраженной стимуляция угнетенного антиоксидантного потенциала плазмы в сочетании со снижением плазменной концентрации малонового диальдегида) при использовании комбинированного пути введения в организм экзогенного оксида азота.
Исследование поддержано грантом Президента РФ для молодых ученых-докторов наук (грант МД-7256.2015.7).
Borodilin R.R., Kubrina L.N., Shvydkiy V.O. et al. A simple protocol for the synthesis of dinitrosyl iron complexes with glutathione: EPR, optical, chromatographic and biological characterization of reaction products // Nitric Oxide Biol. Chem. 2013. V. 35. P. 110-115. 5. Gryglewsky R.J., Minuz P. (Eds.) Nitric oxide. Basic research and clinical application. Amsterdam: IOS Press, 2001. 6. Kumar P. et al. Use of inhaled nitric oxide in preterm infants // Pediatrics. 2014. V. 133. №1. P. 164-170. 7. Stamler J.S., Singel D.J., Loscalso J. Biochemistry of nitric oxide and its redox-activated forms // Science. 1992. V. 258. P. 1898-1902. 8. Vanin A.F. Dinitrosyl-iron complexes with thiolate ligands: physico-chemistry, biochemistry and physiology // Nitric Oxide Biol. Chem. 2009. V. 21. P. 136-149.
СОСТОЯНИЕ ОКИСЛИТЕЛЬНОГО МЕТАБОЛИЗМА КРОВИ КРЫС С ТЕРМИЧЕСКОЙ ТРАВМОЙ ПРИ ОДНОВРЕМЕННОМ ПРИМЕНЕНИИ НЕСКОЛЬКИХ ИСТОЧНИКОВ NO
Мартусевич А.К., Соловьева А.Г., Каримова Р.Г., Плеханова А.Д.
Резюме
Целью работы явилось изучение состояния про- и антиоксидантных систем плазмы крови крыс с термической травмой при одновременном проведении курсов ингаляций оксида азота и введения его депонированной формы - ДНКЖ. Исследование проведено на 30 крысах линии Вистар, 10 из них были включены в интактную группу, остальным наносили термическую травму. Животным контрольной группы (n=10) лечение осуществляли ежедневными инфузиями физиологического раствора. Крысы основной группы (n=10) получали ДНКЖ в физиологическом растворе (1:9). На 10 сутки в крови определяли интенсивность процессов липопероксидации и общую антиоксидантную активность плазмы, а также уровень малонового диальдегида в ней. Установлено положительное действие комбинации «ингаляции NO – ДНКЖ» на восстановление баланса про- и антиоксидантных систем крови при термической травме.
STATE OF BLOOD OXIDATIVE METABOLISM IN RATS WITH THERMAL TRAUMA UNDER CONCURRENT USE OF FEW SOURCES OF NTRIC OXIDE
Martusevich A.K., Soloveva A.G., Karimova R.G., Plekhanova A.D.
Список литературы Состояние окислительного метаболизма крови крыс с термической травмой при одновременном применении нескольких источников NO
- Карелин В.И., Буранов С.Н., Пименов О.А. с соавт. Плазмохимическая установка для NO-терапии//Медиаль. 2013. №4. С. 46. 2. 2.
- Мартусевич А.К., Соловьева А.Г., Ашихмин С.П., Перетягин С.П. Влияние ингаляций оксида азота на состояние окислительного и энергетического метаболизма крови крыс//Российский физиологический журнал им. И.М. Сеченова. 2015. Т. 101, №2. С. 180-188. 3.
- Мартусевич А.К., Соловьева А.Г., Перетягин С.П., Ванин А.Ф. Сравнительный анализ действия свободного и депонированного NO на состояние про-и антиоксидантных систем крови//Биофизика. -2015. -Т. 60, вып. 2. -С. 348-354. 4.
- Borodilin R.R., Kubrina L.N., Shvydkiy V.O. et al. A simple protocol for the synthesis of dinitrosyl iron complexes with glutathione: EPR, optical, chromatographic and biological characterization of reaction products//Nitric Oxide Biol. Chem. 2013. V. 35. P. 110-115. 5.
- Gryglewsky R.J., Minuz P. (Eds.) Nitric oxide. Basic research and clinical application. Amsterdam: IOS Press, 2001. 6.
- Kumar P. et al. Use of inhaled nitric oxide in preterm infants//Pediatrics. 2014. V. 133. №1. P. 164-170. 7.
- Stamler J.S., Singel D.J., Loscalso J. Biochemistry of nitric oxide and its redox-activated forms//Science. 1992. V. 258. P. 1898-1902. 8.
- Vanin A.F. Dinitrosyl-iron complexes with thiolate ligands: physico-chemistry, biochemistry and physiology//Nitric Oxide Biol. Chem. 2009. V. 21. P. 136-149.


