Состояние процессов свободно-радикального окисления при остром поражении печени
Автор: Кантюков С.А., Кривохижина Л.В., Фархутдинов Р.Р.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 39 (256), 2011 года.
Бесплатный доступ
В данном исследовании изучено состояние процессов свободно-радикального окисления (СРО) в крови и гомогенате печени методом регистрации железоиндуцированной хемилюминесценции и определением продуктов перекисного окисления липидов (ПОЛ) при остром экспериментальном токсическом поражении печени четыреххлористым углеродом. Показано, что в первые часы острого отравления возрастает интенсивность хемилюминесценции и накапливаются продукты ПОЛ в ткани печени и крови, обусловленное снижением общей антиокислительности, появлением свободных радикалов, увеличением количества гидроперекисей липидов. Снижение показателей хемилюминесценции в гомогенате печени к 2-3-м суткам интоксикации относительно первых часов обусловлено возрастанием скорости окисления, повреждением клеток печени, но не усилением мощности общей антиокислительной системы. Характер изменений СРО в крови и печени в динамике ее острого повреждения различен
Поражение печени, свободно-радикальное окисление, хемилюминесценция
Короткий адрес: https://sciup.org/147152884
IDR: 147152884 | УДК: 616.36-099-074:535.379
Текст научной статьи Состояние процессов свободно-радикального окисления при остром поражении печени
Классическая модель острого токсического гепатита, индуцированная тетрахлорметаном (ССl 4 ), привлекает внимание исследователей разнонаправ-ленностью действия, приводящего к нарушению многих функций печени: синтетической, дезин-токсикационной, нарушению прооксидантно-анти-оксидантного равновесия, гиперпродукции про-воспалительных цитокинов и других [3, 5]. В литературе указывается, что повреждение печени тетрахлорметаном обусловлено взаимодействием между ядом и цитохромом Р-450 с образованием активных метаболитов ССl 4 в гепатоцитах; активацией макрофагальных клеток печени с усилением образования активных форм кислорода [3, 5, 6].
С учетом того, что симптомы интоксикации у животных при воздействии четыреххлористого углерода начинают проявляться уже в первые часы после введения, а к 6–8-му ч крысы впадали в коматозное состояние, необходимо изучение ранних этапов окислительного напряжения в организме при остром поражении печени, что и послужило целью исследования.
(АЛТ) определяли с использованием стандартных наборов. Цитоморфологические исследования проводились на кафедре патологической анатомии Башкирского государственного медицинского университета. Результаты обрабатывали методами вариационной статистики с использованием пакета прикладных программ «Statistika v. 6.0 for Windows» [1, 4]. Для описания результатов использовали М-среднее значение признака, m-стандартную ошибку среднего, s-среднее квадратичное отклонение, характеристику выборки представляли в формате М ± m. Для анализа нормальности распределения данных применяли критерий Шапиро–Уилка. Проверку статистических гипотез в группах проводили с использованием параметрических (Стьюдента) и непараметрических (Манна-Уитни) критериев. Отличия считали статистически значимыми при р < 0,05.
Результаты исследования. Через 3–6 ч после отр авления цитоморфологические исследования выявили вакуолизацию, набухание гепатоцитов, полнокровие сосудов, а через 9–12 ч обнаруживались дистрофические изменения и участки некроза в центральных и промежуточных долях печени. В последующем у крыс развивались явления, характерные для липидной дистрофии печени. Острая интоксикация тетрахлорметаном вызывала значительное повышение амино-трансферазной активности в сыворотке крови. На 1-е и 2-е сутки после введения тетрахлометана активность АСТ и АЛТ повысилась в 7 и в 10 раз соответственно. Через 72 ч активность АСТ и АЛТ снижалась относительно первых суток воздействия, но оставалась выше контрольных значений. Максимальная гибель животных была на 24–36-й ч и составила 30 %.
Острое поражение печени с первого часа после введения CCL 4 сопровождается активацией свободно-радикального окисления в крови и максимальной активацией на 24-й ч – спонтанная хемилюминесценция (СП ХЛ) возрастает более чем в 5 раз.
С первого часа поражения печени в плазме крови возрастали амплитуда быстрой вспышки (А) и светосумма свечения (S). Возрастает количество первичных продуктов ПОЛ (ДК) и вторичных продуктов ПОЛ (ТБК-активных продуктов) (табл. 1). Максимальное увеличение ДК наблюдается на 24-й ч, а максимальное увеличение ТБК АП – на 48-й ч.
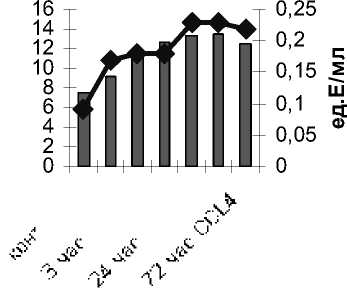
Следует отметить, что в динамике развития окислительного напряжения между интенсивностью СП ХЛ и накоплением первичных и вторичных продуктов ПОЛ отсутствует зависимость. Динамика накопления гидроперекисей липидов (А) соответствует динамике накопления первичных и вторичных продуктов. Первоначально повышаются гидроперекиси липидов (А), а через 12–24 ч возрастают первичные и вторичные продукты ПОЛ (рис. 1, 2).
Кроме того, динамика накопления в плазме крови гидроперекисей липидов соответствует динамике изменений окисляемости липидов (рис. 3).
С первого часа острого повреждения печени в ней активируется СРО – возрастает СП ХЛ, амплитуда быстрой вспышки и светосумма свечения, сокращается период индукции, на 3-й ч повреждения увеличиваются ТБК-активные продукты (табл. 2), что свидетельствует о снижение мощно- сти антиоксидантной защиты, возрастания гидроперекисей липидов, повышения окисляемости липидов.
В контрольной серии (интактная группа) имеется достоверная обратная корреляция средней силы (r = –0,73) между СП ХЛ и периодом индукции (ПИ – интегративный показатель мощности антиокислительной системы). Данная связь сохраняется в течение первого часа острого поражения печени.
Но далее с 3-го до 24-го ч повреждения связь между спонтанной ХЛ и ПИ не обнаруживается. На 24–48-й ч повреждения обратные взаимоотношения между ПИ и СП ХЛ восстанавливаются (рис. 4).
В контрольной серии установлена положительная достоверная связь (г = 0,6; р < 0,05 ) между спонтанной ХЛ и амплитудой быстрой вспышки; между спонтанной ХЛ и светосуммой свечения (г = 0,65; р < 0,05), сохраняющиеся до 1-го ч острого повреждения печени. Затем эти связи нарушаются.
Отсутствие положительных или отрицательных взаимосвязей между спонтанной ХЛ, мощностью анитиокислительной системы (ПИ), наличием гидроперекисией липидов (А), окисляемостью липидов (S) может быть связано с усилением скорости окисления липидов, провоцируемое появлением свободных металлов переменной валентности. Это находит отражение в накоплении ТБК-актив-ных продуктов, а именно, на фоне снижения амплитуды быстрой вспышки и светосуммы свечения (24–48 ч) наблюдается повышение количества ТБК-активных продуктов.
Нарушение свободно-радикального окисления в ткани печении при ее остром повреждении
Таблица 1
Изменение хемилюминесценции плазмы крови и содержания в ней продуктов перекисного окисления липидов при отравлении CCI 4
|
Условия эксперимента |
Свечение плазмы (отн. ед.) |
ДК ед. Е/мл |
ТБК-АП ед. Е/мл |
||
|
СП |
А |
S |
|||
|
Контроль (n = 30) |
0,313 ± 0,07 |
7,51 ± 0,54 |
21,4 ± 1,3 |
0,09 ± 0,007 |
0,04 ± 0,008 |
|
Отравление СCl 4 (n = 60) 1 час |
0,58 ± 0,04 *** |
9,72 ± 0,47 *** |
27,4 ± 1,2 *** |
0,17 ± 0,01 ** |
0,06 ± 0,003 |
|
3 часа |
0,78 ± 0,06 *** |
11,19 ± 0,61 *** |
28,3 ± 0,9 *** |
0,18 ± 0,008 *** |
0,122 ± 0,005 *** |
|
12 часов |
1,08 ± 0,05 *** |
12,74 ± 0,49 *** |
29,7 ± 0,6 *** |
0,18 ± 0,009 *** |
0,13 ± 0,007 *** |
|
24 часа |
1,68 ± 0,08 *** |
13,31 ± 0,45 *** |
33,5 ± 1,3 *** |
0,23 ± 0,006 *** |
0,15 ± 0,004 *** |
|
48 часов |
1,54 ± 0,07 *** |
13,48 ± 0,36 *** |
32,6 ± 1,4 *** |
0,23 ± 0,005 *** |
0,15 ± 0,007 *** |
|
72 часа |
0,98 ± 0,05 *** |
12,43 ± 0,48 *** |
31,0 ± 1,1 *** |
0,22 ± 0,008 *** |
0,13 ± 0,008 *** |
Примечания: СП – спонтанная хемилюминесценция; А – амплитуда быстрой вспышки; S – свето-сумма хемилюминесценции; ДК – диеновые конъюгаты; ТБК-АП – ТБК-активные продукты. Здесь и в табл. 2-3: * р < 0,05; **р < 0,01; ***р < 0,001 относительно контроля.
I-------1 А
ДК
Рис. 1. Динамика изменений амплитуды быстрой вспышки (гидроперекисей липидов) и диеновых конъюгатов в плазме крови
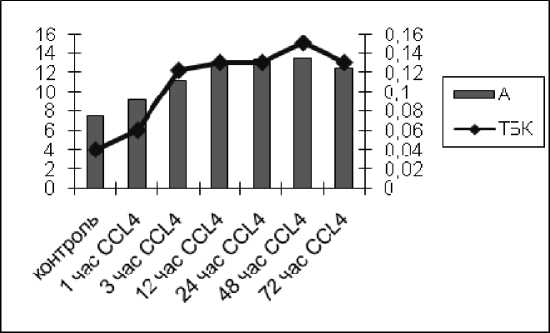
Рис. 2. Динамика изменений амплитуды быстрой вспышки (гидроперекисей липидов) иТБК-активных продуктов в плазме крови

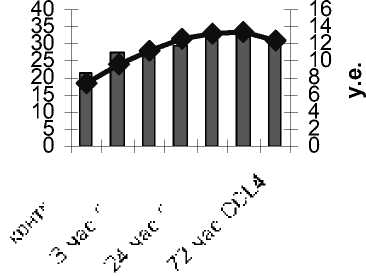
Рис. 3. Динамика изменений амплитуды быстрой вспышки и светосуммы свечения в плазме крови демонстрирует эксперимент по накоплению вторичных продуктов ПОЛ при аэробной инкубации гомогената печени (рис. 5, 6). При повреждении печени в течение 1–3-го ч образование ТБК-актив-ных продуктов при инкубации выше, чем в контроле. Более того, на 3-й ч повреждения образова- ние вторичных продуктов ПОЛ ниже относительно 1-го ч повреждения.
На 12–24-й ч повреждения образование ТБК-активных продуктов одинаково и выше относительно контроля, но на 3-й ч инкубации достоверно не отличаются от значений в контрольных об-
Таблица 2
Изменение хемилюминесценции гемогената печени и накопления ТБК активных продуктов при отравлении CCl4
|
Условия эксперимента |
Хемилюминесценция гемогената |
ТБК–АП ед.Е/мл |
|||
|
СП |
А |
ПИ |
S |
||
|
Контроль (n = 30) |
0,46 ± 0,01 |
7,05 ± 0,53 |
1,8 ± 0,2 |
102,6 ± 7,2 |
0,08 ± 0,001 |
|
Отравление CCl 4 (n = 60) 1 час |
1,62 ± 0,15 *** |
10,60 ± 0,6 *** |
0,7 ± 0,3 * |
141,4 ± 6,4 *** |
0,2 ± 0,06 |
|
3 часа |
1,22 ± 0,06 *** |
9,90 ± 0,5 *** |
0,6 ± 0,1 * |
134,9 ± 5,6 *** |
0,18 ± 0,01 *** |
|
12 часов |
1,02 ± 0,03 *** |
10,89 ± 0,3 *** |
0,7 ± 0,1 * |
140,9 ± 5,2 *** |
0,18 ± 0,01 *** |
|
24 часа |
1,11 ± 0,06 *** |
10,76 ± 0,3 *** |
0,8 ± 0,07 * |
128,0 ± 7,9 * |
0,21 ± 0,01 *** |
|
48 часов |
1,95 ± 0,08 *** |
8,1 ± 0,25 |
0,6 ± 0,1 * |
92,7 ± 10,2 |
0,21 ± 0,01 *** |
|
72 часа |
1,81 ± 0,07 *** |
8,05 ± 0,2 *** |
0,8 ± 0,1 * |
109,4 ± 5,3 |
0,17 ± 0,02 *** |
Примечания: СП – спонтанная хемилюминесценция; А – амплитуда быстрой вспышки; ПИ – период индукции; S – светосумма хемилюминесценции; ТБК-АП – ТБК-активные продукты.
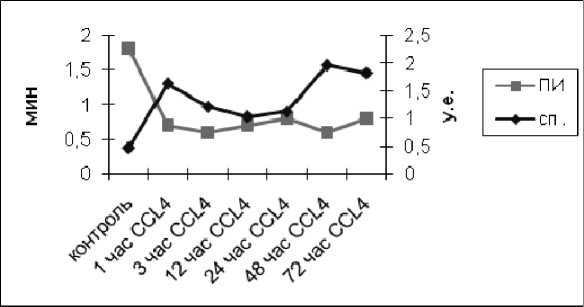
Рис. 4. Динамика изменений спонтанной ХЛ и периода индукции в гомогенате печени при остром поражении
разцах (рис. 5). На 72-й ч повреждения на 2–3-й ч инкубации снижено образование вторичных продуктов ПОЛ как относительно 48-го часа повреждения, так и относительно контроля (рис. 6). Итак, с увеличение времени острого повреждения печени в ней нарушается образование вторичных продуктов ПОЛ и именно в эти сроки наиболее низкие значения параметров (A и S), характеризующих количество гидроперекисей липидов и липидов способных подвергаться окислению.
Таким образом, снижение на 48–72-м ч острого повреждения печени относительно первого часа показателей А и S, на фоне повышения СП ХЛ, вероятно, обусловлено несколькими механизмами – увеличением интенсивности окисления, уменьшением пула легкоокисляемых липидов, и возможно, повреждением молекулярных структур гепатоцитов.
Интенсивность окисления возрастает с первого часа и наибольшая – на 48-й ч повреждения. Это подтверждается соответствующим коэффициентом, рассчитываемым по соотношению: в числителе количество ТБК-АП × 100, в знаменателе сумма количественных значений хемилюмино-граммы (СП +А + S). Кроме того, с увеличением срока повреждения снижается способность гомогената клеток печени к образованию ТБК-активных продуктов (табл. 3.)
Важный аспект, имеющий практическое значение – насколько характер изменений СРО в крови отражает характер изменений в поврежденной печени. Следует отметить, что при общей активации СРО динамика изменений параметров хемилюминесценции в печени и крови различна и изменения в крови не идентичны изменениям в печени.
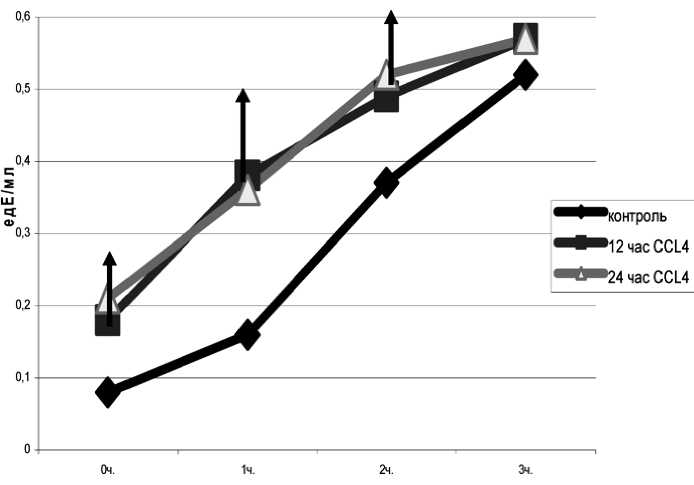
Рис. 5. Накопление ТБК-активных продуктов при аэробной инкубации гомогената печени. Стрелками указаны достоверные изменения относительно контроля
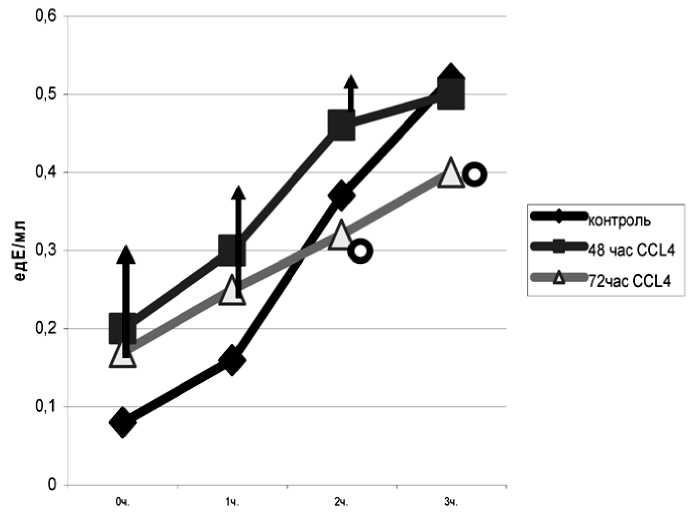
Рис. 6. Накопление ТБК-активных продуктов при аэробной инкубации гомогената печени. Стрелками указаны достоверные изменения относительно контроля, кружком – относительно 48-го часа повреждения
Таблица 3
Прирост вторичных продуктов ПОЛ на 3-й ч инкубации гомогената ткани печени
|
Прирост ТБК – АП, % |
1-й ч поврежд. |
3-й ч поврежд. |
12-й ч поврежд. |
24-й ч поврежд. |
48-й ч поврежд. |
72-й ч поврежд. |
|
430 ± 35,2 |
333 ± 10,5 |
316 ± 8,5 |
271 ± 10 |
294 ± 15,6 |
28 3 ± 21,7 *** |
|
|
Контроль 650 ± 33,5 |
||||||
Примечание. Достоверность указана относительно первого часа повреждения. Доказательство усиления скорости образования ТБК-активных продуктов является к 48-му часу повреждения.
Таким образом, острое повреждение печени приводит к активации свободно-радикального окисления. В течение первого часа острого возрастание хемилюминесценции в ткани печени и крови обусловлено снижением общей антиокислительной активности, наличием свободных радикалов, повышением гидроперекисей липидов, возрастанием пула легкоокисляемых липидов. Снижение амплитуды быстрой вспышки и светосуммы свечения в гомогенате печени к 48–72-му ч относительно первых часов повреждения обусловлено возрастанием скорости окисления, повреждением клеток печени, но не возрастанием мощности общей антиокислитель-ной способности. Характер изменений СРО в крови и печени в динамике ее острого повреждения различен.
Список литературы Состояние процессов свободно-радикального окисления при остром поражении печени
- Гланц, С. Медико-биологическая статистика/С. Гланц. -М.: Практика, 1999. -438 с.
- Кантюков, С.А. Состояние процессов свободно-радикального окисления при термической травме разной степени тяжести/С.А. Кантюков, Л.В. Кривожижина, Р.Р. Фархутдинов//Вестник ЮУрГУ. Серия «Образование, здравоохранение, физическая культура». -2010. -Вып. 24. -№ 24 (200). -С. 117-124.
- Костюк, В.А. Роль ковалентного связывания и ПОЛ в повреждении печени четырехлористым углеродом/В.А. Костюк//Биохимия. -1991. -№ 10. -C. 1878-1885.
- Реброва, О.Ю. Статистический анализ медицинских данных. Применение прикладных программ STATISTIKA/О.Ю. Реброва. -М.: Медиа Сфера, 2006. -312 с.
- Kaplowitz, M.D. Biochemical and cellular mechanisms of toxic liver injury/M.D. Kaplowitz//Semin Liver Dis. -2002. -№ 4. -P. 137-144.
- Fausto, N. Liver regeneration/N. Fausto//Hepatology. -2000. -V. 32(1). -P. 19-31.
- Kaplowitz, M.D. Biochemical and cellular mechanisms of toxic liver injury/M.D. Kaplowitz//Semin Liver Dis. -2002. -№ 4. -P. 137-144.


