Состояние прооксидантной и антиоксидантной систем у детей с атопическим дерматитом на фоне стандартного и комбинированного лечения с применением системной озонотерапии
Автор: Переделкина О.В., Ровда Ю.И., Миняйлова Н.Н., Крекова Н.П., Купрашевич Л.Н.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.28, 2013 года.
Бесплатный доступ
Изучалось состояние прооксидантной и антиоксидантной систем у детей с атопическим дерматитом (n=33). Проводилась оценка первичных и вторичных продуктов перекисного окисления липидов (ПОЛ) и нефермента тивного показателя антиоксидантной системы (антиоксидантная активность эритроцитов - АОА эритроцитов) после стандартного лечения и с применением системной озонотерапии в виде ректальных инсуффляций озонокислородной смеси. Установлено, что терапевтические низкие концентрации медицинского озона, интенсифицируя ПОЛ, параллельно вызывают адекватную компенсаторную мобилизацию эндогенных антиоксидантов из депо.
Атопический дерматит, системная озонотерапия, перекисное окисление липидов, дети
Короткий адрес: https://sciup.org/14919826
IDR: 14919826 | УДК: [616.516.5-08:615.837.5]-053.2
Текст научной статьи Состояние прооксидантной и антиоксидантной систем у детей с атопическим дерматитом на фоне стандартного и комбинированного лечения с применением системной озонотерапии
По данным ряда эпидемиологических исследований, в различных регионах Российской Федерации от 15 до 25% детского населения страдают аллергическими заболеваниями, среди которых преобладают аллергодерматозы – 50–66,4%. Атопический дерматит (АД) является одним из наиболее распространенных и тяжело протекающих дерматозов у детей [1, 2]. Актуальность проблемы определяется не только неуклонным ростом этого заболевания, но и противоречивостью в оценке различных патогенетических механизмов его развития и, как следствие, не всегда эффективными, а подчас неудовлетворительными результатами лечения [10–13].
Считается общепризнанным, что АД – это хроническое заболевание, сопровождающееся кожным зудом и частым инфицированием, возникающее в результате готовности иммунной системы к развитию аллергической реакции, способной быть запущенной как атопическими, так и неатопическими механизмами. Однако независимо от степени участия иммунных и неиммунных механизмов у больных АД отмечается расстройство обще- го и местного кровообращения [6, 9]. Наличие длительного спазма артериол и венозного застоя приводит к выраженным нарушениям капиллярно-тканевой диффузии, накоплению недоокисленных продуктов в очагах поражения, способствуя поддержанию воспаления и хроническому течению заболевания. Нарушение микроциркуляции при АД приводит к недостаточной оксигенации тканей и в ряде случаев – к накоплению ПОЛ [5, 7].
Одним из способов лечения, купирующих резкое снижение энергетики клеток, активацию эндогенных протео- и липолитических ферментов, оптимизацию проок-сидантной и антиоксидантной систем, является озоноте-рапия, которая основана на использовании природного вещества и относится к натуропатическим методам лечения [11, 13]. Озонотерапия как метод лечения зарегистрирована Федеральной службой по надзору в сфере здравоохранения новых медицинских технологий МЗ РФ. Получены регистрационные удостоверения “Применение медицинского озона в акушерстве, гинекологии, неонатологии” (№ ФС-2007/014-у от 15.02.2007 г.) и “Применение кислородно-озоновой смеси в дерматологии и кос- метологии” (Методические рекомендации №2003/84, регистрационное удостоверение ФС-2005/058, 04.10.2005-04.10.2015). В отношении биоорганических объектов установлено селективное действие озона на соединения, содержащие двойные и тройные связи (белки, аминокислоты, ненасыщенные жирные кислоты, входящие в состав липопротеиновых комплексов плазмы и липидного бислоя клеточных мембран. Реакции с этими соединениями лежат в основе биологических эффектов озонотерапии и имеют саногенетическое значение при различных заболеваниях [4, 9].
Процесс свободно-радикального окисления является неспецифическим механизмом повреждения биомембран при многих патологических состояниях, в том числе при АД. Но данные отечественных исследователей, описывающих состояние ПОЛ у взрослого контингента больных, весьма противоречивы. Так, по данным О.А. Ивановой (1998), Т.А. Главинской, О.А. Биткиной (2003), у больных с нейродермитом отсутствовала исходная интенсификация ПОЛ (средний уровень первичных продуктов ПОЛ статистически значимо не отличался от показателей контрольной группы), а по данным Е.С. Шмельковой (2001), И.В. Кошелевой (2001), у 82,9–92,5% больных АД и экземой выявлена интенсификация процессов ПОЛ [4, 8].
С одной стороны, в детской практике данные по оценке состояния ПОЛ при АД малочисленны и до конца не изучены. Так, по данным Ю.П. Часовских (2001), Т.В. Лариной, А.М. Ожегова (2003), О.Д. Куликовой, Н.Г. Романцова (2007), у детей с АД процессы ПОЛ протекают значительно интенсивнее, чем у здоровых детей [4, 5]. С другой стороны, окислительные свойства озона требуют учета баланса про- и антиоксидантных систем [9, 14].
Цель работы: изучение состояния липопероксидаци-оного статуса и антиоксидантной защиты у детей с АД, оценка их динамики при использовании стандартного и комбинированного лечения с применением системной озонотерапии.
Материал и методы
Данное исследование проводилось на основании решения этического комитета ГБОУ ВПО КемГМА Минздрава России (выписка из протокола заседания №22/к от 08.11.2006 г.) и письменного информированного согласия родителей пациентов с АД. Динамическое наблюдение за пациентами проводилось на базе детских отделений (детское нефрологическое, отделение острых респираторных инфекций) ГБУЗ “Кемеровская областная клиническая больница” и МБУЗ “Городская клиническая больница №2 – Детская поликлиника”, Кемерово. Работа выполнена в дизайне открытого рандомизированного контролируемого исследования в параллельных группах. Тип исследования – проспективное, продольное за период 2006–2009 гг. Данный этап исследования соответствует уровню В категорий доказательств для обоснования в применении клинических рекомендаций.
Критерии включения в исследование: возраст 2 мес. – 16 лет; наличие АД, верифицированного на основании международных критериев; информированное письмен- ное согласие пациента и/или его родителей об участии в исследовании. Критерии исключения из исследования: дети младше 2 мес. и старше 16 лет; наличие у ребенка признаков вторичной бактериальной, вирусной и грибковой инфекции кожных покровов; наличие у ребенка острых инфекционных и обострения хронических заболеваний; любые декомпенсированные заболевания, которые могли влиять на участие и результаты исследования; несогласие пациента и/или его родителей участвовать в исследовании.
В исследование включен 71 ребенок (34 мальчика и 37 девочек) в возрасте от 1 года до 16 лет (средний возраст – 7,3±5,4 года), из них 33 человека с АД составили основную группу; 38 человек составили контрольную группу (средний возраст – 8,4±4,2 года), в анамнезе их отсутствовали указания на аллергические проявления и наследственную отягощенность по атопическим заболеваниям.
Диагноз АД верифицирован в соответствии с диагностическими критериями, предложенными J.M. Hanifin, G. Rajka (1980), дополненными J.M. Hanifin, K.D. Cooper (1986), признанными международными Британской группой специалистов на рабочем совещании по атопическому дерматиту в Великобритании (The U.K. Working Party’s diagnostic criteria for atopic dermatitis, 1994), а также в соответствии с критериями Американской академии дерматологии на согласительной конференции по атопическому дерматиту у детей (Consensus Conference on Pediatric Atopic Dermatitis, 2003) [9, 13, 15]. Чувствительность данного набора критериев составляет 85%, а специфичность – 96%. Для объективной оценки степени тяжести клинических симптомов АД использовалась шкала SCORAD (Scoring of Atopic Dermatitis), разработанная и утвержденная Европейской международной группой экспертов по проблемам АД в Женеве (1994).
Все обследуемые с АД методом стратифицированной рандомизации были разделены на две группы. Первая группа: n=15, средний возраст – 5,0±4,5 лет, мальчики – 33,3% (5/15), девочки – 61,1% (10/15) – получали стандартное лечение, регламентированное приказами Министерства здравоохранения и социального развития Российской Федерации № 746 от 11.12.2007 г. “Об утверждении стандарта медицинской помощи больным с атопическим дерматитом” (при оказании амбулаторно-поликлинической помощи) и №432 от 30.05.2006 г. “Стандарт медицинской помощи больным атопическим дерматитом” (при оказании стационарной помощи), рекомендациями научно-практической программы Союза педиатров России “Атопический дерматит: диагностика, лечение, профилактика” (2000), Международным согласительным документом ЕААСI/AAAAI/PRACTALL (2006). Стандартное лечение предполагало включение антигистаминных препаратов 1 и/или 2-го поколения, гипосенсибилизирующих средств (препараты кальция, тиосульфат натрия), препаратов для улучшения толерантности кишечника – сорбенты, эубиотики; в наружной терапии использование противовоспалительных средств, в том числе топических кортикостероидов II–III класса по потребности, а также нестероидных препаратов, эмолентов [1, 15]. Вторая группа: n=18, средний возраст – 5,0±4,5 лет, мальчи- ки – 38,9% (7/18), девочки – 61,1% (11/18) – находились на комбинированном лечении, включающем помимо стандартного системную озонотерапию в виде ректальных инсуффляций озоно-кислородной смеси. Следует подчеркнуть, что стандартное лечение в обеих группах не отличалось по медикаментозному составу, дозировке и длительности применения используемых препаратов. Ректальные инсуффляции озоно-кислородной смеси проводили в соответствии с протоколом Madrid Declaration on ozone therapy (2010) Международной ассоциации окислительной и озоновой медицины (FIOOT), “Руководством по озонотерапии” (2008) Ассоциации Российских озонотерапевтов, методическими рекомендациями, утвержденными Минздравом РФ “Техника озонотерапии” (1996). Озоно-кислородную смесь синтезировали на аппарате для газовой озонотерапии с деструктором озона АГОД “Квазар” (конструкторское бюро измерительных приборов “Квазар”, Нижний Новгород; сертификат соответствия РОСС RU.АЯ74.В34055, регистрационное удостоверение №ФСР 2010/08320). Поток кислорода составлял 1л/мин, концентрация озона на выходе из озонатора – 15 мг/л, доза озона на инсуффляцию – 75 мкг/кг веса пациента. Рассчитанный объем озоно-кислородной смеси (мл) набирался в шприц Жане и вводился пациенту, лежащему на левом боку с согнутыми в коленях ногами, посредством одноразового стерильного ректального катетера (Apexmed, размер СН 10, сертификат соответствия РОСС NL.ИМ15.В01583, регистрационное удостоверение №ФСЗ 2008/02867). Системная озонотерапия проводилась через день в количестве 8 процедур.
Исходные средние значения индекса SCORAD (баллы) детей на стандартной терапии и с дополнительным применением системной озонотерапии составили 35,8±16,1 и 41,1±16,3 баллов соответственно по группам (р=0,78). В целом, по ведущим показателям (гендерные, возраст, степень тяжести клинических симптомов согласно индексу SCORAD), влияющим на анализируемые клинико-метаболические параметры, представленные группы были однородны и сопоставимы, что в рамках методов доказательной медицины отражает корректность проводимого исследования.
Протокол лабораторного исследования состояния процессов свободно-радикального окисления в плазме и антиоксидантной системы защиты включал оценку следующих показателей: первичные (гидроперекиси липидов – ГПЛ) и вторичные (малоновый диальдегид – МДА) продукты липопероксидации, общая оксидантная активность плазмы (ООА плазмы) и антиоксидантная активность эритроцитов (АОА эритроцитов).
Количество ГПЛ определяли модифицированным методом (Гаврилов В.Б., Мешкорудная М.И., 1983), основанным на интенсивном поглощении конъюгированных структур ГПЛ в области 232–234 нм с предварительной экстракцией непредельных жирных кислот смесью геп-тан-изопропанол (Чевари С. и соавт., 1991); результаты выражали в условных единицах поглощения (у.е.). Согласно регламенту лаборатории, выполнявшей исследования, за референсные значения ГПЛ были приняты 1,5–3,5 у.е.
Определение концентрации МДА проводили по методу Л.И. Андреевой, Л.А. Кожемякина с соавт. (1988), в котором МДА образует с тиобарбитуровой кислотой окрашенный комплекс, интенсивность которого пропорциональна концентрации МДА; результат выражается в нмоль/мл.
ООА плазмы определяли по степени накопления в модельной системе конечного продукта ПОЛ с использованием субстрата твин-80; результат выражали в процентах (%).
АОА эритроцитов определяли по степени ингибирования аскорбат- и ферроиндуцированного окисления твина-80 до МДА; результат выражали в процентах (%).
Результаты исследования оценивались по динамике средних значений индекса SCORAD, первичных и вторичных продуктов ПОЛ и неферментативного звена АОС после стандартного лечения и с применением системной озонотерапии у детей с АД через 30 дней лечения.
Cтатистическая обработка данных проводилась с использованием программ Microsoft Office Excel 2003 (лицензионное соглашение 74017-640-0000106-57177) и STATISTICA 6.1 (лицензионное соглашение BXXR006B092218FAN11). При оценке наличия взаимосвязи двух признаков, имеющих ненормальное распределение, применяли методы непараметрической статистики: для зависимых выборок – критерий Вилкоксона (Т), для независимых выборок – критерий Манна–Уитни (U), а также дисперсионный анализ Краскела–Уоллиса. Количественные данные представлены в виде медианы (Ме) и интерквартильного размаха (LQ; UQ) – 25–75-й процентили и М±Std, где M – средне-арифметическое, Std – ошибка среднего.
Результаты и обсуждение
Клиническая оценка результатов лечения (рис. 1) показала, что как в 1-й (стандартное лечение), так и во 2-й группах (комбинированное лечение с использованием системной озонотерапии) через 30 дней терапии средние значения индекса SCORAD в сравнении с исходными данными статистически значимо уменьшились на 34,4% (12,3±2,2 баллов; р=0,0000) и 56,9% (23,4±6,7 баллов; р=0,0000) соответственно. При этом положительная
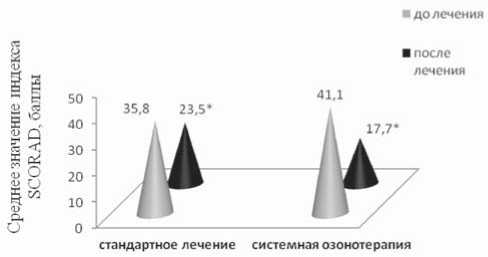
Рис. 1. Динамика средних значений индекса SCORAD детей с атопическим дерматитом на стандартной терапии (1-я группа) и системной озонотерапии (2-я группа). Статистически значимое различие р<0,05 в сравнении с исходными данными в исследуемой группе (непараметрический Т-критерий Вилкок-сона для зависимых выборок)
Таблица
Динамика средних значений показателей липопероксидационного статуса у детей с АД на стандартной (1-я группа) и системной озонотерапии (2-я группа), М±Std, Ме [Q1-Q3]
|
Показатели липопероксидационного статуса |
Группы сравнения |
Контрольная группа (n=38) |
||||
|
1-я группа (n=15) |
2-я группа (n=18) |
|||||
|
До лечения |
После лечения |
До лечения |
После лечения |
|||
|
ГПЛ, у.е. |
М±Std |
3,0±1,0 |
3,7±2,7 |
2,9±1,0 |
4,6±3,9*# |
3,2±1,0 |
|
Me [Q1-Q3] |
3,1 [2,1–3,8] |
3,2 [2,2–3,8] |
3,1 [2,1–3,8] |
2,7 [2,4–5,5] |
3,3 [2,4–4,2] |
|
|
МДА, нмоль/мл |
М±Std |
10,0±3,6 |
9,8±4,4 |
9,0±4,0 |
6,1±4,9 *# |
9,5±2,4 |
|
Me [Q1-Q3] |
8,8 [7,7–12,7] |
8,5 [7,2–13,1] |
8,5 [6,2–11,2] |
6,1 [1,3–11,3] |
8,7 [7,6–11,7] |
|
|
ООА плазмы, % |
М±Std |
3,3±0,9 |
3,3±0,9 |
3,5±1,0 |
3,6±2,3 |
3,4±0,8 |
|
Me [Q1-Q3] |
3,4 [2,6–3,6] |
3,4 [2,7–3,6] |
3,4 [2,7–3,7] |
3,6 [2,0–5,0-] |
3,5 [2,6–3,8] |
|
|
АОА эритроцитов, % |
M±Std |
6,9±1,3 |
7,7±2,6 |
7,2±1,4 |
8,7±3,1*# |
7,2±1,1 |
|
Me [Q1-Q3] |
6,9 [6,2–7,7] |
7,5 [6,6–8,5] |
7,2 [6,5–8,5] |
8,2 [6,6–11,7] |
7,2 [6,5–8,2] |
|
Примечание: * – статистическая значимость различий р<0,05 в сравнении с исходными данными (непараметрический Т-критерий Вилкоксона); # – статистическая значимость различий р<0,05 в сравнении с контрольной группой (непараметрический U-критерий Манна–Уитни); жирным – статистическая значимость различий р<0,05 в сравнении с 1-й группой (непараметрический U-критерий Манна–Уитни).
динамика индекса SCORAD на фоне системной озоноте-рапии превосходила в 1,7 раз таковую детей, получающих стандартную терапию.
Исходное значение показателей прооксидантной (ГПЛ, МДА, ООА пл) и антиоксидантной (АОА эр) систем у детей с АД (1 и 2-я группы) в сравнении с контрольной группой, согласно дисперсионному анализу Краскела– Уоллиса, не имели статистически значимых различий (р>0,05), таблица.
Анализ динамики показателей липопероксидацион-ного статуса показал, что стандартная терапия (1-я группа) не оказала статистически значимого влияния ни на один из его показателей, включенных в протокол лабораторного исследования, в то время как на фоне системной озонотерапии регистрировалась достоверная динамика показателей ПОЛ (ГПЛ, МДА, АОА эр).
Так, уровень ГПЛ, первичного продукта липоперокси-дации, во 2-й группе (с применением инсуффляций озонокислородной смеси) достоверно вырос на 37,0% (на 1,7±2,9 у.е.; df=32; p=0,04) в сравнении с исходными данными и на 30,4% (1,4±2,9 у.е.; df=51; p=0,03) – в сравнении с группой контроля. На фоне стандартного лечения уровень ГПЛ увеличился без статистической значимости на 18,9% (0,7±1,7 у.е.; р>0,05) и на 13,5% (0,5±1,7 у.е.; р>0,05) в сравнении с исходным уровнем и уровнем контрольной группы соответственно.
Средние значения МДА до начала лечения в обеих группах не имели статистически значимых различий, однако на фоне лечения с применением системной озо-нотерапии (2-я группа) данный показатель уменьшился на 32,2% (2,9±0,9 нмоль/мл; df=32; p=0,02) и был достоверно ниже такового 1-й группы на 37,8% (3,7±0,5 нмоль/мл; df=24; p=0,03) и группы контроля на 35,8% (6,1±4,9 против 9,5±2,4 нмоль/мл; df=52; p=0,000). Стандартная терапия не оказала статистически значимого влияния на динамику уровня МДА (0,2±0,5 нмоль/мл; р=0,4).
Согласно представленным в таблице результатам, средние значения ООА плазмы на фоне стандартного лечения (1-я группа) и системной озонотерапии (2-я группа) практически не изменились (р=0,5 и р=0,4 соответственно), что указывает на отсутствие достоверного влияния традиционного лечения и системной озоноте-рапии на величину ООА плазмы у детей при лечении АД.
Оценка антиоксидантной системы показала, что на фоне проводимой системной озонотерапии средний уровень АОА эритроцитов статистически значимо увеличился в сравнении с исходными данными на 20,8% (1,5±1,7; df=32; p=0,04) и показателями контрольной группы на 20,8% (1,5±2,0%; df=52; p=0,006). В результате стандартного лечения средний уровень АОА эритроцитов увеличился лишь на 11,6% (0,8±1,3%) и на 6,9% (0,5±1,5%) в сравнении с исходными показателями и данными контрольной группы соответственно (р>0,05).
Таким образом, результаты данного исследования показали, что стандартная терапия у детей с АД приводит к положительному клиническому эффекту (статистически значимое снижение индекса SCORAD), но не оказывает значимого влияния на показатели ПОЛ (согласно ГПЛ, МДА ООА плазмы) и на активацию антиоксидантной системы защиты от процессов свободно-радикального окисления (согласно АОА эритроцитов). Включение же в схему лечения системной озонотерапии не только улучшает терапевтический клинический эффект (снижение индекса SCORAD в 1,7 раз выше, чем на стандартной терапии), но и приводит к статистически значимому увеличению среднего уровня первичных (ГПЛ), снижению вторичных (МДА) молекулярных продуктов липоперок-сидации, увеличению АОА эритроцитов как показателя антиоксидантной системы. Данная динамика клинических симптомов и липопероксидационного статуса свидетельствует о том, что системная озонотерапия в указанном способе применения и дозировке не приводит к патологической активации и развитию необратимого характера каскадных реакций окислительного стресса (повышение ГПЛ, снижение МДА), а блокирует и нейтрализует последствия запущенного перекисного окисления тканевых субстратов (снижение МДА, повышение АОА эритроцитов). Полученные результаты свидетельствуют о безопасности применяемой методики и согласуются с данными ряда исследований, характеризующими роль первичных продуктов ПОЛ как активаторов антиоксидантной системы защиты по триггерному механизму.
Заключение
Оптимизация про- и антиоксидантных систем организма – один из основных биологических эффектов системного воздействия озонотерапии. Коррекция представленных выше метаболитов (ГПЛ, МДА, АОА эр) может оказывать позитивное влияние на клиническое благополучие пациентов с атопическим дерматитом. Данные настоящего исследования, впервые полученные в педиатрической практике, согласуются с многочисленными исследованиями у взрослых, показывающими роль первичных продуктов ПОЛ (ГПЛ) как активаторов по триггерному механизму антиоксидантной системы защиты. Снижение уровня МДА (вторичного и промежуточного продукта ПОЛ) свидетельствует о статистически значимом снижении процессов липопероксидации у детей, использующих системную озонотерапию, и о безопасности применяемой методики.
Список литературы Состояние прооксидантной и антиоксидантной систем у детей с атопическим дерматитом на фоне стандартного и комбинированного лечения с применением системной озонотерапии
- Атопический дерматит у детей: диагностика, лечение и профилактика: научнопрактическая программа Союза педиатров России. -М., 2000. -С. 96.
- Балаболкин И.И. Современная концепция патогенеза и принципы терапии аллергических заболеваний у детей//Педиатрия. -2003. -№ 4. -С. 52-57.
- Главинская Т.А., Биткина О.А. Криваткин С.Л. Озонотерапия дерматозов. 12 лет спустя//Приложение к Нижегородскому медицинскому журналу. Озонотерапия. -2003. -С. 151-153.
- Кошелева И.В., Иванов О.Л., Виссарионов В.А. и др. Применение кислородноозоновой смеси в дерматологии и косметологии. -Методические рекомендации №2003/84. -М., 2004. -32 c.
- Куликова О.Д., Романцов М.Г. Эффективность реамберина в терапии атопического дерматита у детей//Вестник СПбГМА им. И.И. Мечникова. -2005. -№ 3. -С. 89-91.
- Ларина Т.В., Ожегов А.М., Пенкина Н.И. Клинико-метаболические особенности атопического дерматита у детей раннего возраста //Педиатрия. -2003. -№ 6. -С. 37-42.
- Лукьянова Л.Д. Митохондриальная дисфункция при гипоксии -типовой патологический процесс//Митохондрии в патологии. -Пущино, 2001. -С. 66-68.
- Никитин О.Л., Крюков Н.Н. и др. Озонотерапия и перекисное окисление липидов: современное состояние вопроса//Материалы V Украинскорусской и IV азиатскоевропейской научнопрактической конференции "Озон в биологии и медицине". 6-8 мая 2010. -С. 23-28.
- Обухова Л.М., Ведунова М.В., Конторщикова К.Н. Влияниеозона на белки плазмы крови//Revista Ozonoterapia. -2009. -Vol. 1 (3). -Р. 47-49.
- Согласительный документ Ассоциации детских аллерголо гов и иммунологов России "Современная стратегия терапии атопического дерматита: программа действий педиатра". -М., 2006. -С. 96.
- Bieber. T. Atopic dermatitis//N. Engl. J. Med. -2008. -Vol. 358, No. 14. -P. 483-494.
- Bocci. V. Scientific and medical aspects of ozonetherapy. State of the art//Arch. Med. Res. -2006. -Vol. 37. -P. 425-435.
- Consensus Conference on Pediatric Atopic Dermatitis//J. Am. Acad. Dermatol. -2003. -Vol. 49. -P. 1088-1095.
- Re L., Mawsouf M.M., Menendez S. Leon O.S. et al. Ozone therapy: clinical and basic evidence of its therapeutic potential//Вестник физиотерапии и курортологии. -2008. -Т. 13, № 5. -С. 16-25.
- Wahn U. Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report//J. Allerg. Clin. Immun. Allerg. -2006. -Vol. 61. -P. 969-987.


