Состояние тонкокишечной микробиоты при псориатической болезни
Автор: Гумаюнова Наталья Геннадьевна, Потатуркина-Нестерова Наталия Иосифовна, Нестеров Алексей Сергеевич
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 3, 2016 года.
Бесплатный доступ
Цель. Изучение бактериального роста в тонком отделе кишечника у больных псориатической болезнью. Материалы и методы. Диагностика псориаза проводилась на основании данных объективного обследования с применением пробы на наличие у пациента симптомов псориатической триады. Оценка тяжести заболевания проведена с помощью общепринятого индекса охвата и тяжести псориаза PASI. Основываясь на значениях индекса, выделяли 3 степени тяжести псориаза: легкую, среднюю и тяжелую. Обследовано 100 больных псориазом в возрасте от 19 до 75 лет (средний возраст 41,8 года), находившихся на лечении в стационаре Ульяновского областного клинического кожно-венерологического диспансера в 2012-2014 гг. Группой сравнения являлись 20 практически здоровых людей. Для выявления наличия синдрома избыточного роста бактерий (SIBO) проводили микробиологическое исследование содержимого тонкой кишки пациентов. Результаты и обсуждение. Результаты исследования показали присутствие бактерий в аспирате тонкой кишки в количестве более 105 КОЕ/мл у 70 % (70 чел.) обследованных пациентов с псориазом, что свидетельствует о наличии у них синдрома избыточного бактериального роста. Заключение. Оценка полученных данных свидетельствует о наличии корреляции между тяжестью псориатического процесса по индексу PASI и степенью выраженности SIBO в тонкой кишке (R=0,46), стажем заболевания и значением PASI (R=0,45).
Псориаз, тонкая кишка, синдром избыточного роста бактерий, микробиота, дерматозы
Короткий адрес: https://sciup.org/14113173
IDR: 14113173 | УДК: 616.5:616.1
Текст научной статьи Состояние тонкокишечной микробиоты при псориатической болезни
Введение. Ежегодно во всем мире увеличивается количество людей, страдающих различными хроническими дерматозами, среди которых одним из наиболее часто встречающихся продолжает оставаться псориаз [1].
На современном этапе псориаз можно представить как хроническое рецидивирующее системное заболевание, развивающееся преимущественно у генетически предрасположенных лиц [2]. Псориазом страдает от 2 до 7 % всего населения земного шара, чаще в наиболее трудоспособном возрасте 20–55 лет. Среди клинических форм выделяют бляшечную, экссудативную, эритродер-мическую, артропатическую, пустулезную. Три последние часто являются причиной ин- валидизации пациентов. Недостаточная эффективность стандартной общепринятой терапии, а также значительное количество побочных эффектов от применения препаратов делает весьма актуальным поиск новых патогенетических подходов в терапии псориатической болезни.
Наиболее частыми триггерами (провоцирующими факторами) являются травмы, инфекции, эндокринные нарушения, психогенные причины, медикаменты, инсоляция, метаболические нарушения [3–5]. Общепризна-на роль орофарингеальной стрептококковой инфекции в возникновении и обострении псориаза [6]. У пациентов с псориазом отмечена высокая частота заболеваний желудочно-кишечного тракта, которые, как известно, в большом количестве случаев обусловлены различными инфекционными агентами [2, 7].
В современной науке все чаще поднимается вопрос об участии микрофлоры кишечника, которая в норме выполняет ряд значимых для макроорганизма функций, в патологии человека [8]. При определении влияния микробиоценоза кишечника на течение различных хронических патологических состояний оценивается, как правило, микробиота толстой кишки, тогда как вопрос о состоянии микрофлоры тонкого отдела кишечника остается недостаточно изученным. Так как желудочно-кишечный тракт представляет анатомически целостную систему, нарушения даже в одном ее звене неизбежно приводят к патологическим изменениям в других [9], соответственно, изменения в микрофлоре толстого отдела кишечника будут сопровождаться нарушениями флоры тонкого. В литературе активно обсуждается значение толстокишечного дисбиоза при различных заболеваниях. Однако исследованиями последних лет [10] установлено, что именно нарушения микрофлоры тонкого отдела кишечника приводят к более значимым сдвигам в соматическом состоянии пациентов [11].
При диагностике дисбиоза чаще всего используют бактериологическое исследование фекалий, что дает представление в большей степени о микрофлоре дистального отдела толстой кишки.
В дерматовенерологии доказана патогенетическая связь кишечного фактора и кожного процесса при таких дерматозах, как атопический дерматит, экземы и псориаз [5, 12, 13]. Практически у всех пациентов с перечисленными заболеваниями имеется кишечный дис-биоз. Однако на сегодняшний день не имеется достаточных сведений об особенностях клинических проявлений псориаза на фоне нарушений тонкокишечной микробиоты [14].
Цель исследования. Изучение бактериального роста в тонком отделе кишечника у больных псориатической болезнью.
Материалы и методы. Согласно современным представлениям диагностика псориаза проводится на основании данных объективного обследования с применением пробы на наличие у пациента симптомов псориа- тической триады [2, 15]. Оценка тяжести заболевания производится с помощью общепринятого индекса охвата и тяжести псориаза PASI. Основываясь на значениях индекса, выделяют 3 степени тяжести псориаза: легкую, среднюю и тяжелую.
Обследовано 100 больных псориазом в возрасте от 19 до 75 лет (средний возраст 41,8 года), находившихся на лечении в стационаре Ульяновского областного клинического кожно-венерологического диспансера в 2012–2014 гг. Группой сравнения являлись 20 практически здоровых людей.
Для выявления наличия синдрома избыточного роста бактерий (SIBO) проводили микробиологическое исследование содержимого тонкой кишки пациентов. При этом производили забор аспирата проксимальных отделов тонкой кишки эндоскопически с помощью стерильного тонкокишечного зонда с немедленным посевом на питательные среды. Критерием наличия избыточного роста являлось обнаружение количества бактерий, равного или превышающего 105/мл, или обнаружение в аспирате микроорганизмов, характерных для микроценоза толстой кишки, таких как энтеробактерии, бактероиды, клостридии и др. [17]. Учитывая характер и количество микрофлоры в просвете тонкой кишки, выделяют три степени выраженности SIBO: I – увеличение аэробной нормальной кишечной микрофлоры (>105–106 КОЕ/мл); II – увеличение аэробной нормальной кишечной микрофлоры и появление анаэробных бактерий (>106–107 КОЕ/мл); III – преобладание анаэробной флоры (обсемененность на уровне 109 КОЕ/мл и более) [4, 6]. Однако, по мнению других авторов, даже наличие 104 КОЕ/мл в исследуемом материале, полученном из тонкой кишки, свидетельствует о развитии синдрома избыточного бактериального роста [8].
Учитывая полученные данные, проводилась оценка тяжести и охвата псориаза, рассчитывался индекс PASI. У всех обследованных больных эндоскопически производили биопсию стенки дистального отдела двенадцатиперстной кишки для последующего па-томорфологического исследования. Полученные результаты подвергали корреляцион- ному анализу с помощью пакета программ Statistica.
Результаты и обсуждение. Среди всех обследованных больных доля мужчин составила 65 % (65 чел.), женщин – 35 % (35 чел.). Стаж заболевания псориазом у пациентов варьировал от 2 мес. до 43 лет (в среднем – 15 лет). Псориатическая болезнь у всех пациентов находилась в прогрессирующей фазе. Отмечались следующие клинические разновидности заболевания: псориаз вульгарный, экссудативный, артропатический. Период обострения псориатической болезни к мо- менту госпитализации продолжался от 2 нед. до 5 мес. (в среднем – 1 мес.). Оценка тяжести псориаза проводилась на основании данных объективного исследования и с помощью индекса охвата и тяжести псориаза. У всех пациентов кожный процесс был распространенным: PASI от 38,8 до 72,0 балла (среднее значение – 50,7). 60 % (60 чел.) обследованных больных предъявляли жалобы со стороны работы желудочно-кишечного тракта (боли, имеющие постпрандиаль-ный характер, явления метеоризма, эпизоды диареи).
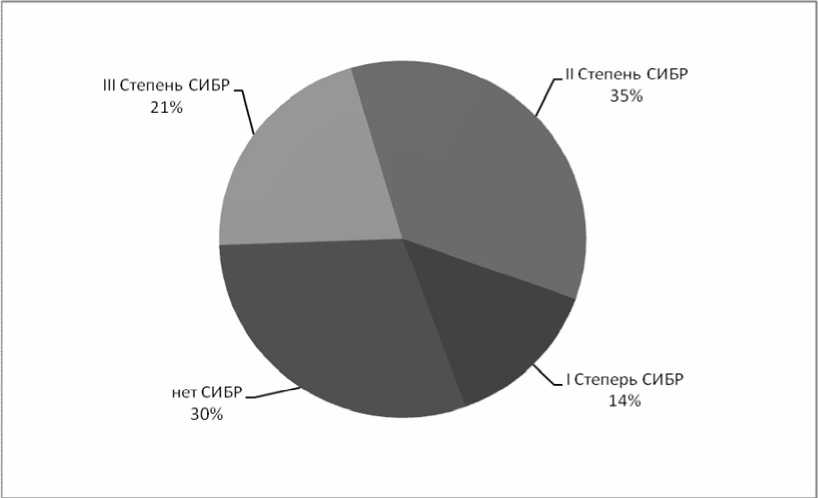
Рис. 1. Распределение выраженности синдрома избыточного бактериального роста у больных псориазом
Результаты исследования показали присутствие бактерий в аспирате тонкой кишки в количестве более 105 КОЕ/мл у 70 % (70 чел.) обследованных пациентов с псориазом, что свидетельствует о наличии у них синдрома избыточного бактериального роста. Следует отметить, что в 30 % случаев (21 чел.) избыточного бактериального роста количество бактерий составляло 109–1011 КОЕ/мл (III степень), в 50 % (35 чел.) – 107–108 КОЕ/мл (II степень), а в 20 % (14 чел.) – 106 КОЕ/мл (I степень) (рис. 1).
Нарушения тонкокишечной микробиоты проявлялись в изменении спектра и количества микроорганизмов: появлении анаэроб- ной флоры, увеличении количества аэробных и условно-патогенных бактерий, росте грибковой флоры. Данные по содержанию микроорганизмов в 1 мл тонкокишечного аспирата у больных псориатической болезнью представлены в табл. 1.
Так называемые фекальные микроорганизмы (кишечная палочка, облигатные анаэробы: клостридии и бактероиды) были выявлены во всех случаях избыточного роста бактерий, что свидетельствует о явлениях транслокации толстокишечной флоры в проксимальном направлении (рис. 2). Помимо облигатных видов, выявлены представители транзиторной флоры – клебсиеллы и протеи.
Так, Klebsiella pneumoniae были выявлены в 10 % случаев (у 8 пациентов), в 25 % случаев обнаруживались Enterococcus faecium. Proteus vulgaris были выявлены только в
5 % случаев. В контрольной группе количество микроорганизмов в аспирате тонкой кишки не превышало 103 КОЕ/мл, патогенная флора не обнаруживалась.
Таблица 1
Микрофлора тонкого отдела кишечника больных псориазом
|
Микроорганизмы |
Больные псориазом |
Здоровые |
||
|
абс. |
% |
lg КОЕ/мл |
lg КОЕ/мл |
|
|
Bifidobacterium |
98 |
98 |
5,30±0,16* |
0,95±1,23 |
|
Lactobacillus |
96 |
96 |
4,66±0,13* |
0,47±1,02 |
|
Bacteroides |
20 |
20 |
3,30±0,35* |
0,33±0,97 |
|
E. coli |
81 |
81 |
5,04±0,18* |
0,75±1,32 |
|
E. coli л/нег. |
4 |
4 |
3,62±0,56 |
- |
|
E. coli гемол. |
18 |
18 |
3,60±0,24 |
- |
|
Enterococcus |
79 |
79 |
5,28±0,20 |
- |
|
S. viridans |
36 |
36 |
5,74±0,23* |
0,07±0,45 |
|
St. aureus |
18 |
18 |
3,24±0,20 |
- |
|
St. pyogenes |
11 |
11 |
4,81±0,21 |
- |
|
S. epidermidis |
75 |
75 |
5,54±0,26* |
1,06±1,41 |
|
Candida |
45 |
45 |
4,76±0,24* |
0,56±1,06 |
|
Acinetobacter |
7 |
7 |
3,56±0,27* |
0,22±0,72 |
|
Proteus |
24 |
24 |
4,10±0,28* |
0,34±0,81 |
|
Clostridium |
24 |
24 |
5,20±0,37 |
- |
|
Klebsiella |
17 |
17 |
3,13±0,51 |
- |
|
Moraxella |
63 |
63 |
4,45±0,16* |
0,57±1,10 |
|
ОМЧ |
100 |
100 |
6,49±0,16* |
3,00±0,52 |
Примечание. * – различия с группой здоровых людей достоверны при p<0,001.
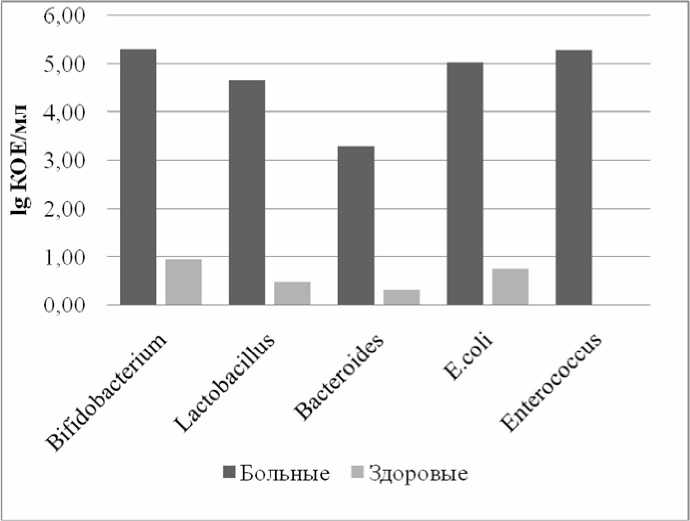
Рис. 2. Содержание типичных представителей фекальной микробиоты в тонкой кишке больных псориазом при SIBO
Морфологическое изучение биоптатов слизистой оболочки дистальных участков двенадцатиперстной кишки показало наличие признаков хронического дуоденита. В препаратах определяли следующие признаки воспаления: лимфогистиоцитарная инфильтрация слизисто-подслизистого слоя двенадцатиперстной кишки, умеренная гиперемия подслизистого слоя, атрофия верхушек и значительная извитость ворсин слизистой, наличие гранулоцитов в подслизистом слое, а также расширение протоков бруннеровых желез.
Проведенный корреляционный анализ показал прямую связь между степенью выраженности SIBO и значением PASI у больных псориазом (R=0,46). Также выявлена прямая связь между SIBO и стажем псориатической болезни (R=0,43), между стажем заболевания и значением PASI (R=0,45).
Заключение. Таким образом, у 70 % обследованных пациентов с псориатической болезнью обнаружен синдром избыточного бактериального роста. В аспирате тонкой кишки пациентов с псориазом были выявлены представители индигенной и условнопатогенной микробиоты в количестве более 105 КОЕ/мл, что свидетельствует о значительных нарушениях микроценоза тонкого отдела кишечника с вовлечением в процесс эпителия кишечной стенки. Это, как известно, сопровождается формированием синдрома мальабсорбции и развитием явлений аутоинтоксикации. Поскольку известно, что эндогенная интоксикация в комплексе с мальабсорбцией практически всегда отягощает течение псориаза, эндоскопическое обследование тонкой кишки с забором аспирата позволяет получить более полную картину тяжести течения псориатической болезни. Большая часть (60 %) обследованных больных с псориатической болезнью предъявляли жалобы на боли, имеющие постпрандиальный характер, явления метеоризма, эпизоды диареи. При этом все пациенты имели прогрессирующую форму заболевания и распространенный псориатический процесс. Обнаружена транслокация микрофлоры из толстого отдела кишечника в тонкий, сопровождающаяся увеличением степени тяжести и ухудшением течения псориаза.
В биоптатах слизистой оболочки тонкой кишки у всех пациентов с SIBO и псориазом обнаружены морфологические признаки хронического воспалительного процесса.
Оценка полученных данных свидетельствует о наличии корреляции между тяжестью псориатического процесса по индексу
PASI и степенью выраженности SIBO в тонкой кишке (R=0,46), стажем заболевания и значением PASI (R=0,45).
Полученные данные могут быть применены врачами-дерматовенерологами и терапевтами при составлении индивидуального плана ведения пациентов, страдающих псориазом. Терапия, направленная на коррекцию дисбиотических нарушений, позволит повысить эффективность общепринятых стандартных схем лечения пациентов с псориатической болезнью.
Список литературы Состояние тонкокишечной микробиоты при псориатической болезни
- Молочков В.А., Бадокин В.В., Альбанова В.И., Волнухин В.А. Псориаз и псориатический артрит. М.: Т-во научных изданий КМК; Авторская академия; 2007. 300.
- Маев И.В., Самсонов А.А. Терапевтическая тактика при синдроме избыточного бактериального роста в тонкой кишке. Консилиум-Медикум. 2007; 9 (7): 46-58.
- Нестеров А. С. Система перекисного окисления липидов эритроцитов при хронических дерматозах. Российский журнал кожных и венерических болезней. 2007; 3: 37-39.
- Рыбин А.В., Нестеров А.С., Потатуркина-Нестерова Н.И., Нестерова А.В. Этиологическая структура онихомикозов у больных псориазом. Успехи современного естествознания. 2011; 1: 107-108.
- Рыбин А.В., Потатуркина-Нестерова Н.И., Нестеров С.А., Нестерова А.В. Результаты выявления афлатоксина Bi у клинических изолятов Aspergillus flavus. Современные наукоемкие технологии. 2011; 1: 47-48.
- Ардатская М.Д., Минушкин О.Н., Прихно Н.И., Дубинин А.В. Летучие жирные кислоты и их диагностическое и прогностическое значение в гастроэнтерологической клинике. Рос. журн. гастроэнтер., гепатол. и колопроктол. 2000; X (5): 63-70.
- Парфенов А.И. Энтерология: руководство для врачей. М.: Триада-Х; 2002. 744.
- Бондаренко В.М., Мацулевич Т.В. Дисбактериоз кишечника как клинико-лабораторный синдром: современное состояние проблемы: руководство для врачей. М.: ГЭОТАР.-Медиа; 2007. 304.
- Белоусов Ю.В. Дисбактериоз кишечника или синдром избыточного роста бактерий? Здоровье Украины. 2004;105: 5-7.
- Zaidel O., Lin H.C. Uninvited Guests: The Impact of Small Intestinal Bacterial Overgrowth on Nutritional Status J. Practical Gastroenterology. 2003; July: 27-34.
- Соколовский Е.В. Пузырные дерматозы. Псориаз. Современные методы лечения. СПб.: СОТИС; 1999. 236.
- Суворова К.Н., Антоньев А.А., Довжанский С.И., Писаренко М.Ф. Атопический дерматит. Саратов: Изд-во Саратовского ун-та; 1989. 211.
- Торопова Н.П., Синявская О.А. Экзема и нейродермит у детей (современные представления о патогенезе, клинике, лечении и профилактике). Свердловск; 1993. 384.
- Гумаюнова Н.Г., Нестеров А. С., Потратуркина-Нестерова Н.И., Магомедов М.А. Новые подходы к диагностике кишечного дисбиоза у пациентов с псориатической болезнью. Вестник РУДН. Сер. Медицина. 2009; 2: 93-97.
- Пегано Дж.О.А. Лечение псориаза -естественный путь: пер. с англ. М.: КУДИЦ-ОБРАЗ; 2001. 194.
- Кубанова А.А. Дерматовенерология. Клинические рекомендации. Российское общество дерматовенерологов. М.: ДЭКС-Пресс; 2010.
- Курников Г.Ю., Клеменова И.А., Жукова Г.И., Воронова Н.Ю. Состояние микрофлоры толстой кишки у больных хроническими дерматозами. Российский журнал кожных и венерических болезней. 2002; 3: 38-39.


