Совершенствование технологии введения и культивирования изолированных тканей растений винограда в условиях in vitro
Автор: Сегет О.Л.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Цель исследований - совершенствование технологии клонального микроразмножения путем подбора эффективного стерилизующего вещества и модифицирования питательных сред, используемых для выращивания сортообразцов винограда в условиях in vitro. Объекты - техничес¬кие сорта винограда Гранатовый, Достойный и Красностоп АЗОС. Экспериментальный опыт проводился на базе селекционно-биотехнологической лаборатории СКФНЦСВВ, г. Краснодар, 2020-2022 гг. В качестве исходных эксплантов в культуре in vitro использованы мерисистемы генотипов винограда размером 0,3-0,5 мм. Методы исследований - общепринятые в практике клонального микроразмножения растений: стерилизация исходного материала, введение в культуру, собственно клональное микроразмножение, укоренение in vitro с последующей адаптацией к условиям in vivo. Наиболее эффективным способом стерилизации из рассматриваемых веществ оказалось погружение эксплантов винограда в хлорсодержащий раствор (50 %). Доля асептических жизнеспособных эксплантов составила 53 %. Установлено, что наилучшей средой для развития генотипов винограда является модифицированная питательная среда по прописи А.Н. Реброва Приживаемость микрорастений на модифицированной среде по прописи А.Н. Реброва с добавлением регуляторов роста 1,0 мг/л 6-БАП + 0,5 мг/л ИУК составила для сорта Гранатовый - 29,4 %, Достойный - 31,2 и Красностоп АЗОС - 41,5 %.
Виноград, in vitro, меристема, стерилизация, питательные среды, биопотенциал
Короткий адрес: https://sciup.org/140305303
IDR: 140305303 | УДК: 634.8.03 | DOI: 10.36718/1819-4036-2024-2-30-35
Текст научной статьи Совершенствование технологии введения и культивирования изолированных тканей растений винограда в условиях in vitro
Введение. Для увеличения срока эксплуатации виноградных насаждений необходим переход к их закладке сертифицированным посадочным материалом [1].
Микроклональное размножение является одним из современных способов репродуцирования растений в культуре тканей и клеток [2]. Полученные растения in vitro генетически идентичны исходному экземпляру. При использовании данного способа происходит освобождение тканей микропобегов от возбудителей многих заболеваний, снижающих урожайность виноградных насаждений до 30–80 % и продолжительность эксплуатации в 1,5–2 раза [3].
Процесс размножения in vitro состоит из следующих методических этапов: интернирование эксплантов и их обеззараживание, обособление апекса, индукция адвентивного побегообразования, укоренение побегов, получение пробирочных растений и их размножение, высадка растений-регенератов в почвенный субстрат.
Получение оздоровленных методом in vitro растений связано с оптимизацией условий их культивирования на каждом этапе [4, 5]. К резкому снижению скорости роста и размножения, а также к ухудшению физиологического состояния регенерантов приводят даже небольшие отклонения от оптимума [6, 7].
Одним из важных условий при работе с культурой изолированных тканей является соблюдение строгой стерильности [8]. Питательная среда – хороший субстрат для развития микроорганизмов. Изолированные от растения апексы, которые высаживаются на питательную среду, легко поражаются микроорганизмами [9]. Для этого, чтобы предотвратить заражения апексов сортообразцов растений, необходимо проводить как стерилизацию эксплантов, так и самой питательной среды, на которой будут культивироваться апексы [10–12].
Результативность клонального микроразмножения, как отмечают ряд авторов научных исследований, в значительной степени определяется правильным выбором питательных сред, так как состав среды является важнейшим фактором для эффективного морфогенеза и дальнейшего успешного развития первичных эксплантов. Детализированный состав питательных сред, отработанный для одних сортообраз-цов, в полной мере не может соответствовать для других [13–15].
Таким образом, эффективность микрокло-нального размножения зависит от многих факторов: морфогенетического потенциала размножаемого растения, стерилизующих веществ при введении в in vitro , от размера, вырезаемого меристемного апекса, состава питательной среды, влажности и температуры на различных этапах, укоренения микрорастений, адаптации винограда к условиям in vivo. Для этого важное значение приобретает изучение того или иного фактора на каждом этапе культивирования микрорастений.
Цель исследований – совершенствование некоторых элементов технологии микрокло-нального размножения винограда in vitro путем подбора эффективного стерилизующего вещества для вводимых эксплантов и оптимальноприемлемого состава питательной среды для получения безвирусных клонов с целью производства здорового посадочного материала винограда.
Объекты и методы. Объекты – технические сорта винограда Гранатовый (Vitis Vin.), Достойный (Vitis Vin.) и Красностоп АЗОС (Vitis Lab.). Опыт проводился на базе селекционно-биотехнологической лаборатории СКФНЦСВВ, г. Краснодар, 2020–2022 гг. В качестве исходных эксплантов в культуре in vitro использованы меристемы генотипов винограда размером 0,3– 0,5 мм. Для стерилизации эксплантов примене- ны: этиловый спирт (70 %), пероксид водорода (3 %), дезинфицирующие таблетки ОКА-ТАБ, содержащие 50 % активного хлора (обработка 0,5 %-м раствором в течение 5 минут с 3-кратной промывкой дистиллированной водой). Для введения сортообразцов винограда in vitro использованы среды – Murasige-Skuga (MS – контроль) (Тимофеева С.Н., Смолькина Ю.В. и др. Технологии микроразмножения in vitro: учеб.-метод. пособие. Саратов, 2016; Реброва А.Н. Патент № 2636030. Питательная среда для ввода и регенерации меристем винограда в условиях in vitro, 17.11.2017). Закладку опытов проводили в трехкратной повторности, в одной повторности 30 пробирок. Наблюдения в опытах проводились по общепринятым в биотехнологии методикам П.Я. Голодрига (1986), Н.П. Дорошенко (2012).
Результаты и их обсуждение. Наиболее действенным стерилизатором из экспериментальных веществ оказалось погружение эксплантов винограда в хлорсодержащий раствор (таблетки ОКА-ТАБ, 50 % активного хлора). Доля асептических жизнеспособных эксплантов составила 53 %. Применение этилового спирта, пероксида водорода характеризуется меньшим процентом выживаемости эксплантов растений винограда ввиду недостаточно эффективной стерилизации (рис. 1).
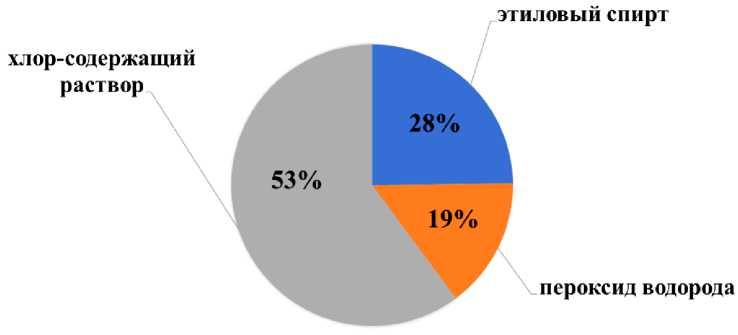
Рис. 1. Доля эксплантов, % асептических жизнеспособных эксплантов
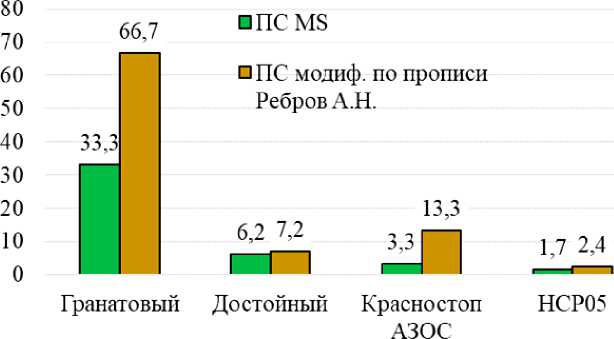
Прошедшие стерилизацию фрагменты растений высаживали в пробирки на питательные среды, приготовленные по прописи Murasige-Skuga (MS) и модифицированные по прописи А.Н. Реброва. Результаты культивирования первичных эксплантов в течение 18 дней в беспересадочной культуре показали, что повышенная регенерационная активность меристем винограда наблюдалась на экспериментальной среде по прописи А.Н. Реброва (рис. 2).
сг я н к л ч я и
^ U о S и я к я £
Сорт винограда
Рис. 2. Приживаемость меристем селекционно-ценных генотипов в культуре in vitro
Сравнение регенерационной активности изучаемых генотипов винограда показало, что приживаемость эксплантов сортов Гранатовый и Красностоп АЗОС была выше на модифицированной среде по прописи А.Н. Реброва, чем в контроле, на 33,4 и 10 %. Адаптированность меристем сорта Достойный к контрольной и модифицированной среде не показало существенного различия и составила всего 1,0 %.
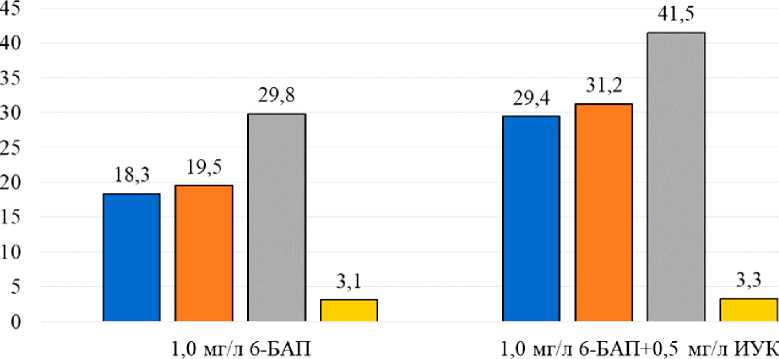
Для изучения влияния регуляторов роста на укоренение, рост и развитие растений винограда in vitro на модифицированной среде по прописи А.Н. Реброва были использованы два варианта сочетания 6-БАП и ИУК, в качестве контроля использована среда с содержанием 6-БАП-1 мг/л (рис. 3).
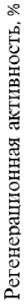
■ Гранатовый □ Достойный ОКрасностоп АЗОС DHCP05
Рис. 3. Регенерация сортов винограда на модифицированной среде по прописи А.Н. Реброва с различным содержанием регуляторов роста (через 30 дней культивирования)
На основании полученных данных учетов и наблюдений было отмечено, что лучшее развитие генотипов отмечалось на исследуемой среде, содержащей 1,0 мг/л 6-БАП + 0,5 мг/л ИУК. Приживаемость микрорастений сортов Гранатовый, Достойный, Красностоп АЗОС была выше на 11,1 и 11,7 %, чем в контроле, и составляла 29,4 %, 31,2 и 41,5 %. В контрольном варианте – среда с содержанием 6-БАП-1 мг/л, регенерация исследуемых сортов составила 18,3 %, 19,5 и 29,8 %.
В ходе наблюдений была выявлена закономерность, что развитие пробирочных растений происходит не линейно и зависит от следующих факторов: периода развития и сортовой специфики.
Заключение. На этапе введения в культуру in vitro винограда наиболее эффективный стерилизующий агент – таблетки ОКА-ТАБ (50 % активного хлора). Доля асептических жизнеспособных эксплантов составила 53 %.
Оптимизирован компонентный состав питательной среды для выращивания сортов винограда Гранатовый, Достойный и Красностоп АЗОС в культуре in vitro . Приживаемость микрорастений на модифицированной среде по прописи А.Н. Реброва с добавлением регуляторов роста 1,0 мг/л 6-БАП + 0,5 мг/л ИУК составила для сорта Гранатовый – 29,4 %, Достойный – 31,2 и Красностоп АЗОС – 41,5 %.
Список литературы Совершенствование технологии введения и культивирования изолированных тканей растений винограда в условиях in vitro
- Куликов И.М, Упадышев М.Т., Высоцкий В.А. Достижения и перспективные направления биотехнологических исследований в ФГБНУ «Всероссийский селекционно-технологический институт садоводства и питомниковод-ства» // Биотехнология в плодоводстве: мат-лы междунар. науч. конф. Самохваловичи, 2016. С. 26-28.
- Оптимизация методологии получения плодовых растений из почек в культуре тканей in vitro / В.А. Зленко [и др.] // Магарач. Виноградарство и виноделие. 2017. № 1. 3 с.
- Кухарчик Н.В. Биотехнологии в плодоводстве Беларусии // Наука и инновации. 2016. № 6 (160). С. 17-22.
- Батукаев А.А., Панаева Д.О., Собралие-ва Э.А. Совершенствование состава питательных сред при микрочеренковании винограда in vitro // Научные труды СевероКавказского федерального научного центра садоводства, виноградарства, виноделия. Краснодар, 2018. Т. 18. С. 76-80.
- Янковская М.Б. Модификация питательных сред при работе с культурой in vitro // Генетические основы селекции сельскохозяйственных культур: мат-лы междунар. науч.-практ. конф., посвящ. памяти акад. РАН, д-ра с.-х. наук, проф. Н.И. Савельева (24-26 мая 2017 г.). Воронеж: Кварта, 2017. С. 362-366.
- Браткова Л.Г., Малыхина А.Н., Цаценко Н.Н. Приемы адаптации мериклонов винограда к условиям in vivo // Плодоводство и вино-градорство юга России. 2015. № 34 (04). С. 14-29.
- The effect of foliar fertilizing on ecological optimization of the application of fungicides on the productivity and phenolic complex composition of grapes / A.A. Batukaev [et al.] // Preservation and innovation: expectations at the environmental, economic and social level book of abstracts of 42st world congress of vine and wine 17th general assembly of the oiv. 2019. P. 61-63.
- Relief of necrosis of the tips of shoots during propagation of grapes in vitro cv. Red ball / N.K. Surakshaa [et al.] // Scientia horticulturae Vol. 248. 2019. P. 118-125.
- Дорошенко Н.П., Пузырнова В.Г. Оздоровление растений от фитоплазм и микоплазм при клональном микроразмножении винограда // Русский виноград. 2018. Т. 8. С. 44-52.
- Phenolics and their antifungal role in grapevine wood decay: Focus on the Botryosphaeriaceae family / C. Lambert [et al.] // Journal of Agricultural and Food Chemistry, vol. 60, is. 48. 2012. P. 11859-11868.
- Zawadzka M., Orlikowska T. Factors modifying regeneration in vitro of adventitious shoots in five red raspberry cultivars // J. Fruit ornamental Plant Res. 2006. Vol. 14. P. 105-115.
- Control of contamination during micropropagation process of Rootstocks Mariana (Prunus mariana) / S. Amiri [et al.] // Annals of Biological Research. 2013. Vol. 4 (3). P. 149-151.
- Кастрицкая М.С., Змушко А.А., Красинская Т.А. Микроразмножение растений рода Prunus L.: инициация и размножение // Плодоводство: сб. науч тр. Самохваловичи, 2018. Т. 30. С. 258-264.
- Маркова М.Г., Сомова Е.Н. Влияние питательной среды и спектрального состава света на размножение земляники in vitro // Аграрная наука Евро-Северо-Востока. 2018. Т. 63, № 2. С. 35-41.
- Иванова-Ханина Л.В. Влияние состава субстрата на приживаемость микрорастений Vitis vinifera L. in vivo // Ekosystemy. 2018. Vol. 13 (43). С. 84-88.


