Современные представления о CAR T-клеточной терапии
Автор: Кувшинов А. Ю., Волошин С. В., Кузяева А. А., Шуваев В. А., Михалева М. А., Мартынкевич И. С., Чечеткин А. В., Бессмельцев С. С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Обзор литературы
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Адоптивная иммунотерапия является одним из признанных современныхметодов лечения онкологических заболеваний,основанном на достижениях генетики, молекулярной биологии и иммунологии, цельюкоторого является восстановление нормального функционирования противоопухолевогоответа. В основу данного вида терапии положено создание опухоль-специфичных цитотоксических лимфоцитов, экспрессирующиххимерный антигенный рецептор (chimericantigen receptor, CAR). Из экспериментальнойтехнологии лечение онкологических заболеваний CAR T-клетками превращается в быстроразвивающийся подход к терапии с более чем500 зарегистрированными клиническими исследованиями при гематологических новообразованиях и солидных опухолях. В статьепредставлено описание биотехнологии, результаты клинических исследований, обсуждениепобочных эффектов и проблем появления резистентности опухолей, а также рассмотреныперспективы дальнейшего развития и внедрения в рутинную клиническую практику CART-клеточной терапии.
Адоптивная иммунотерапия, химерный антигенный рецептор, cart-клетка, онкогематология
Короткий адрес: https://sciup.org/170172533
IDR: 170172533
Текст обзорной статьи Современные представления о CAR T-клеточной терапии
Иммунная система. Иммунный ответ осуществляется посредством двух форм иммунитета: врожденного и приобретенного (адаптивного). Врожденный иммунитет распознает чужеродные антигены, не нанося вреда клеткам и тканям организма. Распознавание чужеродных антигенов вызывает ответную реакцию воспаления и фагоцитоза с участием врожденных иммунных клеток (нейтрофилы и макрофаги). Такой ответ происходит быстро. Адаптивный иммунитет требует больше времени для формирования ответа. В тимусе в течение первого года жизни человека развиваются Т-клетки, которые отражают ненаследуемые материнские аллоантигены, поскольку они вероятно, не подвергались иммуностимуляции патогеном [1]. Воздействие различных антигенов улучшает процесс адаптивного иммунитета. Т-лимфоциты, являясь ключевым звеном адаптивного иммунного ответа, обладают следующими эффекторными функциями: 1) уничтожение инфицированных или опухолевых клеток (цитотоксические Т-лимфоциты); 2) активация (Т-хелперы) макрофагов, В-клеток, секреция цитокинов; ослабление иммунных реакций.
Иммунная система и онкология. Критическим компонентом адаптивного иммунитета является способность Т-клеток распознавать патоген-ассоциированные иммуностимуляторы по топографии эпитопа чужеродного антигена. Процесс развития опухоли и изменение ее свойств при взаимодействии с иммунной системой, в том числе с участием Т-клеток, сформировался как концепция «иммуноредактирования рака». Основные фазы взаимодействия опухоли и иммунной системы: 1) элиминация; 2)равновесие и 3)ускользание [2]. Переориентирование иммунной системы опухолью возможно вследствие ее пластичности.
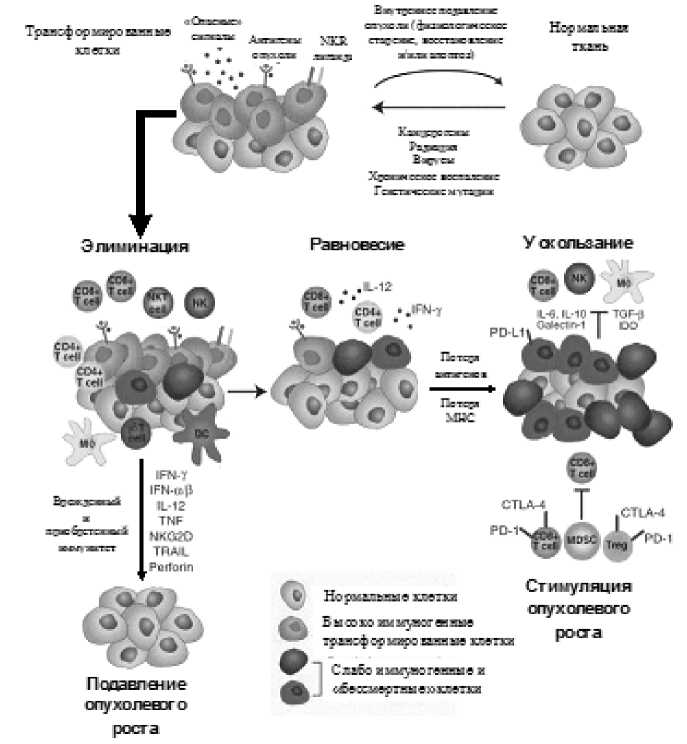
Рис. 1. Процесс взаимодействия иммунной системы и опухоли [2]
Во время фазы «элиминации» чужеродные эпитопы, продуцируемые раковыми клетками устраняются Т-клетками, что согласуется с теорией иммунного надзора, когда иммунная система активно ищет раковые клетки и устраняет их [3]. По мере роста опухоли включаются механизмы,связанные с ангиогенезом и локальным воспалением,что ведет к сильному иммунному ответу с вовлечением NKT, NK, γδ T-клеток, макрофагов и дендритных клеток продуцирующих IFN-γ [1, 3]. IFN-γ создает прямые и непрямые механизмы клеточной гибели и, как следствие, ведет к образованию клеточного детрита,который попадает в лимфатические узлы, где дендритные клетки косвенно активируют CD4 и CD8 Т-клетки. В конечном итоге, CD4 и CD8 Т-клетки мигрируют к опухолевому очагу, чтобы «убить» опухолевые клетки [4].
Фаза «равновесия» наступает тогда, когда раковые клетки погибают с той же скоростью с какой происходит их рост. Если оставшиеся после фазы «элиминации» опухолевые клетки мутируют и размножаются таким образом, что динамическое равновесие сдвигается в сторону роста опухоли, то, согласно Дарвиновской эволюции, те клетки, которые приспособились к иммунному ответу, могут размножаться бесконтрольно [3].
Таким образом, фаза «ускользания» из-под иммунного надзора происходит, когда раковые клетки становятся неузнаваемыми для иммунной системы,посредством мутаций в генах или под влиянием эпигенетических факторов. Процесс дальнейшего подавления иммунного контроля продолжается путем формирования микроокружения опухоли [3].
Мутации на клеточной мембране,которые не распознаются иммунной системой,пред-ставляют особый интерес для иммунотерапии. Необходимо понимать, что процесс распознавания лимфоцитами целого спектра антигенов которые могут быть различны по своей иммуногенности, не представляется возможным рассматривать в простой бинарной системе.
История. Концепция создания химерного антигенного рецептора принадлежит G. Gross и его коллегам, которые в 1989 г. обнаружили возможность перенаправлять Т-клеточный ответ с помощью сконструированного искусственного рецептора. Это исследование заложило основу для разработки CAR первого поколения клеток [5]. Годы последовательных и масштабных испытаний ознаменовались первым успешным клиническим применением CAR T-клеток 1-го поколения (α-GD2 CAR) о котором в 2008 г. сообщили M. Brenner et al.: у трех из 11 пациентов с нейробластомой была достигнута полная ремиссия заболевания [6 7]. С этого момента началось бурное развитие данной биотехнологии.
Химерный антигенный рецептор . Химерный антигенный рецептор состоит из внеклеточного домена — одноцепочечного вариабельного фрагмента антитела (single-chain variable fragment, scFv) и внутриклеточных сигнальных доменов,состоящих из ζ-цепи CD3 и дополнительных ко-стимулирующих молекул. Вне- и внутриклеточный домены связаны с помощью внеклеточного шарнира (spacer)и трансмембранного домена. Активация Т-клеток происходит в процессе передачи сигнала от внеклеточного домена,который распознает ассоциированный с опухолью антиген (tumor associated antigen, TAA), через трансмембранный домен на внутриклеточный [7]. Такая структура CAR заставляет Т-лимфоциты специфически реагировать на опухолевые клетки с избранными антигенами.
В настоящее время существует 4 поколения CAR, отличающихся между собой по строению внутриклеточного домена. Внутриклеточный домен химерных рецепторов 1-го поколения состоит только из ζ-цепи CD3, в то время как у химерных рецепторов 2-го и 3-го поколений он состоит из одной или двух костимулирующих молекул, таких как CD27, CD28, CD134 (OX-40) CD137 (4–1BB) [7]. Костимулирующие молекулы усиливают литическую и пролиферативную активность CAR T-клеток. Но, наличие второго костимулирующего домена в химерных рецепторах 3-го поколения увеличивает активность CAR T-клеток, что приводит к усилению выброса цитокинов [1]. Это ограничило применение рецепторов 3-го поколения,в то время как химерные рецепторы 2-го поколения находятся на различных этапах клинических испытаний. Последнее, 4-е поколение — Т-клетки перенаправленные для универсального цитокин-опос-редованного уничтожения (T cells redirected for universal cytokine-mediated killing, TRUCKs) которые активируют врожденную иммунную систему посредством депонирования интерлейкина-12 (ИЛ-12) в опухолевом очаге [8].
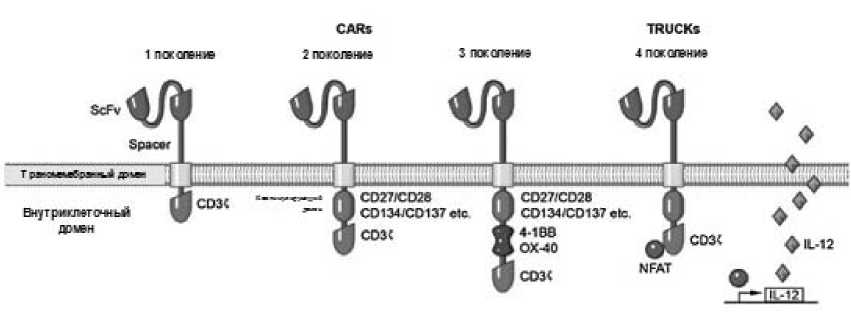
Рис. 2. Поколения химерных антигенных [1]
Приоритетом разработки внеклеточного домена является поиск подходящих мишеней которыми обычно являются поверхностные антигены, эпитоп которых уникален для раковых клеток.
Таблица 1
Мишени в CAR T-клеточной терапии (адаптировано из [1, 7])
|
Опухоль |
Антигены, на которые нацелены CAR |
|
Онкогематологические заболевания |
CD19 |
|
CD20 |
|
|
CD22 |
|
|
CD30 |
|
|
CD33 |
|
|
CD38 |
|
|
CD138 |
|
|
ROR1 |
|
|
Lewis(Le)-T (Ley) |
|
|
α-цепь рецептора интерлейкина-3 (ИЛ-3) |
|
|
Igκ легкие цепи |
|
|
Антиген созревания В-клеток (B cell matura^on an^gen, BCMA) [9, 10]. |
|
|
Лиганд NKG2D [11]. |
|
|
Немелкоклеточный рак легких |
Рецептор эпидермального фактора роста (Epidermal growth factor receptor, EGFR) |
|
Меланома |
HLA-A1/MAGE-A1 |
|
Ганглиозид GD2 |
|
|
Нейробластома |
L1-клеточная молекула адгезии (CD171) |
|
Глиома |
EGFRvIII |
|
Рак предстательной железы |
Человеческий простат-специфический мембранный антиген (Human prostate-specific membrane antigen, hPSMA) |
|
Мезотелиома |
Мезотелин |
|
Белок активации фибробластов (Fibroblast ac^va^on protein, FAP) |
|
|
Остеосаркома |
Человеческий рецептор эпидермального фактора роста (Human epidermal growth factor receptor, HER2) |
|
α-цепь рецептора интерлейкина-11 (ИЛ-11) |
|
|
Рак шейки матки |
CD44v7 и CD44v8 |
|
Желудочно-кишечные стромальные опухоли |
KIT |
|
Рак яичников |
Фолатный рецептор-α (Folate receptor-α, FRα) |
|
Лиганд NKG2D |
|
|
Опухоли брюшины |
MUC16 |
Продолжение таблицы
|
Опухоль |
Антигены, на которые нацелены CAR |
|
Глиобластома |
α2-цепь рецептора интерлейкина-13 (ИЛ-13) |
|
HER2 и α2-цепь рецептора ИЛ-13 |
|
|
Метастатический почечно-клеточный рак |
Карбокси-ангидраза-IX (carboxy-anhydrase-IX, CAIX) |
|
Аденокарцинома поджелудочной железы |
Her2/neu и CD24 |
|
Рак молочной железы |
ErbB2 и MUC1 |
|
Метастазирование в печень |
Раковый-эмбриональный антиген (Carcinoembryonic antigen, CEA) |
|
Универсальное воздействие |
Биотин |
|
Изотиоцианат флюоресцин (fluorescein isothiocyanate, FITC) |
|
|
Воздействие на опухолевую сосудистую сеть |
VEGFR-2 |
Ведутся разработки тандемных CAR, внеклеточный домен которых состоит из двух разных scFv. Например, биспецифический тандем CAR — HER2 и α2-цепь рецептора ИЛ-13 демонстрирует дополнительную активацию Т-клеток при встрече с обоими антигенами [12]. A. Bister et al. сообщают о потенциально эффективной комбинации CD5 и CD19 тандемного CAR у пациентов с мантийноклеточной лимфомой. Данная комбинация позволяет уменьшить воздействие на здоровые клетки несущие на себе лишь один из этих рецепторов (« on-target off-tumor » токсичность) [13].
С целью упрощения конструкции разработана концепция универсальных CAR, которые с помощью искусственных молекул-адапто- ров (например, изотиоцианат флюоресцин (fluorescein isothiocyanate, FITC)) распознают альтернативные ТАА, что позволяет «настраивать» активность CAR T-клеток и делает их применение более безопасным [7].
Одна из многообещающих и наиболее распространенных [14] мишеней (57 %) — рецептор CD19, который экспрессируется на большинстве как нормальных, так и опухолевых В-лимфоцитов.
Технологии производства. Существует два возможных способа получения CAR T-клеток: in vivo (in situ) (в кровь пациента вводятся наночастицы, превращающие Т-клетки пациента в CAR T-клетки) и ex vivo (производство состоит из нескольких этапов).
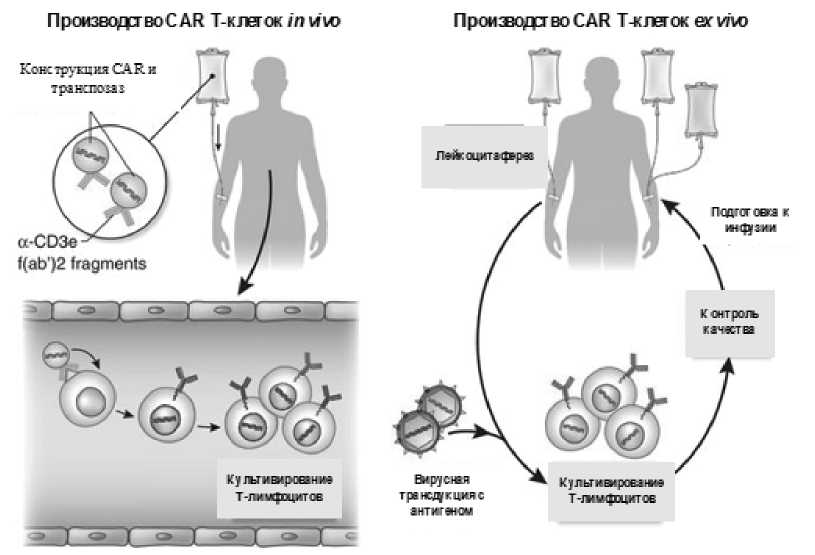
Рис. 3. Способы получения CAR T-клеток [15]
Этапы производства CAR T-клеток ex vivo [16]:
-
1) лейкоцитаферез;
-
2) вирусная /невирусная трансдукция с антигеном;
-
3) культивирование до идеальной дозы от 1 до 5 х 10 8 клеток;
-
4) контроль продукта (качество, стерильность);
-
5) подготовка к инфузии.
Клинические исследования . Из экспериментальной технологии лечение онкологических заболеваний CAR T-клетками превращается в быстро развивающийся подход к терапии с более чем 500 зарегистрированными клиническими исследованиями при гематологических новообразованиях и солидных опухолях. При этом большинство из них проводится в США и Китае [17].
Клинические исследования CD19 CAR T-клеток показали эффективность при онкоге-матологических заболеваниях, включая острый лимфобластный лейкоз (ОЛЛ), хронический лимфолейкоз (ХЛЛ) и неходжкинские лимфомы (НХЛ) [18].
Продемонстрирована активность BCMA-CAR T-клеток у пациентов с множественной миеломой (ММ) [19, 20], начаты испытания у пациентов с лимфомой Ходжкина (ЛХ) [21 22]. Продолжаются исследования в области применения CAR T-клеточной терапии при некоторых солидных опухолях (глиобластома, нейробластома, HER2-позитивная саркома) [23–25].
По данным систематизированного обзора и мета-анализа исследований в области CAR T-клеток за период 2008–2017 гг. [26] было опубликовано 60 исследований: 18 исследований (30 %) в области онкологии и 42 исследования в области гематологии (32 % — ОЛЛ 18 % — НХЛ, 3 % — ОМЛ, 2 % — ХЛЛ, 2 % — ЛХ 13 % — пациенты с двумя или более онкогема-тологическими диагнозами). В большинстве (57 %) — это исследования I фазы.
Аутологичные CAR T-клетки. В 2017 году Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) одобрило первые два препарата для CAR T-клеточной терапии: Kimriahтм (tisagenlecleucel CTL019, Novartis) [27] для лечения пациентов до 25 лет с рецидивирующими или рефрактерными (Р/Р) формами пре-В-клеточного острого лимфобластного лейкоза (пре-В-ОЛЛ) [28] и для лечения взрослых пациентов с Р/Р формами диффузной крупноклеточной В-клеточной лимфомы (ДКВКЛ) [29] и Yescartaтм (axicabtagene ciloleucel, Kite Pharma/Gilead) [30], для лечения взрослых пациентов с Р/Р формами ДКВКЛ [31]. Оба препарата являются CD19-CAR2-го поколения, с отличием в использованном векторе на этапе производства: лентивирусный вектор — Kimriahтм, ретровирусный — Yescartaтм. Другие CAR T-клетки являются исследовательскими продуктами в рамках международных или локальных клинических испытаний.
По данным многоцентрового исследования Yescartaтм II фазы у взрослых пациентов с рефрактерной формой ДКВКЛ (Zuma 1) частота общего ответа (ЧОО) составила 82 %, полной ремиссии (ПР) — 54 %. За период наблюдения (медиана — 15,4 месяца) у 40 % пациентов ПР сохраняется [32].
В исследовании Kimriahтм II фазы у пациентов с В-ОЛЛ ЧОО составила 81 %, ПР с отсутствием минимальной остаточной болезни (МОБ-негативная) — 60 %, МОБ-негативная ПР с не полностью восстановившимся кроветворением — 21 %. Бессобытийная выживаемость (БСВ) и общая выживаемость (ОВ) на период наблюдения 6 месяцев составили 73 % и 90 % соответственно, а на период 12 месяцев: БСВ — 50 %, а ОВ — 76 % [28].
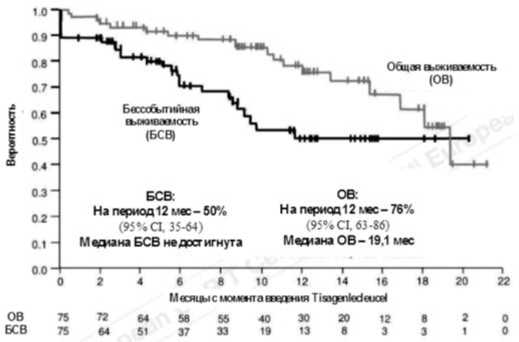
Рис. 4. Бессобытийная и общая выживаемости у пациентов с В-ОЛЛ при проведении терапии Kimriah тм [28]
Побочные эффекты терапии. Лечение онкологических заболеваний без возникновения токсичности и нежелательных явлений — редкость. Аутологичная CAR T-клеточная терапия не исключение,она имеет серьезные побочные эффекты и различный профиль токсичности.
Наиболее распространенными побочными эффектами являются синдром выброса цитокинов («цитокиновый шторм»);
нейротоксичность;
синдром лизиса опухоли;
аллергические реакции;
В-клеточная аплазия.
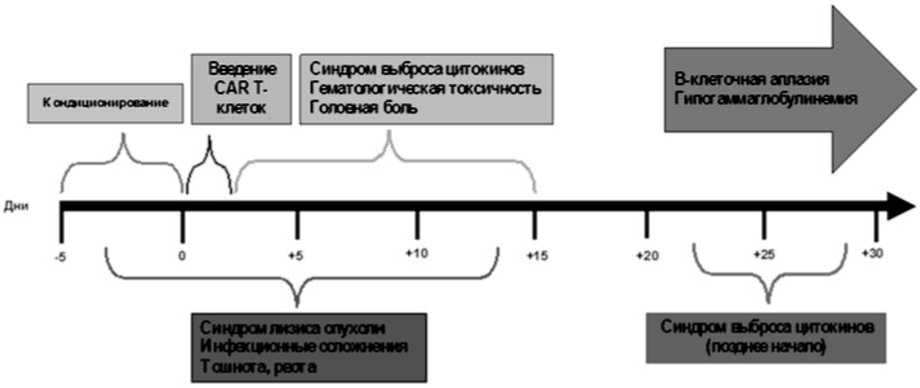
Рис. 5. Сроки возникновения токсичности [32, 33]
Таблица 2
Частота синдрома выброса цитокинов и нейротоксичности (адаптировано из [34])
|
Исследование |
Продукт |
Заболевание |
Синдром выброса цитокинов, степень 3/4 |
Нейро-токсичность, степень 3/4 |
|
ZUMA-1 |
Yescartaтм |
ДВККЛ и ПМВКЛ |
13 % |
28 % |
|
Transcend |
Tisangenlecleucel |
ДВККЛ |
1 % |
15 % |
|
Juliet |
Kimriahтм |
ДВККЛ |
22 % |
12 % |
|
CRB-401 |
BB2121 |
ММ |
2 % |
<1 % |
Синдром выброса цитокинов (СВЦ) — это жизнеугрожающее состояние, основными проявлениями которого являются гипотензия гипоксия, лихорадка и неврологические нарушения. Данное осложнение развивается в период от 1 до 10 дней (медиана — 3 дня) [34]. Факторами риска являются высокая опухолевая нагрузка, наличие активной инфекции на момент начала CAR T-клеточной терапии. Нейротоксичность развивается в течение 8 недель после введения препарата: медиана — 7 дней для пре-В-ОЛЛ и 12 дней для ДКВКЛ [34].
Основные проявления — изменение уровня сознания, галлюцинации, делирий, афазия атаксия, судороги, тремор. В-клеточная аплазия обусловлена деплецией пула нормальных В-лимфоцитов.
Проблемы CAR T-клеточной терапии и пути их преодоления. Возникновение рецидивов заболевания связано со снижением количества CD19 CAR T-клеток в крови пациента, либо обусловлено потерей экспрессии CD19 на поверхности опухолевых клеток.
Потеря эффективности
Потеря CD19 с поверхности клеток ОЛЛ

Потеря CAR-T клеток из крови

CD 19 рецидив
CD19+ рецидив
-
• CAR Т-клеткам требуется более высокая плотность таргетного антигена, чем естественным Т-клеткам.
Потеря активных CAR Т-клеток связана с их истощением
-
* Опухолевые клетки имеют низкую плотность CD 19
-
• Данный механизм резистентности «включается» у пациентов с высокой опухолевой нагрузкой
Е. \Л»л«, 1« European САЯ-I tai m<*1ift£ Рйга 5019
Рис. 6. Причины потери эффективности CAR T-клеточной терапии (адаптировано из [35])

Как улучшить CAR Т терапию?
Потеря CD19 с поверхности клеток ОЛЛ
Потеря CAR-T клеток из крови


CD19 рецидив

-
• -Двойное таргетирование»: CD19 и CD22
-
• Четвертое поколение CAR Т клеток
-
• Повышение эффективности CAR T клеток с помощью ингибиторов сигнального пути
• Повторная использование таргетирования* • Использование терапии, для истощения
CD19' рецидив

«двойного
комбинированной предотвращения
• Создание гуманизированного scFv против таргетных антигенов.
Е Wck-rg. Iм Етгермп С*ЯТ Рис. 7. Пути повышения эффективности CAR T-терапии (адаптировано из [35]) Заключение. Адоптивная иммунотерапия с использованием генно-модифицированных Т-лимфоцитов, безусловно, стала прорывным направлением в медицине и квинтэссенцией современной парадигмы онкологии и не только ведет к персонализированной медицине,но и дает надежду на значительное улучшение результатов лечения. Данные биотехнологии требуют высоких материальных (автоматизация технологического процесса), интеллектуальных и организационных ресурсов что предполагает их возможную реализацию (во всяком случае, на первоначальном этапе освоения) лишь в крупных научных центрах. Необходимо повышение как эффективности так и безопасности применения CAR T-клеток. В то же время, предстоит решить один из немаловажных вопросов: управляемость CAR T-клетками во временных, пространственных и функциональных измерениях. Нельзя отрицать, что адоптивная Т-клеточная иммунотерапия обладает потенциально высокой эффективностью. К сожалению, несмотря на то что появление CAR T-клеточной терапии открывает новые возможности лечения пациентов с онкологическими заболеваниями, частота достижения ответа ограничена,а появление рецидивов не редко. В терапии солидных опухолей успехи менее впечатляющие, чем в он-когематологии,что связано с особенностями биологии солидных опухолей и нерешенными вопросами стимулирования инфильтрации и персистирования CAR T-клеток в опухолевом микроокружении. Тем не менее, адоптивная иммунотерапия находится в начале своего пути и, возможно, пришло время для более тщательной оценки способов влияния на иммунную систему, которые позволят повысить эффек- тивность и минимизировать неблагоприятные явления связанные с CAR T-клеточной терапией в будущем. Вероятно, дальнейшие клинические исследования терапии CAR T-клетками будут направлены не столько на преодоление рефрактерности опухоли к стандартным программам лечения,сколько на решение проблемы эрадикации остаточного опухолевого клона на ранних этапах терапии, что откроет перспективы к излечению онкологических заболеваний в условиях реальной клинической практики.
Список литературы Современные представления о CAR T-клеточной терапии
- Smith AJ, Oertle J, Warren D, Prato D. Chimeric antigen receptor (CAR) T cell therapy for malignant cancers: Summary and perspective. Journal of cellular Immunotherapy. 2016;2:59-68.
- Schreiber RD, Old LJ, Smyth MJ. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion. Science. 2011;331:1565-70.
- Dunn GP, Bruce AT, Ikeda H, Old LJ, Schreiber RD. Cancer immunoediting: from immunosurveillance to tumor escape. Nat Immunol. 2002; 3:991-8.
- ShankaranV, Ikeda H, Bruce AT, White JM, Swanson PE, Old LJ, et al. IFN-gamma and lymphocytes prevent primary tumour development and shape tumour immunogenicity. Nature. 2011;410:1107-11.
- Gross G, Waks T, Eshhar Z. Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc Natl Acad Sci Unit States Am. 1989;86(24):10024-8.
- Pule MA, Savoldo B, Myers GD, Rossig C, Russell HV, Dotti G, et al. Virus-specific T cells engineered to coexpress tumor-specific receptors: persistence and antitumor activity in individuals with neuroblastoma. Nat Med. 2008;14(11):1264.
- Wen Si, Cheng Li, Ping Wei. Synthetic immunology: T-cell engeneering and adoptive immunotherapy. Synthetic and Systems Biotechnology.2018;3: 179-85.
- Chmielewski M, Abken H. Trucks: the fourth generation of CARs. Expert Opin Biol Ther. 2015;15: 1145-54.
- Antonana-Vidosola A, Perez-Amill L, Sune G, Castella M, Najjar A, Lozano E, Urbano-Ispizua A, Martin-Antonio B. BCMA CAR T-cell immunotherapy beyond myeloma: a novel target to fight B-cell non-Hodgkin lymphoma. 1st European CAR T-cell meeting, 14-16 February 2019, Paris. PI17/01043.
- Perez-Amill L, Sune G, Antonana-Vidosola A, Najjar A, Castella M, Lozano E, Urbano-Ispizua A, Martin-Antonio B. Pre-clinical evaluation of murine versus humanized BCMA-chimeric antigen receptor modified T cells (ARI2) for Multiple Myeloma treatment. 1st European CAR T-cell meeting, 14-16 February 2019, Paris. PI17/01043, PI14/00798.
- Leivas A, Valeri A, Rio P, Garcia-Ortiz A, Pacello ML, Perez-Martinez A, Lee D, Martinez-Lopez J. NKG2D-CAR transduced primary natural killer cells efficiently target multiple myeloma cells. 1st European CAR T-cell meeting, 14-16 February 2019, Paris.
- Hegde M, Mukherjee M, Grada Z, Pignata A, Landi D, Navai SA, et al. Tandem CAR T cells targeting HER2 and IL13Ralpha2 mitigate tumor antigen escape. J Clin Invest.2016;126(8):3036-52.
- Bister A, Haist C, Schulte E, Scheckenbach K, Hanenberg H, Gattermann N, Wiek C. Dual targeting to reduce on-target off-tumor toxicities in CAR T-cell therapy for mantle cell lymphoma. 1st European CAR T-cell meeting, 14-16 February 2019, Paris.
- Grigor EJM, Fergusson D, Kekre N, et al. Risks and Benefits of Chimeric Antigen Receptor T-Cell (CAR-T) Therapy in Cancer: A Systematic Review and Meta-Analysis, Transfusion Medicine Reviews. 2019. https://doi. org/10.1016/ j. tmrv.2019.01.005.
- Olweus J. Manufacture of CAR-T cells in the body. Nature Biotechnology.2017;35:520-1.
- Zhao Z, Chen Y, Francisco NM, Zhang Y, Wu M. The application of CAR T-cell therapy in hematological malignancies: advantages and challenges. Acta Pharmaceutica Sinica B. 2018;8(4):539-551.
- Li Y, Huo Y, Yu L et al. Quality Control and Nonclinical Research on CAR-T Cell Products: General Principles and Key Issues, Engineering. 2019. https://doi. org/10.1016/j. eng.2018.12.003.
- Brudno JN, Kochenderfer JN. Recent advances in CAR T-cell toxicity: Mechanisms, manifestations and management. Blood Reviews. 2019. https://doi. org/10.1016/j. blre.2018.11.002.
- Brudno JN, Maric I, Hartman SD, Rose JJ, Wang M, Lam N, et al. T cells genetically modified to express an anti-B-cell maturation antigen chimeric antigen receptor cause remissions of poor-prognosis relapsed multiple myeloma. J Clin Oncol Aug. 2018;36(22):2267-80.
- Mikkilineni L, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for multiple myeloma. Blood. 2017;130:2594-602.
- Wang CM, Wu ZQ, Wang Y, Guo YL, Dai HR, Wang XH, et al. Autologous T cells expressing CD30 chimeric antigen receptors for relapsed or refractory hodgkin lymphoma: an open-Label phase I trial. Clin Cancer Res. 2017;23:1156-66.
- Ramos CA, Ballard B, Zhang H, Dakhova O, Gee AP, Mei Z, et al. Clinical and immunological responses after CD30-specific chimeric antigen receptor-redirected lymphocytes. J Clin Invest. 2017;127(9):3462-71.
- Brown CE, Alizadeh D, Starr R, Weng L, Wagner JR, Naranjo A, et al. Regression of glioblastoma after chimeric antigen receptor T-cell therapy. N Engl J Med. 2016;375:2561-9.
- Louis CU, Savoldo B, Dotti G, Pule M, Yvon E, Myers GD, et al. Antitumor activity and long-term fate of chimeric antigen receptor-positive T cells in patients with neuroblastoma. Blood. 2011;118:6050-6.
- Ahmed N, Brawley VS, Hegde M, Robertson C, Ghazi A, Gerken C, et al. Human epidermal growth factor receptor 2 (HER2) -specific chimeric antigen receptor- modified T cells for the immunotherapy of HER2-positive sarcoma. J Clin Oncol. 2015;33:1688-96.
- Grigor EJM, Fergusson D, Kekre N, et al. Risks and Benefits of Chimeric Antigen Receptor T-Cell (CAR-T) Therapy in Cancer: A Systematic Review and Meta-Analysis. Transfusion Medicine Reviews. 2019. https://doi. org/10.1016/ j. tmrv.2019.01.005.
- Novartis (2017) Prescribing Information (KymriahH). Available at: https://www. pharma. us. novartis. com/ sites/www. pharma. us. novartis. com/files/kymriah. pdf
- Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med. 2018;378(5):439-48.
- Schuster SJ, Svoboda J, Chong EA, Nasta SD, Mato AR, Anak O, et al. Chimeric antigen receptor T cells in refractory B-cell lymphomas. N Engl J Med. 2017;377:2545-54.
- YescartaH (2017) Prescribing Information. Available at: https://www. fda. gov/downloads/ BiologicsBloodVaccines/ CellularGeneTherapyProducts/ApprovedProducts/ UCM581226. pdf
- Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene ciloleucel CAR T-cell therapy in refractory large B-cell lymphoma. N Engl J Med. 2017;377(26):2531-44.
- Neelapu SS, Tummala S, Kebriaei P, Wierda W, et al. Chimeric antigen receptor T-cell therapy — assessment and management of toxicities. Rev Clin Oncol. 2018; 15: 47-62.
- Shank BR. Management of CAR T-cell Adverse Effects in hematological malignancies. HOPA Annual meeting. 2018 March.
- Ellard R, 1st European CAR T-cell meeting, 14-16 February 2019, Paris.
- Vickers E. What is driving CARs into the spotlight?-the science simplified. 1st European CAR T-cell meeting, 14-16 February 2019, Paris.


