Создание гипотетической компьютерной модели органических форм микроэлементов
Автор: Жамсаранова С.Д., Лыгденов Д.В., Соколов Д.В., Болхонов Б.А.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 3 (74), 2019 года.
Бесплатный доступ
В статье изложены результаты исследований по созданию гипотетической компьютерной модели органических форм йода, цинка и селена с низкомолекулярными пептидами. В качестве органического носителя был использован гидролизат соевого белка. С использованием приложения HyperChemv8.0 квантово-химическими, полуэмпирическими и молекулярно-динамическими методами изучены изменения молекулярных свойств, проведено квантово-механическое моделирование атомных структур. Созданы молекулярные структуры органических форм микроэлементов с аминокислотами, выполнена их геометрическая оптимизация. Были рассмотрены все возможные варианты и комбинации соединения цинка, йода и селена с четырьмя аминокислотами, в наибольшем количестве входящими в состав гидролизата соевого белка. Свидетельством корректности геометрической оптимизации, минимизации потенциальной энергии и сбалансированности энергетических свойств системы являлась величина суммарной энергии исследованных компонентов. Полученные результаты свидетельствуют о возможности связывания микроэлементов с аминокислотами.
Соевый гидролизат, микронутриенты, микроэлементы, молекулярный докинг, энергия связи
Короткий адрес: https://sciup.org/142228767
IDR: 142228767 | УДК: 641.11:577.117
Текст научной статьи Создание гипотетической компьютерной модели органических форм микроэлементов
На протяжения всей жизни человек всегда нуждался и нуждается в поступлении физиологических концентраций микронутриентов. Анализ рациона питания современного человека свидетельствует об изменении структуры и качества питания, что приводит к нарушению пищевого статуса, связанного с недостаточной или избыточной концентрацией микронутриентов, поступающих в организм [1]. Микронутриенты - это вещества, необходимые в дозах от мг до мкг. Микронутриенты играют важную роль в метаболизме, а также могут обладать токсическим действием. Эти эффекты зависят от дозы микроэлемента.
На сегодня актуальной проблемой является недостаток микроэлементов, которые не синтезируются в организме и, следовательно, должны поступать в организм с пищей. Из-за недостаточной концентрации микроэлементов возникает множество эндемических заболеваний [2]. Так, в России, по данным Российского общества микроэлементологии, дефицит цинка в отдельных регионах достигает 30-90% [3]. По данным эпидимиологических исследований, в России обеспеченность селеном в среднем более чем у 80% населения ниже оптимального уровня. В разных регионах Российской Федераций распространенность дефицита йода и заболеваний, вызванных этим фактором, колеблется от 15 до 98% [4].
Наиболее дефицитными на территории Сибири являются йод, цинк и селен, каждый из которых выполняет специфические функции в организме, например йод - основной компонент гормонов щитовидной железы, который регулирует метаболические реакции, участвует в регуляции обмена энергии, температуры тела. Цинк необходим для синтеза белков, в том числе коллагена, и формирования костей, принимает участие в процессах деления и дифференцировки клеток, формировании Т-клеточного иммунитета. Селен участвует в построении и функционировании глутатионпероксидазы, глицинредуктазы, цитохрома С - основных антиоксидантных ферментов, т.е. защищает клетки организма от действия свободных радикалов [5].
Свободные ионы металлов, несущие электрический заряд, с трудом всасываются в организме; все соли микроэлементов, рекомендуемые к применению, гидролизуются с образованием практически нерастворимых гидроксидов, которые выводятся с экскрементами; ионы металлов из минеральных солей выступают катализаторами окисления витаминов, вводимых в премиксы, при котором ценность премиксов снижается. Проблема заключается в форме элемента, поступающего в организм. Так, йод - высоколетучий, цинк и селен чаще всего встречаются в природе в виде неорганических соединений [6].
Поэтому в последние годы внимание ученых сосредоточено на разработке и создании комплексных препаратов, полученных путем синтеза микроэлементов с аминокислотами или другими веществами (так называемыми хелатными соединениями микроэлементов) [7].
Известно, что микроэлементы лучше усваиваются, когда они связываются с органическими соединениями. Особый интерес представляют соединения металлов с аминокислотами, пептидами. Известно, что при образовании таких соединений наблюдаются изменения их химических, а также биологических свойств, причем ионы металлов становятся менее токсичными и могут катализировать различные биохимические процессы. Кроме того, высокая эффективность применения органических, связанных форм элементов, их более полноценная усвояемость в живом организме позволяют сократить дозы употребления в 2-3 раза [8].
Целью данной работы явилась разработка гипотетической модели связывания йода, цинка и селена с пептидами белка сои.
Материалы и методы
За основу взят метод молекулярного докинга - это метод молекулярного моделирования, который позволяет предсказать наиболее выгодную для образования устойчивого комплекса ориентацию и конформацию лиганда в центре связывания рецептора. Необходимо рассчитать положения и конформацию лиганда, при которых достигается минимум свободной энергии (dG) связывания [9].
Объектами исследований явились низкомолекулярные пептиды соевого гидролизата. В компьютерной среде HyperChem v8.0 [10] поэтапно разработана одна наиболее вероятная гипотетическая модель химического взаимодействия солей цинка, йода и селена с низкомолекулярными пептидами соевого гидролизата. Для наиболее вероятного подтверждения существования возможного варианта связывания молекул мы ориентировались на энергию связи, рассчитанную с помощью полуэмперического метода (PM3) [11], так как известно из теорий об энергии химической связи: чем отрицательнее суммарная энергия молекулы, тем устойчивее и стабильнее молекула. Исходя из этого принципа, литературных данных, а также баз данных белковых молекул [12] были разработаны гипотетические модели возможных связей молекул, содержащих органические формы цинка, йода и селена.
Результаты и их обсуждения
В первую очередь был проанализирован аминокислотный состав соевого гидролизата.
Как следует из данных, полученных Н.Я. Пивоваровым и др. [13], в наибольшем количестве в соевом гидролизате содержатся следующие аминокислоты: аспарагиновая кислота, глутаминовая кислота, фенилаланин и аргинин.
Атом цинка может быть связан с аминокислотами по типу белковой структуры «ЦИНКОВЫЙ ПАЛЕЦ» (рис. 1), что представляет собой тип белковой структуры, стабилизированный одним или двумя ионами цинка, связанными координационными связями с аминокислотными остатками белка.
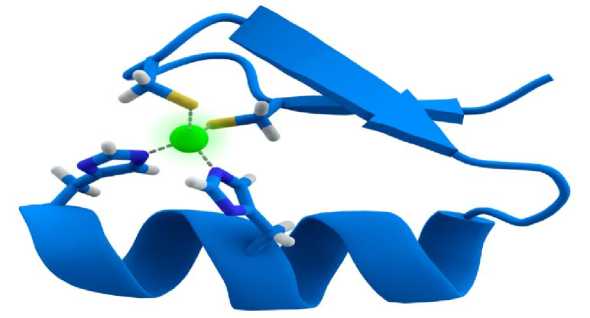
Рисунок 1 - Схема «цинкового пальца»
На рисунке 2 предложены наиболее вероятные варианты моделей взаимодействия цинка с аминокислотными остатками.
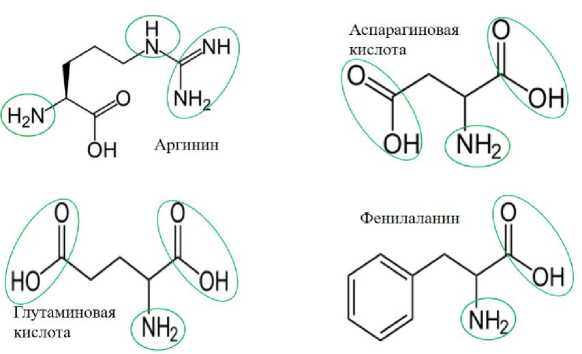
Рисунок 2 - Возможные варианты взаимодействия функциональных групп аминокислот с цинком
Были построены четыре возможные связи с аминокислотами в программе Hyper-Chemv 8.0 и рассчитаны энергии связи. В результате было получено, что наибольшей энергией связи (равной E=-2409,4081 Kcal/mol) обладал аргинин (табл. 1).
Таблица 1
Энергия связи разных аминокислот
|
Название аминокислоты |
Энергия связи (E), Kcal/mol |
|
Глутаминовая кислота |
-1865,2609 |
|
Аспарагиновая кислота |
-1695,6231 |
|
Фенилаланин |
-2412,8448 |
|
Аргинин |
-2409,4081 |
Были рассмотрены варианты взаимодействия цинка через NN-Zn-NN и O-Zn-O. Из расчетов было получено, что наибольшей энергией связи (E=-9298,4455 Kcal/mol) обладал цинк, соединенный с аргинином через NN-Zn-NN (рис. 3). В дальнейшем было решено использовать именно эту модель в качестве прототипа молекулы, содержащей атом цинка.
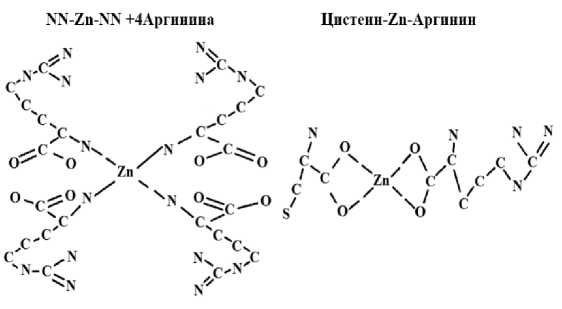
Е= -9298,4455
Е= –3756,7771
Рисунок 3 – Возможные варианты взаимодействия цинка с аминокислотами (2D)
Следующим шагом было рассмотрение взаимодействия цинка с четырьмя аминокислотными остатками (аспарагиновой кислотой, аргинином, глутаминовой кислотой, фениалалани-ном), связанными с цинком через NN-Zn-NN (рис. 4). Анализ показал, что наибольшей энергией связи (E=-9298,4455 Kcal/mol) обладал аргинин (табл. 2), и в последующих расчетах брали именно эту модель.
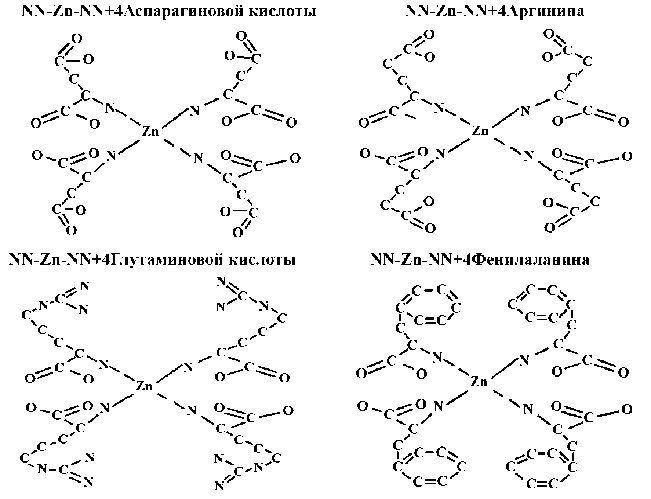
Рисунок 4 – Возможные варианты взаимодействия цинка с аминокислотами и расчетные энергии связи этих взаимосвязей (2D)
Таблица 2
Аминокислоты и рассчитанные энергии связи с цинком
|
Название аминокислоты |
Энергия связи (E), Kcal/mol |
|
Аспарагиновая кислота |
-5993,7668 |
|
Глутаминовая кислота |
-7349,4223 |
|
Фенилаланин |
-9362,9666 |
|
Аргинин |
-9298,4455 |
Что касается фенилаланина, то в предыдущих аналитических расчетах и на основе результатов ИК спектрометрий было установлено, что йод не связывается с молекулами по бензольному кольцу, поэтому было решено не отбрасывать этот вариант, но при этом и не полагаться на него [16].
Селен может связываться с карбоновыми кислотами, а также цистеином, замещая молекулу серы (рис. 5) [14].
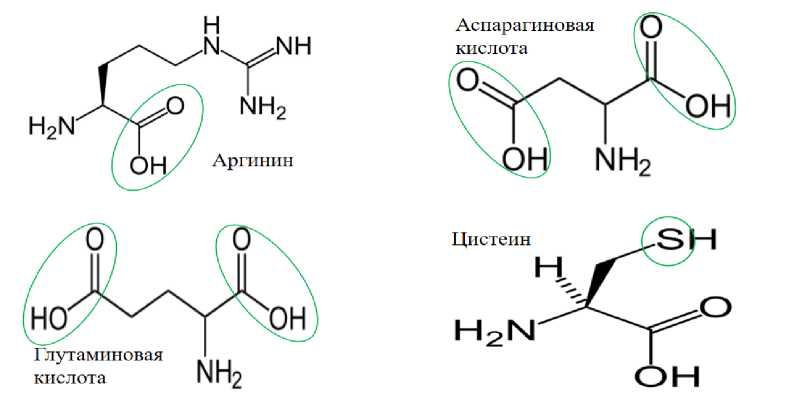
Рисунок 5 – Возможные варианты взаимодействия селена с функциональными группами аминокислот
Рассмотрели случаи, когда атом селена находится слева, справа, по обе стороны от цинка и когда атом серы замещен на атом селена в цистеине, оказалось, что наибольшая энергия связи (E=-9778,9912 Kcal/mol) будет в том случае, когда атом селена будет находиться по обе стороны относительно цинка (табл. 3).
Таблица 3
Энергия связи разных моделей взаимодействия с селеном
|
Положение атома селена |
Энергия связи (E), Kcal/mol |
|
Взаимодействие селена с цистеином |
-3756,7771 |
|
Селен справа относительно цинка |
-9650,1621 |
|
Селен слева относительно цинка |
-9592,7740 |
|
Селен по обе стороны относительно цинка |
-9778,9912 |
Атом йода может взаимодействовать с аминогруппой, замещая один атом водорода, также может взаимодействовать с углеродом в остатке аминокислоты, также замещая один атом водорода, и последний вариант - садится на аминокислотное кольцо, также замещая атом водорода (рис. 6) [15].
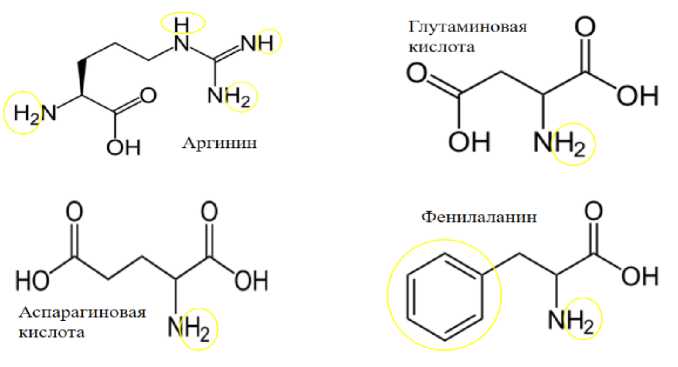
Рисунок 6 – Возможные варианты взаимодействия йода с функциональными группами аминокислот
Как следует из структурных формул аминокислот, имеется большое количество активных центров, по которым может произойти связывание йода. Была изучена зависимость энергий связи гипотетической молекулы от количества атомов йода в молекуле. Модель молекулы, имеющая в себе один атом йода, имела наибольшую энергию связи (E = -9695,0189 Kcal/mol). Поэтому решили строить на основе гипотетической модели, содержащей один атом йода (рис. 7).
NN-Zn-NN+4ApniHHHa+2Se+3I на 3NH2
NN-Zn-NN+4ApniHHHa+2Se+2I на 2NH2
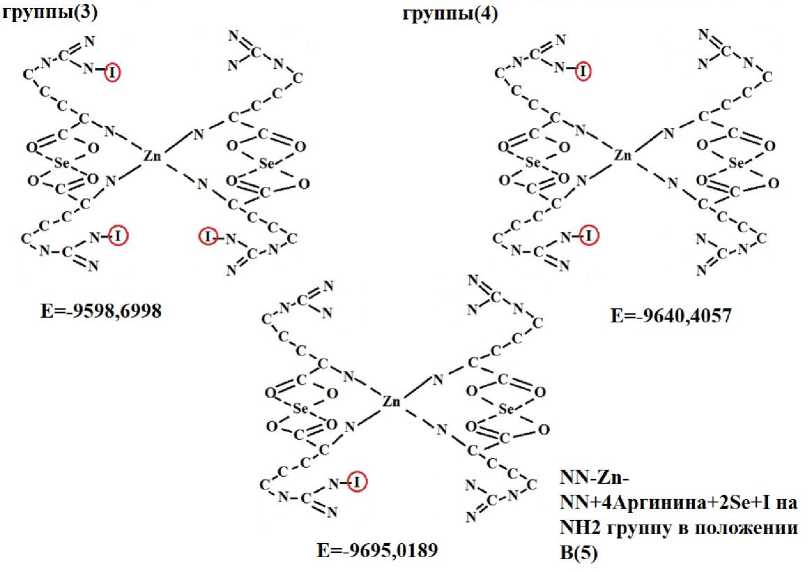
Рисунок 7 – Возможные варианты органических форм йода в зависимости от количества атомов йода (2D)
На следующем этапе нужно было выяснить, с какой группой (NH или NH2) будет присоединяться атом йода так, чтобы энергия связи была наибольшей (рис. 8). Наибольшей энергией связи (E=-9693,2487 Kcal/mol) обладала модель молекулы, в которой атом йода присоединялся на (NH2) - группу (табл. 4).
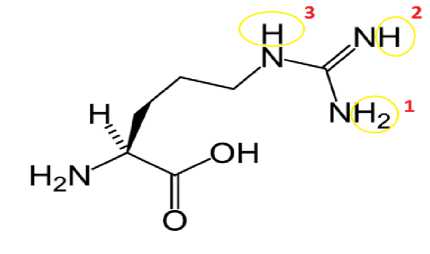
Рисунок 8 – Возможные варианты расположения атома йода в аргинине
Таблица 4
Энергия связи в зависимости от положения атома йода
|
Положение атома йода |
Энергия связи (E), Kcal/mol |
|
Атом йода в положение 1 |
E=-9693,2487 |
|
Атом йода в положение 2 |
E=-9590,6392 |
|
Атом йода в положение 3 |
E=-9590,1389 |
Далее следовало выяснить, в каком из положений (A, B, C, D) будет наибольшая энергия связи, если йод присоединится с (NH2) группой (рис. 9).
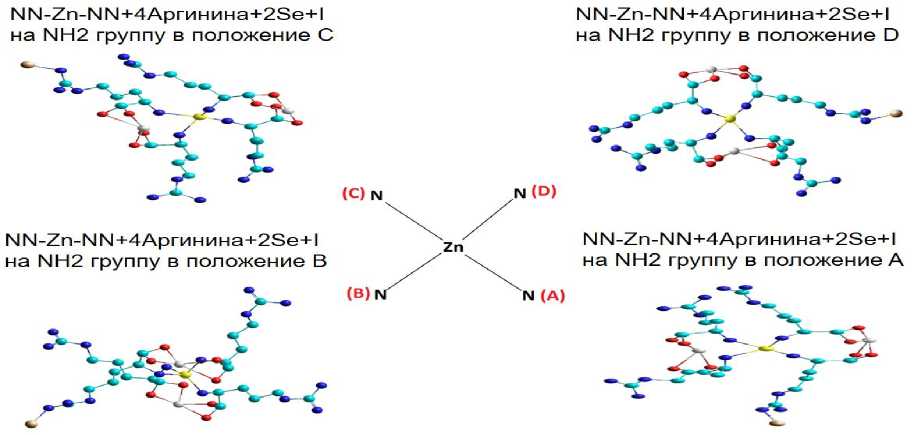
Рисунок 9 – Возможные варианты органической формы йода в зависимости от связывания c азотом или аминогруппой в аргинине (3D)
Энергия связи больше, если атом йода присоединяется в положении B (E=-9695,0189 Kcal/mol) (табл. 5).
Таблица 5
Энергия связи в зависимости от положения атома йода в модели
|
Положение йода |
Энергия связи (E), Kcal/mol |
|
Положение A |
E=-9694,3482 |
|
Положение B |
E=-9695,0189 |
|
Положение C |
E=-9694,8145 |
|
Положение D |
E=-9692,7556 |
Таким образом, на основе полученных данных можно утверждать, что наиболее вероятный комплекс аминокислоты, соединенный с цинком, селеном и йодом, представлен ниже. (NN-Zn-NN+4Аргинина+2Se+I на NH2-группу в положении B (-9695,0189 Kcal/mol)). Этот комплекс обладал наибольшей энергией связи (E=9695,0189 Kcal/mol).
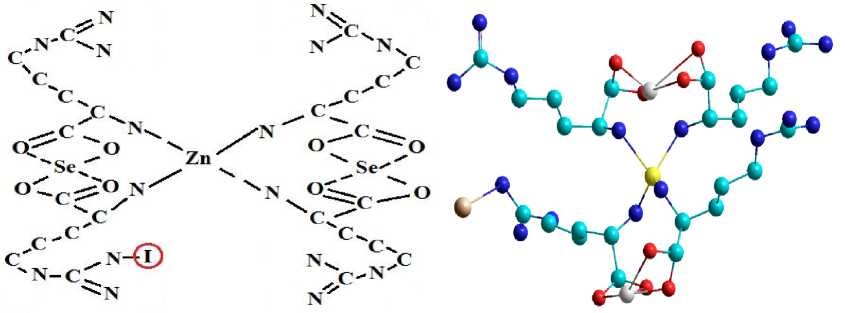
a b
Рисунок 10 – Гипотетическая модель органической формы йода, цинка и селена: a - 2D; b - 3D
Заключение
В результате проведенных исследований была разработана гипотетическая модель одного из наиболее вероятных вариантов, содержащих комплекс аминокислот, связанный с цинком, йодом и селеном. Экспериментальный синтез, а также изучение спектрометрических характеристик вероятных моделей связывания микроэлементов с аминокислотами пептидов соевого гидролизата позволят выяснить достоверность данных моделей и послужат основой для разработки функционального ингредиента, необходимого при создании продуктов, обогащенных микроэлементами.
Список литературы Создание гипотетической компьютерной модели органических форм микроэлементов
- Коденцова В.М. [и др.].Витаминно-минеральные комплексы в питании взрослого населения // Вопросы питания. 2015. №6. С. 141-150.
- Пастушкова Е.В., Мысаков Д.С., Чугунова О.В. Некоторые аспекты фактора питания и здоровья человека // The Journal of scientific articles "Health and Education Millennium". 2016. Vol. 18,N4. P. 67-71.
- Кудрин В.С. Мониторинг медицинской деятельности в системе ее комплексной оценки // Проблемы социальной медицины, здравоохранения и истории медицины. 2001. № 2. С. 26-28.
- Минина Л.А.[и др.].Селендефицит у населения Забайкалья // Геохимическая экология и биохимическое изучение таксонов биосферы: материалы IV Рос. биохимич. школы. М.: Наука, 2003. - С. 238-239.
- Жамсаранова.С.Д., ПластининаЗ.А.Биохимия микронутриентов: учеб.пособие.Улан-Удэ: Изд-во ВСГУТУ, 2013.164с.


