Спектрофотометрическое определение крахмала в томатных продуктах с антроновым реактивом
Автор: Рачкова В.П., Сураева Н.М., Глазков С.В., Самойлов А.В.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Технические науки
Статья в выпуске: 6, 2018 года.
Бесплатный доступ
Крахмал входит в состав многих пищевых продук- тов, а также используется в качестве пищевой добав- ки, поэтому так важен метод его количественного определения в продуктах питания, подтверждающий их качество и гарантирующий отсутствие возможных фальсификаций. В отечественной нормативной доку- ментации установлены стандарты на методы количе- ственного определения содержания крахмала только для молочной, мясной продукции и кормов для животных. Цель исследований - разработка комплексной методики определения крахмала в томатопродуктах спектро- фотометрическим методом с помощью антронового реактива. Спектрофотометрический метод основан на гидролизе полисахаридов в кислой среде до глюкозы, с последующей дегидратацией последней до 5-гидроксиметилфурфурола, который образует при реакции с антроном окрашенный продукт. К преимуще- ствам этого метода можно отнести его высокую чув- ствительность, а также использование доступных, недорогостоящих оборудования и реактивов. В задачи работы также входило изучение различных условий экстракции моно-, дисахаридов и гидролиза крахмала в кислой среде на модельных системах...
Томатная паста, крахмал, ан- троновый реактив, спектрофотометрическое определение
Короткий адрес: https://sciup.org/140238147
IDR: 140238147 | УДК: 664.22/.27,
Текст научной статьи Спектрофотометрическое определение крахмала в томатных продуктах с антроновым реактивом
Введение. Крахмал является составной частью многих пищевых продуктов и находит широкое применение в качестве пищевой добавки, поэтому так важен метод его количественного определения в продуктах питания, подтверждающий их качество и гарантирующий отсутствие возможных фальсификаций. Основным сырьем в производстве различных томатных продуктов является томатная паста, полученная из томатов различной степени зрелости. В потребительской корзине отечественного покупателя томатная паста, томатные соки, соус, кетчуп являются незаменимыми продуктами и используются регулярно в значительных объемах при приготовлении разнообразного ассортимента блюд в домашних условиях. В состав томатов входят моно- и дисахариды (глюкоза, фруктоза, сахароза: в 100 г – 1,6, 1,2 и 0,7 г соответственно), а также небольшое количество крахмала (в 100 г – 0,3 г) [1]. Согласно введенному в действие межгосударственному стандарту на томатные продукты [2], массовая доля углеводов в концентрированных томатных продуктах не нормируется. Однако при изготовлении кетчупа, кроме основного сырья – томатной пасты, в зависимости от его категории используются различные добавки, в том числе и крахмал в качестве загустителя, количественное содержание или отсутствие которого регламентируется. Так, например, высшая категория такому продукту, как кетчуп, присваивается в случае отсутствия крахмала, но в остальных категориях его присутствие допускается [3].
Известно, что минимальное количество крахмала в томатах подтверждает факт их естественного созревания (спелости), таким образом, качество томатной пасты и продукции из неё напрямую зависит от количественного содержания в ней крахмала. Этот показатель не менее важен для производителей и представителей торговых сетей, так как позволяет поставить барьер перед продукцией низкого качества. Однако в настоящее время в существующей нормативной базе методов определения крахмала в продуктах переработки фруктов и овощей регламентирован только качественный метод, основанный на окрашивании крахмала в пробе продукта в синий, фиолетовый, красный или бурый цвет после добавления йода [4]. При этом недостатком такого подхода является неполное освобождение от природных каротиноидов (ликопина, каротина), придающих раствору образца желтоватый оттенок. Поэтому при проведении данной качественной реакции развитие окраски осложняется различными оттенками цветов, из-за чего возможно получение как ложноотрицательных, так и ложноположительных результатов. Следует отметить, что в отечественной нормативной документации установлены стандарты на методы количественного определения содержания крах- мала, например, в молочной, мясной продукции и кормах для животных [5–7].
Таким образом, существует обоснованная необходимость разработки количественного метода определения крахмала в продуктах переработки овощей и фруктов, в частности в томатопродуктах.
В связи с разнообразием видов крахмала по своему химическому строению, в зарубежной и отечественной литературе представлено достаточно много методик количественного определения как обычных, так и модифицированных крахмалов. Чаще всего используют классические поляриметрический, ферментативный, йодометрический [8, 9] методы, которые основаны на измерении содержания глюкозы после кислотного или ферментативного гидролиза крахмала. В литературе также опубликованы современные методы определения глюкозы, такие как спектрофотометрический [10] и ВЭЖХ [11, 12].
Каждый из них имеет определенные преимущества и недостатки, связанные как с их надежностью и точностью, так и с трудоемкостью и необходимостью использования дорогостоящего оборудования и расходных материалов. В нашей работе был использован спектрофотометрический метод количественного определения крахмала, основанный на гидролизе полисахаридов в кислой среде до глюкозы, с последующей дегидратацией последней до 5-гидроксиметилфурфурола (реакция Маяра), который образует при реакции с антроном комплексный продукт сине-зеленого цвета [13, 14]. К преимуществам этого метода можно отнести его высокую чувствительность, а также использование доступного оборудования и реактивов.
Цель исследований . Разработка комплексной методики количественного определения крахмала в томато-продуктах спектрофотометрическим методом. В связи с тем, что объектом наших исследований являлась томатная паста, необходимо было разработать подходы к выделению крахмала из томатной пасты, его гидролизу до глюкозы, удалению натуральных красителей и количественному определению глюкозы.
Поэтому в задачи нашей работы входило изучение различных условий экстракции моно- и дисахаридов и гидролиза крахмала в кислой среде, оценка мешающего влияния натуральных красителей, а также ряда других показателей в выбранных модельных системах.
Объекты и методы исследований. В качестве объектов исследования использовали крахмал (Химмед, чда), D-глюкозу, D-фруктозу, сахарозу c содержанием основного вещества 99 % (Alfa-Aesar, Великобритания), томатную пасту, приобретенную из торговой сети.
Гидролиз крахмала. Навеску крахмала количественно переносили в круглодонную колбу вместимостью 250 см3, смывая 80 см3 5 %-го раствора серной кислоты, ХЧ (АО «ЭКОС-1», Россия), и проводили гидролиз кипячением в течение 15 минут с обратным холодильником. Прозрачный гидролизат охлаждали до комнатной температуры под струей холодной воды, количественно переносили в мерную колбу вместимостью 250 см3 и доводили до метки дистиллированной водой.
Приготовление смеси крахмала с томатной пастой. В стакан помещали 6,93 г крахмала (5,87 г в пересчете на сухое вещество), приливали 150 см3 кипящей дистилли- рованной воды. Содержимое тщательно перемешивали, охлаждали до комнатной температуры и снова взвешивали. В полученную смесь путем обратного взвешивания добавляли 94,06 г томатной пасты с содержанием растворимых сухих веществ 34,4 %. Пробу перемешивали на диспергаторе (IKA, Германия) с частотой вращения 3400 мин-1 в течение двух часов и охлаждали до комнатной температуры.
Получение и гидролиз экстракта смесей моно- и дисахаридов в смеси с крахмалом. Экстракция горячей водой. Образцы смеси крахмала с углеводами (в различных соотношениях) помещали в конические колбы вместимостью 250 см3 и заливали 60 см3 нагретой до температуры 60 °С воды. Пробы перемешивали на встряхивающем аппарате с частотой встряхивания 200 колебаний в минуту в течение 20 мин. После чего фильтровали полученный раствор через стеклянную воронку с бумажным фильтром (Whatman GE, Великобритания) в мерную колбу вместимостью 100 см3. Осадок переносили количественно на фильтр и промывали небольшим количеством дистиллированной воды. Отсутствие крахмала в водном растворе контролировали по отрицательной реакции с йодом.
Экстракция 80%-м этиловым спиртом. Образцы смеси крахмала с углеводами (в различных соотношениях) и крахмала с томатной пастой помещали в пробирку вместимостью 50 см3 с 80%-м раствором этилового спирта и центрифугировали при 1000 в течение 10 мин. Верхний слой декантировали. Экстракцию повторяли 5 раз.
Осветление гидролизатов. Для осветления гидролизатов в мерные колбы вместимостью 100 см3 отбирали аликвоты полученных растворов. Затем последовательно добавляли по 2 см3 реактивов Карреза I и II, перемешивали и оставляли на 20 мин при периодическом перемешивании, фильтровали через бумажный фильтр.
Проведение цветной реакции, измерение оптической плотности растворов и построение градуировочного графика для количественного расчета. Антроновый реактив готовили смешением в стакане 0,2 г кристаллического антрона (Диа-М, Индия) с 100 см3 концентрированной серной кислоты (АО «ЭКОС-1, Россия). Градуировочный график строили методом стандартных серий. Для этого в мерные колбы вместимостью 100 см3 добавляли по 0; 5; 10; 15; 20 и 25 см3 раствора глюкозы массовой концентрации 0,3 г/дм3 и доводили объемы растворов дистиллированной водой до метки, тщательно перемешивали. Разбавленные растворы использовали для проведения цветной реакции со свежеприготовленным антроновым реактивом.
В мерные пробирки вместимостью 25 см3 последовательно добавляли по 10 см3 антронового реактива, по 2 см3 градуировочных растворов и растворов гидролизатов, перемешивали, ставили на кипящую водяную баню на 30 мин, охлаждали до комнатной температуры. Появляется сине-зеленое окрашивание различной интенсивности.
Оптическую плотность полученных растворов измеряли относительно раствора сравнения на спектрофотометре Cary WinUV 100 (Varian, США) при длине волны 625 нм, в кюветах с толщиной поглощающего слоя 10 мм.
Массовую долю крахмала вычисляли по формуле
m • V • V i - 100
X — * 0,9 , m * V * 2
где m – масса глюкозы, вычисленная по градуировочному графику, мг; V – объем исходного раствора, см3; V 1 – объем разбавленного раствора, см3; V 2 – объем исходного раствора, взятый для разбавления, см3; 2 – объем разбавленного раствора, взятый для окрашивания, см3; m 1 – масса навески, мг; 100 – коэффициент пересчета в проценты; 0,9 – коэффициент пересчета массовой доли глю-
козы на массовую долю крахмала.
Степень извлечения крахмала W , %, вычисляли по формуле
W —
X
пробы + добавки
-
пробы
X
добавки
-100
,
где X пробы+добавки – массовая доля крахмала, найденная в образцах пробы с добавкой, %; X пробы – массовая доля крахмала, найденная в образцах без добавки, %; X добавки – массовая доля крахмала, найденная в образцах с добавкой, %; 100 – коэффициент пересчета в проценты.
Обработку результатов, оценку измеряемой величины и расчет среднего квадратического отклонения (СКО) группы из n результатов, проверку на наличие грубых погрешностей проводили по [15] с использованием критерия Граббса G при заданном уровне доверительной вероятности P = 0,95.
Расчет границ доверительного интервала случайной погрешности ± A X (принято X в = X н ) проводили по формуле
±A X —
S - 1 ( P , f )
, n
где t - коэффициент Стьюдента, при f — n — 1 равный 2,571
Проведение качественной реакции на редуцирующие углеводы (глюкозу, фруктозу). К 4 см3 экстракта добавляли 2 см3 5%-го раствора гидроксида натрия и по каплям 5%-й раствор сульфата меди. Раствор окрашивается в темно-синий цвет за счет образования комплексного соединения меди с углеводами. При нагревании полученного раствора на кипящей водяной бане появляется яркокрасный осадок, реакция считается положительной.
Проведение качественной реакции на сахарозу . К 2 см3 экстракта добавляли 1 см3 5%-го раствора гидроксида натрия, несколько капель 2%-го раствора сульфата кобальта. Раствор перемешивали. При наличии фиолетовой окраски реакция считается положительной.
Проведение качественной реакции на крахмал. К 50 см3 экстракта добавляли 0,5 см3 0,01 М раствора йода. Содержимое перемешивали. При наличии фиолетовой, красной и бурой окраски реакция считается положительной.
Результаты и их обсуждение. В результате измерения оптической плотности трех градуировочных растворов глюкозы, использованных при разработке методики с антроновым реактивом, было определено, что макси-
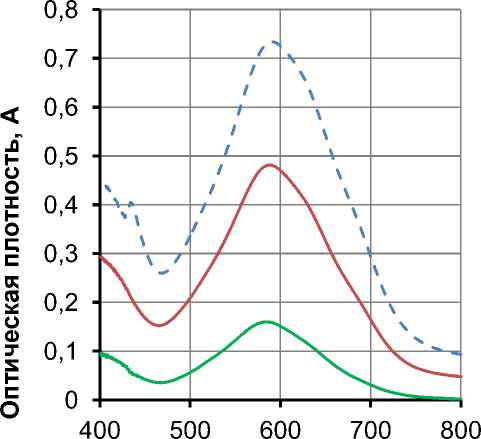
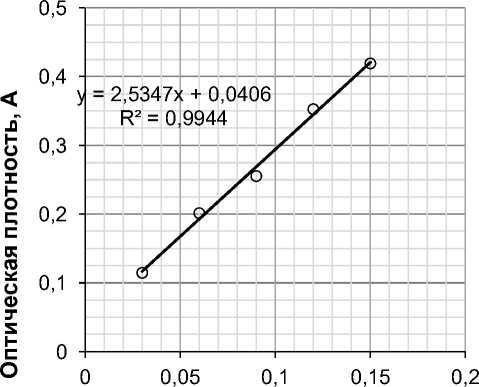
мальное развитие окраски происходило через 30 мин и сохранялось в течение 30 мин после охлаждения гидролизата, при этом максимальное значение величины абсорбции наблюдалось при 580–590 нм. Представленный на рисунке 2 градуировочный график, построенный по результатам измерения оптической плотности растворов сравнения глюкозы с этим же реактивом, был описан уравнением регрессии линейного вида y = 2,5347x+0,0406 с высоким коэффициентом корреляции (R² 0,9944).
Длина волны, нм
Рис. 1. Спектры поглощения растворов глюкозы: зеленый – 0,015%-й раствор; красный – 0,045%-й раствор; синий – 0,075%-й раствор
Масса глюкозы в растворе, мг
о Экспериментальные точки
Рис. 2. Градуировочный график по результатам измерения оптической плотности растворов сравнения глюкозы при длине волны 590 нм
Чувствительность метода также была высокой, так как нижний предел определения глюкозы составил 0,03 мг в 2 см3 [16].
Для установления полноты гидролиза изучали влияние различных параметров этого процесса в водных растворах серной кислоты. Ранее было рекомендовано ис- пользовать 1%-й раствор этой кислоты [17], однако в представленных исследованиях использование кислоты с данной концентрацией не позволяло добиться полного гидролиза, тогда как при увеличении времени кипячения до 15 минут и концентрации серной кислоты до 5 % гидролиз проходил в полной мере, что подтверждалось отрицательной реакцией гидролизата с йодом (табл.1).
Гидролиз и количественное определение крахмала
Таблица 1
|
Массовая доля серной |
Время |
Масса |
Определение крахмала |
|
|
кислоты в растворе, % |
кипячения, мин |
крахмала, г |
Качественное |
Количественное |
|
1 |
5 |
0,1007 0,1019 0,0871 |
+ + + |
Не проводилось |
|
5 |
15 |
0,1139 0,0965 0,1226 0,0976 |
- - - - |
102,61±13,94 |
Известно, что моно- и дисахара экстрагируются горячей водой, а также 80%-м раствором этилового спирта, при этом крахмал остается в осадке [17,18]. Поэтому, с целью изучения параметров удаления свободных углеводов, была приготовлена модельная смесь различных концентраций крахмала с простыми углеводами (D-глюкоза, D-фруктоза и сахароза смешивались в равных долях) и проведена экстракция последних с помощью горячей воды и 80%-го раствора этилового спирта. Оказалось, что при экстракции свободных углеводов из мо- дельной смеси горячей водой растворялся и крахмал, что было подтверждено с помощью положительной реакции с йодом, тогда как при экстракции 80%-м раствором этанола крахмал в фильтрате не был обнаружен. Увеличение кратности экстракции способствовало повышению выхода крахмала. Оказалось, что отрицательная качественная реакция на редуцирующие углеводы достигалась после пяти экстракций. При этом степень извлечения крахмала из смеси составила 105,63±14,28 % (табл. 2).
Таблица 2
Результаты извлечения крахмала в смеси с углеводами после экстракции 80%-м раствором спирта
|
Номер образца для экстракции |
Масса навески образца, г |
Массовая доля крахмала |
Степень извлечения крахмала W i , % |
Среднее значение W ср , % |
СКО S W ср , % при n = 6 |
Границы доверительного интервала ±Δ W при Р = 0,95 |
|
|
добавленная в образец, X добавки, i , % |
определенная в образце, x пробы + добавки , i , % |
||||||
|
1 |
0,1930 |
25,70 |
24,48 |
95,25 |
105,63 |
14,28 |
14,99 |
|
2 |
0,1106 |
40,15 |
47,71 |
118,82 |
|||
|
3 |
0,2101 |
45,03 |
44,19 |
98,13 |
|||
|
4 |
0,1905 |
40,31 |
37,87 |
93,94 |
|||
|
5 |
0,2136 |
44,90 |
44,66 |
99,47 |
|||
|
6 |
0,1505 |
37,14 |
47,60 |
128,16 |
|||
Влияние нативных компонентов и достоверность исследованного подхода количественного определения крахмала оценивали по результатам экспериментов, в которых крахмал добавляли к томатной пасте. При этом смесь томатной пасты и крахмала была приготовлена таким образом, чтобы наиболее соответствовать по техническим условиям рецептуре кетчупа, в составе которого, как указывалось выше, разрешено использовать крахмал в виде добавки. Так как в томатной пасте присутствовал нативный крахмал, то доля добавленного крахмала измерялась нами как разница между массовой долей крахмала в образце томатной пасты, где он был добавлен, и без него. В связи с тем обстоятельством, что томатная паста содержит натуральные красители, после удаления свободных углеводов и гидролиза в сильнокислой среде также была проведена процедура осветления полученного раствора. Однако эта процедура существенно не повлияла на выход крахмала. Вероятно, природные красители полностью экстрагировались 80%-м раствором спирта в условиях выбранного метода экстракции.
Результаты извлечения крахмала в томатной пасте
Таблица 3
|
Массовая доля добавленного крахмала, X добавки, % |
Массовая доля найденного крахмала, x пробы + добавки , i , % |
Степень извлечения крахмала W i , % |
Среднее значение массовой доли найденного крахмала x пробы + добавки , % |
СКО S X пробы+добавки , % при n = 6 |
Границы доверительного интервала ±Δ X пробы+добавки , % при Р = 0,95 |
|
2,18 |
1,97 |
90,36 |
2,07 |
0,25 |
0,27 |
|
1,98 |
90,82 |
||||
|
2,39 |
109,63 |
||||
|
2,38 |
109,17 |
||||
|
1,77 |
81,19 |
||||
|
1,94 |
88,99 |
Как видно из таблицы 3, степень выхода добавленного крахмала была высокой и составила в среднем 95 %, с погрешностью в пределах 0,3 %.
Выводы
-
1. Изучены параметры экстракции свободных углеводов и гидролиза крахмала на их модельной смеси. Предложено проводить экстракцию свободных углеводов 80%-м водным раствором этанола, а гидролиз 5%-м раствором серной кислоты в течение 15 минут.
-
2. Разработана комплексная доступная методика количественного определения крахмала в томатопродуктах с использованием антронового реактива спектрофотометрическим методом, которая позволяет определять крахмал в присутствии других моно-, дисахаридов и природных красителей с приемлемой для практических задач погрешностью, не превышающей 0,3 %, при степени извлечения крахмала в пределах 81–109 %. Предел обнаружения метода составляет 0,03 мг в 2 см3 крахмала в анализируемом образце.
Список литературы Спектрофотометрическое определение крахмала в томатных продуктах с антроновым реактивом
- Химический состав пищевых продуктов: справочник/под ред. И.М. Скурихина, М.Н. Волгарева. -М.: Агропромиздат, 1987. -С. 329.
- ГОСТ 3343-2017. Продукты томатные концентрированные. Общие технические условия. -М.: Изд-во стандартов, 2017.
- ГОСТ 32063-2013. Кетчупы. Общие технические условия. -М.: Изд-во стандартов, 2013.
- ГОСТ Р 54347-2011. Продукты переработки фруктов и овощей. Качественный метод выявления присутствия крахмала в томатопродуктах. -М.: Изд-во стандартов, 2011.
- ГОСТ Р 54759-2011. Продукты переработки молока. Методы определения массовой доли крахмала. -М.: Изд-во стандартов, 2011.
- ГОСТ 10574-2016. Продукты мясные. Методы определения крахмала. -М.: Изд-во стандартов, 2016.
- ГОСТ ISO 15914-2016. Корма для животных. Ферментативный метод определения содержания общего крахмала. -М.: Изд-во стандартов, 2016.
- Brunt K., Sanders P., Rozema T. 1998. The enzymatic determination of starch in food, feed, and raw materials of the starch industry. -Starke (Starch) 50 (10). -P. 413-419.
- Bernetti R., Kochan D., Trost V., Young S. 1990. Modern methods of analysis of food starches. Cereal Foods World 35. -S. 1100-1105. Jarvis C.E., Walker J.R.L. 1993.
- Simultaneous, rapid, spectrophotometric determination of total starch, amylose and amylopectin. Journal of the Science of Food and Agriculture 63. -S. 53-57.
- Henshall A. 1996. Analysis of starch and other complex carbohydrates by liquid chromatography. Cereal Foods World 41 (5). -S. 419-424.
- Ovando M., Whitney K., Simsek S. 2013. Analysis of starch in food systems by high performance size exclusion chromatography. Journal of Food Science 78. -S. 192-198.
- Определение сахаров спектрофотометрическими методами/И.А. Самылина //Фармация. -2009. -№ 4. -С. 3-5.
- Clegg K.M. 1956. The application of the anthrone reagent to the estimation of starch in cereals//Journal of the Science of Food and Agriculture 7. -P. 40-44.
- ГОСТ Р 8.736-2011. Государственная система обеспечения единства измерений. Измерения прямые многократные. Методы обработки результатов измерений. Основные положения. -М.: Изд-во стандартов, 2011.
- PUBL-TS-056-96 Laboratory Guide for Determining Method Detection Limits, Wisconsin Department of Natural Resources. Laboratory Certification Program, April 1996.
- ГОСТ 26176-91. Корма, комбикорма. Методы определения растворимых и легкогидролизуемых углеводов. -М.: Изд-во стандартов, 1991.
- Оленников Д.Н., Танхаева Л.М. Методика количественного определения группового состава углеводного комплекса растительных объектов//Химия растительного сырья. -2006. -№ 4. -С. 29-33.


