Способ оптимизации состава и свойств культуральной среды для репродукции вирусов
Автор: Хазиев Л.Р., Глаголева И.С., Плотникова Э.М., Гурьянов Н.И., Хамзина Е.ю, Кириллова Ю.М.
Статья в выпуске: 3 т.211, 2012 года.
Бесплатный доступ
Определена возможность репродукции вирусов ИРТ крупного рогатого скота на перевиваемой культуре клеток ЛЭК, выращенной на ростовой среде 0,5%-ный ГЛА на основе раствора Хэнкса с 10-тью% сыворотки крови бычков. При культивировании вируса ИРТ было выявлено снижение инфекционной активности на 1 lg ТЦД50/мл в опыте по сравнению с контролем.
Культура клеток, репродукция вирусов, перевиваемая, гидролизатлактальбумина, дрожжевой экстракт
Короткий адрес: https://sciup.org/14287576
IDR: 14287576 | УДК: 619:611.018.54:591.111
Текст научной статьи Способ оптимизации состава и свойств культуральной среды для репродукции вирусов
Актуальность проблемы: В решении современных как теоретических, так и практических проблем ветеринарной биотехнологии, значительное место занимает культивирование клеток in vitro [1]. Они являются важным объектом при проведении вирусологических, биохимических, молекулярно-генетических и других исследований. В связи с этим актуальна проблема разработки условий наиболее эффективного их выращивания [5].
Необходимо отметить, что во время становления технологии культур клеток для их выращивания использовали сначала простые среды или даже физиологический раствор с применением в качестве биологических добавок сывороток крови животных или гидролизатов животного и растительного происхождения [3]. Наибольшее применение в это время для культивирования клеток имела среда 0,5 % гидролизата лактальбумина (ГЛА) на растворе Хэнкса с добавлением в нее 10% сыворотки крови животных. Данная среда была универсальной для большинства первичных культур клеток сельскохозяйственных животных. Но для отдельных линий клеток млекопитающих, в том числе человека, в дальнейшем разработаны специальные среды, обеспечивающие оптимальный рост этих клеток или возможность их культивирования в бессывороточной среде [2].
В 2009 году в ФГБУ «ФЦТРБ-ВНИВИ» поступили серии сухих гидролизата лактоальбумина и дрожжевого экстракта фирмы «Sigma», негативно влияющие как на пролиферацию, морфологию клеток животного происхождения, так и репродукцию в них вирусов инфекционных заболеваний животных [4]. Посев профильтрованного готового 0,5%-ного ГЛА на растворе Хенкса на стандартные бактериальные и микоплазменные среды не выявил контаминантов. Мы были поставлены перед дилеммой: данные сухие компоненты культуральной питательной среды содержат в своем составе или микроорганизмы, не обнаруживаемые при бакпосевах и проходящие через стерилизующие фильтры, или вещества, ингибирующие пролиферацию клеток, что в свою очередь ведет к снижению накопления в них вирусной массы.
Общеизвестно, что надежным способом стерилизации биологических жидкостей и сухих веществ является их γ-облучение, но, оно, кроме того, вызывает изменения структуры белков, ферментов, аминокислот, с последующей активацией ферментов метаболизма, катализирующих обмен веществ, даже у растений, человека и животных.
Цель данной работы состояла в том, чтобы некачественные серии гидролизата лактоальбумина и дрожжевого экстракта были пригодны для производства культуральных питательных сред, используемых при выращивании клеток животного происхождения, которые служат субстратом для репродукции вирусов при производстве вакцин и диагностикумов против заболеваний животных.
Для устранения возможной микробной контаминации и изменения структуры дрожжевого экстракта и гидролизата лактоальбумина проведено их γ-облучение на установке «Исследователь», при этом перед нами не стояло задачи в изучении изменения структуры данных биологически активных веществ.
В связи с вышеизложенным была проведена работа по экспериментальному обоснованию возможности культивирования перевиваемой линии клеток ЛЭК (легкое эмбриона коровы) на питательной среде, основой которой являлась среда ГЛА, содержащий, облученные гидролизат лактоальбумина и дрожжевой экстракт, а также репродукции в этих клетках вируса ИРТ крупного рогатого скота.
Материалы и методы. Исследования проводили в лабораториях культур клеток и гибридомной технологии и радиобиологии – гамма-стерилизацию гидролизата лактоальбумина и дрожжевого экстракта на установке «Исследователь» в дозах 700 Гр, 3006 Гр, 10000 Гр ФГБУ «ФЦТРБ-ВНИВИ».
Тестовую клеточную культуру ЛЭК /LEK – перевиваемая культура легкого эмбриона крупного рогатого скота/ культивировали на среде, содержащей 90% ГЛА на основе раствора Хэнкса, 10% сыворотки крови крупного рогатого скота (КРС) с добавлением классического комплекса антибиотиков при 370C до получения полного монослоя в течение нескольких последовательных пассажей. В качестве контроля была та же линия клеток, но выращенная на питательной среде Игла МЕМ с 10-тью% бычьей сыворотки крови. Инфекционную активность вирусов определяли титрованием в культуре клеток ЛЭК. Титр вируса вычисляли по методу Рида и Менча. Было проведено 4 последовательных пассажа вирусов с последующим определением их титра.
Результаты исследований. Адаптация перевиваемой культуры ЛЭК в лаборатории культур клеток и гибридомной технологии ФГБУ «ФЦТРБ-ВНИВИ» в течение 40 последовательных пассажей в питательной среде
ГЛА с необлученным гидролизатом лактальбумина и дрожжевым экстрактом привела к появлению в монослое длительно не зарастающих «окон», а также нечеткости клеточных границ, изменению морфологии клеток (рис.1Б). В ходе опытов показано, что при культивировании ЛЭК в ростовой среде на основе ГЛА происходит сдвиг рН в кислую сторону уже через 24ч инкубации. Ростовые среды на основе МЕМ и ГЛА, используемые нами в ходе эксперимента, различаются между собой по значению буферной емкости.
При γ-облучении дрожжевого экстракта и гидролизата лактальбумина на установке «Исследователь» хорошие результаты были достигнуты при дозах 1000000 рентген.
После выращивания культуры клеток LEK на среде с облученными гидролизатом лактальбумина и дрожжевым экстрактом, морфология их восстанавливается и становится аналогичной, как и на контрольной среде, что видно на рис.1 А.
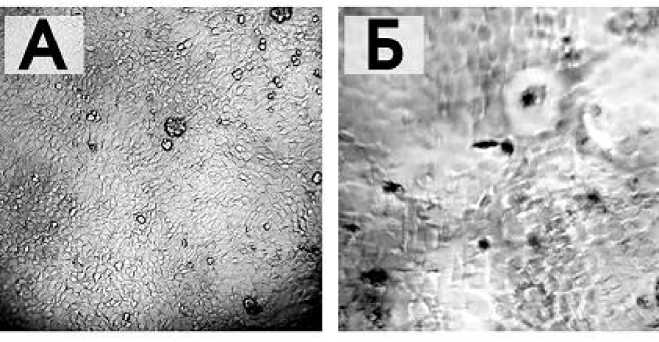
Рис.1. Монослой ЛЭК через 48ч культивирования на контрольной (А) и опытной (Б) среда ГЛА до облучения ее компонентов Ок.×10, об. ×10.
Показано, что инфекционная активность вируса ИРТ на культуре клеток ЛЭК, выращенных на опытной среде ГЛА с облученными компонентами составляла 5,5 lg ТЦД 50/мл , в то время как в контроле она была 6,5 lg ТЦД 50/мл . По литературным данным, вирус ИРТ предпочитает щелочную рН (от 7,3 до 9,0) среды. При репродукции вируса ИРТ на культуре клеток ЛЭК, выращенной с использованием ростовой среды ГЛА через 72 ч рН становится ниже 6,0, что снижает репродукцию вышеперечисленных инфекционных агентов. Добавлением в культуральную среду ГЛА 9%-ного бикарбоната натрия в процессе культивирования клеток нам удалось повысить инфекционную активность вируса ИРТ на 0,75 lg ТЦД 50/мл , доведя ее до 6,25 lg ТЦД 50/мл .
Заключение. Результатами проведенных исследований установлено, что серии сухих гидролизата лактальбумина и дрожжевого экстракта, полученные в ФГБУ «ФЦТРБ-ВНИВИ» и используемые для приготовления среды ГЛА непригодны без их предварительного облучения на гамма - установке «Исследователь». Эти компоненты, по всей вероятности, содержат в своем составе или не обнаруживаемые при бакпосевах микроорганизмы, или вещества, ингибирующие пролиферацию клеток, что в свою очередь ведет к снижению накопления в них вирусной массы. Гамма облучение гидролизата лактальбумина и дрожжевого экстракта, используемых для приготовления культуральной среды способствует улучшению пролиферации, стабилизации морфологии культуры клеток ЛЭК и репродукции на них вируса ИРТ крупного рогатого скота. Увеличивая буферную емкость среды ГЛА, содержащей облученные биологически активные компоненты, бикарбонатом натрия, в процессе культивирования клеток, нам удалось повысить репродукцию вируса ИРТ крупного рогатого скота на клетках ЛЭК до 6,25 lg ТЦД50/мл, что лишь незначительно ниже, чем на клетках, выращенных на среде Игла МЕМ.
Таким образом, при культивировании клеток ЛЭК и репродукции вируса ИРТ крупного рогатого скота дорогостоящую среду Игла МЕМ можно успешно заменить средой 0,5%-ным ГЛА на растворе Хенкса с 10-тью % сыворотки крови бычков.
ЛИТЕРАТУРА: 1. Дьяконов, Л.П. Животная клетка в культуре (Методы и применение в биотехнологии)/ Под ред. проф. Л.П. Дьяконова, проф. В.И. Ситькова – М.: Компания Спутник+. - 2000. – 400 с. 2. Методы культивирования клеток. - под ред.: Г.П. Пинаева, М.С.Богдановой. – СПб.: Изд-во Политехн. ун-та. - 2008.-278с. 3. Плотникова, Э.М.
Возможность репродукции вирусов на перевиваемой культуре клеток ЛЭК, выращенной на ростовой среде гидролизатлактальбумина на основе раствора Хенкса/ Э.М. Плотникова, Н.И. Гурьянов, И.М. Ганиев, Е.Ю. Хамзина, Ю.М Кириллова// Межд.научно-практ.конф. «Сучаснi системи бiобепеки та бiозахисту у ветеринарнiй медицинi»20-24 вересня 2010р.-Феодосия, Крым. – 2010. 4. Плотникова, Э.М. Новые питательные среды для культивирования клеток животного происхождения и вирусов/ Э.М. Плотникова, Н.И. Гурьянов и др.// Биотехнология: состояние и перспективы развития. - Материалы конгресса. - М. – 2011. - Ч.1. - С.206207. 5. Цыренов, В.Ж. Основы биотехнологии: культивирование клеток человека и животных/ В.Ж. Цыренов – Улан-Удэ: ВСГТУ. - 2005. – 48 с.
СПОСОБ ОПТИМИЗАЦИИ СОСТАВА И СВОЙСТВ КУЛЬТУРАЛЬНОЙ СРЕДЫ ДЛЯ РЕПРОДУКЦИИ ВИРУСОВ
Хазиев Л.Р., Глаголева И.С., Плотникова Э.М., Гурьянов Н.И., Хамзина Е.Ю, Кириллова Ю.М.
Резюме
Определена возможность репродукции вирусов ИРТ крупного рогатого скота на перевиваемой культуре клеток ЛЭК, выращенной на ростовой среде 0,5%-ный ГЛА на основе раствора Хэнкса с 10-тью% сыворотки крови бычков. При культивировании вируса ИРТ было выявлено снижение инфекционной активности на 1 lg ТЦД50/мл в опыте по сравнению с контролем.
WAY OF OPTIMIZATION OF STRUCTURE AND PROPERTIES OF THE KULTURALNY ENVIRONMENT FOR A REPRODUCTION OF VIRUSES
Khaziev L.R., Glagoleva I.S., Plotnikova E.M., Gurianov N.I., Khamzina E.Y., Kirillova J.M.


