Способы обнаружения инфицированности семян подсолнечника патогенной микофлорой
Автор: Пивень В.Т., Мурадасилова Н.В., Шуляк И.И., Алифирова Т.П.
Рубрика: Защита и иммунитет
Статья в выпуске: 2 (155-156), 2013 года.
Бесплатный доступ
Проведены исследования по выявлению более полного патогенного комплекса семян подсолнечника и локализации возбудителей болезней в тканях плода с помощью разработанных нами методов фитоэкспертизы. Выявлено, что более достоверные результаты получаются при анализе ядер семянок, инкубированных на картофельно-глюкозном агаре при переменных температурах в интервале от 18 до 25 °C в течение более длительного времени - до 14-15 суток. За это время успевают появляться не только колонии быстро растущих грибов Alternaria spp., Fusarium spp., Sclerotinia sclerotiorum, Sclerotium bataticola, но и колонии грибов с более компактным мицелием - Verticillium dachliae, Phomopsis spp. Усовершенствованный нами метод фитоэкспертизы Н.А. Наумовой (1960) эффективен при выделении возбудителей фомопсиса, белой гнили из семян, собранных с растений подсолнечника с пораженным стеблем при отсутствии симптомов болезни на корзинках.
Семена подсолнечника, фитоэкспертиза семян, патогенная микофлора, поверхностная и внутренняя инфекция, скрытый патогенез
Короткий адрес: https://sciup.org/142151135
IDR: 142151135 | УДК: 632.4:633.854.78:631.531.172
Текст научной статьи Способы обнаружения инфицированности семян подсолнечника патогенной микофлорой
Введение. Зараженность семян микроорганизмами является одной из важнейших причин ухудшения их посевных качеств и возникновения болезней на вегетирующих растениях. О значении патогенов, переносимых с семенами, свидетельствуют многочисленные публикации [1; 2; 3; 4; 5; 6; 7].
Семена подсолнечника тоже являются благоприятным субстратом для развития многообразной микофлоры, состоящей главным образом из грибов [8; 9; 10; 11; 12; 13; 14; 15].
Анализ состояния вопроса показал, что в отечественной и мировой практике изу- чают поверхностную (внешнюю) и внутреннюю патогенную микофлору семян подсолнечника. Поверхностная инфекция включает в себя пропагулы грибов, локализующиеся на поверхности перикарпа, а внутренняя – соответственно находящиеся в тканях перикарпа и зародыша семени.
В настоящее время общеизвестным методом фитоэкспертизы является метод Наумовой (ГОСТ–12044-81) [9], с помощью которого зараженность семян подсолнечника выявляют при помещении их во влажную камеру, инкубируя при постоянной температуре 25 ºС в течение срока (5 суток), установленного для определения всхожести семянок по ГОСТ – 12038-84. Поверхность семянок перед закладкой во влажную камеру предварительно дезинфицируют.
Эффективная защита всходов подсолнечника от болезней обеспечивается правильным подбором фунгицидных составов на основе результатов той фитоэкспертизы, которая более полно отражает видовой состав патогенного комплекса семян и локализацию инфекционного начала возбудителей болезней в тканях плода, поэтому модификация уже существующей методики актуальна.
На сегодняшний день остро стоит вопрос защиты подсолнечника от широко распространенных и вредоносных болезней, таких как ложная мучнистая роса (ЛМР), белая, серая, пепельная и сухая гнили, фузариоз, альтернариоз, фомопсис, требующий более глубокого изучения передачи их семенами.
Материалы и методы. В своих исследованиях, для более точного разделения поверхностной и внутренней инфекций, в отличие от общепринятого метода мы отдельно изучали микофлору плодовой оболочки и семени. Стерилизацию семянок, предварительно смоченных в спирте, осуществляли обжигом в пламени спиртовки. Из средней пробы анализировали по 100 штук семянок в 3 повторностях. Ядра и лузгу отдельно помещали на кар- тофельно-глюкозный агар (КГА) в чашки Петри по 10 штук в каждую и инкубировали их при колебании температуры от 18 до 25 ºС в течение 15 суток. Первый учет проводили через 7 суток, второй – через 15. После образования колоний грибы идентифицировали по характерным видовым признакам, используя определители [16; 17]. В каждой чашке Петри подсчитывали количество плодовых оболочек и ядер семянок, несущих инфекционное начало возбудителя той или иной болезни, а затем вычисляли процент их зараженности каждым видом возбудителя отдельно.
Результаты и обсуждение . Предложенные нами условия для проведения этой фитоэкспертизы позволили расширить спектр выделяющихся из семянок возбудителей болезней и дать возможность определить наличие инфекционного начала в ядре семянки. При использовании нашей методики удалось получить более объективные данные при выделении инфекционного начала возбудителей фомопсиса и белой гнили из семян с растений подсолнечника при пораженном стебле и отсутствии симптомов болезней на корзинках (табл. 1).
Таблица 1
Сравнение методов выделения грибов – возбудителей фомопсиса и белой гнили из семян растений подсолнечника при отсутствии симптомов болезней на корзинках
Краснодар, ВНИИМК, 2007–2008 гг.
|
Вариант опыта |
Пораженность семян грибами, % |
|||||
|
Метод Н.А. Наумовой (целые семянки) |
Модифицированный метод |
|||||
|
Phomopsis spp. |
Scle-roti-nia scle-rotio-rum (Lib) . de Bary |
ядро |
плодовая оболочка |
|||
|
Phomopsis spp. |
Scle-roti-nia scle-rotio-rum |
Phomopsis spp. |
Scle-roti-nia scle-ro-tio-rum |
|||
|
Семена с растений, при пораженном стебле: фомопсисом |
4,5 |
- |
15,0 |
- |
3,4 |
- |
|
белой гнилью |
- |
0 |
- |
6,8 |
- |
0 |
Из данных, представленных в таблице 1, видно, что по методу Н.А. Наумовой, ин- фекционное начало фомопсиса выделено из 4,5 % семянок. При раскладывании на агар отдельно ядер и плодовых оболочек получен совершенно другой, резко отличающийся результат: в среднем в 3,3 раза превышающий предыдущий и показывающий, что у большинства семянок инфекционное начало возбудителя болезни сосредоточено в ядрах – 15,0 %.
При выделении гриба Sclerotinia scle-rotiorum (Lib.) de Bary из семян растений подсолнечника, пораженных прикорневой и стеблевой формами проявления белой гнили, были использованы такие же подходы в модификации, но приоритетным фактором являлось применение переменных температур от 18 до 25 ºС. Только при таких условиях ведения фитоэкспертизы у 6,8 % ядер семянок на 14–15-е сутки мицелий возбудителя склеротинио-за с формирующимися на нем склероция-ми начинает пробиваться поверх ранее выросших колоний грибов.
Для определения скрытой инфекции возбудителей болезней подсолнечника использовали метод истощения проростков. Основу для этого метода предложила Е.М. Долгова [18]. Суть его в следующем: семена подсолнечника раскладывают на влажную фильтровальную бумагу. Через 5 суток проводят учет на всхожесть и поражение патогенами. Здоровые, без признаков болезней проростки помещают в дистиллированную воду. Лишаясь элементов минерального питания, патогены, развивающиеся в скрытой форме, вынуждены добывать их, подключая свою ферментативную систему. Побурение тканей гипокотилей проростков или появление на них перетяжек свидетельствует о начале патологического процесса и о наличии в них инфекционного начала возбудителей болезней. С помощью разработанного метода Долгова обнаружила, что внешне здоровые проростки подсолнечника могут нести инфекционное начало белой, серой и сухой гнилей, альтернариоза и фузариоза.
Анализируя более поздние публикации многих зарубежных авторов по выявлению скрытого заражения семян различных культур, в основном вирусами (табак, огурцы, сахарный тростник, кукуруза) [19; 20; 21; 22], мы пришли к выводу, что метод Долговой является для нас наиболее приемлемым (как более доступный, дешевый в исполнении), но нуждающимся в модификации.
В эксперименте мы использовали семена подсолнечника, всхожесть которых приближалась к 100 %. Семянки раскладывали на увлажненную фильтровальную бумагу в два ряда в шахматном порядке. Сверху накрывали этой же бумагой, заворачивали в рулоны и устанавливали в сосуды, заполненные стерильной водой на 2– 3 см. На 7-е сутки внешне здоровые проростки с развитым главным корнем и боковыми корешками помещали в стаканы с дистиллированной водой. Культивировали в диапазоне температур, с медленным понижением их в ночное время – до 18 ºС, и повышением в дневное – до 25–26 ºС. Учет количества больных проростков проводили через 9–10 суток. Пораженные участки гипокотилей с граничащей с ними здоровой тканью помещали в стерильные чашки Петри на стерильную увлажненную стерильной водой фильтровальную бумагу и инкубировали при переменных температурах (18–25 ºС) до появления спороношения или формирования плодовых структур. Видовую принадлежность патогенов устанавливали микроскопированием. Количество скрыто инфицированных семян определяли по отношению к общему количеству заложенных в рулоны.
За счет использованного нами режима переменных температур удалось выявить более широкий спектр болезней, инфекционное начало возбудителей которых выделено из внешне здоровых проростков. Впервые обнаружено скрытое инфицирование семян подсолнечника возбудителями фомопсиса по образующимся на некрозах гипокотилей пикнидам (рис. 1), при созревании которых формировались или только ß-споры в случае идентификации вида Phomopsis helianthi Munt.-Cvet., или ß- и α-споры в случае идентификации вида Ph. arctii Lash.
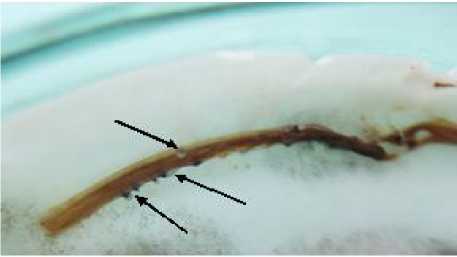
Рисунок 1 – Гипокотиль проростка подсолнечника с симптомами скрытого патогенеза фомопсиса (стрелками указаны созревшие пикниды) (ориг.)
Кроме того, впервые выявлено скрытое инфицирование семян подсолнечника грибом, идентифицированным ранее как Alter-naria consortiale (Thiim.) Hughes по микросклероциям и конидиям (рис. 2); возбудителем вертициллеза Verticillium dahliae Kleb. – по мицелию и спороношению; возбудителем ЛМР – по хлоротичным пятнам на лицевой стороне семядолей.
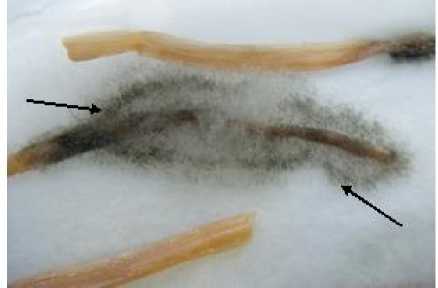
Рисунок 2 – Гипокотиль проростка подсолнечника с симптомами скрытого патогенеза альтернариоза, вызванного грибом Alternaria consortiale (Thiim.) Hughes (стрелками указаны микросклероции гриба) (ориг.)
В таблице 2 приведены данные, полученные с применением модифицированного метода фитоэкспертизы семян подсолнечника на скрытое заражение патогенами.
Таблица 2
Поражение семян подсолнечника сорта Мастер скрытой формой патогенов
Краснодар, ВНИИМК, 2006–2008 гг.
|
Патоген |
Скрытый патогенез, % |
|||
|
2006 г. |
2007 г. |
2008 г. |
среднее за 3 года |
|
|
Alternaria spр ., в т.ч. A. consortiale (Thiim.) Hughes |
94,7±1,3 24,0±2,5 |
82,0±2,2 26,0±2,5 |
92,7±1,5 27,0±2,6 |
89,8±1,7 25,7±2,5 |
|
Fusarium spр. |
9,7±1,7 |
4,7±1,2 |
12,0±1,9 |
8,8±1,6 |
|
Botrytis cinerea Pers. |
0 |
0 |
0,3±0,3 |
0,1±0,1 |
|
Sclerotinia sclerotiorum (Lib.) de Bary |
0 |
0 |
0,3±0,3 |
0,1±0,1 |
|
Phomopsis spp. |
0,3±0,3 |
0,3±0,3 |
1,0±0,6 |
0,5±0,4 |
|
Verticillium dahliae Kleb. |
0,7±0,5 |
0,3±0,3 |
0,7±0,5 |
0,6±0,5 |
|
Rhizopus spp. |
0,3±0,3 |
2,7±0,9 |
1,0±0,6 |
1,3±0,7 |
Наибольшее развитие на гипокотилях проростков подсолнечника получили грибы – представители рода Alternaria . Скрытый патогенез альтернариоза в среднем за три года выявлен у 89,8 % проростков, из них Alternaria consortiale – 25,7 %.
Признаки скрытого инфицирования возбудителями фомопсиса выявлены в среднем у 0,5 % семян; возбудителями фузариоза – у 8,8 %. В незначительном количестве (0,3 %) выявлена скрытая форма возбудителей серой и белой гнилей в семенах урожая 2008 г. В среднем за три года исследований инфекционное начало грибов Verticillium dahliae и Rhi-zopus spp. было обнаружено на некрозах проростков в 0,6 и 1,3 % случаев соответственно.
На ранних этапах изучения ЛМР ученые были заинтересованы таким явлением, как отсутствие симптомов болезни на растениях подсолнечника, полученных из больных семян. Впервые ответ на этот вопрос был дан Н.С. Новотельновой [23], открывшей скрытый патогенез ложной мучнистой росы, что сыграло положительную роль в решении вопроса о передаче болезни семенами. Для обнаружения скрытой инфекции возбудителя болезни ею был предложен метод, в основе которого лежало выращивание подсолнечника из семян пораженных растений в полевых условиях. При этом необходимым являлось исключение возможности инфицирования подсолнечника через почву и анемофорным путем. Корни выросших внешне здоровых растений, достигших 7 пар настоящих листьев, закладывали во влажную камеру. О наличии болезни судили по образующемуся на них спороно-шению гриба. Позднее О.И. Тихоновым [24] был предложен метод, согласно которому, скрытое течение ЛМР выявляли при просмотре продольных срезов стеблей внешне здоровых растений подсолнечника. При наличии возбудителя болезни область корневой шейки имела желтовато-коричневую окраску. Эти методы не нашли широкого применения при оценке семян подсолнечника на зараженность ЛМР из-за сложности в исполнении.
В наших исследованиях методику определения инфицированности семян подсолнечника возбудителем ЛМР – грибом Plasmopara helianthi Novot. отрабатывали на семенах, полученных с растений, пораженных разновидностью второй и пятой форм болезни. Семянки проращивали во влажных рулонах в течение 7 дней при суточном диапазоне температур с медленным понижением их в ночное время – до 16 ºС, и повышением в дневное – до 22 ºС. После учитывали количество проростков с визуальными симптомами ЛМР. У проростков семян растений со второй формой болезни таковыми являлись бурые некрозы на границе корня с гипокотилем, а у проростков семян растений с пятой формой – коричневокирпичного цвета штрихи вдоль гипокотиля и обеих сторон семядолей. Корни были лишены боковых корешков и имели такой же коричнево-кирпичный цвет (рис. 3).
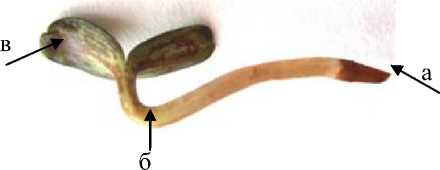
Рисунок 3 – Проросток подсолнечника с визуальными признаками ЛМР, полученный из семян растений с симптомами пятой формы болезни (ориг.): а – не развившийся от концентрации патогена корешок проростка;
б – гипокотиль проростка с локализацией патогена в виде некрозов;
в – семядоли проростка с локализацией патогена в виде некрозов
За основу определения скрытого инфицирования семян облигатным патогеном Pl . helianthi был также взят метод «истощения» Внешне здоровые 7-дневные проростки без признаков болезни мы помещали в сосуды с дистиллированной водой и вели за ними ежедневное наблюдение. Соблюдая диапазон температур (16–22 ºС), начиная с пятых суток экспозиции, учитывали проростки с хлоротичными пятнами на лицевой стороне семядолей (рис. 4).

Рисунок 4 – Семядоли подсолнечника с симптомами скрытого течения ложной мучнистой росы (ориг.):
а – семядоли здорового проростка;
б – деформированные семядоли больного проростка с хлоротичными пятнами
Микроскопирование срезов тканей в области некрозов и хлорозов подтверждало наличие гиф гриба Pl . helianthi . Окончательный учет скрытого инфицирования проводили через 7–8 суток после помещения проростков в воду. В каждом варианте подсчитывали общее количество пораженных ЛМР семянок, суммируя проростки с видимыми симптомами и проростки с симптомами скрытого течения болезни.
Разработанный нами лабораторный метод обнаружения инфекционного начала ЛМР в семенах подсолнечника, по сравнению с ранее предложенными [23; 24], имел ряд преимуществ: полностью исключалось заражение проростков почвенной и вторичной инфекциями; появилась возможность искусственно поддерживать оптимальные для развития патогена и проявления болезни режимы влажности и температуры, которые в полевых условиях в период вегетации подсолнечника могут отсутствовать. При оптимальном для развития патогена температурном режиме (16–22 ºС) было выявлено наибольшее количество пораженных проростков, в том числе и среди внешне здоровых (табл. 3).
Таблица 3
Инфицированность семян подсолнечника сорта Мастер возбудителем ложной мучнистой росы (лабораторный метод)
Краснодар, ВНИИМК, 2007–2008 гг.
|
Вариант опыта |
Проростки с видимыми симптомами ЛМР (в рулонах), % |
Проростки с симптомами скрытого течения ЛМР (в стаканах с дистиллирован-ной водой), % |
Всего поражен-ных ЛМР проростков, % |
|
Семена с растений с симптомами раннего проявления ЛМР (разновидность 2-й формы) |
49,5 |
50,5 |
100 |
|
Семена с растений с симптомами позднего проявления ЛМР (5-я форма) |
31,5 |
14,8 |
46,3 |
|
Контроль (семена со здоровых растений) |
0 |
0 |
0 |
Проростки подсолнечника, выращенные из семян растений, пораженных второй формой болезни, заражены в 100 % случаев, с растений с поздней формой проявления болезни – в 46,3 % случаев, из них проростков с симптомами скрытого заражения – 50,5 и 14,8 % соответственно.
Проводимая нами лабораторная диагностика впервые позволила выявлять количество инфицированных ЛМР семян не только по проросткам со скрытым течением болезни, но и по проросткам с видимыми симптомами поражения, которые не обнаруживались в проводимых ранее полевых исследованиях [23]. В наших опытах проростки, полученные из семян растений с симптомами разновидности 2-й формы, несли такие признаки ЛМР в 49,5 % случаев, а из семян растений с симптомами 5-й формы – в 31,5 % случаев.
Таким образом, предложенный нами метод за счет суммирования проростков с видимыми симптомами поражения и с симптомами скрытого течения болезни позволил выявлять большее количество семян, несущих инфекционное начало Plasmopara helianthi, по сравнению с ранее существующими методами.
Выводы. 1 . Существующая стандартизованная методика Н.А. Наумовой (1960) позволяет выявлять в основном инфицирование поверхностных тканей семян подсолнечника.
-
2. Модифицированная нами методика Н.А. Наумовой позволяет выделять из ядра семянки возбудителей болезней, которые при наличии благоприятных условий приводят к заболеванию проростков и взрослых растений подсолнечника.
-
3. Использование режима переменных температур и метода истощения позволяет более полно выявлять численный и видовой состав патогенной микофлоры во внешне здоровых проростках.
-
4. Разработанный нами лабораторный метод обнаружения семян подсолнечника, несущих инфекционное начало возбудителя ложной мучнистой росы, позволяет быстрее, качественнее и более
полно выявлять степень инфицированно-сти семенного материала ЛМР.


