Сравнение гибких и жестких колец для коррекции функциональной трикуспидальной недостаточности: две разные модели обратного ремоделирования правых отделов сердца
Автор: Овчаров М.А., Богачев-прокофьев А.В., Астапов Д.А., Пивкин А.Н., Малоземов К.С., Подсосникова Т.Н., Малахова О.Ю., Караськов А.М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.34, 2019 года.
Бесплатный доступ
Цель: сравнение моделей обратного ремоделирования правых отделов сердца после пластики трикуспидального клапана (ТрК) жесткими и гибкими кольцами.Материал и методы. В период с сентября 2016 г. по февраль 2018 г. 308 пациентов без существенных различий в клиническом статусе, имеющих показания к вмешательству на митральном клапане (МК) и сопутствующую трикуспидальную недостаточность (ТрН), были рандомизированы на две группы. Пациентам обеих групп выполнено вмешательство на МК с одномоментной коррекцией ТрН жестким кольцом (Rigid группа, n=154) или гибким кольцом (Flex группа, n=154) Результаты. Периоперационная летальность составила 2,0% в Rigid группе и 2,5% в Flex группе (р=0,504). Не было обнаружено разницы в частоте имплантации кардиостимулятора (5,1 против 2,6%, р=0,238). Свобода от возвратной ТрН за период наблюдения 12 мес. была сопоставима (96,7% в Rigid группе vs 96,1% в Flex группе; р=0,521). При оценке глобальной систолической функции правого желудочка (ПЖ) фракционного изменения площади (ФИП); фракции выброса (ФВ) у пациентов обеих групп отмечен статистически значимый рост (р
Эхокардиография, пластика трикуспидального клапана, обратное ремоделирование, трикуспидальная недостаточность
Короткий адрес: https://sciup.org/149125305
IDR: 149125305 | УДК: 616.126.46-089.844-77:616.123 | DOI: 10.29001/2073-8552-2019-34-2-89-98
Текст научной статьи Сравнение гибких и жестких колец для коррекции функциональной трикуспидальной недостаточности: две разные модели обратного ремоделирования правых отделов сердца
Умеренная и выраженная трикуспидальная недостаточность (ТрН) часто встречается у пациентов с заболеваниями клапанов левых отделов сердца [1]. ТрН, как правило, связана с дилатацией фиброзного кольца трикуспидального клапана (ТрК), возникающей как результат дилатации/дисфункции правых отделов сердца при отсутствии патологии створок ТрК и его подклапанного аппарата [2]. Согласно текущим рекомендациям, пациентам, которые подвергаются операциям на аортальном или митральном клапане (МК) [3], вмешательство на ТрК показано в случае умеренной либо выраженной ТрН. Однако поскольку кольцо ТрК имеет сложную геометрию [4], анатомические параметры, прежде всего дилатация фиброзного кольца ТрК (диаметр более 21 мм/м2 или диаметр более 70 мм), является показателем, при котором можно выполнять профи- лактическую аннулопластику ТрК, в том числе у пациентов без выраженной ТрН. Некорригированная умеренная ТрН после операции является фактором прогрессирующей сердечной недостаточности (СН) [5]. Повторные вмешательства по поводу возвратной ТрН увеличивают смертность [6]. Аннулопластика ТрК традиционно выполнялась с использованием шовных методик (De Vega). За последние 20 лет появилось большое количество устройств (жесткие кольца различной конструкции и формы, гибкие кольца), которые применяются все шире. К тому же прямое сравнение шовной пластики с устройствами для ан-нулопластики говорит об однозначно большей эффективности последних [7]. Если же учитывать сложную форму и физиологию ТрК, то вопрос о влиянии того или иного устройства на такие результаты, как свобода от возвратной ТрН и ремоделирование правых отделов сердца остается открытым [8].
Цель исследования: оценка свободы от возвратной ТрН (умеренной и выраженной), ремоделирования правых отделов сердца после пластики ТрК двумя разными устройствами.
Материал и методы
Исследование включало анализ данных взрослых пациентов, оперированных по поводу порока МК и сопутствующей ТрН в период с сентября 2016 г. по февраль 2018 г. Пациенты были рандомизированы в соответствии с простой процедурой рандомизации согласно компьютерным случайным числам за день до операции. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации. Протокол исследования был одобрен этическим комитетом Национального медицинского исследовательского Центра имени академика Е.Н. Мешалки-на Министерства здравоохранения Российской Федерации. До включения в исследование все участники предоставили письменное информированное согласие.
Включенные в исследование пациенты случайным образом распределялись на две группы. В первой группе (Rigid группа) пациентам выполнена операция на МК с пластикой ТрН путем имплантации жесткого кольца (МедИнж АТ 11 ЗАО НПП МедИнж, Пенза, Россия); во второй группе операция путем имплантации гибкого кольца (МедИнж АТ 13 ЗАО НПП МедИнж, Пенза, Россия).
Конечные точки включали оценку свободы от возвратной ТрН (умеренной и выраженной) и ремоделирования правого желудочка (ПЖ) через 12 мес. после операции. По основным антропометрическим данным не выявлено различий между группами (табл. 1).
Таблица 1. Характеристика пациентов до операции
Table 1. Characteristics of patients before surgery
|
Характеристики |
Группа Rigid |
Группа Flex |
p |
|
Пол, мужчины, n (%) |
97 (63,2) |
95 (61,4) |
0.814 |
|
Возраст ( M ± SD ), лет |
56,5±9,5 |
57,18±9,2 |
0.088 |
|
Рост ( M ± SD ), см |
167±6,3 |
169±7,1 |
0.067 |
|
ИМТ ( M ± SD ), кг/м2 |
26,7±4,1 |
25,8±4,3 |
0.564 |
|
Степень ТрН до операции: |
|||
|
0 (отсутствует), n (%) |
– |
– |
– |
|
I (невыраженная), n (%) |
– |
– |
– |
|
II (умеренная), n (%) |
96 (62,5) |
94 (61,1) |
0,814 |
|
III/IV (выраженная), n (%) |
58 (37,5) |
60 (38,9) |
0,814 |
|
NYHA, n (%): |
|||
|
I |
9 (5,4) |
6 (3,6) |
0,427 |
|
II |
40 (25,9) |
36 (21,9) |
0,597 |
|
III |
113 (68,9) |
119 (72,5) |
0,427 |
|
IV |
3 (1,82 ) |
4 (1,82) |
0,702 |
|
ФП, n (%) |
115 (74,6) |
106 (68,5) |
0,254 |
|
Форма ФП, n (%): |
|||
|
Пароксизмальная |
14 (12,1) |
11 (10,4) |
0,531 |
|
Персистирующая |
39 (33,9) |
44 (41,5) |
0,521 |
|
Длительно персистирующая |
62 (54,0) |
51 (48,1) |
0,193 |
|
Этиология поражения МК, n (%): |
|||
|
Ревматизм |
|||
|
Дегенеративный порок |
52 (33,7) |
46 (29,9) |
0,462 |
|
Дисплазия |
36 (23,4) |
39 (25,3) |
0,690 |
|
Эндокардит |
59 (38,3) |
64 (41,6) |
0,560 |
|
7 (4,6) |
5 (3,2) |
0,555 |
|
|
Гемодинамические проявления поражения МК, n (%): |
|||
|
Стеноз |
46 (29,8) |
40 (26,0) |
0,446 |
|
Недостаточность |
66 (42,9) |
71 (46,1) |
0,566 |
|
Сочетанный порок |
42 (27,3) |
43 (27,9) |
0,898 |
|
АГ, n (%) |
79 (51,6) |
76 (49,3) |
0,732 |
|
ИБС, n (%) |
18 (11,6) |
20 (13) |
0,729 |
|
Пациенты с ЛГ, n (%) |
44 (28,6) |
39 (25,3) |
0,521 |
|
ФВ ЛЖ ( M ± SD ), % |
55,6±8,2 |
58,0±7,1 |
0,698 |
|
КДО ЛЖ ( M ± SD ), мл |
172,5±44,0 |
169,5±37,0 |
0,594 |
Примечание: данные представлены как среднее стандартное отклонение ( M ± SD ) или n (%); ИМТ – индекс массы тела; ТрН – трикуспидальная недостаточность; NYHA – Нью-Йоркская кардиологическая ассоциация; ФП – фибрилляция предсердий; МК – митральный клапан; АГ – артериальная гипертензия; ИБС – ишемическая болезнь сердца; ФВ ЛЖ – фракция выброса левого желудочка; КДО ЛЖ – конечно-диастолический объем левого желудочка; Rigid – вмешательство на митральном клапане с пластикой трикуспидального клапана жестким кольцом; Flex – вмешательство на митральном клапане с пластикой трикуспидального клапана гибким кольцом. ЛГ – легочная гипертензия.
Note: data are presented as mean±standard deviation ( M ± SD ) or n (%). ИМТ – body mass index; ТрН – tricuspid insufficiency; NYHA – New York Heart Association; ФП – atrial fibrillation; МК – mitral valve; АГ – arterial hypertension; ИБС – coronary artery disease; ФВ ЛЖ – left ventricular ejection fraction; КДО ЛЖ – end diastolic volume of the left ventricle; Rigid – intervention on the mitral valve with tricuspid valve repair with a rigid ring; Flex – intervention on the mitral valve with tricuspid valve repair with a flexible ring. ЛГ – pulmonary hypertension.
Детальное описание критериев включения, а также использованных в настоящем исследовании хирургических технологий на МК, ТрК и особенностей выполнения сочетанных процедур было представлено в ранее опубликованной работе [9].
Двухмерная эхокардиография
Размер ПЖ оценивался путем измерения конечно-диастолического и конечно-систолического размеров ПЖ из апикальной 4-камерной позиции, ориентированной на ПЖ. Размеры правого предсердия (ПП) также определялись из этой позиции.
Оценка функции ПЖ с помощью двухмерной эхокардиографии (2DЭхоКГ) включала вычисление фракционного изменения площади ПЖ (ФИП; FAC), систолической экскурсии кольца ТрК (TAPSE). Данные получены из 4-камерной позиции в М-режиме [10]. Из этой же позиции с использованием пульсового тканевого допплеровского режима производилось определение продольной скорости систолической экскурсии фиброзного кольца ТрК (DTI; S’). Пиковая скорость ТрН, давление в ПП, а также степень коллабирования нижней полой вены (НПВ) использовались для расчета систолического давления в легочной артерии.
Трехмерная эхокардиография
Данные было получены за 4–6 последовательных циклов сердечных сокращений с частотой кадров от 18 до 36 Гц из апикальной 4-камерной позиции, адаптированной для улучшения визуализации правых отделов сердца. Показатели были сохранены в цифровом виде и затем перенесены на рабочую станцию для автономного анализа после обработки и трехмерной реконструкции. Количественное определение объемов ПЖ и геометрии кольца ТрК осуществлялось через коммерчески доступную специализированную систему
Оценка объемов и функции ПЖ
Программное обеспечение для трехмерного анализа ПЖ использовалось для анализа наборов данных для реконструкции и вычисления 30ФВПЖ в соответствии со стандартизированным методом [11]. Объемы ПЖ были полуавтоматически рассчитаны на протяжении всего сердечного цикла, из которого был получен конечно-диастолический объем (КДО ПЖ) и рассчитана 3DФВПЖ.
Эхокардиографическая оценка трикуспидального клапана
Оценку производили с применением как 2DЭхоКГ, так и трехмерной ЭхоКГ (ЗОЭхоКГ). Диаметр ТрК измеряли с помощью 2DЭхоКГ как расстояние между точками прикрепления септальной и задней створок к атриовентрикулярному соединению через апикальную 4-камерную позицию в диастолу во время максимального раскрытия ТрК.
ЗОЭхоКГ в режиме реального времени использовали с целью получения диаметра кольца ТрК и его площади. Трехмерные данные был собраны в течение приблизительно 5-10 с после задержки дыхания из апикального окна.
Степень ТрН оценивалась следующим образом: степень 0 ноль или тривиальная; степень 1 слабая (площадь струи регургитации <5 см2; ширина вены контракты <3 мм); степень 2 умеренная (площадь струи регургитации >5 см2, но <10 см2;
ширина вены контракты ≥3 мм, но <7 мм); степень 3 тяжелая (площадь струи регургитации >10 см2; ширина вены контракты >7 мм [12].
ЭхоКГ параметры были получены до операции. Сразу после оперативного лечения с помощью чреспищеводной ЭхоКГ (ЧПЭхоКГ) оценивался результат оперативного лечения. Перед выпиской проводился стандартный протокол трансторакального ультразвукового исследования. После выписки пациентам выполнялась ЭхоКГ через 3, 6 и 9 мес. для выявления возвратной ТрН; в конце периода наблюдения через 12 мес. всем выжившим пациентам трансторакальная ЭхоКГ с обязательной оценкой функции и ремоделирования ПЖ и ПП.
Статистический анализ
Анализ данных проводился с использованием программы STATISTICA для Windows, версия 10.0 (StatSoft, Inc, USA). Проверка гипотезы о нормальности распределения признаков производилась с использованием критерия Шапиро–Уилка. Условие равенства дисперсии проверялось с помощью критерия Левена. Для описания количественных нормально распределенных признаков применялись средние значения и стандартные отклонения. Для описания количественных признаков с распределением, отличным от нормального, и качественных порядковых признаков использовались медиана и соответствующий интервал между 25- и 75-м процентилями ( Q 1 : Q 3); для качественных номинальных признаков – относительные частоты в процентах.
Для определения статистической значимости межгрупповых сравнений в группах номинальных данных применялся критерий хи квадрат; в группах порядковых данных — непараметрический U-критерий Манна-Уитни; в группах непрерывных данных – критерий Стъюдента (при нормальном распределении признака) или непараметрический U-критерий Манна–Уитни (при распределении, отличном от нормального). Уровень значимости для всех использующихся методов установлен как p<0,05. Анализ выживаемости, свободы отТрН проводился методом Каплана–Мейера.
Результаты
Между группами не наблюдалось отличий по времени искусственного кровообращения, длительности окклюзии аорты и спектру выполненных вмешательств (табл. 2).
Периоперационная смертность составила 1,94 и 2,5% в Rigid и Flex группах соответственно ( p =0,504). Сердечная недостаточность (СН), острый инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК), внутригрудное кровотечение, имплантация постоянного электрокардиостимулятора (ЭКС) были наиболее частыми осложнениями после операции. Рестернотомия в первые сутки после операции с целью гемостаза выполнялась у 6 пациентов Rigid группы и 5 пациентов Flex группы ( р =0,508). Частота имплантации постоянного ЭКС также не различалась (0,434).
В отдаленном периоде при анализе выживаемости и свободы от тромбоэмболических событий методом Каплана-Мейера через 12 мес. (рис. 1) между двумя группами не наблюдалось значительных различий ( p =0,562 и 0,484 соответственно).
В обеих группах отмечалось значимое уменьшение симптомов СН по сравнению с исходным уровнем ( p <0,001 в обеих группах в отношении NYHA III/IV), межгрупповой разницы при этом не регистрировалось ( p =0,491; табл. 3).
Таблица 2. Интраоперационные результаты
Table 2. Perioperative results
|
Параметры |
Rigid группа ( n =154) |
Flex группа ( n =154) |
p |
|
Время пережатия аорты ( M ± SD ), мин |
86±17,52 |
84±13,1 |
0,816 |
|
Время искусственного кровообращения ( M ± SD ), мин |
112,8±15,7 |
106,8±16,9 |
0,354 |
|
Размер кольца для пластики ТрК: |
|||
|
28 мм |
95 |
19 |
<0,0001 |
|
30 мм |
36 |
72 |
<0,0001 |
|
32 мм |
23 |
63 |
<0,0001 |
|
ПрМК, n (%) |
83 (53,8) |
78 (51,8) |
0,568 |
|
ПлМК, n (%) |
71 (46,2) |
76 (49,2) |
0,568 |
|
Тромбоз ЛП, n (%) |
8 (5,2) |
11 (7,4) |
0,474 |
|
Maze IV, n (%) |
115 (74,6) |
106 (68,5) |
0,254 |
Примечание: данные представлены как среднее±стандартное отклонение ( M ± SD ) или n (%); ТрК – трикуспидальный клапан; ПрМК – протезирование митрального клапана; ПлМК – пластика митрального клапана; MAZE IV – хирургическое лечение фибрилляции предсердий согласно схеме MAZE IV; Rigid – вмешательство на митральном клапане с пластикой трикуспидального клапана жестким кольцом; Flex – вмешательство на митральном клапане с пластикой трикуспидального клапана гибким кольцом.
Note: data are presented as mean±standard deviation ( M ± SD ) or n (%). ТрК – tricuspid valve; ПрМК – mitral valve replacement; ПлМК – mitral valve repair; MAZE IV – surgical treatment of atrial fibrillation according to the MAZE IV; Rigid – intervention on the mitral valve with tricuspid valve repair by a rigid ring; Flex – intervention on the mitral valve with tricuspid valve repair by a flexible ring.
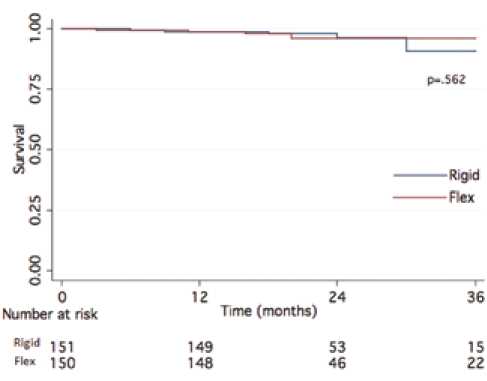
Рис. 1. Анализ выживаемости по методу Каплана–Мейера в
Rigid и Flex группах
Fig. 1. Kaplan–Meier Survival Analysis in the Rigid and Flex groups
Таблица 3. NYHA, класс сердечной недостаточности
Table 3. NYHA heart failure class
|
NYHA, n (%) |
Rigid группа |
Flex группа |
р |
|
I |
127 (85,1) |
129 (87,3) |
0,895 |
|
II |
17 (11,2) |
16 (10,6) |
0,883 |
|
III/IV |
5 (3,7) |
3 (2,1) |
0,491 |
Примечание: NYHA – Нью-Йоркская кардиологическая ассоциация; Rigid – вмешательство на митральном клапане с пластикой трикуспидального клапана жестким кольцом; Flex – вмешательство на митральном клапане с пластикой трикуспидального клапана гибким кольцом.
Note: NYHA – New York Heart Association; Rigid – intervention on the mitral valve with tricuspid valve repair by a rigid ring; Flex – intervention on the mitral valve with tricuspid valve repair by a flexible ring.
Ремоделирование правых отделов сердца
Результаты ЭхоКГ исследования представлены в табл. 4. В раннем послеоперационном периоде у нас не было пациентов с ТрН2. При наблюдении за пациентами в обеих группах отмечалось значимое устранение ТрН по сравнению с дооперационным уровнем (р <0,0001 для обеих групп). Пациентам из обеих групп с возвратной ТрН (ТрН 2-й и 3-й степени нами определялась как возвратная). За весь период наблюдения не выполнялось повторных операций на ТрК. Фактическая частота рецидивов ТрН у пациентов Rigid и Flex групп составила 3,24 и 3,89% соответственно ( p =0,521). Не было выявлено значимого различия между двумя группами при анализе свободы от ТрН≥2+ методом Kaplan–Meier (рис. 2).
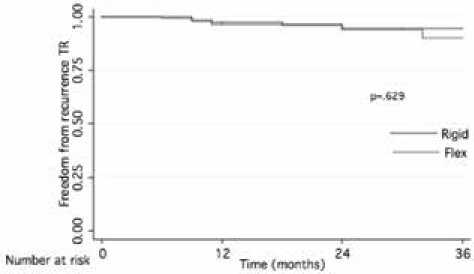
*•»« 154 ISO 49 17
n« 154 149 SO 23
Рис. 2. Анализ свободы от возвратной ТрН в Rigid и Flex группах по методу Каплана–Мейера. TR – трикуспидальная недостаточность; Rigid – группа пациентов с пластикой трикуспидального клапана жестким кольцом; Flex – группа пациентов с пластикой трикуспидального клапана гибким кольцом
Fig. 2. Kaplan–Meier analysis of freedom from recurrence TR in Rigid and Flex groups. TR – tricuspid insufficiency; Rigid – a group of patients with tricuspid repair with a rigid ring; Flex – a group of patients with tricuspid repair with a flexible ring
У пациентов обеих групп отмечалось статистически значимое снижение расчетного систолического давления в легочной артерии (СДЛА) по сравнению с исходным уровнем (<0,001 для пациентов обеих групп), при этом межгрупповая разница отсутствовала (p=0,618). Зарегистрировано значимое снижение линейных размеров ПП в обеих группах без межгруппового различия (табл. 4).
При оценке линейных размеров ПЖ статистически значимая межгрупповая разница была зафиксирована только для базального конечно-диастолического размера (КДР), р <0,005.
Таблица 4. Эхокардиографические параметры
Table 4. Echocardiographic parameters
|
Параметры |
Жесткие кольца |
Мягкие кольца |
Межгрупповое р исходное |
Межгрупповое р после операции |
||||
|
До операции |
12 мес. после операции |
p |
До операции |
12 мес. после операции |
p |
|||
|
Левые отделы сердца |
||||||||
|
ЛП ( M ± SD ), см |
5,46±0,49 |
4,8±0,23 |
<0,001 |
5,65±0,65 |
4,92±0,18 |
<0,001 |
0,635 |
0,567 |
|
ЛЖ КДР ( M ± SD ), см |
5,67±0,89 |
4,7±1,1 |
<0,001 |
5,77±0,76 |
4,8±0,92 |
<0,001 |
0,243 |
0,678 |
|
ЛЖ КДО ( M ± SD ), мл |
165,5±44,0 |
116,3±30,6 |
<0,001 |
169,5±37,0 |
117,3±31,8 |
<0,001 |
0,594 |
0,656 |
|
ЛЖ ФВ ( M ± SD ), % |
63,5±8,89 |
59,2±5,2 |
<0,001 |
61,17±9,3 |
58±4,36 |
<0,001 |
0,589 |
0,453 |
|
Правые отделы сердца |
||||||||
|
ПП короткая ось ( M ± SD ), см |
4,7±0,76 |
4,1±0,41 |
<0,001 |
4,6±0,75 |
4,2±0,52 |
<0,001 |
0,898 |
0,678 |
|
ПП длинная ось ( M ± SD ), см |
5,9±0,8 |
4,8±0,62 |
<0,001 |
5,6±0,78 |
4,9±0,63 |
<0,001 |
0,263 |
0,785 |
|
ПЖ КДО ( M ± SD ), мл |
90,3±13,2 |
68,8±12,6 |
<0,002 |
89,65±16,4 |
63,84±9,04 |
<0,0002 |
0,754 |
0,325 |
|
КДР базальный, ( M ± SD ) (см) |
4.4±0,9 |
3,7±0,7 |
<0,005 |
4,23±0,89 |
3,2±0,68 |
<0,003 |
0,876 |
<0,005 |
|
КДР средний ( M ± SD ), см |
3,23±0,76 |
2,7±0,51 |
<0,004 |
3,3±0,76 |
2,5±0,54 |
<0,005 |
0,695 |
0,456 |
|
КДР длинная ось ( M ± SD ), см |
6,8±0,9 |
5,8±0,3 |
<0,001 |
6,7±0,7 |
5,6±0,2 |
<0,001 |
0,736 |
0,529 |
|
Конечно-диастолическая площадь ( M ± SD ), см2 |
30,5±15,5 |
25,2±8,21 |
<0,005 |
26,3±13,7 |
23,4±7,06 |
<0,005 |
0,867 |
0,238 |
|
Толщина стенки ПЖ ( M ± SD ), см |
0,81±0,05 |
0,57±0,06 |
0,394 |
0,76±0,054 |
0,51±0,045 |
0,405 |
0,678 |
0,342 |
|
Систолическая функция правого желудочка |
||||||||
|
FAC ( M ± SD ), % |
40,07±3,03 |
46,05±4,0 |
<0,001 |
40,01±4,2 |
47,3±7,6 |
<0,001 |
0,865 |
0,231 |
|
3D ФВПЖ ( M ± SD ), % |
42,8±3,8 |
50,37±3,5 |
<0,001 |
43,25±3,8 |
50.8±4.0 |
<0,001 |
0,125 |
0,156 |
|
TAPSE ( M ± SD ), мм |
11,69±1,96 |
15,8±3,42 |
<0,001 |
11,53±2,1 |
17,5±2,5 |
<0,001 |
0,486 |
<0,001 |
|
DTI (S’) ( M ± SD ), см/c |
8,2±2,5 |
9,3±1,2 |
0,009 |
8,4±2,6 |
13,2±1,8 |
0,003 |
0,743 |
0,002 |
|
Трикуспидальный клапан |
||||||||
|
Диаметр в диастолу ТрК 2D-AP4CH ( M ± SD ), мм |
46,6±7,5 |
29,1±2,1 |
<0,001 |
47,3±8,1 |
30,1±2,6 |
<0,001 |
0,781 |
0,668 |
|
Диаметр в диастолу ТрК 3D ( M ± SD ), мм |
50,4±6,9 |
31,4±2,4 |
<0,001 |
49,1±7,3 |
33,5±2,9 |
<0,001 |
0,801 |
0,004 |
|
S ТО 3D в диастолу ( M ± SD ), мм2 |
207,4±64,6 |
105,8±67,5 |
<0,001 |
211,6±70,1 |
107,6±68,9 |
<0,001 |
0,882 |
0,002 |
|
Площадь смещения створок ТрК ( M ± SD ), см2 |
2,55±1,66 |
1,01±0,33 |
<0,001 |
2,62±1,154 |
0,98±0,41 |
<0,001 |
0,673 |
0,489 |
|
Длина смещения створок ТрК ( M ± SD ), см |
1,1±0,48 |
0,50±0,168 |
<0,001 |
1,09±0,48 |
0,54±0,166 |
<0,001 |
0,786 |
0,466 |
|
Средний диастолический градиент ( M ± SD ), мм рт. ст. |
– |
2,5±1,49 |
– |
– |
2,1±0,99 |
– |
– |
0,007 |
|
Пиковый диастолический градиент ( M ± SD ), мм рт. ст. |
– |
4,23±1,95 |
– |
– |
2,1±0,99 |
– |
– |
0,276 |
|
Р (ЛА) систолическое ( M ± SD ), мм рт. ст. |
51,4±13,9 |
34,7±6,2 |
<0,001 |
53,5±11,9 |
33,1±6,64 |
<0,001 |
0,731 |
0,618 |
|
Трикуспидальная недостаточность |
||||||||
|
II (умеренная), n (%) |
96 (62,5) |
3 (1,94) |
<0,001 |
94 (61,1) |
2 (1,29) |
<0,001 |
0,814 |
0,653 |
|
III/IV (выраженная), n (%) |
58 (37,5) |
1 (0,64) |
<0,001 |
60 (38,9) |
3 (1,94) |
<0,001 |
0,814 |
0,315 |
Примечание: данные представлены как среднее ± стандартное отклонение ( M ± SD ) или n (%); ЛП – левое предсердие; ЛЖ – левый желудочек; КДР – конечно–диастолический размер; КДО – конечно-диастолический объем; ФВ – фракция выброса; ПП – правое предсердие; ПЖ – правый желудочек; FAC – фракционное изменение площади; 3D – трехмерная эхокардиография; TAPSE – систолическая экскурсия фиброзного кольца трикуспидального клапана; S’ – продольная скорость систолической экскурсии фиброзного кольца трикуспидального клапана; ТрК – трикуспидальный клапан; 2D-AP4CH – двухмерная эхокардиография, четырехкамерная апикальная позиция; S ТО – площадь трикуспидального клапана; Р – систолическое давление в легочной артерии.
Note: data are presented as mean ± standard deviation ( M ± SD ) or n (%). ЛП – left atrium; ЛЖ – left ventricle; КДР – end diastolic size; КДО – end diastolic volume; ФВ – ejection fraction; ПП – right atrium; ПЖ – right ventricle; FAC – fractional area change; 3D – three-dimensional echocardiography; TAPSE – systolic excursion tricuspid valve ; S’ – longitudinal velocity of the tricuspid valve; ТрК – tricuspid valve; 2D-AP4CH – two-dimensional echocardiography, four-chamber apical position; S TO – tricuspid valve area; P – systolic pressure in the pulmonary artery.
Тем не менее, оба типа устройств обеспечили статистически значимое ремоделирование по этому показателю до нормальных значений (табл. 4) При оценке объемных показателей в Flex группе отмечалось большее уменьшения КДО и конечно-диастолической площади (КДП), однако межгрупповая разница была не значима ( p =0,325 и 0,238 соответственно). Толщина стенки ПЖ также была сопоставима ( р =0,342).
При внутригрупповом сравнении фракционное изменение площади (ФИП), как и 3DФВПЖ, значимо возросли по сравнению с исходными данными (для обоих показателей р <0,001). Межгрупповые различия по этим показателям были не значимы ( р= 0,845 и 0,648 соответственно).
При внутригрупповом сравнении по таким показателям, как систолическая экскурсия кольца ТрК (TAPSE), продольная скорость систолической экскурсии фиброзного кольца ТрК (S’), пациенты обеих группы показали значимое улучшение ( p <0,001 для обоих параметров). При межгрупповом сравнении пациенты из Flex группы по всем приведенным параметрам демонстрировали значимо более высокий рост. Также стоит отметить, что у пациентов из Rigid группы эти показатели оставались достаточно низкими.
Внутригрупповое сравнение с использованием методик 2DЭ-хоКГ и 3DЭхоКГ показало, что жесткие и гибкие кольца значимо уменьшают как площадь, так и диаметр фиброзного кольца ТрК ( p <0,001 для обоих параметров). При межгрупповом сравнении с использованием 2DЭхоКГ значимых различий в диаметре кольца ТрК после операции не выявлено ( p =0,668). При анализе 3DЭхоКГ пациенты из Rigid группы имели значимо меньший диаметр кольца и меньшую площадь ТрК по сравнению с пациентами из Flex группы ( p =0,004 и 0,002 соответственно).
При оценке пикового и среднего диастолических градиентов не наблюдалось значимой межгрупповой разницы ( р =0,007 и 0,376 соответственно). Длина натяжения и площадь натяжения створок также не отличались между группами ( p =0,466 и 0,489 соответственно).
Обсуждение
До недавнего времени хирургическая коррекция ТрН выполнялась с использованием шовных методик. Неудовлетворительные результаты (высокий уровень возвратной ТрН, прорезывание швов) в отдаленном периоде заставили постепенно отказаться от широкого применения методов шовной пластики в пользу имплантируемых устройств [13]. К основному достоинству данных устройств стоит отнести низкий уровень возвратной ТрН по сравнению с шовными методиками [14].
На сегодняшний день существует две концепции, которые включают использование жестких колец, обеспечивающих ремоделирование кольца ТрК, либо гибких колец, обеспечивающих редукцию кольца ТрК. Опыт применения обоих типов устройств был отражен во многих работах [8, 15]. Однако анализ результатов имел ретроспективный характер, некоторые из них не включали группу сравнения. Наше проспективное рандомизированное исследование показало, что в краткосрочном периоде жесткие и гибкие кольца с одинаковой эффективностью обеспечивают поддержание низкого уровня возвратной ТрН, не увеличивают количество периоперационных осложнений, тромботических событий и риск имплантации постоянного ЭКС. Кроме того, выявлены две различные модели обратного ремоделирования ПЖ.
Как известно, кольцо ТрК имеет седловидную форму. Характерной особенностью является и равномерная экскурсия кольца ТрК в течение сердечного цикла. После появления и последующего увеличения ТрН кольцо ТрК приобретает более плоскую форму, теряя при этом равномерность сокращения [16], что приводит к увеличению площади смещения створок и длины смещения створокТрК [17]. ПрогрессирующаяТрН вызывает дилатацию ПЖ и увеличивает натяжение хорд, что также увеличивает площади и длину смещения створок ТрК [18].
Гибкие кольца обладают несомненными преимуществами, что обусловлено их гибкостью. Это свойство определяет более простую технику имплантации, снижая тем самым риск повреждения проводящих путей и коронарных артерий во время операции. Особенно это важно, если имплантация, как в нашем исследовании, производится на работающем сердце. Кроме того, при имплантации во время окклюзии аорты до восстановления сердечной деятельности данный тип колец позволяет уменьшить риск развития стеноза в случае имплантации устройства меньшего размера [19]. B. Pfannmuller и соавт. [20] в своем исследовании пришли к выводу, что гибкие кольца имеют минимальный риск отрыва от фиброзного кольца ТрК. Это свойство связано с меньшим напряжением швов, так как гибкое кольцо может более эффективно следовать естественному движению кольца ТрК во время сердечного цикла. Гибкие кольца могут в большей степени способствовать восстановлению функции ПЖ после операции, о чем сообщалось в некоторых исследованиях [15, 21]. Данные, приведенные авторами, согласуются с результатами наших исследований. Однако стоит отметить, что эти исследования имеют ретроспективный характер, часть из них не имеет групп сравнения, зачастую ЭхоКГ оценка включает только линейные размеры ПЖ.
С другой стороны, гибкие кольца при движении кольца ТрК во время сердечного цикла могут не поддерживать оптимальную седловидную форму клапана [19]. Это привело к развитию концепции устройств с заранее заданной формой, близкой к физиологичной седловидной (3D кольца, ремоделирующая ан-нулопластика).
Жесткие кольца имеют низкие показатели возвратной ТрН по сравнению с гибкими кольцами [13]. Кроме того, существующие исследования показали, что уровень ТрН после коррекции жестокими кольцами относительно стабилен во времени по сравнению с медленно увеличивающимся уровнем ТрН после пластики гибким кольцами [23]. Однако стоит отметить ретроспективный характер исследований, различные клинические данные у пациентов разных групп, различную технику имплантации устройств. Согласно нашим результатам, в среднесрочном периоде наблюдения оба устройства имеют сопоставимую эффективность в коррекции ТрН.
G. Gatti и соавт. [23] в своей работе показали, что имплантация жесткого кольца в отдаленном периоде положительно сказалась на ремоделировании ПЖ, ПП и ТрК. Так, в группе пациентов, которым имплантировались жесткие кольца, авторы отметили значимое снижение СДЛА ( р =0,0011) и увеличение FAC ( р =0,0017), тогда как в группе с использованием гибких колец наблюдалось снижение СДЛА ( р =0,0011). При анализе линейных размеров авторы указали на положительное влияние имплантации жестких колец на линейные размеры ПЖ ( р <0,045) и ПП ( p =0,0002), отметив также эффективную редукцию расширенного кольца ТрК жесткими кольцами ( р <0,0001). Однако анализ приведенных данных был несколько затруднен для интерпретации в связи с тем, что авторы не предоставили межгруппового сравнения. При анализе графиков по таким показателям, как диаметр кольца ТрК, длина и площадь смещения створок, пациенты с пластикой ТрК гибкими кольцами имели значимое снижение этих показателей до целевых значений (длина смещения не более чем 0,76 см; площадь смещения не более чем 1,6 см2), а также значимую редукцию кольца ТрК
( р <0,0001) что может свидетельствовать о положительном влиянии пластики на объемные показатели ПЖ. Стоит отметить, что в исследование включены пациенты, которым пластика ТрК выполнялась как 3D кольцами, так и стандартными жесткими кольцами, поэтому сложно сделать вывод о преимуществе конструкции того или иного жесткого кольца.
В нашем исследовании в Rigid группе пациентам имплантировались стандартные жесткие кольца. Для исследования диаметра ТрК нами использовался метод 2DЭхоКГ и 3DЭхоКГ. При оценке с помощью 3DЭхоКГ выявлена статистически значимая межгрупповая разница в отношении диаметра кольца ТрК ( р =0,004), хотя результаты, полученные при 2DЭхоКГ, значимо не различаются ( р =0,668). Наши данные согласуются с результатами исследования A.M. Anwar и соавт. [24], согласно которому размеры, полученные при 3DЭхоКГ, имеют значимо большие значения по сравнению с 2DЭхоКГ ( p <0,001). С учетом сложной формы кольца ТрК его измерение наиболее корректно осуществлять с помощью 3DЭхоКГ.
Оценка глобальной систолической функции ПЖ производилась путем измерения ФИП и 3DФВПЖ. Межгрупповой разницы по данным параметрам получено не было ( р =0,231 и 0,156 соответственно). Однако при оценке показателей региональной систолической функции (TAPSE, S’) у пациентов из Flex группы показатели оказались значимо лучше. Стоит отметить, что при имплантации ригидных колец, несмотря на статистически значимый рост при внутригрупповом сравнении, показатели остались на достаточно низком уровне, что свидетельствует о неполном восстановлении региональной систолической функции.
На полученные результаты, по нашему мнению, мог повлиять тип имплантированного устройства. Стандартное жесткое кольцо прочно фиксирует кольцо ТрК, уменьшает его диаметр до нормальных размеров, придавая ему более плоскую форму, ограничивает при этом его равномерное сокращение во время сердечного цикла. Однако за счет нивелирования ТрН уменьшается объемная перегрузка ПЖ, что приводит к восстановление его объемных показателей. Этим можно объяснить полученные нами данные касательно длины и площади смещения створок, которые, согласно исследованию S. Fukuda и соавт., являются независимыми предикторами возвратной ТрН [25].
С другой стороны, гибкие кольца обеспечивают эффективную редукцию кольца ТрК, устраняя ТрН, что в отдаленном периоде также приводит к ремоделированию ПЖ [26]. Подобные выводы подтверждаются нашими результатами. После пластики ТрК с использованием гибких колец было отмечено уменьшение объемных показателей ПЖ до нормальных значений, эффективное снижение площади смещения и длины смещения створок ТрК.
Таким образом, оба типа колец имеют низкий уровень возвратной ТрН в среднесрочном периоде, способствуют восстановлению глобальной систолической функции ПЖ, однако жесткие кольца ввиду дизайна прочно фиксируют фиброзное кольцо ТрК, что неизбежно сказывается на региональной систолической функции. Гибкие кольца могут в перспективе не препятствовать восстановлению естественной формы кольца и его равномерному сокращению во время сердечного цикла. Данные выводы подтверждаются тем, что регионарная систолическая функция при имплантации гибких колец восстанавливается лучше.
Ограничения
Наше исследование имело проспективный рандомизированный дизайн, однако оно было ограничено одним центром. Одним из основных ограничений исследования является относительно короткий период наблюдения. Необходим более долгосрочный период наблюдения, а также многоцентровый дизайн исследования.
Выводы
-
1. Выполнение аннулопластики ТрК с использованием как жестких, так и мягких колец показывает сопоставимые результаты по свободе от возвратной ТрН в среднесрочном периоде наблюдения.
-
2. Статистически значимыми предикторами возвратной ТрН в среднесрочном периоде наблюдения являются постоянная форма ФП/ТП (ОШ 1,6 с 95% ДИ 0,88–3,2; р =0,001) и остаточная ЛГ (ОШ 1,3 с 95% ДИ 0,91–2,4; р =0,001).
-
3. Выполнение аннулопластики ТрК с использованием обоих типов устройств имеет сопоставимый уровень больших кардиоваскулярных осложнений на этапе среднесрочного наблюдения.
-
4. Использование обоих типов колец в среднесрочном периоде наблюдения способствует обратному ремоделированию ПЖ и восстановлению глобальной систолической функции.
-
5. Имплантация мягких колец в трикуспидальную позицию показывает значимое преимущество в восстановлении регионарной систолической функции ПЖ (TAPSE и S’) на этапе 12-месячного наблюдения в сравнении с ригидными аннулопластиче-скими имплантатами.
Практические рекомендации
Информация о вкладе авторов
Овчаров М.А. – концепция, дизайн исследования, написание текста, оформление, подготовка к печати.
Богачев-Прокофьев А.В. – концепция, редактирование статьи, организация проведения исследования.
Астапов Д.А. – организация проведения исследования, организация обследования пациентов в отдаленном периоде.
Пивкин А.Н. – обследование пациентов в отдаленном периоде.
Малоземов К.С. – оформление раздела статьи, обследование пациентов на госпитальном и в отдаленном периодах.
Подсосникова Т.Н. – оформление раздела статьи, обследование пациентов на госпитальном и в отдаленном периодах.
Малахова О.Ю. – оформление раздела статьи, обследование пациентов на госпитальном и в отдаленном периодах.
Караськов А.М. – концепция, редактирование статьи, утверждение окончательного варианта текста, организация проведения исследования.
Список литературы Сравнение гибких и жестких колец для коррекции функциональной трикуспидальной недостаточности: две разные модели обратного ремоделирования правых отделов сердца
- Varadarajan P., Pai R.G. Tricuspid regurgitation in patients with severe mitral regurgitation and normal left ventricular ejection fraction: risk factors and prognostic implications in a cohort of 895 patients. J. Heart Valve Dis. 2010;19(4):412-419.
- Goldstone A.B., Howard J.L., Cohen J.E., MacArthur Jr J.W., Atluri P., Kirkpatrick J.N., et al. Natural history of coexistent tricuspid regurgitation in patients with degenerative mitral valve disease: implications for future guidelines. J. Thorac. Cardiovasc. Surg. 2014;148(6):2802-2810. DOI: 10.1016/j.jtcvs.2014.08.001
- Nishimura R.A., Otto C.M., Bonow R.O., Carabello B.A., Erwin J.P., Guyton R.A., et al. 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014 Jun. 10;129(23):2440-2492. DOI: 10.1161/CIR.0000000000000029
- Topilsky Y., Tribouilloy C., Michelena H.I., Pislaru S., Mahoney D.W., Enriquez-Sarano M. Pathophysiology of tricuspid regurgitation: quantitative Doppler echocardiographic assessment of respiratory dependence.Circulation. 2010;122(15):1505-1513. DOI: 10.1161/CIRCULATIONAHA.110.941310
- Koelling T.M., Aaronson K.D., Cody R.J., Bach D.S., Armstrong W.F. Prognostic significance of mitral regurgitation and tricuspid regurgitation in patients with left ventricular systolic dysfunction. Am. Heart J. 2002;144(3):524-529.
- Nath J., Foster E., Heidenreich P.A. Impact of tricuspid regurgitation on long-term survival. J. Am. Coll. Cardiol. 2004 Feb. 1;43(3):405-409.
- DOI: 10.1016/j.jacc.2003.09.036
- Huang X., Gu C., Men X., Zhang J., You B., Zhang, H., et al. Repair of functional tricuspid regurgitation: comparison between suture annuloplasty and rings annuloplasty. Ann. Thorac. Surg. 2014 Apr.;97(4):1286-1292.
- DOI: 10.1016/j.athoracsur.2013.10.037
- Wang N., Phan S., Tian D.H., Yan T.D., Phan K. Flexible band versus rigid ring annuloplasty for tricuspid regurgitation: a systematic review and meta-analysis. Annals of Cardiothoracic Surgery. 2017;6(3):194-203.
- Овчаров М.А., Богачев-Прокофьев А.В., Пивкин А.Н., Будагаев С.А. Афанасьев А.В., Шарифулин Р.М., и др. Сравнение жестких колец и гибких бэндов в коррекции сопутствующей недостаточности трикуспидального клапана у пациентов, перенесших операцию на митральном клапана. Кардиология и сердечно-сосудистая хирургия. 2019;12(2):122-131
- Miller D., Farah M.G., Liner A., Fox K., Schluchter M., Hoit B.D. The relation between quantitative right ventricular ejection fraction and indices of tricuspid annular motion and myocardial performance. J. Am. Soc. Echocardiogr. 2004;17(5):443-447.
- DOI: 10.1016/j.echo.2004.01.010
- Maffessanti F., Muraru D., Esposito R., Gripari P., Ermacora D., Santoro C., et al. Age-, body size-, and sex-specific reference values for right ventricular volumes and ejection fraction by three-dimensional echocardiography: a multicenter echocardiographic study in 507 healthy volunteers. Circulation: Cardiovascular Imaging. 2013 Jun.;6(5):700-710.
- DOI: 10.1161/CIRCIMAGING.113.000706
- Lancellotti P., Moura L., Pierard L.A., Agricola E., Popescu B.A., Tribouilloy C.; European Association of Echocardiography recommendations for the assessment of valvular regurgitation. Part 2: mitral and tricuspid regurgitation (native valve disease). European Journal of Echocardiography. 2010;11(4):307-332.
- DOI: 10.1093/ejechocard/jeq031
- McCarthy P.M., Bhudia S.K., Rajeswaran J., Hoercher K.J., Lytle B.W., Cosgrove D.M., et al. Tricuspid valve repair: durability and risk factors for failure. J. Thorac. Cardiovasc. Surg. 2004;127(3):674-685.
- DOI: 10.1016/j.jtcvs.2003.11.019
- Tang G.H., David T.E., Singh S.K., Maganti M.D., Armstrong S., Borger M.A. Tricuspid valve repair with an annuloplasty ring results in improved long-term outcomes. Circulation. 2006;114(1 Suppl.):577-581.
- DOI: 10.1161/CIRCULATIONAHA.105.001263
- Gatti G., Marciano F., Antonini-Canterin F., Pinamonti B., Benussi B., Pappalardo A., et al. Tricuspid valve annuloplasty with a flexible prosthetic band. Interactive Cardiovascular and Thoracic Surgery. 2007;6(6):731-735.
- DOI: 10.1510/icvts.2007.156786
- Izutani H., Nakamura T., Kawachi K. Flexible band versus rigid ring annuloplasty for functional tricuspid regurgitation. Heart International. 2010 Dec. 31;5(2):e13.
- DOI: 10.4081/hi.2010.e13
- Sagie A., Schwammenthal E., Padial L.R., de Prada J.A.V., Weyman A.E., Levine R. A determinants of functional tricuspid regurgitation in incomplete tricuspid valve closure: Doppler color flow study of 109 patients. J. Am. Coll. Cardiol. 1994;24(2):446-453.
- Fukuda S., Song J.M., Gillinov A.M., McCarthy P.M., Daimon M., Kongsaerepong V. et al. Tricuspid valve tethering predicts residual tricuspid regurgitation after tricuspid annuloplasty. Circulation. 2005 Feb. 14;111(8):975-979.
- DOI: 10.1161/01.CIR.0000156449.49998.51
- Wang H., Liu X., Wang X., Lv Z., Liu X., Xu P. Comparison of outcomes of tricuspid annuloplasty with 3D-rigid versus flexible prosthetic ring for functional tricuspid regurgitation secondary to rheumatic mitral valve disease. Journal of Thoracic Disease. 2016;8(11):3087-3095.
- DOI: 10.21037/jtd.2016.11.97
- Pfannmüller B., Doenst T., Eberhardt K., Seeburger J., Borger M.A., Mohr F.W. Increased risk of dehiscence after tricuspid valve repair with rigid annuloplasty rings. J. Thorac. Cardiovasc. Surg. 2012;143(5):1050-1055.
- DOI: 10.1016/j.jtcvs.2011.06.019
- Zhu T.Y., Wang J.G., Meng X. Is a rigid tricuspid annuloplasty ring superior to a flexible band when correcting secondary tricuspid regurgitation? Interactive Cardiovascular and Thoracic Surgery. 2013;17(6):1009-1014.
- Navia J.L., Nowicki E.R., Blackstone E.H., Brozzi N.A., Nento D.E., Atik F.A., et al. Surgical management of secondary tricuspid valve regurgitation: annulus, commissure, or leaflet procedure? J. Thorac. Cardiovasc. Surg. 2010;139(6):1473-1482.
- DOI: 10.1016/j.jtcvs.2010.02.046
- Gatti G., Dell'Angela L., Morosin M., Maschietto L., Pinamonti B., Benussi B. et al. Flexible band versus rigid ring annuloplasty for functional tricuspid regurgitation: two different patterns of right heart reverse remodelling. Interactive Cardiovascular and Thoracic Surgery. 2016 Jul.;23(1):79-89.
- DOI: 10.1093/icvts/ivw047
- Anwar A.M., Geleijnse M.L., ten Cate F.J., Meijboom F.J. Assessment of tricuspid valve annulus size, shape and function using real-time three-dimensional echocardiography. Interactive Cardiovascular and Thoracic Surgery. 2006 Dec. 1;5(6):683-687.
- DOI: 10.1510/icvts.2006.132381
- Fukuda S., Gillinov A.M., Song J.M., Daimon M., Kongsaerepong V., Thomas J.D., et al. Echocardiographic insights into atrial and ventricular mechanisms of functional tricuspid regurgitation. Am. Heart J. 2006;152(6):1208-1214.
- DOI: 10.1016/j.ahj.2006.07.027
- Benedetto U., Melina G., Angeloni E., Refice S., Roscitano A., Comito C., et al. Prophylactic tricuspid annuloplasty in patients with dilated tricuspid annulus undergoing mitral valve surgery. J. Thorac. Cardiovasc. Surg. 2012 Mar.;143(3):632-638.
- DOI: 10.1016/j.jtcvs.2011.12.006


