Сравнение эффективности плазмид 1 и 3 поколения, кодирующих химерный Т-клеточный рецептор к опухолевому маркеру рака яичников
Автор: Киселева Я.Ю., Большакова О.Б., Кулинич Т.М., Шишкин А.М., Боженко В.К.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 2 т.21, 2021 года.
Бесплатный доступ
Рак яичников – пятая по частоте причина смерти от рака у женщин и вторая по частоте диагностирования опухоль в гинекологии. Поиск новых эффективных методов лечения рака яичника является актуальной клинической задачей. Одним из наиболее 26 перспективных методов на сегодняшний день является иммунотерапия с использованием CAR-T технологии. Антиген CA125, который имеет высокую экспрессию при раке яичника, может стать мишенью при разработке данных методов терапии. В данной работе представлены результаты разработки метода CAR-T терапии рака яичника с использованием плазмидных конструкций, несущих гены мономолекулярных Т-клеточных рецепторов к СА125. Разработаны и синтезированы три варианта плазмиды, проведены экспериментальные исследования, показавшие правильность и эффективность сборки Т--клеточных рецепторов к СА125 после проведенной трансфекции клеток плазмидными конструкциями, показана эффективность связывания генно-модифицированных клеток с растворенной формой СА125. Было показано, что химерная конструкция р3СА2 (эпитоп Х181) обладает большей эффективностью (72% трансфецированных Т-лимфоцитов приобретают способность связывать СА125) и является более перспективной для дальнейшего исследования.
Онкология, иммунотерапия, химерный антигенный рецептор, плазмида, рак яичников, CAR-T-терапия.
Короткий адрес: https://sciup.org/149135680
IDR: 149135680
Текст научной статьи Сравнение эффективности плазмид 1 и 3 поколения, кодирующих химерный Т-клеточный рецептор к опухолевому маркеру рака яичников
Лечение и рациональная диагностика онкологических заболеваний в настоящее время являются чрезвычайно важной проблемой. Муцин 16 (MUC 16) занимает особую позицию среди белков, являясь не только диагностическим биомаркером, но и терапевтической мишенью [8, 9, 14]. MUC16 представляет собой высокомолекулярный трансмембранный гликопротеин, который обычно экспрессируется на поверхности определенных типов эпителиальных клеток [11]. Являясь представителем семейства муцинов, он содержится в слизи, покрывающей урогенитальные, дыхательные и пищеварительные тракты, а также конъюнктиву и роговицу. MUC16 в совокупности с другими муцинами защищает их от обезвоживания, инфекций и прочих повреждений (химического или физического характера) [6]. Превращение эпителиальных клеток в злокачественные сопутствуется экспрессией большого количества данного вещества на их поверхности [11].
Роберт Бастом и его коллеги первыми обнаружили MUC16. Ими было отмечено, что опухоль-ассоциативный антиген, экспрессирующий в 80% случаев рака яичников, связывается ранее обнаруженным моноклональным антителом OC125 [4]. Впоследствии новый антиген получил название СА125 (cаncer antigen 125) [5].
В настоящее время CA125 хорошо изучен и обширно используется как опухолевый маркер при раке яичников [2]. Он попадает в кровоток благодаря протеолитическому расщеплению и десквамации N-концевого домена MUC16
(sМUС16) с поверхности клеток опухоли. Антигенный эпитоп CA125 обнаруживают в сыворотке крови методом иммуноферментного анализа. Его принято считать лучшим биомаркером эпителиального рака яичников серозного типа. Иммунотерапия при раке яичников – перспективный и прогрессивно развивающийся метод, минимально влияющий на нормальные ткани организма, вследствие своей высокой специфичности. Поэтому поиск новейших подходов, в частности возможность использования CAR-T технологии, является актуальной клинической задачей. Известно, что иммунная система играет важную роль не только в этиологии онкологического заболевания, но и определяет его течение. Ключевой задачей фундаментальной науки является изучение взаимодействия клеток опухоли и иммунной системы, поэтому метод обращения собственного иммунитета против развития злокачественного новообразования может со временем быть представлен, как новый и эффективный способ лечения рака.
Один из таких методов – адоптивная иммунотерапия на основе искусственных (химерных) Т-клеточных рецепторов (CAR-therapy). Она включает введение в организм пациента Т-лимфоцитов, генетически модифицированных ex vivo и несущих на своей поверхности искусственный рецептор заданной специфичности. CAR представляет собой белок слияния и состоит из внеклеточного одноцепочечного вариабельного фрагмента иммуноглобулина scFv (single-chain Fv) и внутриклеточных сигнальных доменов Т-лимфоцитов [12]. В отличие от Т-клеточных рецепторов, которые узнают процессированные антигены в составе главного комплекса гистосовместимости, химерные Т-клеточные рецепторы нацелены на распознавание поверхностных нативных (непроцессированных) антигенов, ассоциированных со злокачественной трансформацией клеток [13].
Технология САR даёт возможность вне тела пациента перепрограммировать его собственные иммунные клетки с целью создания химерного рецептора антигена, который может охотиться за раковыми клетками и эффективно разрушает опухоль.
СAR, сконструированные по такому методу, входящие в состав иммунных эффекторных клеток, позволяют последним приобрести высокую избирательность благодаря добавленному рецептору от моноклональных антител. Полученные таким образом клетки после используются для адоптивной иммунной терапии, которая является разновидностью иммунотерапии рака [10].
Изначально химерные антигенные рецепторы имели в своей структуре нормальные рецепторы T-лимфоцитов, включали в себя цитоплазматическую эффекторную и антиген-распознающую части, а также передаточный фрагмент [3]. В дальнейшем были созданы CAR второго и третьего поколения, которые кроме CD3ζ содержали вспомогательные костимулитрующие домены. Чаще всего CAR второго поколения включают цитоплазматический домен молекулы CD28, расположенный между трансмембранным доменом и сигнальной последовательностью, содержащей ITAM [1, 3, 7]. Третье поколение конструкций допускает присутствие трёх внутриклеточных сигнальных доменов. В них, кроме фрагментов СD28 и СD3 ζ, могут содержаться сигнальные последовательности СD137 / 4-1ВВ, DАP10, СD134 / ОХ-40 и прочие.
Цель данной работы: (1) исследование и выбор оптимальной плазмиды 1 и 3 поколений, содержащей ген мономолекулярного химерного Т-клеточного рецептора к опухолеспецифическому антигену CA125, предназначенной для пассивной иммунотерапии опухолей; (2) оценка функциональности полученных рекомбинантных плазмид на клетках рака молочной железы (МСF-7) и лимфоцитах человека.
Материалы и методы
В работе использованы линии клеток рака яичника человека OVCAR-3, OVKATE и MCF-7 (рак молочной железы, человек), клетки культивировали в стандартных стерильных условиях с использованием среды DMEM (ПанЭко, Россия) при 5% СО2, 37 °С. Ряд экспериментов проведен на лимфоцитах периферической крови человека, полученных от условно здоровых доноров. Выделение фракции лимфоцитов проведено с помощью наслаивания на раствор фиколла-урографина (плотность 1,077 г/см3) (ПанЭко, Россия). Лимфоциты культивировали в стандартных условиях на среде RPMI (ПанЭко, Россия), с содержанием 10% фетальной бычьей сыворотки (ПанЭко, Россия). Т-лимфоциты активировали добавлением в среду интерлейкина-2 (50 ЕД/мл) (Ронколейкин, БИОТЕК, Россия) и фитогемагглютинина (1 мкг/мл) (ФГА, ПанЭко). Моноклональные биотинилированные мышиные антитела (изотип IgG1), способные в растворе связываться с СА125, были предоставлены OOO «XEМА» (Россия, Москва). Структура антител исследована с помощью методов электрофореза белков (SDS-PAGE) с применением технологии изоэлектрического фокусирования (IEF) (Agilent 7100, ФИЗЛАБПРИБОР, Россия).
Трансфекция Т-лимфоцитов человека и клеток MCF-7 проводилась с использованием прибора Amaxa Nucleofector (Lonza) и наборов «Humаn Т-Cеll Nuсlеоfесtоr Kit» (Lоnzа). Для клеток были использованы программы V-024, Т-020 и Т-023, обеспечивающие высокую эффективность трансфекции данных типов клеток.
Оценка экспрессии Z-цепи Т-клеточного рецептора, а также оценка связывания СА125 в растворе были проведены методом проточной цитометрии (Cytomics FC500, Beckman Coulter, USA). Биотинилированные антитела, для плазмиды plCAl - Х75, для плазмиды р3СА2 - Х181, для р3СА3 - Х189 были предоставлены ООО «ХЕМА» (Россия).
Результаты и обсуждение
Создание генно-инженерных конструкций (плазмид), экспрессирующих химерные T-клеточные рецепторы, которые могли распознать антиген СА125 на поверхностях клеток-мишеней, стало важным этапом проделанной работы. Было продемонстрировано, что трансфицированные такой плазмидой лимфоциты периферической крови человека, приобретают свойства экспрессировать на поверхности мономолекулярный Т-клеточный рецептор специфический к СА125.
Работа включала несколько этапов: на первом этапе проводился выбор целевого эпитопа молекулы антигена СА125; на втором этапе были синтезированы конструкции мономолекулярных рецепторов, включающих последовательности, комплементарные к выбранным участкам, и проведено определение правильности сборки рецепторов на поверхности клеток; на третьем этапе выполнено исследование функциональной активности данных конструкций Т-клеточных рецепторов.
Выбор целевого эпитопа СА125
Были созданы моноклональные биотинилированные мышиные антитела (изотип IgG1), способные связаться в растворе с СА125, а именно: Х193, Х189, Х181, Х144, Х75, Х69.
Также были выбраны три клеточные линии OVKATE, OVCAR-3 (рак яичника, человек), MCF-7. Линия OVCAR-3 и линия OVKATE несут на поверхности клеток антиген СА125, а линия MCF-7 не экспрессирует, поэтому ее использовали в качестве контроля. Структура исследуемых антител была изучена с помощью таких методов, как электрофорез белков (SDS-PAGE) и изоэлектрическое фокусирование (IEF).
Помимо этого для всех представленных антител с помощью метода проточной цитофлуориметрии определили связывание с клеточными культурами рака яичников. На основании результатов связывания антител с поверхностными антигенами СА125 было идентифицировано три антитела, демонстрирующих наивысший уровень связывания с линиями клеток OVKATE и OVCAR-3 - Х189, Х181, Х75. С помощью антител полученных к эпитопам СА125 (Х75, Х181, Х189) были разработаны плазмиды, несущие ген химерного мономолекулярного рецептора. В плазмиду рСI было проведено клонирование фрагментов Т-клеточного рецептора: вариабельные фрагменты легких и тяжелых цепей рецептора, комплементарные к соответствующим участкам антител, гибкий шарнирный участок молекулы СD8, фрагмент СD247, являющийся ζ-цепью Т-клеточного рецептора и включающий поверхностный и внутриклеточный домен. На основании структуры (поколения) рецептора данным конструкциям присвоены названия: р1СА1, р3СА2, р3СА3. В таблице 1 представлены описания последовательностей разработанных плазмидных конструкций.
Таблица 1. Структура плазмид, созданных входе исследования
|
№ |
Название |
Сокращен ное название |
Клон антитела scFv |
Шарнир ный участок |
Трансмем бранный домен |
Активаци онные домены |
|
1 |
pCI/CA1-CD8-CD247 (pCI/1C6-CD8-CD247) |
p1CA1 |
X75 |
CD8 |
CD247 |
CD247 |
|
2 |
pC1/3CA2-CARg |
p3CA2 |
X181 |
CD8 |
CD28 |
CD28, CD137, CD247 |
|
3 |
pCI/3CA3-CAR3g |
p3CA3 |
X189 |
CD8 |
CD28 |
CD28, CD137, CD247 |
Оценка функционирования плазмид, кодирующих химерный Т-клеточный рецептор. Исследование поверхностной экспрессии рецептора к СА125 на поверхности клеток MCF-7 после их модификации плазмидами
Клетки линии МСF-7(рак молочной железы человека) не экспрессируют рецепторы к СА125, поэтому появление данных рецепторов на поверхности клеток после внедрения в них плазмидных конструкций может являться показателем правильности сборки Т-клеточного рецептора. Для того, чтобы подтвердить правильность функционирования Т-клеточного рецептора, клетки линии МСF-7
трансфицировали созданными плазмидными конструкциями. Появление после трансфекции иммунореактивных эпитопов ζ-цепи химерного рецептора (СD3ζ) на поверхности клеток МСF-7 является одним из показателей функциональности созданных плазмид. Проверку экспрессии ζ-цепи линии клеток МСF-7 проводили через 24 часа после трансфекции. Для этого клетки обрабатывали меченными антителами к ζ-цепи химерного рецептора и анализировали на проточном цитофлуориметре. Положительный сигнал был обнаружен в клетках, трансфицированных всеми плазмидами, в то время как в не трансфицированных плазмидными конструкциями контрольных препаратах клеток сигнал отсутствовал. Полученные данные указывают на наличие экспрессии химерного иммунорецептора, кодируемого плазмидой р1СА1, и его правильную внутриклеточную сборку. В аналогичных экспериментах с использованием рекомбинантных плазмидных ДНК р2СА2 и р3СА3 (анализ через 24 часа после трансфекции, окрашивание клеток антителами к CD3ζ), экспрессия ζ-цепи была продемонстрирована в 22,3% и 17% клеток соответственно. Это подтверждает правильную сборку Т-клеточных рецепторов, экспрессируемых этими конструкциями. Проведённый после трансфекции плазмидными конструкциями р3СА2 и р3СА3 анализ клеток МСF-7 показал, что кодируемые исследуемой ДНК T-клеточные рецепторы, собираются на поверхности клеток. Это доказывают более высокий уровень экспрессии ζ-цепи по сравнению с рIСА1 и данные по окрашиванию антителами к внутриклеточному фрагменту ζ- цепи. Рисунок 2 показывает результаты связывания трансфицированных клеток с FITC-меченными антителами, полученные с помощью метода проточной цитофлуорометрии. Для всех изученных плазмид сборка химерного Т-клеточного рецептора протекала правильно. Тем не менее, в ходе исследования было установлено, что для каждой плазмидной конструкции свойственны индивидуальные особенности, выраженные в процентном содержании клеток, несущих химерный иммунорецептор и в разных количественных уровнях экспрессии.
Помимо этого, для того чтобы оценить способность трансфицированных клеток MCF-7 связываться с СА125, их инкубировали в течение 30 минут с раствором данного антигена, меченного флуоресцентным красителем FITC (CA125-FITC). Клетки, трансфицированные плазмидами, связывали CA125 в растворе, что было показано после 30 минут инкубации клеток с раствором CA125, меченным FITC. После трансфекции MCF-7 плазмидой р1СА1 положительный сигнал связывания антител был обнаружен у 16,5% клеток в культуре (рисунок 2Б).
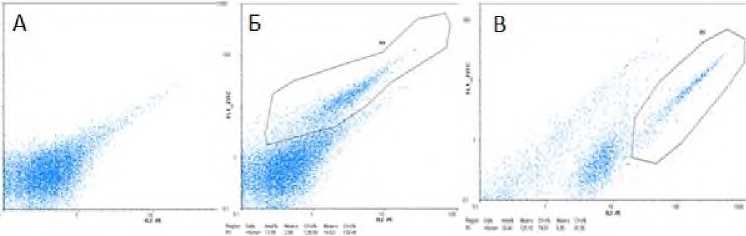
Рисунок 2. Цитофлуориметрический анализ связывания клеток MCF-7, трансфицированных плазмидой p1CA1 через 24 часа после трансфекции. (А) Отрицательный контроль (нетрансфицированные клетки MCF-7). (Б) Клетки MCF-7, трансфицированные плазмидной конструкцией р1СА1, через 24 часа после трансфекции с ФИТЦ-СА125 в растворе. (В) Клетки MCF-7, трансфицированные плазмидной конструкцией р1СА1, после окрашивания FITC-меченными антителами к Z- цепи CD3.
Таким образом, было установлено, что в клетках MCF-7, трансфицированных плазмидой р1СА1, химерный Т-клеточный рецептор экспрессирующийся на их поверхности, способен связать антиген СА125 в растворе, как через 24 часа, так и спустя 48 часов после трансфекции. Исходя из полученных результатов (рисунок 2Б и 2В) был сделан вывод, что клетки, трансфицированные плазмидной конструкцией р1СА1, через 24 часа после трансфекции, экспрессируют поверхностный Т-клеточный рецептор к СА125. При увеличении времени инкубации до 48 часов после трансфекции достоверных изменений в результатах получено не было. При дальнейшем изучении плазмид р3СА2 и р3СА3 было показано, что клетки, трансфицированные этими конструкциями, также спустя 24 и 48 часов после трансфекции, связывают антиген CA125-FITC (Таблица 2). Поэтому можно сделать вывод, что кодируемый всеми исследованными плазмидными конструкциями химерный Т-клеточный рецептор, после проведенной процедуры трансфекции, эффективно экспрессируется на поверхности клеток MCF-7. При исследовании различных вариантов плазмид, кодирующих химерный Т-клеточный рецептор, количественный уровень связывания CA125 с трансфицированными клетками MCF-7 в растворе варьировал в зависимости от выбранной конструкции. Были получены значения относительного уровня связывания FITC-CA125 на поверхности трансфицированных клеток (Таблица 2). Самый высокий уровень связывания СА125 был отмечен в клеточной культуре, трансфицированной плазмидой р3СА2. Анализ проводили через 24 и 48 часов после трансфекции. Стоит отметить, что строгой зависимости уровня связывания FITC-CA125 от времени обнаружено не было.
Таблица 2. Результаты оценки связывания антигена CA125-FITC с клетками линии
MCF-7 генно-модифицированными исследуемыми плазмидными конструкциями
|
Образец (наименование) |
24 часа инкубации |
48 часов инкубации |
|
Количество клеток, несущих поверхностный рецептор к СА125, % |
||
|
MCF-7контроль, нетрансфицированные |
0 |
0 |
|
MCF-7, трансфицированные р1СА1 |
8,3 |
9,2 |
|
MCF-7, трансфицированные р3СА2 |
22,6 |
23,7 |
|
MCF-7, трансфицированные р3СА3 |
17,8 |
16,4 |
Анализ связывания растворимой формы СА125 с лимфоцитами человека, трансфицированными плазмидами p1CA1, р3СА2, р3СА3
После оценки функциональности полученных плазмид, дальнейшее исследование метода иммунотерапии с использованием конструкций химерных Т-клеточных рецепторов к СА125 проводили на лимфоцитах человека. Проанализированные литературные данные свидетельствуют о том, что для повышения уровня экспрессии химерного рецептора и его способности связываться с соответствующим антигеном, а также в целях повышения эффективности трансфекции, рекомендуется предварительная активация лимфоцитов.
В нашем исследовании было проведено сравнение эффективности плазмидных конструкций р1СА1, р3СА2 и р3СА3 при их трансфекции в не активированные и активированные лимфоциты. Активацию проводили рекомбинантным интерлейкином-2 (IL-2) человека (50 ЕД/мл) с параллельной стимуляцией фитогемагглютенином (PHA) в течение 3 суток. По истечении этого срока доля СD3+ Т лимфоцитов в клеточной культуре составляла 60 ± 10%. Последующая трансфекция лимфоцитов человека плазмидными конструкциями методом электропорации была проведена с использованием прибора Amaxa Nucleofector (LonzaEio).
Для того чтобы оценить способность связывать СА125, нестимулированные лимфоциты трансфицировали плазмидами р1СА1, р3СА2 и р3СА3. Затем спустя 24 и 48 часов после трансфекции инкубировали в течение 30 минут с раствором антигена, меченного флуоресцентным красителем FITC (CA125-FITC). Количество клеток, несущих рецептор CA125 на поверхности и связывающих антиген CA125-FITC, оценивали с помощью проточной цитометрии. Проанализировав диаграммы связывания лимфоцитов, которые были трансфицированы исследуемыми плазмидными конструкциями р1СА1, р2СА2, р3СА3 с СА125-НТС, получили 28%, 43% и 36% связывания соответственно. Тем самым было показано, что самый высокий уровень связывания СА125 наблюдается для лимфоцитов, трансфицированных плазмидой р3СА2.
Результаты цитофлуорометрического анализа связывания FITC-CA125 с предварительно активированными IL-2/PHA лимфоцитами, трансфицированными серией плазмидных конструкций, показали, что уровень связывания CA125 активированными клетками значительно превышает уровень связывания с нестимулированными лимфоцитами, трансфицированными теми же плазмидами (р1СА1, р3СА2,р3СА3), и равен 31%, 72% и 56% соответственно. В результате эксперимента было показано, что предварительная активация лимфоцитов, приводит к увеличению экспрессии Т-клеточного рецептора.
Исследования функциональной активности трёх плазмидных конструкций, несущих Т-клеточный рецептор к СА125, продемонстрировали, что разработанные плазмидные конструкции при трансфекции в клетки человека вызывают экспрессию поверхностных рецепторов к СА125. Установлено, что наиболее перспективной для дальнейших исследований является плазмида р3СА2 (pCI/3СА2-CAR3g, антитело Х181), так как она обладает наибольшей функциональностью и эффективностью. Плазмидная конструкция р3СА2 обеспечивает экспрессию функциональных Т-клеточных рецепторов не только на поверхности лимфоцитов человека, но и на клетках линии MCF-7.
Таким образом, проведенное исследование позволило разработать плазмидную конструкцию к опухолевому антигену СА125, что может являться основой для разработки метода иммунотерапии злокачественных новообразований, при которых опухолевые клетки несут на поверхности СА125 (рак яичника, рак легкого).
Список литературы Сравнение эффективности плазмид 1 и 3 поколения, кодирующих химерный Т-клеточный рецептор к опухолевому маркеру рака яичников
- Боженко В. К., Князева А.Д., Киселева Я.Ю. и др. Исследование эффективности различных вариантов химерных Т клеточных рецепторов относительно РЭА позитивных опухолевых клеток. Вестник РНЦРР. 2018. Т. 18. № 2. С. 3 4.
- Сергеева Н.С., Маршутина Н.В. Опухолеассоциированные маркеры в скрининговых программах, направленных на активное выявление рака яичников: реальность, проблемы и перспективы. Практическая онкология. 2010. Т. 11. № 2. С. 110 119.
- Acuto O., Michel F. CD28 mediated co stimulation: a quantitative support for TCR signaling. Nat Rev Immunol. 2003. V. 3. No. 12. P. 939 951. doi: 10.1038/nri1248.
- Bast R. C., Jr., Feeney M., Lazarus H., et al. Reactivity of a monoclonal antibody with human ovarian carcinoma. J Clin Invest. 1981. V. 68. No. 5. P. 1331 1337. doi: 10.1172/JCI110380.
- Bast R. C., Jr., Klug T. L., St John E., et al. A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N Engl J Med. 1983. V. 309. No. 15. P. 883 887. doi: 10.1056/NEJM198310133091503.
- Bottoni P., Scatena R. The Role of CA 125 as Tumor Marker: Biochemical and Clinical Aspects. Adv Exp Med Biol. 2015. V. 867. P. 229 244. doi: 10.1007/978 94 017 7215 0_14.
- Cheng J., Montecalvo A., Kane L.P. Regulation of NF κB induction by TCR/CD28. Immunol Res. 2011. V. 50. No. 2 3. P. 113 117. doi: 10.1007/s12026 011 8216 z.
- Das S., Batra S.K. Understanding the Unique Attributes of MUC16 (CA125): Potential Implications in Targeted Therapy. Cancer Res. 2015. V. 75. No. 22. P. 4669 4674. doi: 10.1158/0008 5472.CAN 15 1050.
- Felder M., Kapur A., Gonzalez--Bosquet J., et al. MUC16 (CA125): tumor biomarker to cancer therapy, a work in progress. Mol Cancer. 2014. V. 13. Article ID 129. doi: 10.1186/1476--4598--13--129.
- Haji--Fatahaliha M., Hosseini M., Akbarian A., et al. CAR--modified T--cell therapy for cancer: an updated review. Artificial Cells Nanomed Biotechnol. 2016 V. 44. No. 6. P. 1339--1349. doi:10.3109/21691401.2015.1052465.
- Haridas D., Ponnusamy M. P., Chugh S., et al. MUC16: molecular analysis and its functional implications in benign and malignant conditions. Faseb J. 2014. V. 28. No. 10. P. 4183--4199. doi: 10.1096/fj.14--257352.
- Jena B., Dotti G., Cooper L.J. Redirecting T--cell specificity by introducing a tumor--specific chimeric antigen receptor. Blood. 2010. V. 116. No. 7. P. 1035--1044. doi: 10.1182/blood--2010--01--043737.
- Klebanoff C.A., Rosenberg S.A., Restifo N.P. Prospects for gene--engineered T--cell immunotherapy for solid cancers. Nat Med. 2016. V. 22. No. 1. P. 26--36. doi: 10.1038/nm.4015.
- Marcos--Silva L., Narimatsu Y., Halim A., et al. Characterization of binding epitopes of CA125 monoclonal antibodies. J Proteome Res. 2014. V. 13. No. 7. P. 3349--3359. doi: 10.1021/pr500215g.


