Сравнение качественной и количественной характеристик пэт-визуализации экспериментальной костной патологии с применением 68Ga-оксабифора и Na18F
Автор: Лунв А.С., Клементьева О.Е., Лунва К.А., Жукова М.В., Малышева А.О.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Радиационная медицина
Статья в выпуске: 4 т.13, 2017 года.
Бесплатный доступ
Цель: сравнение качественной и количественной характеристик экспериментальной костной патологии у мышей с применением Na18F и перспективного радиофармпрепарата (РФП) «Оксабигал, 68Ga», представляющего собой комплекс галлия-68 с оксабифором (окса-бис- (этиленнитрило) тетраметиленфосфоновой кислотой). Материал и методы. Эксперимент выполнен на нелинейных мышах-самках (30 шт.) массой 20,6±1,9 г разводки питомника «Филиал Андреевка ФГБУН НЦБМТ ФМБА России» с моделью костной патологии. Животным внутривенно вводили препараты, меченные галлием-68 и фтором-18, после чего через определенный интервал времени проводили ПЭТ-сканирование (позитрон-эмиссионная томография) с последующим расчетом фармакокинетических параметров. Результаты. Введение двух РФП позволило отчетливо визуализировать смоделированную костную патологию с помощью ПЭТ. Заключение. Очаги экспериментальной костной патологии удалось контрастно визуализировать уже в первый час после введения как «Оксабигала, 68Ga», так и Na18F. Статистически достоверная разница в накоплении препаратов в крови отличает ПЭТ-изображения с «Оксаби-галом, 68Ga» более высоким «шумом» и медленным клиренсом крови, однако не сказывается на позитивных результатах. Генераторный способ получения галлия-68 делает меченные им остеотропные препараты важным дополнением к независимому выбору применения других РФП для ПЭТ-визуализации костных патологий, в том числе с Na18
Костная патология, пэт-визуализация, радиофармпрепарат
Короткий адрес: https://sciup.org/14918568
IDR: 14918568
Текст научной статьи Сравнение качественной и количественной характеристик пэт-визуализации экспериментальной костной патологии с применением 68Ga-оксабифора и Na18F
1Введение. Метастатическое поражение скелета является серьезным осложнением, проявляющимся в виде болевого синдрома, прогрессирующего со временем и приводящего к патологическим переломам, компрессии спинного мозга и гиперкальциемии [1]. Поэтому раннее выявление костных патологий, определение степени распространенности метастатических очагов и их агрессивности имеют решающее значение для правильной постановки диагноза, стадирования заболевания, оказания своевременного лечения и, как следствие, повышения качества жизни пациентов. Проведение исследований, позволяющих выявить наличие метастатических очагов в скелете, особенно важно при наличии высокой степени риска метастазов первичного опухолевого очага.
Одним из таких методов является радионуклидная диагностика (РНД) и визуализация костных метастазов, позволяющая сделать оценку патофизиологических изменений и отразить функциональный статус патологии методом эмиссионной томографии до возникновения анатомических изменений в ткани [2], тогда как другие методы исследования (КТ, МРТ) опираются на морфологические изменения и не могут выявить процесс на ранней стадии его развития [3]. Остеосцинтиграфия в настоящее время не имеет альтернатив для раннего выявления костных метастазов и является самой массово используемой технологией ядерной медицины.
Для первых сцинтиграфических исследований костей использовали 47Са, 85Sr и 87mSr, но их широкое применение ограничивалось низким качеством получаемых изображений и значительной лучевой нагрузкой на пациентов, что обусловливалось неоптимальными ядерно-физическими характеристиками указанных радионуклидов [4]. В 70-х гг. прошлого столетия для сцинтиграфии скелета впервые было предложено использовать фосфатные комплексы технеция-99 m c полифосфатом, трифосфатом и пирофосфатом [5]. Однако применение фосфатных комплексов неизбежно приводило к их ферментативному гидролизу фосфатазами in vivo . Решением этого вопроса стала возможность применения 99mTc-меченых бисфосфонатных комплексов, отличающихся высокой аффинностью к костной ткани и резистентностью к гидролизу фосфатазами, благодаря наличию P-C-P связи [6].
Кроме технеция-99 m, одним из удобных радионуклидов для остеосцинтиграфии являлся изотоп фтора-18, и еще за несколько десятилетий до внедрения современных ПЭТ-систем натрия фторид Na18F получил широкое применение для визуализации костных патологий. Однако необходимость использования высокоэнергетического коллиматора в однофотонной эмиссионной компьютерной томографии (ОФЭКТ) для фтора-18, с одной стороны, и генераторный способ получения технеция-99 m с его
идеальными для ОФЭКТ ядерно-физическими характеристиками, с другой, исключили возможность использования фтора-18 в ОФЭКТ-визуализации [7].
На качественно новую ступень своего развития поднялась РНД с внедрением высоких технологий и серийным выпуском установок для ПЭТ, где изображение формируется регистрацией совпадений лишь строго в противоположных ячейках кольцевой системы детекторов, что позволяет значительно улучшить качество изображений и, следовательно, их информативность [8]. Поэтому еще с начала 1990-х гг. наряду с 18F-ФДГ для ПЭТ-визуализации костных метастазов предпринимались попытки использования Na18F, которые увенчались клиническим успехом [9]. К сожалению, в настоящее время ключевым недостатком применения фтора-18 является циклотронный способ его получения, который осложняет возможность использования в некоторых регионах России, что связано с логистическими ограничениями его доставки.
Решение проблемы заключается в использовании более доступных для ПЭТ-центров, не оснащенных циклотроном или размещенных на значительном удалении от него, генераторных позитрон-излуча-ющих радионуклидов, одним из которых является галлий-68 [10], получаемый из генератора 68Ge/68Ga (ЗАО «Циклотрон», Обнинск). Возросший в последние годы интерес к галлий-меченным бисфосфонатам как к перспективным РФП для ПЭТ-визуализации костных метастазов подтверждается частотой мировых тематических публикаций [11–14], так как многолетний мировой опыт использования РФП и конкретные позитивные результаты дают возможность независимого выбора их применения для каждого конкретного клинического случая.
Цель: сравнение качественной и количественной характеристик экспериментальной костной патологии у мышей с применением Na18F и перспективного РФП «Оксабигал, 68Ga», представляющего собой комплекс галлия-68 с оксабифором (окса-бис- (этиленнитрило) тетраметиленфосфоновой кислотой).
Материал и методы. Объектами исследования служили РФП «Оксабигал, 68Ga» и Na18F. РФП «Оксабигал, 68Ga» разработан и приготавливался для данных экспериментов в ФГБУ ГНЦ ФМБЦ им. А. И. Бурназяна, его готовая лекарственная форма имеет следующий состав (на 1 мл), представленный в табл. 1.
Таблица 1
Состав готовой лекарственной формы РФП «Оксабигал, 68 Ga»
68Ga в виде комплекса 68Ga-оксабифор
Вспомогательные вещества: оксабифор-кислоты дигидрата натрия гидрофосфата додекагидрата
37–370 МБк на дату и время изготовления
5,16 мг
4,0 мг
Окончание табл. 1
|
68Ga в виде комплекса 68Ga-оксабифор |
37–370 МБк на дату и время изготовления |
|
натрия фосфата додекагидрата |
0,95 мг |
|
натрия гидроокиси |
5,59 мг |
|
натрия хлорида |
2,0 мг |
|
кислоты хлористоводородной 0,1 М |
до 1,0 мл |
Для приготовления радиофармацевтического препарата во флакон, содержащий лиофилизированный реагент «Оксабигал, 68Ga», с помощью шприца вносили 2 мл предварительно очищенного элюата [15] генератора 68Ge/68Ga (ЗАО «Циклотрон», Обнинск). Реакционную смесь инкубировали при комнатной (20оС) или повышенной (90-95оС) температуре в течение определенного времени.
Раствор фторида-18 натрия получен из отделения циклотронных радиофармпрепаратов ФГБУ «РНЦРХТ» Минздрава России (Санкт-Петербург). В экспериментах использованы препараты с радиохимической чистотой 98,2% («Оксабигал, 68 Ga») и 99,9% (Na18F).
Исследования выполнены на нелинейных мышах-самках (30 шт.) массой 20,6±1,9 г разводки питомника «Филиал Андреевка ФГБУН НЦБМТ ФМБА России». Животных, поступивших из питомника, включали в эксперимент после десятидневного карантина, по завершении которого проводили моделирование патологического очага. Во время экспериментов животных содержали в стандартных условиях (специальное помещение, рекомендованный рацион, свободный доступ к питьевой воде, естественное освещение). Все манипуляции с животными проводились в соответствии с правилами, принятыми Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986).
Моделирование костной патологии. В качестве модели патологии выбран закрытый перелом бедренной кости в стадии активного формирования костной мозоли. Для проведения процедуры перелома животных наркотизировали путем внутрибрюшинного введения раствора хлоралгидрата в физиологическом растворе из расчета 400 мг на 1 кг массы тела. В течение последующих 9–10 суток после создания закрытого перелома активно формировалась костная мозоль, которая и служила моделью костной патологии.
ПЭТ-визуализация мышей. Неинвазивная визуализация, как универсальный метод изучения функциональной пригодности РФП на биологических тест-системах с моделированием различных человеческих патологий, становится стандартным подходом в доклинических испытаниях РФП [16], так как позволяет избежать большого числа жертв лабораторных животных [17].
РФП вводили лабораторным животным однократно в хвостовую вену в объеме 0,1 мл с активностью не более 2 МБк/мышь. Визуализацию проводили на позитронно-эмиссионном томографе PET/X-RAY Genisys4 (Sofie Bioscience, USA) для лабораторных животных PET Box. Процедуру сканирования выполняли через 15, 30, 60 и 120 минут после внутривенной инъекции. Время сканирования 10 минут.
Реконструкция и анализ изображений. Выходной файл формата *.dicom использовался для его последующей количественной обработки в программе Vivo Quant версии 2.30 и для получения читаемых изображений с фильтром invert (black and white). Программа позволяет рисовать зоны интереса 3DROI (regions of interest), определять в них накопление активности радионуклида и рассчитывать стандартизованные коэффициенты накопления SUV (1) (standardized uptake value) для ROI, г/мл:
Corg A org m TB % lAorg m TB
--- _---_---
CTB lA Vorg 100% Vorg
где Corg — концентрация накопленной активности Aorg в объеме органа Vorg , МБк/мл; — концентрация введенной активности lA во всем теле mTB (background), МБк/г; — процент накопленной активности в органе от общей введенной активности. Физический смысл SUV (1) заключается в предоставлении информации об аномальном накоплении препарата в ROI по отношению к общему распределению во всем теле. Чем больше коэффициент SUV отличен от единицы ( SUV >1), тем контрастнее визуализируется область интереса ROI. Зная SUV , можно найти процент накопленной активности.
Клиренс крови CL отражает элиминацию радиофармпрепарата путем его выведения из крови или биотрансформации. Чем больше значение клиренса крови (2), тем быстрее препарат покидает кровоток. Если препарат выводится из крови экспоненциально, согласно функции A (t) = A0·e-λt , то площадь под кривой AUC (area under curve), показывая накопленную активность (3), может быть использована для расчета клиренса крови:
CL =
lA
AUC ,
AUC = J A(t ) -5 1 = - A 0 , (3)
J ^biol где A0 — угловой коэффициент; λbiol — константа скорости выведения (мин-1), подбирающиеся методом наименьших квадратов (методом Рунге — Кутты). Зная клиренс крови, можно найти объем биораспределения Vd (4), который показывает, какой объем займет введенный радиофармпрепарат с текущей концентрацией в крови: чем ниже концентрация, тем больше объем биораспределения.
CL _ CL
^ eff ^ biol + ^ phys
где λeff — эффективная константа скорости крови, показывающая время, за которое радиоактивность в крови уменьшается вдвое; λphys — физическая константа скорости радионуклида, зависящая от периода полураспада.
Радиометрия. Через 15, 30, 60 и 120 минут после инъекции исследуемых препаратов животных умерщвляли методом частичной декапитации для отбора органов и тканей (кровь, костная мозоль, бедро интактное) с последующим определением в них радиоактивности методом прямой радиометрии на автоматическом гамма-счетчике Wizard 2480 (Perkin Elmer, USA).
Статистическая обработка результатов. При статистической обработке результатов иссле-
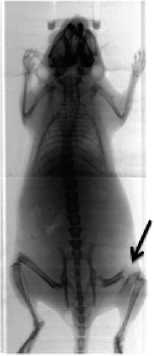
Рис. 1. Рентгеновское изображение мыши с переломом правой бедренной кости (показано стрелкой)
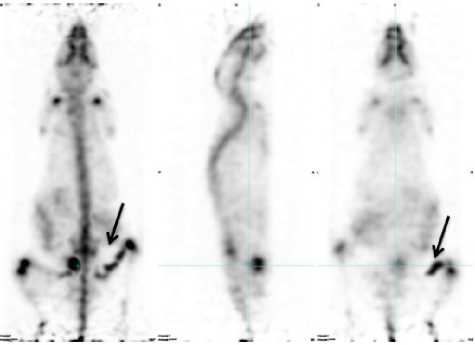
Рис. 2. ПЭТ-изображение через 60 минут после введения РФП «Оксабигал, 68Ga» (область патологии указана стрелкой)
дования определяли показатели средних арифметических значений (M), стандартных ошибок с учетом отклонения значений выборки от средних арифметических (±m). Нормальность распределения проверяли с использованием теста Колмогорова — Смирнова, при условии соответствия распределения нормальности достоверность полученных различий сопоставляемых величин оценивали с использованием t-критерия Стьюдента. При несоответствии нормальности распределения достоверность различий оценивали с использованием U-критерия Манна — Уитни. Частоты признаков сравнивались с использованием критерия χ2. Различия считали достоверными при p<0,05.
Результаты. Наличие костной патологии у мышей оценивали путем пальпации, визуально по поведенческим реакциям, нарушению локомоции, а также с помощью рентгенографии всего тела (рис. 1).
По прошествии часа после введения остеотроп-ных препаратов получали информативные ПЭТ-изображения с четкой визуализацией скелета мыши и, в особенности, активно формирующейся костной мозоли (рис. 1, 2). Кроме того, более четко по сравнению со всем скелетом удалось визуализировать зоны роста костей, для которых характерен более интенсивный метаболизм бластических клеток, что обусловливает отчетливую гиперфиксацию препаратов.
Кроме главных визуальных сходств, в изображениях, полученных после внутривенного введения «Оксабигал, 68Ga» и Na18F, наблюдали разницу: для
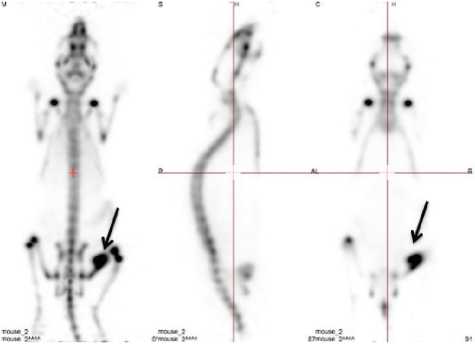
Рис. 3. ПЭТ-изображение мыши через 60 минут после введения Na18F (область патологии указана стрелкой)
РФП на основе галлия-68 «Оксабигал, 68Ga» характерно наличие более высокого «шума» от циркулирующего пула крови, позволяющего отчетливо видеть силуэт тушки мыши (см. рис. 2). «Шумовое накопление» обусловливается высоким количеством препарата главным образом в крови, что позволяет сделать вывод о более высоком клиренсе крови у мышей с введенным Na18F. Количественный анализ накопления-выведения во времени подтвердил визуальное описание ПЭТ-изображений (табл. 2).
Таблица 2
Динамика распределения РФП «Оксабигал, 68Ga» и Na18F во времени
|
РФП |
Органы и ткани |
Содержание препарата, %/орг или %/г (%/мл) |
|||
|
Время отбора проб органов и тканей, мин |
|||||
|
15 |
30 |
60 |
120 |
||
|
Кровь, мл |
1,31±0,15 |
0,45±0,05 |
0,29±0,10 |
0,23±0,03 |
|
|
Оксабигал, 68Ga |
Костная мозоль |
2,55±0,24 |
3,27±0,29 |
2,11±0,25 |
2,38±0,27 |
|
Бедро, норма |
0,78±0,10 |
0,88±0,18 |
1,05±0,05 |
0,82±0,10 |
|
|
Кровь, мл |
0,48±0,16 |
0,19±0,04 |
0,07±0,02 |
0,02±0,00 |
|
|
Na 18 F |
Костная мозоль |
2,93±0,27 |
3,76±0,34 |
4,66±0,85 |
4,02±0,10 |
|
Бедро, норма |
1,45±0,25 |
1,63±0,28 |
1,95±0,19 |
1,05±0,32 |
|
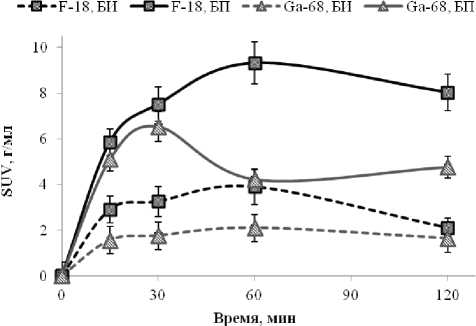
Рис. 4. Динамика изменения значений SUV бедра интактного (БИ) и бедра с переломом (БП) для Na18F (■) и «Оксабигал, 68Ga» (▲)
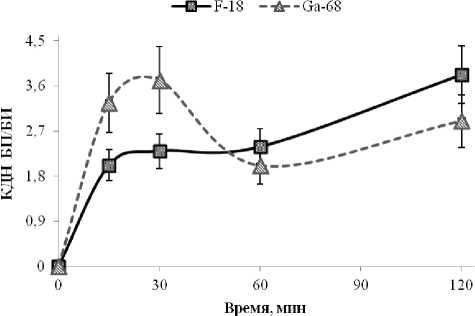
Рис. 5. Сравнение изменения коэффициентов дифференциального накопления (КДН) бедра с переломом к бедру интактному (БП/БИ) для Na18F (■) и «Оксабигал, 68Ga» (▲)
Фармакокинетические параметры крови
Таблица 3
|
Радиофармпрепарат |
λ биол |
λ физ |
λ эфф |
МБк A UC, --мин ’ мл |
CL,^- ’ мин |
^,мл |
|
Фторид Na18F |
0,029 |
0,0063 |
0,0353 |
18,39±1,75 |
1,09±0,12 |
30,80±3,47 |
|
«Оксабигал, 68Ga» |
0,014 |
0,0102 |
0,0242 |
68,67±6,51 |
0,29±0,03 |
12,04±1,02 |
По результатам, представленным в табл. 2, видно, что натрия фторид-18 более активно накапливался в костной ткани. В течение первых 30 минут после введения оба препарата ведут себя примерно одинаково, однако уже через час количество «Оксабигал, 68Ga» в месте перелома начинает снижаться, тогда как для Na18F нет статистически достоверной разницы между накоплением на протяжении по крайней мере двух часов исследования (рис. 4).
Следует отметить, что для визуализации важно не столько абсолютное накопление препарата в определенном локусе, столько относительное накопление в нем по отношению к окружающим здоровым тканям (рис. 5).
Анализ динамики изменения коэффициентов дифференциального накопления для обоих препаратов показывает, что статистически достоверную разницу между визуализацией патологических очагов можно заметить в течение 30 минут после введения РФП, так как костная аккумуляция натрия фторида-18 значительно выше, чем у «Оксабигала, 68Ga», для которого характерен более медленный клиренс крови (табл. 3) и меньшее накопление в здоровой костной ткани.
Расчет и анализ фармакокинетических параметров крови (см. табл. 3) показали, что при естественном снижении площади под кривой, описывающей выведение препарата из крови, прямо пропорционально увеличивались ее клиренс и объем биораспределения.
Более высокие значения клиренса для Na18F (в 3,76±0,03 раза больше, чем для «Оксабигал, 68Ga») и быстрое накопление в скелете по отношению к крови обусловливают его визуализацию в течение длительного времени (рис. 6).
Несмотря на весомую разницу КДН перелом/ кровь (через час отношение для натрия фторида-18 в 4,27±0,08 раза больше, чем для «Оксабигала, 68Ga»), необходимо отметить, что для четкой визуализации достаточно, чтобы это отношение составля-
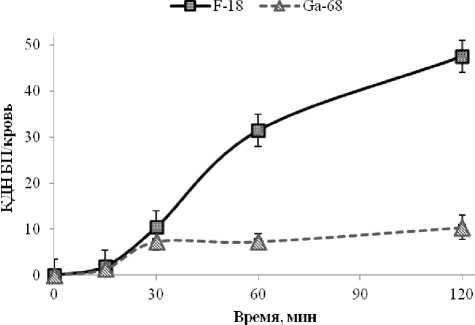
Рис. 6. Сравнение изменения коэффициентов дифференциального накопления (КДН) бедра с переломом к крови (БП/ кровь) для Na18F (■) и «Оксабигала, 68Ga» (▲)
ло 3–4, поэтому столь значительной разницы в ПЭТ-изображениях (см. рис. 1, 2) костей и перелома для сравниваемых в данном исследовании РФП не обнаруживается.
Обсуждение. Очаги экспериментальной костной патологии удалось контрастно визуализировать уже в первый час после введения как «Оксабигала, 68Ga», так и Na18F. Статистически достоверная разница в накоплении препаратов в крови отличает ПЭТ-изображения с «Оксабигалом, 68Ga» более высоким «шумом» и медленным клиренсом крови, однако не сказывается на позитивных результатах. Следует подчеркнуть, что генераторный способ получения галлия-68 делает меченные им остеотропные препараты важным дополнением к независимому выбору применения других радиофармпрепаратов (РФП) для ПЭТ-визуализации костных патологий, в том числе с Na18F.
Заключение. ПЭТ-визуализация патологических очагов и совершенствование ранее применяемых
РФП является актуальной задачей для нашей страны в связи с интенсивным развитием и открытием ПЭТ-центров в России. Применение 68Ga-меченных препаратов для визуализации костных патологий наряду с натрия фторидом-18 отвечает заявленным требованиям современной ядерной медицины, связанным с оценкой патофизиологических изменений и отражением функционального статуса в поврежденных органах и тканях на ранней стадии развития процесса.
Список литературы Сравнение качественной и количественной характеристик пэт-визуализации экспериментальной костной патологии с применением 68Ga-оксабифора и Na18F
- Модников О. П., Новиков Г. А., Родионов В. В. Костные метастазы рака молочной железы: патогенез, клиника, диагностика и лечение: руководство для врачей. М., 2001, 256 с.
- Rybak LD, Rosental Dl. Radiological imaging for the diagnosis of bone metastases. Q J Nucl Med 2001; 45: 53-64
- Uchida N.Sugimura K, KajitaniA, YoshizakoT, IshidaT. MR imaging of vertebral metastases: evaluation of fat saturation imaging. Eur J Radiol 1993; 17: 91-94
- Harbert JC, Eckelman WC, Neumann RD. Nuclear Medicine: Diagnosis and Therapy. New York: Thieme Medical Publishers Inc, 1996
- McAfee G.Tc-99m-methylenediphosphonate -a superior agent for skeletal imaging: comparison with other technetium complexes. J Nucl Med 1975; 16: 744
- Ebetino FH, Barnett BL, Russell RGG. A computational model delineates differences in hydroxyapatite binding affinities of bisphosphonate. J Bone Miner Res 2005; 20 (1): 259
- Blau M, Ganatra R, Bender MA. 18F-Fluoride for bone imaging. Semin Nucl Med 1972; 2: 31-37
- Bateman TM. Advantage sand disadvantages of PET and SPECT in a busy clinical practice. J Nucl Cardiol 2012; 19 (2): 3-11
- Grant FD, Fahey FH, Packard AB, DavisRT.AIaviA, Treves ST. Skeletal PET with 18F-Fluoride: Applying New Technology to an Old Tracer. J Nucl Med 2008; 49: 68-78
- Breeman WAP, Verbruggen AM. The 68Ge/68Ga generator has high potential, but when can we use 68Ga-label led tracer sin clinical routine? Eur J Nucl Med Mol Imaging 2007; 34: 978-81
- Fellner M, Baum RP, Kubicek V. PET/CT imaging of osteoblastic bone metastases with 68Ga-bisphosphonates: first human study. Eur J Nucl Med Mol Imaging 2010; 37: 834-834
- Suzuki K, Satake M, Suwada J. Synthesis and evaluation of a novel 68Ga-chelate-conjugated bisphosphonate as a bone-seeking agent for PET imaging. Nucl Med Biol 2011; 38 (7):1011-8
- Ogawa K, Takai K, Kanbara H. Preparation and evaluation of a radiogallium complex-conjugated bisphosphonate as a bone scintigraphy agent. Nucl Med Biol 2011; 38: 631 -6
- Goulet RT, Shysh A, Noujaim AA, Lentle BO Investigation of 68Ga tripolyphosphate as a potential bone scanning agent. Int J App Rad and Isotopes 1975; 26 (4): 195-9
- Патент РФ № 2522892
- Phelps ME. Positron emission tomography provides molecular imaging of biological processes. Proc Nat Acad Sci USA 2000; 97: 9226-33
- Herschman HR, MacLaren DC, Iyer M. Seeing is believing: non-invasive, quantitative and repetitive imaging of reporter gene expression in living animals, using positron emission tomography. J Neuro Sci Res 2000; 59: 699-705.


