Сравнение образцов кормов по содержанию в них незаменимых аминокислот
Автор: Артамонов Иван Владимирович
Журнал: АгроЗооТехника @azt-journal
Рубрика: Кормопроизводство, кормление сельскохозяйственных животных и технология кормов
Статья в выпуске: 1 т.5, 2022 года.
Бесплатный доступ
В статье представлены результаты аминокислотного анализа различных видов кормов для крупного рогатого скота. Маркерными аминокислотами выбраны метионин (в форме метионин-сульфона), лизин, лейцин, изолейцин, гистидин, валин. Анализ выполнен методом высокоэффективной жидкостной хроматографии с использованием Na-ионообменных колонок с постколоночной дериватизацией. Исследованы образцы силоса, травосмесей, комбикорма, полученные от различных производителей и животноводческих хозяйств. Также в ходе работы установлены ограничения используемого сочетания оборудования и методики, включая нижний предел концентрации аминокислот в анализируемых образцах. Цель исследования -определить различия в аминокислотном составе разных видов кормов. Задачи: апробация метода определения аминокислотного состава в условиях лаборатории, анализ спектра образцов кормов, сравнение их по количественному содержанию аминокислот. Такой подход, заключающийся в анализе рационов с точки зрения элементарного состава, относительно нов. При этом появляются научно обоснованные возможности для балансирования рационов как через изменение состава кормовых смесей с учетом их аминокислотного состава, так и через внесение в кормовые смеси отдельных аминокислот или добавок с высоким их содержанием.
Высокоэффективная жидкостная хроматография, ионообменная хроматография, корма, аминокислоты, белок
Короткий адрес: https://sciup.org/147236318
IDR: 147236318 | УДК: 636.085.3 | DOI: 10.15838/alt.2022.5.1.1
Текст научной статьи Сравнение образцов кормов по содержанию в них незаменимых аминокислот
Качество кормов сельскохозяйственных животных может быть определено по нескольким критериям, среди которых одним из основных выступает содержание белка, так как протеины – важнейшая группа соединений, напрямую влияющих на питательную ценность корма.
Однако сам факт высокого содержания белка в кормах не является исчерпываю- щим критерием (Рядчиков, 2007). Сельское хозяйство нуждается в полноценном белке, удовлетворяющем потребности животных, например, в незаменимых аминокислотах, что составляет одну из предпосылок их высокой продуктивности (Toomer et al., 2020). Однако фактическая потребность мирового животноводства в белке при существующей кормовой базе, по некоторым оценкам, сей- час удовлетворена на 70–75% (Логвинова и др., 2016; Титарева и др., 2018).
Вопрос о качестве кормов можно перевести в другую плоскость, а именно – аминокислотного состава. При этом важно разделять свободные аминокислоты, так или иначе присутствующие в кормовых смесях и имеющие естественное происхождение или являющиеся добавками, и общие аминокислоты, куда включаются как свободные, так и входящие в состав белков. Результаты таких исследований могут стать основой для коррекции рационов путем внесения основных аминокислот, получаемых синтетическим путем (таковыми в настоящее время являются, например, метионин, треонин, лизин, триптофан) (Измаилович, 2010).
Для высокопродуктивных пород сельскохозяйственных животных балансирование рационов незаменимыми аминокислотами становится определяющим фактором. Тем не менее, этот аспект в российской практике разработан недостаточно, включая как сами принципы балансирования, так и схемы расчета добавок (Харитонов, 2010; Харитонов и др., 2018).
В зарубежной практике вопросам аминокислотного состава кормов уделяется особое внимание. Исследуется не только содержание и доступность аминокислот в кормовой базе, но и их непосредственная усвояемость различными группами сельскохозяйственных животных и птицы (Lemme et al., 2004), влияние недостатка аминокислот в рационах на разных стадиях развития животных (Nyachoti et al., 2006) и множество других аспектов (Chung, Baker, 1992).
Будучи составными частями белков и, следовательно, ферментов, аминокислоты являются необходимым условием нормального углеводного, липидного обмена. Некоторые аминокислоты представляют из себя предшественников других важных для организма соединений (например, адреналина, тироксина, меланина, пуринов, пиримидинов) (Николаев и др., 2014).
Методики определения аминокислот сводятся преимущественно к высокоэффективной жидкостной хроматографии (ВЭЖХ) – надежному и точному методу, который, тем не менее, имеет объективные недостатки.
Во-первых, при определении общих аминокислот невозможно выявить их источник. Свободные аминокислоты, аминокислоты перевариваемого и непере-вариваемого белка будут определяться совместно. Это необходимо учитывать. Так, например, в случае растительных источников усвояемость белка может не превышать 30%.
Во-вторых, некоторые аминокислоты (например, триптофан) разрушаются при кислотном гидролизе и должны определяться с использованием иного процесса пробоподготовки (Molnar-Perl, 1999; Yust et al., 2004). Тем не менее, жидкостная хроматография – один из наиболее точных и чувствительных методов определения аминокислот в сравнении с другими (Sherwood, 1990; Joseph, Davies, 1983).
Различные корма существенно отличаются не только по содержанию белка, но и по его аминокислотному составу и доступности аминокислот (Lund et al., 2008). Так, например, весьма распространенный источник белка – соя – может стать причиной недостатка метионина, который практически не содержится в белках сои (Friedman, Brandon, 2001). В некоторых случаях показано, что чрезмерное потребление отдельных аминокислот приводит к тому, что они престают нормально усваиваться (Yin et al., 2019).
Следовательно, правильное сочетание аминокислот в рационах является условием эффективного животноводства. Недостаток аминокислот препятствует синтезу протеинов и тормозит рост, избыток же приводит к дополнительным энергоза- тратам и увеличивает нагрузку на выделительную систему (Семенов и др., 2011). В свою очередь тип кормов прямым образом влияет на усвояемость аминокислот (Barua et al., 2021).
Цель работы – апробация метода анализа аминокислотного состава растительных образцов, включая образцы кормов, средствами высокоэффективной жидкостной хроматографии. Для этого были поставлены и решены следующие задачи: выбор конкретного метода разделения; подбор начальных условий, включая степень разведения образцов перед анализом; построение градуировок хроматографической системы; многократный анализ образцов для определения стабильности разделения и повторяемости результата.
Методика
Анализируемые образцы представляют собой различные по составу кормовые смеси, включая силосы, кормосмеси, травосмеси, комбикорма, полученные из различных хозяйств Вологодской области, а также образцы семян бобовых, собранные сотрудниками СЗНИИМЛПХ с опытных посевов.
Пробоподготовка выполнена в соответствии с ГОСТ 32195-20131. Измельченный до отсева на сите 0,5 мм растительный образец массой около 0,4 г, взвешенный с точностью до 0,0001 г, подвергали окислению смесью перекиси водорода и муравьиной кислоты в течение часа. Остаточную пермуравьиную кислоту нейтрализовали метабисульфитом натрия массой 0,84 г. Далее образец подвергали гидролизу 6М соляной кислотой в течение 24 часов. По окончании времени гидролиза образцы нейтрализовали 7,5М рас- твором гидроксида натрия и доводили рН до 2,20. Полученный раствор доводили цитратным буфером с рН = 2,20 до объема 200 мл. Аликвоту фильтровали через мембранный фильтр 0,45 мкм и переносили в виалу из темного стекла. Готовые пробы хранили при температуре 1–2 °С не более недели.
Перед вводом в хроматограф пробу разводили цитратным буфером в соотношении 1 : 1 (объем : объем) и переносили в хроматографическую виалу. Ввод осуществлялся посредством автосэмплера Shimadzu SIL-20A. Объем ввода составил 100 мкл. Полное разделение гарантированно достигается при концентрации аминокислот не более 0,5 мкМоль/мл. При больших концентрациях некоторые пары аминокислот могут либо не разделяться, либо разделяться не полностью. В случае неполного разделения проба разводилась в соотношении 1 : 4 и повторно вводилась в хроматограф2.
Разделение производилось на Na-ионообменной колонке производства Sevko с последующей дериватизацией нингидрином и детектированием дериватов диодноматричным детектором Shimadzu SPD-M20A на длинах волн 440 нм для деривата пролина3 и 570 нм – для всех остальных дериватов (Friedman, 2004). Описанным способом возможно полное разделение 18 протеиногенных аминокислот (Pickering, Ofitserova, 2006).
Хроматограмма смешанного стандарта аминокислот и калибровочная кривая представлены на рис. 1, 2.
Полученные в двух повторениях хроматограммы обрабатывали в программе LabSolution. Последующие вычисления производили в MS Excel.
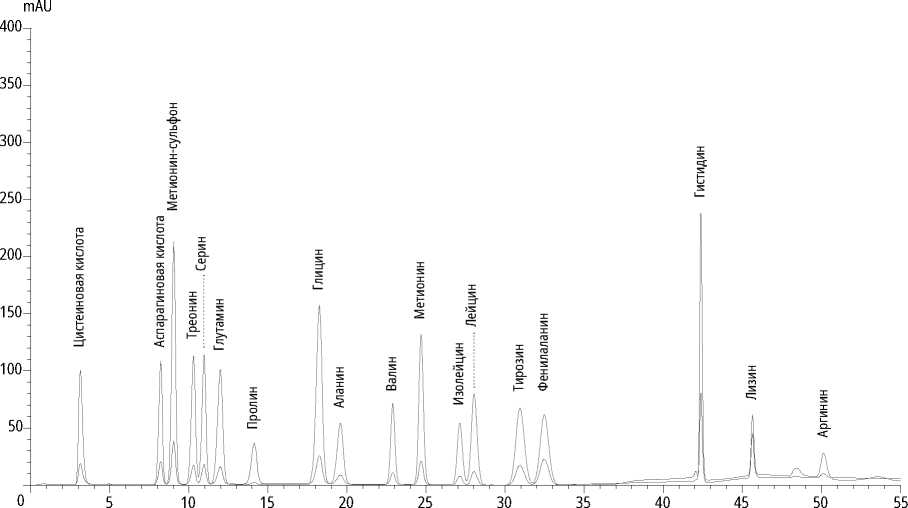
Рис. 1. Хроматограмма смешанного стандарта аминокислот концентрацией 0,25 мкМоль/мл для двух длин волн детектирования (440 и 570 нм)
Источник: составлено автором.
Площадь [*10^6]
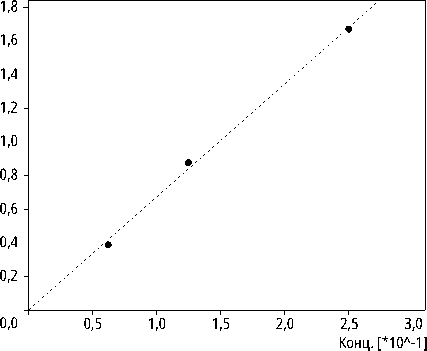
Рис. 2. Калибровочная кривая цистеиновой кислоты, полученная на основе разделения градуировочных растворов смешанного стандарта с концентрациями 0.25, 0.125, 0.0625 мкМоль/мл (для остальных аминокислот построены аналогичные калибровочные кривые)
Источник: составлено автором.
Приведенная методика представляет собой классический вариант разделения и определения аминокислот. Существующие на сегодня иные варианты (на- пример, с предколоночной дериватиза-цией о-фталевым альдегидом (Tcherkas, Denisenko, 2001), фенилизотиоцианатом (Albin et al., 2000), нафаталинальдегидом, дансилхлоридом (Kang et al., 2006) и т. д.) могут быть более чувствительными и не требовать дополнительного оборудования (реакторов для дериватизации, отдельного типа хроматографических колонок), а также иметь большую селективность. Но при этом метод с постколоночной дериватизацией менее чувствителен к ошибкам, не требует сложной пробо-подготовки и при ее корректном выполнении обладает высокой линейностью и чувствительностью.
Результаты
В качестве маркерных использовались незаменимые аминокислоты: валин, изолейцин, лейцин, гистидин, лизин, метионин. Так как последний перед кислотным гидролизом подвергается окислению, его учет ведется в форме метионин-сульфо-на, который образуется при окислении количественно. В случаях, когда в пробах определяются остаточные количества метионина (как правило, это сотые доли процента от общего количества аминокислот), количества метионина и мети-онин-сульфона складываются. В случае если содержание остаточного метионина велико, пробоподготовку и анализ проводят повторно, изменяя, например, степень размола.
Количественное (граммов на 100 граммов исходного сухого образца) содержание маркерных аминокислот в исследованных кормах приведено в табл. 1.
Доля маркерных аминокислот от общего количества определенных аминокислот представлена в табл. 2. Так как никакими иными способами белок в исследованных образцах не выявлялся, доля указанных аминокислот вычислялась от суммы всех определяемых описанным выше методом аминокислот.
Маркерные аминокислоты в сумме составляют в среднем 30% от общего количества определяемых аминокислот.
В целом все исследованные образцы сбалансированы по содержанию исследуемых аминокислот, то есть содержат их
Таблица 1. Содержание маркерных аминокислот в исследованных образцах, г на 100 г сухого вещества
|
Показатель |
Валин |
Изолейцин |
Лейцин |
Гистидин |
Лизин |
Метионин |
Сумма |
|
Силос-1 |
0,332 |
0,246 |
0,409 |
0,047 |
0,103 |
0,095 |
1,232 |
|
Силос-2 |
0,221 |
0,162 |
0,273 |
0,040 |
0,146 |
0,049 |
0,889 |
|
Кормосмесь |
0,343 |
0,206 |
0,369 |
0,043 |
0,169 |
0,068 |
1,198 |
|
Сено |
0,111 |
0,062 |
0,095 |
0,012 |
0,048 |
0,028 |
0,356 |
|
Комбикорм |
0,212 |
0,157 |
0,291 |
0,049 |
0,559 |
0,050 |
1,319 |
|
Травосмесь-1 |
0,693 |
0,534 |
1,095 |
0,397 |
0,834 |
0,235 |
3,787 |
|
Травосмесь-2 |
0,376 |
0,313 |
0,636 |
0,130 |
0,216 |
0,141 |
1,811 |
|
Люпин |
1,071 |
1,112 |
2,003 |
0,428 |
1,637 |
0,143 |
6,393 |
|
Кормовые бобы |
1,385 |
1,276 |
2,470 |
0,816 |
2,305 |
0,201 |
8,453 |
|
Вика яровая |
0,898 |
0,793 |
1,397 |
0,438 |
1,790 |
0,138 |
5,454 |
|
Горох полевой |
0,972 |
0,879 |
1,629 |
0,528 |
1,991 |
0,153 |
6,151 |
|
Источник: составлено автором. |
|||||||
Таблица 2. Доля маркерных аминокислот в исследованных образцах, % от общего определенного содержания
|
Показатель |
Валин |
Изолейцин |
Лейцин |
Гистидин |
Лизин |
Метионин |
% от общего |
|
Силос-1 |
8,374 |
6,223 |
10,323 |
1,190 |
2,610 |
2,400 |
31,120 |
|
Силос-2 |
8,108 |
5,938 |
10,040 |
1,454 |
5,364 |
1,788 |
32,691 |
|
Кормосмесь |
8,720 |
5,225 |
9,379 |
1,104 |
4,290 |
1,725 |
30,442 |
|
Сено |
9,248 |
5,156 |
7,874 |
1,003 |
4,021 |
2,368 |
29,669 |
|
Комбикорм |
5,608 |
4,155 |
7,676 |
1,306 |
14,767 |
1,328 |
34,839 |
|
Травосмесь-1 |
5,013 |
3,863 |
7,924 |
2,874 |
6,039 |
1,704 |
27,417 |
|
Травосмесь-2 |
6,092 |
5,063 |
10,295 |
2,106 |
3,504 |
2,276 |
29,336 |
|
Люпин |
4,539 |
4,714 |
8,490 |
1,814 |
6,937 |
0,604 |
27,097 |
|
Кормовые бобы |
4,685 |
4,318 |
8,360 |
2,761 |
7,801 |
0,681 |
28,607 |
|
Вика яровая |
5,201 |
4,594 |
8,091 |
2,535 |
10,368 |
0,798 |
31,586 |
|
Горох полевой |
4,819 |
4,359 |
8,083 |
2,619 |
9,876 |
0,757 |
30,513 |
|
Источник: составлено автором. |
|||||||
Таблица 3. Относительное содержание маркерных аминокислот в образцах кормов со сравнимой суммой определяемых аминокислот (выделены наибольшие значения, приведены эквивалентные количества корма, необходимые для компенсации низкого содержания данной аминокислоты), г на 100 г сухого вещества
Необходимо, однако, соотносить эти цифры с общим содержанием белка в образцах и долей усвояемого белка, а с поправкой на влажность кормов содержание аминокислот в них будет еще ниже.
С учетом полученных значений содержания аминокислот в исследованных образцах растительных кормов и их компонентов становится очевидной необходимость такого анализа при балансировании рационов не только по основным группам питательных веществ (белки, витамины, углеводы и т. д.).
Образцы силоса 185, кормосмеси 190 и комбикорма 192 содержат практически одинаковое количество аминокислот (3,96, 3,93 и 3,79 г аминокислот в сумме соответственно), но по содержанию аминокислот существенно отличаются. Соот- ношение содержания маркерных аминокислот в указанных образцах приведено в табл. 3.
Так, чтобы получить такое же количество метионина, какое содержится в образце силоса 185, потребуется в 1,4 раза большее количество кормосмеси 190 и в 1,9 раза большее количество комбикорма 192. Для получения лизина в количестве, аналогичном получаемому из комбикорма 192, потребуется в 3,3 раза большее количество кормосмеси 190 и в 5,4 раза большее количество силоса 185.
Выводы
Очевидно, что различные виды кормов в силу происхождения и состава отличаются содержанием аминокислот в белках. Эта особенность прямым образом отражается на их питательности. Число и количество доступных для усвоения аминокислот – один из важнейших факторов полноценности корма.
Имея в своем распоряжении данные об аминокислотном составе используемых кормов и добавок, животноводческие хозяйства получают возможность составлять рационы более точно и в соответствии с конкретными потребностями различных групп животных.
Это касается не только крупного рогатого скота, на котором обычно сосредоточены исследования кормовой базы, но и птицеводства, мясного животноводства, а также рыбного хозяйства и прочих отраслей сельского хозяйства.
В свою очередь ВЭЖХ (как примененный в данном случае метод ионообменной хроматографии, так и классические обращенно-фазовые методы) является эффективным средством анализа аминокислотного состава, имеющим сравнительно низкую себестоимость и достаточно высокую точность, несмотря на указанные ранее недостатки.
Кроме того, существует множество реализаций ВЭЖХ, дающих возможность расширенного анализа аминокислотного состава, включая и не определяемые в примененной методике аминокислоты, а также метод сверхвысокоэффективной жидкостной хроматографии (УВЭЖХ), позволяющий кратно уменьшить время анализа4.
Список литературы Сравнение образцов кормов по содержанию в них незаменимых аминокислот
- Измаилович И.Б. (2010). Актуальные проблемы кормового белка // Вестн. АПК Верхневолжья. № 12. С. 31–33.
- Логвинова Т.И., Колодина Е.Н., Артемьева О.А., Никанова Д.А. (2016). Изучение свойств штаммов дрожжей, в качестве микробиологических продуцентов кормового белка // Актуальные проблемы гуманитарных и естественных наук. № 12 (1). С. 57–61. DOI: https://doi.org/10.3929/ethz-b-000238666
- Николаев С.И., Карапетян А.К., Корнилова Е.В. (2014). Сравнительный аминокислотный состав кормов // Изв. Нижневолж. агроуниверситетского комплекса: наука и высшее профессиональное образование. № 3 (35). С. 126–130.
- Рядчиков В.Г. (2007). Нормы потребности свиней мясных пород и кроссов в энергии и переваримых аминокислотах // Политематический сетевой электронный журн. Кубан. гос. аграрн. ун-та. № 34. С. 188–216.
- Семенов В.В., Кононенко С.И., Кононенко И.С. (2011). Питательность и аминокислотный состав сортов зерна сорго, используемых в кормлении животных // Сб. науч. тр. Ставроп. науч.-иссл. ин-та животноводства и кормопроизводства. № 1 (4–1). С. 86–88.
- Титарева Т., Петрович Э., Петрович В. (2018). Обеспечение кормовым белком отечественного производства – важное условие повышения экономической эффективности животноводства // Организационно-правовые аспекты инновационного развития агробизнеса. № 15. С. 119–123.
- Харитонов Е.Л. (2010). Современные проблемы при организации нормированного питания высокопродуктивного молочного скота // Молочное и мясное скотоводство. № 4. С. 16–18.
- Харитонов Е.Л., Березин А.С. (2018). Физиологические основы оптимизации аминокислотного питания молочного скота // Вестн. науки и образования. № 18–1 (45). С. 56–60.
- Albin D.M., Wubben J.E., Gabert V.M. (2000). Effect of hydrolysis time on the determination of amino acids in samples of soybean products with ion-exchange chromatography or precolumn derivatization with phenyl isothiocyanate. Journal of Agricultural and Food Chemistry, 48 (5), 1684–1691. DOI: 10.1021/jf990599q
- Barua M., Abdollahi M., Zaefarian F., Wester T., Girish C., Ravindran V. (2021). Influence of feed form on the standardised ileal amino acid digestibility of common grains for broiler chickens. Animal Feed Science and Technology, 272, 114743. DOI: 10.1016/j.anifeedsci.2020.114743
- Chung T.K., Baker D.H. (1992). Ideal amino acid pattern for 10-kilogram pigs. Journal of Animal Science, 70 (10), 3102–3111. DOI: 10.2527/1992.70103102x
- Friedman M. (2004). Applications of the ninhydrin reaction for analysis of amino acids, peptides, and proteins to agricultural and biomedical sciences. Journal of Agricultural and Food Chemistry, 52 (3), 385–406. DOI: 10.1021/jf030490p
- Friedman M., Brandon D.L. (2001). Nutritional and health benefits of soy proteins. Journal of Agricultural and Food Chemistry, 49 (3), 1069–1086. DOI: 10.1021/jf0009246
- Joseph M.H., Davies P. (1983). Electrochemical activity of o-phthalaldehyde-mercaptoethanol derivatives of amino acids. Application to high-performance liquid chromatographic determination of amino acids in plasma and other biological materials. Journal of Chromatography, 277, 125–136. Available at: http://www.ncbi.nlm.nih.gov/pubmed/6643598
- Kang X., Xiao J., Huang X., Gu Z. (2006). Optimization of dansyl derivatization and chromatographic conditions in the determination of neuroactive amino acids of biological samples. Clinica Chimica Acta, 366 (1–2), 352–356. DOI: 10.1016/j.cca.2005.11.011
- Lemme A., Ravindran V., Bryden W.L. (2004). Ileal digestibility of amino acids in feed ingredients for broilers. World’s Poultry Science Journal, 60 (4), 423–438. DOI: 10.1079/WPS200426
- Lund P., Weisbjerg M.R., Hvelplund T. (2008). Profile of digested feed amino acids from untreated and expander treated feeds estimated using in situ methods in dairy cows. Livestock Science, 114 (1), 62–74. DOI: 10.1016/j.livsci.2007.04.012
- Molnar-Perl I. (1999). Advances in the analysis of tryptophan and its related compounds by chromatography. In: Huether G. et al. (eds.). Tryptophan, Serotonin and Melatonin: Basic Aspects and Application. New York. Pp. 801–816.
- Nyachoti C.M., Omogbenigun F., Rademacher M., Blank G. (2006). Performance responses and indicators of gastrointestinal health in early-weaned pigs fed low-protein amino acid-supplemented diets1. Journal of Animal Science, 84 (1), 125–134. DOI: 10.2527/2006.841125x
- Pickering M., Ofitserova M. (2006). Persistence of cation-exchange chromatography for analysis of free amino acids. Drug Development, 70–72.
- Sherwood R.A. (1990). Amino acid measurement by high-performance liquid chromatography using electrochemical detection. Journal of Neuroscience Methods, 34 (1–3), 17–22. DOI: 10.1016/0165-0270(90)90037-G
- Tcherkas Y.V., Denisenko A.D. (2001). Simultaneous determination of several amino acids, including homocysteine, cysteine and glutamic acid, in human plasma by isocratic reversed-phase highperformance liquid chromatography with fluorimetric detection. Journal of Chromatography A, 913 (1–2), 309–313. DOI: 10.1016/S0021-9673(00)01201-2
- Toomer O.T. et al. (2020). Feeding high-oleic peanuts to meat-type broiler chickens enhances the fatty acid profile of the meat produced. Poultry Science, 99 (4), 2236–2245. DOI: 10.1016/j.psj.2019.11.015
- Yin D. et al. (2019). Extending daily feed access intervals does not influence lysine HCl utilization but enhances amino acid digestibilities in broiler chickens. Poultry Science, 98 (10), 4801–4814. DOI: 10.3382/PS/PEZ200
- Yust M., Pedroche J., Giron-Calle J., Vioque J., Millan F., Alaiz M. (2004). Determination of tryptophan by high-performance liquid chromatography of alkaline hydrolysates with spectrophotometric detection. Food Chemistry, 85 (2), 317–320. DOI: 10.1016/j.foodchem.2003.07.026


