Сравнение результатов определения цианотоксинов (анатоксина-А и микроцистина-RR) методом хромато-масс-спектрометрии, полученных с помощью приборов с различными типами ионных ловушек
Автор: Русских Яна Владимировна, Чернова Е.Н., Некрасова Л.В., Царев В.С., Подольская Е.П., Жаковская З.А.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
В работе сравниваются результаты хромато-масс-спектрометрического определения цианобактериальных токсинов на примере анатоксина-а (Ana-a) и микроцистина-RR (MC-RR) на приборах с различными типами ионных ловушек. Рассматриваются данные, полученные на хромато-масс-спектрометрах LCMS-IT-TOF (фирмы "Shimadzu") и LTQ Orbitrap (фирмы "Thermo Finnigan"). Исследования проводили на растворах стандартов и модельных системах.
Цианотоксины, хроматография, масс-спектрометрия, тандемная масс-спектрометрия, преобразование фурье, линейная ионная ловушка
Короткий адрес: https://sciup.org/14264674
IDR: 14264674 | УДК: 543+
Текст научной статьи Сравнение результатов определения цианотоксинов (анатоксина-А и микроцистина-RR) методом хромато-масс-спектрометрии, полученных с помощью приборов с различными типами ионных ловушек
В связи с увеличением антропогенной нагрузки вегетация (цветение) сине-зеленых водорослей (цианобактерий) становится все более интенсивной и широко распространенной даже в ранее "нецветущих" водоемах. Известно, что некоторые метаболиты цианобактерий — цианотоксины — представляют опасность для здоровья людей и животных [1–3]. Цианотоксины различают по способу воздействия на живые организмы на несколько групп, из которых для пресноводных водоемов наиболее актуальны нейротоксины (анатоксины) и гепатотоксины (микроцистины) [2, 4–7].
Биоаналитические методы определения микроцистинов (иммуноферментный анализ ELISA и исследования ингибирования фосфатазной активности белков) [8–10] успешно применяются в качестве первичного тестового анализа в полевых условиях. Однако для нейротоксинов и микроцистинов требуются раздельное ферментное ингибирование и иммуноферментный анализ.
Для раздельного определения данных групп токсичных соединений используются различные физико-химические методы [11–13]. С их помощью возможно проводить разделение компонентов смеси и их количественное определение, т. к. различные микроцистины обладают различной токсичностью. Метод высокоэффективной жидкостной хроматографии с УФ-детектированием, широко использовавшийся ранее, может быть недостаточно селективным и определять в основном общее количество микроцистинов, поскольку они имеют сходные УФ-спектры поглощения, а анатоксины практически не поглощают в УФ-диапазоне [12]. Надежная идентификация в этом случае требует дорогостоящих стандартных образцов всех обнаруженных токсинов. Кроме того, влияние матрицы может уменьшать чувствительность аналитического определения.
Метод жидкостной хроматографии—масс-спектрометрии (LC-MS) лишен этих недостатков, особенно в сочетании с тандемной масс-спектрометрией (MS-MS) высокого разрешения, применяемой в анализе цианотоксинов в последние годы [14–16]. В этом случае надежность идентификации достигается сочетанием информации, полученной из фрагментных масс-спектров и точных значений молекулярных масс, избирательно характеризующих определяемые соединения.
В последнее время уделяется большое внимание проблемe интеркалибрации результатов, полученных различными лабораториями на разном оборудовании. Поэтому было интересно сравнить результаты хромато-масс-спектрометрического определения цианобактериальных токсинов на примере анатоксина-а и микроцистина-RR, полученные на хромато-масс-спектрометрах LCMS-IT-TOF (фирмы "Shimadzu") и LTQ Orbitrap (фирмы "Thermo Finnigan"). Была разработана методика определения присутствия цианотоксинов в природной воде методом высокоэффективной жидкостной хроматографии—масс-спектрометрии высокого разрешения с использованием тандемной масс-спектрометрии высокого разрешения.
Entrance Ring Exit
Endcap Electrode Endcap
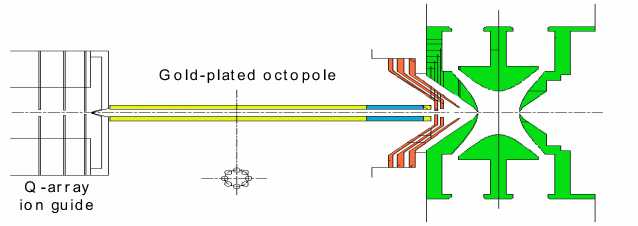
Рис. 1. Принципиальная схема прибора LCMS-IT-TOF (фирмы "Shimadzu")
D ifferentially pum ped quadrupole ion trap
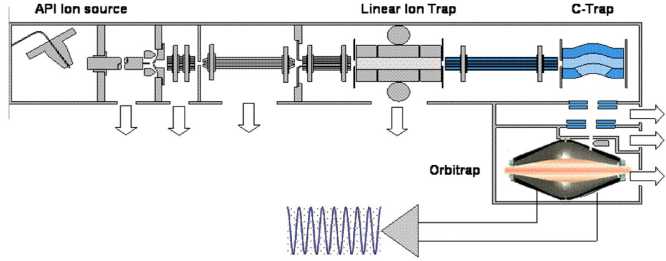
Рис. 2. Принципиальная схема прибора LTQ Orbitrap (фирмы "Thermo Finnigan")
Хромато-масс - спектрометр LCMS-IT-TOF (Shimadzu) является комбинацией жидкостного хроматографа и масс-спектрометра с системой ввода образца электроспрей (ESI), ионной ловушкой и времяпролетным детектором. Прибор может одновременно регистрировать спектры положительных и отрицательных ионов (время переключения 100 мс). Эффективность ввода ионов в ионную ловушку и высокую чувствительность в MS n -режимах (CID) (чувствительность по резерпину в MS-MS режиме — 5 пг при соотношении сиг-нал/шум 50:1) обеспечивает устройство компрессионной инжекции ионов в систему ионной оптики из жидкостного хроматографа. Прибор оснащен квадрупольной ионной ловушкой с технологией "охлаждения" ионов с использованием аргона. Двухступенчатый рефлектрон (DSR) и баллистическая экстракция ионов (BIE) позволяют проводить MS n -анализ до MS10, обеспечивая высокое разрешение ( R ≥ 10 000) и высокую точность (5 ppm — с внутренним стандартом и 10 ppm — с внешним) во всех использовавшихся режимах работы: MS, MS-MS (MS2) и MS-MS-MS (MS3). Рабочий режим находится в интервале масс m / z от 50 до 5000 (3000 при MS-MS). Рекомендуемая точность выделения иона-прекурсора — 3 Да. Принципиальная схема прибора LCMS-IT-TOF представлена на рис. 1.
LTQ Orbitrap (Thermo Finnigan) является комбинацией высокоэффективного жидкостного хроматографа и тандемного масс-спектрометра высокого разрешения. В приборе предусмотрены различные способы ионизации образца: электроспрей (ESI), химическая ионизация при атмосферном давлении (APCI), атмосферная фотоионизация (APPI). Разделение ионов осуществляется в двух видах ионных ловушек: в линейной квадрупольной ловушке CID, которая может работать как отдельный прибор, и в орбитальной ловушке. Стандартный режим работы LTQ Orbitrap предусматривает время сканирования в 1 с, из которых 750 мс ионы находятся в орбитальной ловушке, где происходит их детектирование. Так как путь переноса ионов в орбитальную ловушку короток и ионы ускоряются линзами ионной оптики переноса, отсутствует эффект дискриминации по массам за счет времяпролетного эффекта. А малая величина целевого значения ионного времени позволяет повысить качество MS n .
Прибор имеет широкий динамический диапазон (m/z от 50 до 2000 или от 200 до 4000), высокую чувствительность (при использовании внешнего стандарта — 5 ppm, при использовании внутреннего стандарта — 2 ppm), разрешение 30 000 или 60 000. Тандемные масс-спектры можно регистрировать в ионной ловушке в CID-режиме и/или в орбитальной ловушке в HCD или PQR-режимах при заданной варьируемой энергии столкновений в диапазоне от 1 до 100 %. Точность определения масс не зависит от интенсивности пиков и является достаточно постоянной величиной в пределах калибровки (от недели до месяца) при неизменной температуре в помещении.
Принципиальная схема прибора LTQ Orbitrap (фирмы "Thermo Finnigan") приведена на рис. 2.
МАТЕРИАЛЫ И МЕТОДЫ
В данной работе использованы следующие реактивы: ацетонитрил сорта "0" Криохром и Super Gradient (LAB SCAN, Ireland); метанол марки LC-MS CHROMASOLV (Fluka); бидистиллированная вода, полученная с помощью системы Milli-Q (Millipore, электропроводность 0.056 мкСм/см при 25 ºС); трифторуксусная кислота (ТФУ), очищенная перегонкой. Аналитические стандарты: ана-токсин-a фумарат (A. G. Scientific, Inc., CA и TOCRIS bioscience, UK), микроцистин-RR (Alexis Biochemicals).
Использовали растворы смеси стандартов различной концентрации и модельные растворы, которые готовили следующим образом. К 100 мл природной воды добавляли по 10 мкг каждого аналитического стандарта и выдерживали в течение 40 мин. рН полученной смеси доводили до 10 добавлением 1 М раствора NaOH по каплям, а затем пропускали через диски для твердофазной экстракции ENVI-18 DSK (диаметр 47 мм, Supelco) в течение 40 мин. После фильтрации диски сушили в токе воздуха до постоянной массы. Аналиты элюировали 50 мл метанола в течение 15 мин. Фильтрацию и элюирование проводили с по- мощью водоструйного насоса. Элюат концентрировали до влажного остатка на роторном испарителе и перерастворяли в 1.5 мл водно-ацетонитрильной (95:5) смеси, содержащей 0.01 % ТФУ.
Для хроматографического разделения использовали колонку с обращенной фазой С-18 Thermo Hypersil Gold 100 × 3 мм, зернение 3 мкм, в градиентном режиме хроматографирования. Элюент А — 0.01 %-й водный раствор ТФУ. Элюент В — 0.01 %-й раствор ТФУ в ацетонитриле. Градиент: 0–2 мин — 5 % В; 2–12 мин — 5–75 % В; 17.0– 17.1 мин — 75–5 % В. Поток элюента 0.2 мл/мин.
Масс-спектрометрический анализ на обоих приборах проводили в условиях электрораспыли-тельной ионизации в режиме регистрации положительных ионов. На LCMS-IT-TOF масс-спектры регистрировали в интервале масс m / z 100–650 Да, напряжение на детекторе составляло 1.6 кВ.
MS2-режим: CID (ионная ловушка), энергия столкновений 5–50 %, энергия газа (соударений) Col. Gas 50 %, q (Frequency) = 0.169. На хромато-масс-спектрометре Orbitrap масс-анализатор в режиме MS1 — орбитальная ловушка, разрешение 30 000. Диапазон масс m / z 100–1200 Дa. MS2-режим: HCD (орбитальная ловушка) или CID (ионная ловушка), энергия столкновений 5–45 %.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
С использованием описанных выше приборов были получены УФ- и масс-спектры растворов исследуемых стандартов (анатоксина-а и микроцис-тина-RR) и модельных растворов, содержащих добавки указанных стандартов. При сравнении УФ-спектров проб отмечено, что лучшее разделение,
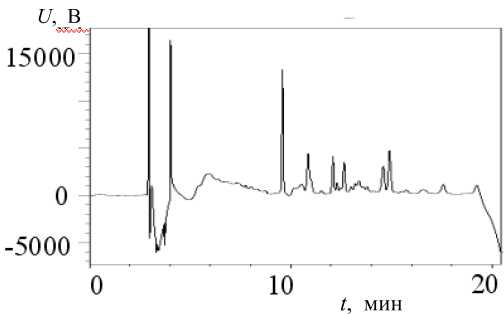
Рис. 3. Хроматограмма раствора смеси стандартов MC-RR и Ana-a (по 3.5 нг на ввод), полученная с использованием PDA-матрицы прибора LCMS-IT-TOF
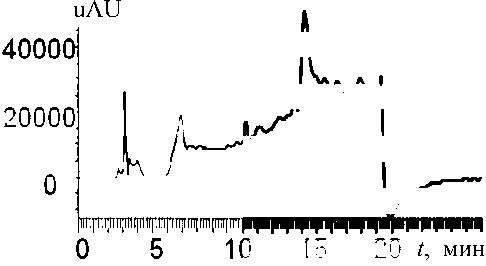
Рис. 4. Хроматограмма раствора смеси стандартов MC-RR и Ana-a (по 1 нг на ввод), полученная с использованием хроматографа Accela (LTQ Orbitrap)
более четкие пики и ровная фоновая линия достигаются на PDA-матрице хроматографа фирмы "Shimadzu" (рис. 3). Хроматограммы, полученные с помощью хроматографа Accela ("Thermo Finnigan"), часто не дают нужной информации, т. к. имеют нестабильную "плывущую" фоновую линию, что существенно осложняет обработку нужного хроматографического пика (рис. 4).
При анализе масс-спектрометрических данных идентификацию соединений проводили по точным массам ионов и хроматографическим временам удерживания (совпадение с аналитическим стандартом в пределах 0.3 мин). Для анатоксина-а характеристичным является положительно-заряженный ион МН+ с m / z 166.12, микроцистин-RR отслеживали по двухзарядному иону М2Н+ с m / z 519.79. Результаты определения аналитов в модельных растворах выборочно подтверждали фрагментными спектрами MS-MS, сравнивая экспериментальные масс-спектры модельных растворов со спектрами аналитических стандартов ана-токсина-a и микроцистина-RR. При анализе стандарта MC-RR (в концентрации 100 нг/мл) мы практически не наблюдали пика однозарядного протонированного иона 1038.57, но четко фиксировали сигнал двузарядного протонированного иона 519.79 (см. Приложение, рис. П1, П2). В структуре MC-RR содержится 2 концевых остатка аргинина с легко протонируемыми фрагментами гуанидина, что и приводит к появлению сигнала двузарядного протонированного иона в его масс-спектре [16, 17] в отличие от большинства других микроцистинов и нодуларинов (представители второй группы гепатотоксинов). Поэтому именно этот ион был выбран в качестве родительского иона для (MS-MS)-анализа. Порог устойчивого обнаружения микроцистина-RR из растворов стандарта составлял 0.5 нг на ввод в SIM-режиме — для LCMS-IT-TOF и 0.1 нг на ввод — для LTQ Orbitrap. Для анатоксина-а эти величины составили 0.25 и 0.05 нг на ввод соответственно (Приложение, рис. П3).
Тандемная масс-спектрометрия на хромато-масс-спектрометрах LCMS-IT-TOF (фирмы "Shimadzu") и LTQ Orbitrap (фирмы "Thermo Finnigan") имеет существенные отличия.
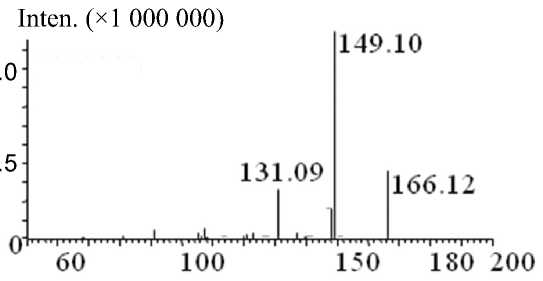
При использовании LCMS-IT-TOF (времяпро-летного хромато-масс-спектрометра) получали тандемные спектры с варьированием величины энергии столкновительной диссоциации CID (от 1 до 50 %). В этих условиях на (MS-MS)-спектре анатоксина-а присутствуют только 2 фрагмента с массами m / z : 166.12 — протонированный молекулярный ион и 149.10 — фрагментарный ион, полученный при потере родительским ионом анаток-сина-а молекулы аммиака NH 3 (Приложение, рис. П4):
МН+ ( m / z 166.12) – NH 3 → МН+ ( m / z 149.10).
На LTQ Orbitrap тандемные спектры получали в 2-х режимах:
– с фрагментацией в линейной ловушке и регистрацией полученных фрагментов в орбитальной ловушке (CID—FTMS)
– и с фрагментацией и регистрацией в орбитальной ловушке (HCD—FTMS). Это позволило получить точные значения фрагментных масс. В обоих случаях на тандемных спектрах анатокси-на-а кроме указанных уже ионов наблюдается также ион с m / z 131.08 (приложение, рис. П5), который соответствует потере воды (–Н 2 О) [17]:
МН+ ( m / z 149.10) – H 2 О → МН+ ( m / z 131.08).
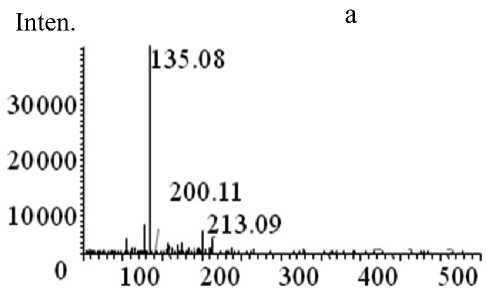
В спектре MS-MS микроцистина-RR, полученном на LCMS-IT-TOF, наблюдали дочерние ионы с m / z 440.98, 298.17 и 135.10 (рис. П6). Дочерний ион с m / z 135.11 является характеристичным для всех микроцистинов ионом, соответствующим немодифицируемому Adda-фрагменту конечного распада микроцистинов — эритро -2-метил-3-метокси-4-фенилмасляной кислоты (PhCH 2 CH (OCH 3 )СН(СН 3 )СООН) [7, 14].
Тандемные спектры MC-RR, полученные на LTQ Orbitrap в режимах HCD—FTMS и CID— FTMS (энергия разбиения от 5 до 45 %) представлены на рис. П7. В режиме HCD—FTMS не удалось подобрать мягких условий фрагментации, и молекулы MC-RR либо не претерпевали деструкции (при 5–25 %), давая в масс-спектре лишь ион прекурсора, либо фрагментировались (при 25– 45 %) до четкого интенсивного пика Adda-фрагмента с m / z 135.08 (рис. П7, а).
В режиме CID при малой величине энергии (10–15 %) также регистрировали только двузарядный ион, но при ее увеличении наблюдали интенсивные ионы фрагментов (рис. П7, б).
Для анализа данных, полученных из тандемных масс-спектров, была использована программа Mass Frontier 5.0 ("Thermo"), которая позволяет рассчитать все теоретически возможные варианты фрагментации этого соединения и структуры заряженного и нейтрального фрагментов. Такая информация значительно облегчает идентификацию изомеров, а в случае исследования проб неизвестного состава позволяет уточнить структуры исследуемых соединений.
Известно, что MC-RR имеет два изомера (рис. 5). Сопоставление теоретических данных, полученных при помощи программы Mass Frontier 5.0 для фрагментации изомеров 1 и 2, с данными реального спектра показало, что в спектре MS-MS стандарта MC-RR наряду с ионами, встречающимися
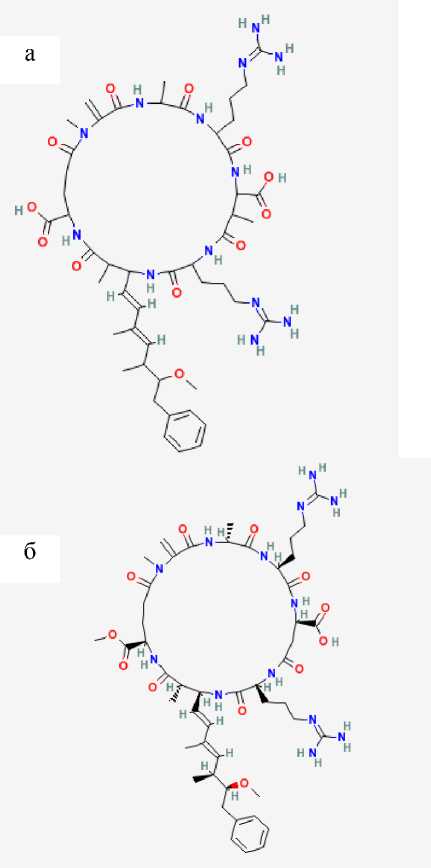
Рис. 5. Структуры изомеров MC-RR C 49 H 75 N 13 O 12 , М Еx = 1038.1997 [г/моль].
а — изомер 1 (CID: 4111340);
б — изомер 2 (CID: 23248162)
при распаде обоих изомеров ( m / z 1020.56, 519.79, 505.79, 452.75, 311.18, 157.11, 135.08), присутствуют ионы, характерные только для фрагментации изомера 1, — 440.22, 423.20, 357.19, 213.09. Следовательно, данный спектр можно приписать изомеру 1 стандарта MC-RR. Данный вывод можно было сделать лишь на основе результатов масс-спектрометрического анализа, выполненного на приборе LTQ Orbitrap, т. к. сигналы, соответствующие ионам при фрагментации изомера 1, в масс-спектрах на LCMS-IT-TOF отсутствуют. Возможно, это связано с трудностями подбора условий для удачного протекания данного пути фрагментации.
Из полученных данных можно заключить, что оба прибора позволяют надежно обнаруживать и идентифицировать цианотоксины, в том числе в составе сложных матриц. Использование прибора LTQ Orbitrap позволяет получить более полную информацию о структуре исследуемых соединений.
Работа выполнена при поддержке проекта РФФИ № 10-08-00895-а "Создание портативной биоаналитической системы для определения нейротоксинов на основе планарных электрохимических биосенсоров для целей экологического мониторинга".
ПРИЛОЖЕНИЕ
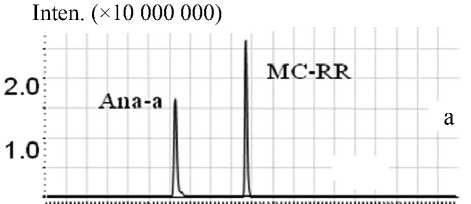
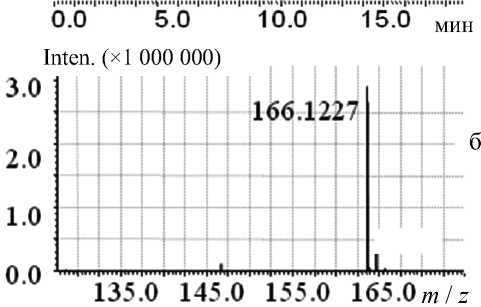
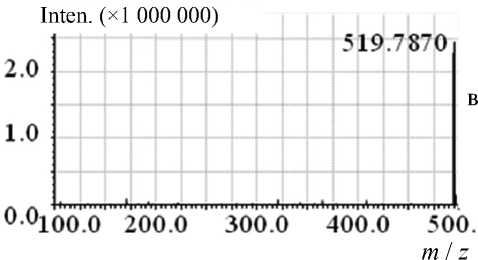
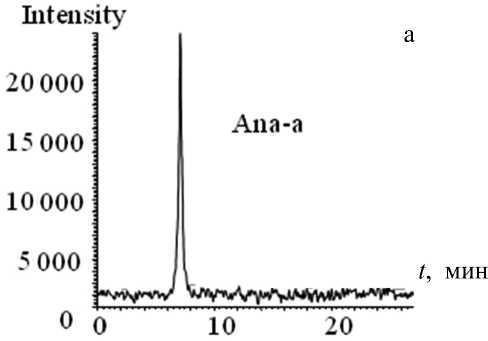
Рис. П1. Результаты анализа LCMS-IT-TOF.
а — масс-хроматограмма (SIM) раствора смеси стандартов MC-RR и Ana-a (по 3.5 нг на ввод); б — масс-спектр раствора стандарта Ana-a (3.5 нг на ввод); в — масс-спектр раствора стандарта MC-RR (3.5 нг на ввод)
|
20000 |
Intensity |
б |
|
|
15000 |
MC-RR |
||
|
10000 |
|||
|
5000 |
t , мин |
||
|
0 |
0 |
10 |
20 |
Intensity
1500 000
1000 000
|
166.12 |
|
|
в |
|
|
№2 . __1 |
|
|
155 165 175 185 195 m / z |
|
|
Intensity 600 000 |
519.79 г |
|
|
400 000 |
520.29 |
|
|
200 000 |
520.79 |
|
|
[521.29 |
||
|
521.79 |
||
|
0 |
500 510 520 m / z |
|
Рис. П2. Результаты анализа LTQ Orbitrap.
а — масс-хроматограмма (SIM) раствора стандарта Ana-a (1 нг на ввод); б — масс-хроматограмма (SIM) раствора стандарта MC-RR (1 нг на ввод); в — масс-спектр раствора стандарта Ana-a (1 нг на ввод); г — масс-спектр раствора стандарта MC-RR (1 нг на ввод)
S пика ×1000
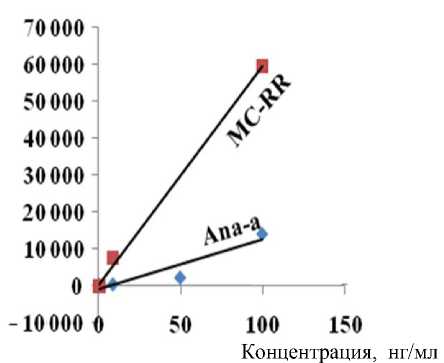
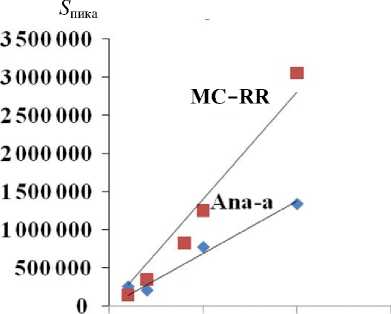
0.5 1 1.5
Концентрация, мкг/мл
Рис. П3. Концентрационная зависимость, полученная для растворов стандартов MC-RR и Ana-a. а — LCMS-IT-TOF; б — LTQ Orbitrap
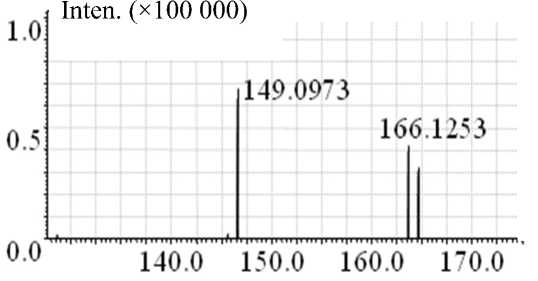
m / z
m / z
Рис. П5. Тандемный масс-спектр анатоксина-а, LTQ Orbitrap (MS 2— CID 35 %)
Рис. П4. Тандемный масс-спектр анатоксина-а, LCMS-IT-TOF (CID 10 %, Col. Gas. 50 %, q = 0.169)
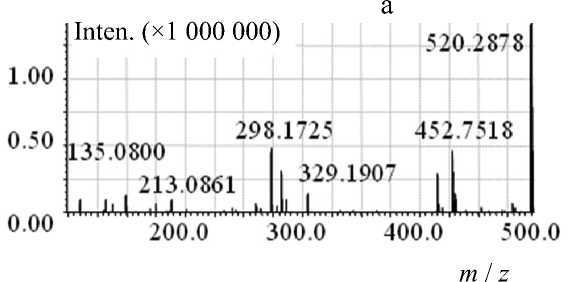
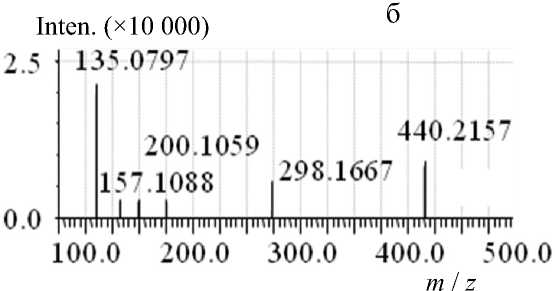
Рис. П6. Тандемный масс-спектр MC-RR, LCMS-IT-TOF.
а — CID 20 %, Col. Gas. 50 %, q = 0.169; б — CID 40 %, Col. Gas. 50 %, q = 0.169
m / z
Inten.
213.09
б
298.17
,329.19
440,13
357.19
505.79
510.78
* i.i и . iii. I )»। 11I 111 ■ I .
1П|П1]11Ц1П|пцп1ПП|и1[1П|1И|1П|пц1П|пцпппЧ,,ЧиЧ,и1,|,П|
400 SOO m / z
Рис. П7. Тандемные масс-спектры MC-RR, LTQ Orbitrap. MS 2 : а — HCD-FTMS 25 %; б — CID-FTMS 35 %


