Сравнение точности оценки коррекции поглощения и размеров опухоли при последовательном выполнении 18F-ФДГ ПЭТ/КТ и ПЭТ/МРТ молочных желез
Автор: Гележе П.Б., Морозов С.П., Шавладзе Н.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 4 т.19, 2019 года.
Бесплатный доступ
Использование гибридных ПЭТ/МРТ систем является перспективным направлением диагностики в маммологии за счет комбинированного получения данных об уровне метаболизма и структуре объемных образований молочных желез. МРТ с динамическим контрастным усилением обладает более высокой диагностической точностью в отношении выявления первичных опухолей молочных желез по сравнению с КТ. Однако коррекция аттенюации при ПЭТ/МРТ сопряжена с техническими сложностями. Цель исследования состояла в оценке точности коррекции аттенюации 18F-ФДГ ПЭТ/МРТ молочных желез по сравнению с 18F-ФДГ ПЭТ/КТ и сравнении размеров первичной опухоли, определяемых при последовательном выполнении 18F-ФДГ ПЭТ/КТ и 18F-ФДГ ПЭТ/МРТ молочных желез. Исследования проводились последовательно, на одном введении радиофармпрепарата, средний интервал между исследованиями составил 43 минуты. На основании анализа и статистической обработки данных сформулирован вывод об идентичности точности коррекции аттенюации ПЭТ на основании методов МРТ и КТ. Для КТ характерна недооценка размеров опухоли по сравнению с данными МРТ, которая не носит систематический характер. Методика 18F-ФДГ ПЭТ/МРТ молочных желез технически выполнима, не уступает 18F-ФДГ ПЭТ/КТ в оценке уровня метаболизма опухоли и имеет преимущество в определении размеров опухоли.
Онкология, пэт/мрт, рак молочной железы
Короткий адрес: https://sciup.org/149132118
IDR: 149132118
Текст научной статьи Сравнение точности оценки коррекции поглощения и размеров опухоли при последовательном выполнении 18F-ФДГ ПЭТ/КТ и ПЭТ/МРТ молочных желез
Список сокращений
18F-ФДГ – 18-фтордезоксиглюкоза
APD – avalanche photodiodes, фотодиоды типа «аваланч»
SUVmax – максимальное значение стандартизованной величины поглощения
ZTE – zero time echo, нулевое время эхо
ДВИ – диффузионно-взвешенные изображения
ИКД – измеряемый коэффициент диффузии
КТ – компьютерная томография
ДКУ – динамическое контрастное усиление
МР-КП – карта поглощения по данным МРТ
МРТ – магнитно-резонансная томография
ПЭТ – позитронно-эмиссионная томография
ПЭМ – позитронно-эмиссионная маммография
РФП – радиофармпрепарат
Введение
Использование на протяжении многих лет сочетания ПЭТ с 18F-ФДГ и КТ, объединяющего информацию о метаболизме и анатомических особенностях опухоли, привело к повышению специфичности диагностики рака молочной железы. В первую очередь 18F-ФДГ ПЭТ/КТ используется для стадирования и оценки ответа на лечение. Данное исследование не показано для первичной диагностики и оценки подмышечных лимфатических узлов в связи с низкой чувствительностью. Для диагностики рака молочной железы существует большое количество разновидностей 18F-ФДГ ПЭТ/КТ; в частности, возможны варианты сканирования на спине и на животе. Позиция на животе имеет более высокую чувствительность, однако точность метода ограничена за счет эффектов объемного усреднения и различного сродства клеток опухоли к 18F-ФДГ [2]. В литературе имеются сообщения об успешных попытках повысить разрешение ПЭТ за счет новых способов постобработки изображения, реализованных в позитронно-эмиссионной маммографии (ПЭМ) [13]. При этом считается, что КТ-компонент исследования зачастую не позволяет дифференцировать опухоль.
Появившиеся в последние годы комбинированные системы ПЭТ/МРТ позволяют одновременно получать информацию об уровне метаболизма и анатомических размерах опухоли за счет превосходной мягкотканной контрастности. При этом ПЭТ/МРТ имеет ряд преимуществ перед ПЭТ/КТ, заключающихся в первую очередь в крайне низкой лучевой нагрузке [5]. Кроме этого, за счет сбора данных в одном положении (на животе) достигается более высокая точность оценки анатомических размеров опухоли [7]. В случае, если пациентке требуется выполнение МРТ молочных желез с динамическим контрастным усилением, его можно выполнить в тот же визит с ПЭТ/МРТ. Использование современных методов качественной и количественной оценки опухоли, таких как МР-спектроскопия, ДВИ, МР-перфузия, позволяет с более высокой точностью прогнозировать исход заболевания [10, 12].
Образцы комбинированных систем ПЭТ/МРТ сконструированы с расчетом на получение качества изображения ПЭТ, аналогичного системам ПЭТ/КТ. Однако использование МРТ вместо данных КТ может привести к снижению точности расчета коррекции поглощения (КП). Например, карта коррекции поглощения по данным МР (МР-КП) не учитывает компактное вещество кости, принимает в качестве однородной структуру легких, а при использовании некоторых систем с малым полем обзора (field of view – FOV) в карту КП не входят руки пациента.
Несмотря на указанные недостатки, визуализация рака молочной железы является областью, в которой применение ПЭТ/МРТ является наиболее перспективным [24].
Оптимизированные протоколы исследования дают преимущество за счет одновременного использования диагностических возможностей обеих модальностей, сокращения времени обследования пациентов, которым требуется проведение ПЭТ и МРТ, снижения лучевой нагрузки по сравнению с ПЭТ/КТ [3]. Кроме того, некоторые исследования демонстрируют дополнительные преимущества ПЭТ/МРТ. Pace с соавторами [17], в частности, показали эквивалентную точность ПЭТ/КТ и ПЭТ/МРТ в обнаружении опухолевых очагов; значения SUV и метаболический объем опухоли коррелировали между собой. Интерпретация изображений ПЭТ и МРТ, собранных одновременно, повышает точность диагностики рака молочной железы [15, 23].
Цель исследования: оценить точность коррекции аттенюации 18F-ФДГ ПЭТ/МРТ молочных желез по сравнению с 18F-ФДГ ПЭТ/КТ и сравнить размеры первичной опухоли при последовательном выполнении 18F-ФДГ ПЭТ/КТ и 18F-ФДГ ПЭТ/МРТ молочных желез.
Материалы и методы
В работе использованы результаты обследования 21 пациентки с раком молочной железы (средний возраст 56,4±11,1), которым были проведены 18F-ФДГ ПЭТ/МРТ и 18F-ФДГ ПЭТ/КТ молочных желез с интервалом не более 1 часа. Сбор материалов производился в процессе стажировки в отделении лучевой диагностики Case Western Reserve Medical Center (Соединенные Штаты Америки, 10900 Euclid Ave., Cleveland, Ohio 44106) в период с 1.10.2016 по 26.12.2016 года. Данный материал использовался для оценки методологии одновременного сбора данных на комбинированных аппаратах ПЭТ/МРТ (Philips PET/MRI Ingenuity TF) и формирования представления о ПЭТ/МРТ семиотике первичных опухолей молочных желез. Данная ПЭТ/МРТ система является комбинацией модифицированных ПЭТ-сканера Philips Gemini TF и МР-сканера Philips Achieva 3Т, установленных в одной аппаратной комнате. Благодаря вращению стола между гентри аппаратов, которое занимает около одной минуты, возможен последовательный сбор данных ПЭТ и МРТ без смены позиции пациента. Каждой пациентке после однократного введения дозы радиофармпрепарата 18F-ФДГ последовательно выполнялись ПЭТ/КТ и ПЭТ/МРТ молочных желез; общее количество исследований – 42. Средний интервал между выполнением исследований составил 43 минуты.
Протокол ПЭТ/МРТ молочных желез включал в себя последовательность mDixon с селективным жироподавлением «только жир» и «только вода» в рамках MobiView atMRBreast 2D (TR: 68,5; TE: 2,3), динамическое контрастное усиление eTHRIVE (TR: 4,7, TE: 2,3), построение карты коррекции аттенюации по данным МРТ.
Время сбора данных ПЭТ составляло от 2 до 3 минут на позицию стола; серия КТ выполнялась без внутривенного контрастного усиления. Все пациентки находились в положении на животе в процессе сбора данных ПЭТ/МРТ и ПЭТ/КТ; область исследования от яремной вырезки до мечевидного отростка (130 кВ, 50 мА/с, толщина среза 5 мм, область интереса 700 мм).
Технические сложности ПЭТ/МРТ
Размещение аппаратов ПЭТ и МРТ в помещении или корпусе одного прибора может привести к некоторым ограничениям их работы. Детекторы ПЭТ значительно влияют на гомогенность магнитного поля, что приводит к возникновению артефактов МР-изображения. В то же время градиентные импульсные последовательности могут приводить к возникновению наводящих токов в традиционных детекторах ПЭТ. Одним их вариантов решения проблемы является расположение аппаратов МРТ и ПЭТ/КТ в отдельных помещениях с возможностью сканирования на столе-«шаттле» [25]. Стол позволяет добиться точного совмещения изображений, но получаемое изображение не является истинным ПЭТ/МРТ. Следующим вариантом возможно размещение моно-ПЭТ и МРТ в одном помещении на расстоянии 3-х метров с наличием дополнительной защиты моно-ПЭТ от магнитного поля. При этом теряется возможность выполнения ПЭТ/КТ, как в первом варианте [26]. Третьим вариантом является совмещение ПЭТ и МРТ в одном аппарате за счет создания нового типа детекторов ПЭТ – avalanche photodiodes (APD) [27].
Дополнительной сложностью при создании комбинированных ПЭТ/МРТ изображений является коррекция аттенюации. Традиционно при выполнении ПЭТ/КТ это решается за счет построения карты поглощения фотонов энергией в 511 кэВ на основе данных КТ. К сожалению, не существует корреляции между физической плотностью тканей и интенсивностью МР-сигнала. Типичным решением данной проблемы является сегментация тканей на несколько классов, таких как легкие, кости, жир [14]. К сожалению, в настоящее время на ПЭТ/МР сканерах, доступных на рынке, не реализована возможность расчета коррекции аттенюации компактного вещества кости. Небольшие различия между значениями SUV при выполнении исследований на ПЭТ/МРТ и ПЭТ/КТ системах объясняются отсутствием адекватной коррекции аттенюации по данным МРТ [6]. В частности, в исследовании пациентов с миеломной болезнью по данным ПЭТ/МРТ было выявлено то же количество очагов, что и по данным ПЭТ/КТ, однако в среднем уровень SUV по данным ПЭТ/МРТ был ниже [22]. По данным Kershah с соавторами [11] уровень SUV в пуле медиастиальной крови у здоровых добровольцев был в среднем ниже по данным ПЭТ/МРТ, чем при ПЭТ/КТ. Вероятно, описанная разница отражает определенный временной интервал между исследованиями.
ПЭТ/МРТ молочных желез
МРТ молочных желез с динамическим контрастным усилением наиболее часто используется для оценки местного распространения заболевания у пациенток с впервые выявленной опухолью. Высокое пространственное разрешение совместно с оценкой уровня васкуляризации обеспечивают высокую чувствительность МРТ молочных желез с ДКУ [19]. Тем не менее, низкая специфичность является слабым местом описываемого метода. Сочетание функциональной информации МРТ с ДКУ и оценки уровня метаболизма по данным ПЭТ с 18F-ФДГ позволяет повысить специфичность метода (Рис. 1). В работе Pinkerс соавторами [20] было показано, что использование ДКУ, ДВИ, МР-спектроскопии приводит к повышению точности дифференциальной диагностики доброкачественных и злокачественных новообразований молочной железы.
Адекватное стадирование на дооперационном этапе помогает мультидисциплинарной команде правильно спланировать лечение. Так, в работе Botsikas с соавторами [4] было произведено сравнение диагностической точности ПЭТ/МРТ и МРТ молочных желез у 58 пациенток, у которых было выявлено в общей сложности 101 опухолевый очаг и 198 измененных лимфатических узлов. В отношении выявления первичной опухоли чувствительность МРТ превышала ПЭТ/МРТ (100% против 77%), в то время как ПЭТ/МРТ продемонстрировала более высокую специфичность (100% против 67%). Показатели точности выявления лимфатических узлов были равнозначны. В работе Taneja с соавторами [23] 36 пациентам с инвазивным протоковым раком последовательно выполнялись 18F-ФДГ ПЭТ/МРТ и МРТ молочных желез. Оба метода показали специфичность 91% в определении метастатического процесса аксиллярных лимфоузлов, однако МРТ продемонстрировала большую чувствительность (93,3 против 60%). Комбинирование количественных показателей МРТ и ПЭТ позволяет более точно диагностировать метастатический процесс лимфатических узлов (Рис. 2) .
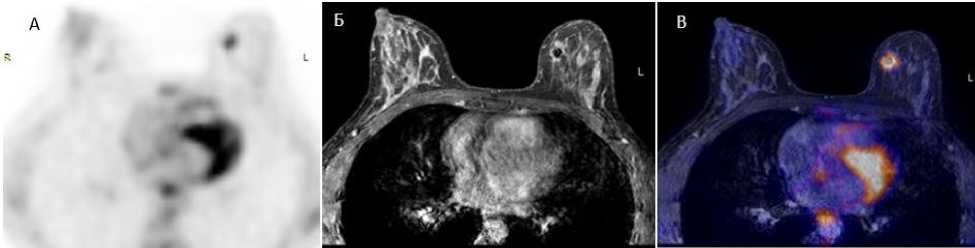
Рис. 1. Гиперметаболическая опухоль правой молочной железы. А) ПЭТ с 18F-ФДГ с коррекцией аттенюации на базе МР-изображения, аксиальная реконструкция. Б) Т1-ВИ с контрастным усилением, аксиальная реконструкция. В) Совмещенное изображение ПЭТ/МРТ, аксиальная реконструкция
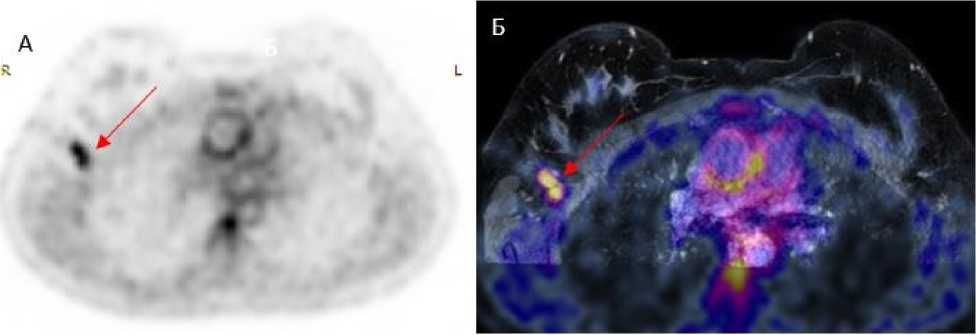
Рис. 2. Подмышечная лимфаденопатия, визуализируемая методом ПЭТ/МРТ с 18F-ФДГ ПЭТ с 18F-ФДГ с коррекцией аттенюации на базе МР-изображения, совмещенное изображение ПЭТ/МРТ в аксиальных (А, Б). На изображениях А и Б визуализируются увеличенные правые подмышечные лимфатические узлы с гиперметаболизмом (красная стрелка).
Результаты и обсуждение
Сравнение средних значений выборок величин SUVmax, SUVmin, SUVmean, определенных на картах с коррекцией аттенюации CTAC и MRAC, соответственно, производилось путем расчета парного t-критерия Стьюдента. Статистически значимых (p<0,05) различий между измеряемым уровнем метаболизма первичной опухоли по данным различных способов коррекции аттенюации выявлено не было. Наименьший размер опухоли по данным МРТ составил 3 мм, наибольший – 49 мм. У трех пациенток (14,3%) выявленные по МРТ опухоли не прослеживались по данным КТ без внутривенного контрастного усиления. При расчете их размеры были приняты за 0; наибольший размер выявленной опухоли по данным КТ составил 43 мм. Была установлена статистически достоверная (p<0,001) разница средних значений наибольшего размера опухоли (Рис. 3); так, по данным МРТ средний размер опухоли составил 25,2 мм (доверительный интервал от 18,9 до 31,4 мм). По данным КТ средний размер опухоли был равен 20,1 мм (доверительный интервал от 13,9 до 26,4 мм). Однако при сравнении средних размеров методом Бланда-Алтмана выявлено, что недооценка размера по данным КТ не носит систематического характера (Рис. 4). Таким образом, различия в технике коррекции аттенюации при ПЭТ/КТ и ПЭТ/МРТ не приводят к значимому изменению показателей метаболизма 18F-ФДГ, даже с учетом разницы во времени после введения РФП. Недооценка размеров опухоли по данным 18F-ФДГ ПЭТ/КТ по сравнению с ПЭТ/МРТ не носит систематический характер.
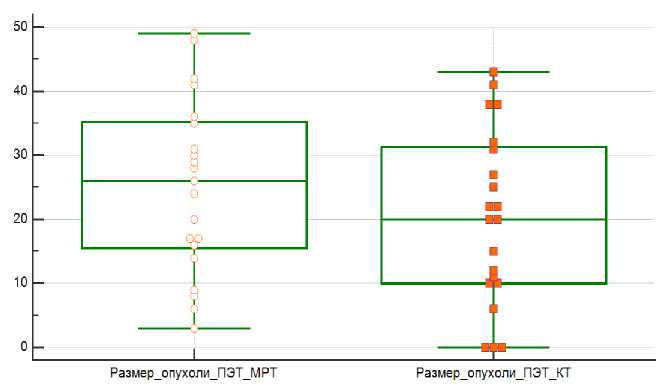
Рисунок 3. Диаграмма, демонстрирующая статистически значимую (p<0,001) разницу средних размеров опухоли по данным измерений ПЭТ/МРТ и ПЭТ/КТ
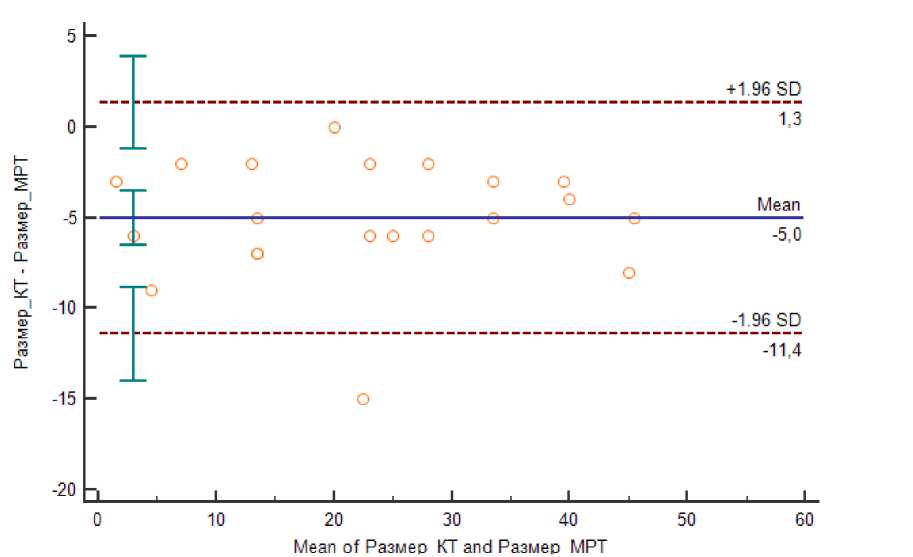
Рисунок 4. Сравнение средних значений размеров опухоли, измеренных по методам 18F-
ФДГ ПЭТ/КТ и ПЭТ/МРТ по методу Бланда-Алтмана (p<0,0001)
В современной научной литературе нами не обнаружено работ, оценивающих точность коррекции поглощения ПЭТ/МРТ при исследовании молочных желез. В исследовании Okazawa с соавторами [16] показано, что точность коррекции аттенюации на основе КТ и МР-последовательностей с нулевым временем эхо (ZTE) не имеет статистически значимых различий. В работе Fraum с соавторами [8], посвященной оценке воспроизводимости измерений ПЭТ/МРТ и ПЭТ/КТ на примере опухолей таза, сформулированы аналогичные выводы.
В отношении сравнения выявляемости первичных опухолей молочных желез при помощи 18F-ФДГ ПЭТ/КТ и ПЭТ/МРТ в мировой литературе приводятся различные данные. В частности, в работе Appenzeller с соавторами не было выявлено статистически значимых различий между количеством и размерами первичных опухолей молочных желез по данным ПЭТ/КТ и ПЭТ/МРТ всего тела [1]. В сходной по дизайну работе Pogson с коллегами [21] указывается на преимущество Т2-ВИ МРТ в оценке размеров послеоперационной серозной полости молочной железы. По данным Garcia-Velloso с соавторами создание комбинированных изображений 18F-ФДГ ПЭТ/КТ и МРТ молочных желез повышает точность выявления первичных опухолей по сравнению с 18F-ФДГ ПЭТ/КТ [9]. Несомненным недостатком нашей работы является отсутствие корреляции лучевых размеров опухоли с патологоанатомическими размерами. Описан принципиально иной подход к оценке размера первичной опухоли молочной железы, основанный на измерении перитуморального гало по данным 18F-ФДГ ПЭТ/КТ. В исследовании Park с коллегами описанный подход показал более высокую точность по сравнению с МРТ [18].
Выводы
Методика 18F-ФДГ ПЭТ/МРТ молочных желез технически выполнима, не уступает 18F-ФДГ ПЭТ/КТ в оценке уровня метаболизма опухоли и имеет преимущество в определении размеров опухоли. На основании анализа и статистической обработки данных можно сделать вывод об идентичности точности коррекции аттенюации ПЭТ на основании методов МРТ и КТ. Для КТ характерна недооценка размеров опухоли по сравнению с данными МРТ, которая не носит систематический характер.
Список литературы Сравнение точности оценки коррекции поглощения и размеров опухоли при последовательном выполнении 18F-ФДГ ПЭТ/КТ и ПЭТ/МРТ молочных желез
- Appenzeller P., Mader C., Huellner M.W., et al. PET/CT versus body coil PET/MRI: how low can you go? Insights into imaging. 2013. V. 4. No. 4. P. 481-490.
- Avril N., Rosé C.A., Schelling M., et al. Breast Imaging With Positron Emission Tomography and Fluorine-18 Fluorodeoxyglucose: Use and Limitations. J Clin Oncol. 2000. V. 20. No. 18. P. 3495-3502.
- Baba S., Isoda T., Maruoka Y., et al. Diagnostic and Prognostic Value of Pretreatment SUV in 18F-FDG/PET in Breast Cancer: Comparison with Apparent Diffusion Coefficient from Diffusion-Weighted MR Imaging. J Nucl Med. 2014. V. 5. No. 55. P. 736-742.
- Botsikas D., Kalovidouri A., Becker M., et al. Clinical utility of 18F-FDG-PET/MR for preoperative breast cancer staging. Eur Radiol. 2016. V. 26. No. 7. P. 2297-2307.
- Delso G., Furst S., Jakoby B., et al. Performance Measurements of the Siemens mMR Integrated Whole-Body PET/MR Scanner. J Nucl Med. 2011.V. 52. No. 12. P. 1914-1922.
- Delso G., Martinez-Möller A., Bundschuh R.A., et al. Preliminary study of the detectability of coronary plaque with PET. Phys Med Biol. 2011. V. 56. No. 7. P. 2145-2160.
- Dregely I., Lanz T., Metz S., et al. A 16-channel MR coil for simultaneous PET/MR imaging in breast cancer. Eur Radiol. 2015. V. 25. No. 4. P. 1154-1161.
- Fraum T.J., Fowler K.J., Crandall J.P. et al. Measurement Repeatability of 18 F-FDG- PET/CT versus 18 F-FDG-PET/MRI in Solid Tumors of the Pelvis. J Nucl Med. 2019. V. 60. No. 8. P. 1080-1086.
- Garcia-Velloso M.J., Ribelles M.J., Rodriguez M., et al. MRI fused with prone FDG PET/CT improves the primary tumour staging of patients with breast cancer. Eur Radiol. 2017. V. 27. No. 8. P. 3190-3198.
- He N., Xie C., Wei W., et al. A new, preoperative, MRI-based scoring system for diagnosing malignant axillary lymph nodes in women evaluated for breast cancer. Eur J Radiol. 2012. V. 81. No. 10. P. 2602-2612.
- Kershah S., Partovi S., Traughber B.J., et al. Comparison of Standardized Uptake Values in Normal Structures Between PET/CT and PET/MRI in an Oncology Patient Population. Mol Imaging Biol. 2013. V. 15. No. 6. P. 776-785.
- Kuhl C.K. Current Status of Breast MR Imaging Part 2. Clinical Applications. Radiology. 2007. V. 244. No. 3. P. 672-691.
- MacDonald L., Edwards J., Lewellen T., et al. Clinical Imaging Characteristics of the Positron Emission Mammography Camera: PEM Flex Solo II. J Nucl Med. 2009. V. 50. No. 10. P. 1666-1675.
- Martinez-Moller A., Souvatzoglou M., Delso G., et al. Tissue Classification as a Potential Approach for Attenuation Correction in Whole-Body PET/MRI: Evaluation with PET/CT Data. J Nucl Med. 2009. V. 50. No. 4. P. 520-526.
- Moy L., Noz M.E., Maguire Jr G.Q., et al. Role of Fusion of Prone FDG-PET and Magnetic Resonance Imaging of the Breasts in the Evaluation of Breast Cancer. Breast J. 2010. V. 16. No. 4. P. 369-376.
- Okazawa H., Tsujikawa T., Higashino Y., et al. No significant difference found in PET/MRI CBF values reconstructed with CT-atlas-based and ZTE MR attenuation correction. EJNMMI Res. 2019. V. 9. No. 1. Article Number 26.
- Pace L., Nicolai E., Luongo A., et al. Comparison of whole-body PET/CT and PET/MRI in breast cancer patients: Lesion detection and quantitation of 18F-deoxyglucose uptake in lesions and in normal organ tissues. Eur J Radiol. 2014. V. 83. No. 2. P. 289-296.
- Park S.H., Seo M., Choi H.-J., et al. More accurate than MRI measurement of tumor size in breast cancer by using the peri-tumoral halo uptake layer method of the 18F-FDG PET/CT scan. Hell J Nucl Med. V. 21. No. 2. P. 108-114.
- Peters N.H., Borel Rinkes I.H., Zuithoff N.P., et al. Meta-Analysis of MR Imaging in the Diagnosis of Breast Lesions. Radiology. 2008. V. 246. No. 1. P. 116-124.
- Pinker K., Bogner W., Baltzer P. et al. Improved Differentiation of Benign and Malignant Breast Tumors with Multiparametric 18Fluorodeoxyglucose Positron Emission Tomography Magnetic Resonance Imaging: A Feasibility Study. Clin Cancer Res. 2014. V. 20. No. 13. P. 3540-3549.
- Pogson E.M., Delaney G.P., Ahern V., et al. Comparison of Magnetic Resonance Imaging and Computed Tomography for Breast Target Volume Delineation in Prone and Supine Positions. Int J Radiat Oncol Biol Phys. 2016. V. 96. No. 4. P. 905-912.
- Sachpekidis C., Hillengass J., Goldschmidt H. et al. Comparison of (18)F-FDG PET/CT and PET/MRI in patients with multiple myeloma. Am J Nucl Med Mol Imaging. 2015. V. 5. No. 5. P. 469-478.
- Taneja S., Jena A., Goel R., et al. Simultaneous whole-body 18 F-FDG PET-MRI in primary staging of breast cancer: A pilot study. Eur J Radiol. 2014. V. 83. No. 12. P. 2231-2239.
- Torigian D.A., Zaidi H., Kwee T.C., et al. PET/MR Imaging: Technical Aspects and Potential Clinical Applications. Radiology. 2013. V. 267. No. 1. P. 26-44.
- Veit-Haibach P., Kuhn F.P., Wiesinger F., et al. PET-MR imaging using a tri-modality PET/CT-MR system with a dedicated shuttle in clinical routine. MAGMA. 2013. V. 26. No. 1. P. 25-35.
- Zaidi H., Ojha N., Morich M., et al. Design and performance evaluation of a whole-body Ingenuity TF PET-MRI system. Phys Med Biol. 2011. V. 56. No. 10. P. 3091-3106.
- Zeimpekis K.G., Barbosa F., Hüllner M., et al. Clinical Evaluation of PET Image Quality as a Function of Acquisition Time in a New TOF-PET/MRI Compared to TOF-PET/CT- Initial Results. Mol Imaging Biol. 2015. V. 17. No. 5. P. 735-744.


