Сравнение влияния селективных β^ адреноблокаторов небиволола и метопролола на раннее ремоделирование левого желудочка у больных острым инфарктом миокарда
Автор: Вершинина Е.О., Рябов В.В., Репин А.Н., Марков В.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3-1 т.26, 2011 года.
Бесплатный доступ
В статье представлены результаты открытого рандомизированного клинического исследования, в сравнительном аспекте изучившего влияние высокоселективного β-адреноблокатора с дополнительным вазодилатирующим действием небиволола и селективного β-адреноблокатора метопролола на ремоделирование ЛЖ в ранний постинфарктный период. Было показано, что небиволол усиливал раннее расширение и сферификацию ЛЖ. При этом существенно не снизилась сократительная функция, улучшилась насосная функция ЛЖ. Метопролол сдерживал дилатацию и сферификацию ЛЖ в течение первой недели заболевания. При этом достоверно снизилась сократительная функция ЛЖ по сравнению с исходной (увеличился КСИ на 22,4%), но насосная функция ЛЖ при этом существенно не изменилась.
Острый инфаркт миокарда, β-адреноблокаторы, постинфарктное ремоделирование лж
Короткий адрес: https://sciup.org/14919521
IDR: 14919521 | УДК: 616.127-005.8-089-06:616.124
Текст научной статьи Сравнение влияния селективных β^ адреноблокаторов небиволола и метопролола на раннее ремоделирование левого желудочка у больных острым инфарктом миокарда
Основной причиной смертности от сердечно-сосудистых заболеваний является ишемическая болезнь сердца (ИБС), которая в структуре смертности от болезней системы кровообращения составляет 48,1%, а в общей структуре смертности от всех причин – 27% [3]. Несмотря на значительные успехи в диагностике и лечении острого инфаркта миокарда, госпитальная летальность от этого заболевания у нас в стране остается существенно более высокой, чем во многих странах с высоким уровнем развития здравоохранения [16]. Во многом это обусловлено недостаточно широким и повсеместным использованием эффективных методов диагностики и лечения острого инфаркта миокарда, таких как селективная коронаро-ангиография и ангиопластика венечных артерий сердца, тромболитическая терапия (ТЛТ). Однако нельзя недооценивать и роль современного медикаментозного сопровождения всех этапов лечения и реабилитации пациентов острым инфарктом миокарда (ОИМ).
Мировая кардиология накопила огромный опыт применения блокаторов β -адренорецепторов ( β -АБ) у больных ОИМ. Вместе с тем ясно, что кардиопротективный эффект и влияние на смертность при ОИМ – это эффекты не класса препаратов, поскольку различные представители этой группы лекарств имеют дополнительные особенности фармакодинамики. Большим прогрессом в области применения блокаторов бета-адренорецепторов следует считать появление β -адреноблокаторов с вазоактивными свойствами, однако информация об их эффективности у больных ОИМ ограничена. Небиволол – это β -АБ нового поколения, обладающий специфическими фармакологическими свойствами, основными из которых являются высокоселективный характер воздействия на β 1-адренорецепторы и прямое сосудорасширяющее воздействие посредством стимуляции эндогенной продукции NO.
Цель работы: в сравнительном аспекте изучить влияние высокоселективного блокатора β -адренорецепторов с дополнительным вазодилатирующим действием неби-волола – Н (Небилет, “Берлин-Хеми”, Италия) и селективного бета-адреноблокатора метопролола М (Корвитол, “Берлин-Хеми”, Италия) на ремоделирование ЛЖ в ранний постинфарктный период.
Материал и методы
Объектом открытого рандомизированного клинического исследования являлись больные острым крупноочаговым инфарктом миокарда, поступившие в стационар в течение первых 12 ч от начала заболевания. Диагноз ОИМ устанавливался по критериям ВОЗ [7]. Критериями исключения из исследования были острая недостаточность ЛЖ IV класса по классификации Т. Killip [8], атрио-вентрику-лярная блокада II–III ст., блокада ножек пучка Гиса, гипотония (систолическое АД менее 90 мм рт. ст.), синусовая брадикардия (ЧСС менее 50 в мин), мерцательная аритмия. После рандомизации в две параллельные группы больные первой группы (19 человек, средний возраст 53,7±15,1 лет, 100% передних инфарктов; 68,4% мужчин) как можно раньше при поступлении принимали Н в дозе 2,5–5 мг (средняя доза 4,1±1,0 мг) с последующим приемом 5–7,5 мг/сут (средняя доза 5,4±1,5 мг). Больные второй группы (17 человек, средний возраст 54,2±14,1 лет, 94,1% передних инфарктов; 82,4% мужчин) принимали М при поступлении в дозе 25–50 мг (средняя доза 26,4±7,2 мг) с последующим приемом 50–200 мг/сут (средняя доза 100,8±47,3 мг). После первого приема β -АБ больным при отсутствии признаков самопроизвольной реперфузии проводилась реканализация инфаркт-связан-ной коронарной артерии (ИСКА) либо системным ферментным тромболизисом (78,9% в группе Н и 70,6% в группе М), либо первичной чрескожной транслюминарной коронарной ангиопластикой (15,8% в группе Н и 11,8% в группе М). Коронаровентрикулография была проведена 94,7% пациентов в группе Н и 64,7% – в группе М. Факт реперфузии ИСКА был подтвержден данными коронаро-вентрикулографии у 78,9% больных в группе Н и у 52,9% – в группе М. У 15,8% больных в группе Н и у 11,8% в группе М реперфузионная терапия оказалась безуспешной. Исследование проводилось в течение 30 дней реабилитационного периода после ОИМ. Дополнительно по показаниям назначались сердечные гликозиды, мочегонные, пролонгированные нитраты, кордарон. При этом по потребности в этой дополнительной терапии группы не различались. Клиническая необходимость приема ингибиторов АПФ (тяжелая сердечная недостаточность или артериальная гипертензия, не поддающиеся адекватной коррекции вышеописанной терапией) служила критерием исключения пациентов из исследования.
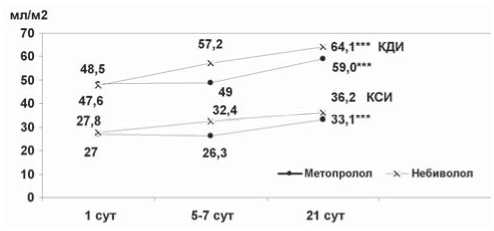
Рис. 1. Динамика объемов ЛЖ у больных ИМ в течение госпитального периода; *** – p ≤ 0,01 – достоверность различий по отношению к исходному значению
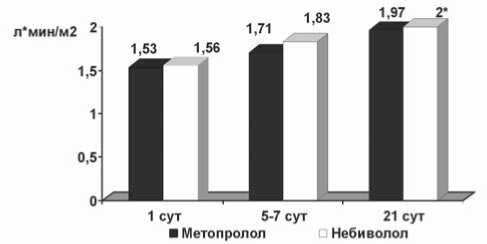
Рис. 2. Динамика сердечного индекса у больных исследуемых групп в течение госпитального периода; * – р<0,1 – достоверность различий по отношению к исходному значению
По основным клинико-демографическим показателям на момент рандомизации группы не различались. Не различались группы и по размеру зоны некроза миокарда, определявшемуся двумя способами: по активности общей КФК (площадь под кривой активности КФК 87585,18±60910,77 в группе Н и 69281,55±50187,21 Ед/лхч в группе М, р=0,227) и электрокардиографическим признакам некроза миокарда, количественно представленным с помощью QRS-индекса (исходный индекс QRS 16,3±11,4 в группе Н и 11,71±10,65% в группе М, р=0,163) [14].
УЗИ сердца проводили трижды: в конце первых суток, на 5–7-е и 21-е сутки ОИМ. Исследования проводили на аппарате “Acuson 128 XP/10” (США) в соответствии с рекомендациями Американской ассоциации эхокардиографии по стандартным методикам [6, 13]. Объемы ЛЖ измеряли в четырехкамерном сечении сердца и рассчитывали по формуле “площадь–длина” [6] с последующим вычислением конечного диастолического индекса (КДИ), конечного систолического индекса (КСИ), фракции выброса (ФВ) ЛЖ. Ударный объем (УО) ЛЖ определяли с помощью допплер-эхокардиографии, затем индексировали к площади поверхности тела.
Для количественной характеристики изменения геометрической формы ЛЖ измеряли: продольный конечный диастолический размер ЛЖ (d1), поперечный конечный диастолический размер ЛЖ (d2), поперечный конечный диастолический региональный размер ЛЖ (d3) в апикальной четырехкамерной позиции ЛЖ; поперечные взаимно перпендикулярные конечные диастолические диаметры (D1 и D2) в парастернальной позиции по короткой оси ЛЖ. Размеры индексировали к площади поверхности тела и в последующем обозначали Di и di. Вычисляли: индекс сферичности (ИС1)=d1/d2; региональный индекс сферичности (ИС2)=d1/d3; индекс эксцентриситета (ИЭ)=D1/D2 [12]. Статистический анализ данных проводили с использованием пакета программ “STATISTICA 5,0 для Windows 95”, “Microsoft Excel для Windows 95” и “Biostat”. Во всех процедурах статистического анализа критический уровень значимости p принимался равным 0,05.
Результаты и обсуждение
Первоначально термин “ремоделирование” был введен M.A. Pfeffer [10] для отражения изменений топогра- фии стенок ЛЖ и геометрии его полости после ИМ. Патогенез ремоделирования миокарда при ОИМ достаточно изучен и подробно изложен в большом количестве работ, основные выводы которых были обобщены и изложены в обзоре А.А. Соколова и Т.Р. Карповой [4]. Термин ремоделирование подразумевает включение в процесс как пораженного, так и интактного миокарда. Экспансия инфаркта – острая дилатация и истончение области инфаркта без дополнительного миокардиального некроза. Уже в течение 1 мин острая окклюзия коронарной артерии приводит к снижению насосной функции сердца, при этом происходит уменьшение толщины стенок и дилатация ЛЖ [15]. В острую фазу ИМ длина саркомеров кардиомиоцитов остается относительно постоянной, а основная перестройка архитектуры связана со степенью мурального скольжения кардиомиоцитов друг относительно друга. Неинфарцированный миокард также подвергается вполне определенным изменениям, заключающимся в растяжении и последующей гипертрофии вследствие вторичной объемной перегрузки [11]. Известно, что успешная ТЛТ ограничивает экспансию инфаркта миокарда [12]. Имеется единодушное мнение о влиянии ингибиторов АПФ, которые препятствуют нарушениям, свойственным феномену ремоделирования [9]. Действие β-АБ на постинфарктные изменения геометрии и функции ЛЖ требует дальнейшего изучения.
В нашем исследовании статистически значимых различий средних значений сократительной и насосной функции ЛЖ в течение первого месяца постинфарктного периода выявлено не было. Однако внутригрупповая динамика этих показателей различалась. В группе М в течение первой недели заболевания достоверного увеличения КДИ и КСИ не происходило. Оба эти объема значимо увеличились к 21-м суткам ОИМ. В группе же Н тенденция к существенному увеличению КДИ и КСИ появилась уже к концу первой недели заболевания. Однако, если КДИ к 21-м суткам увеличился достоверно, то КСИ в этой группе к концу третьей недели заболевания значимо от исходного значения не отличался (табл. 1, рис. 1). СИ за время наблюдения при приеме М не изменился, а в группе Н выявлена тенденция к его статистически значимому увеличению к концу третьей недели заболевания (рис. 2).
Результаты, отражающие последовательные изменения геометрии ЛЖ в течение госпитального периода, представлены в таблицах 2 и 3.
Таблица 1
Показатели гемодинамики и сократительной функции ЛЖ у больных ОИМ в течение госпитального периода
|
Показатели |
Метопролол (n=17) M±SD |
Небиволол (n=19) M±SD |
р |
|
КДИ, 1-е сут |
48,496±11,6 |
47,583±15,58 |
0,963 |
|
КДИ, 5–7-е сут |
48,994±12,47 |
57,16±22,77* |
0,550 |
|
КДИ, 21-е сут |
59,01±17,35 ## *** |
64,07±18,01 # *** |
0,409 |
|
КСИ, 1-е сут |
26,961±9,206 |
27,753±11,9 |
0,581 |
|
КСИ, 5–7-е сут |
26,285±8,039 |
32,371±14,58* |
0,520 |
|
КСИ, 21-е сут |
33,088±10,48*** |
36,162±13,6 |
0,506 |
|
ФВ (%), 1-е сут |
40,79±9,85 |
42,36±16,04 |
0,945 |
|
ФВ (%), 5–7-е сут |
46,71±10,62* |
43,43±7,94 |
0,370 |
|
ФВ (%), 21-е сут |
43,12±8,38 |
43,89±13,78 |
0,963 |
|
УИ, 1-е сут |
19,372±4,42 |
19,827±7,54 |
0,963 |
|
УИ, 5–7-е сут |
22,71±7,642** |
24,789±9,8 |
0,679 |
|
УИ, 21-е сут |
25,924±9,527 # ** |
27,907±12,3*** |
0,692 |
|
СИ, 1-е сут |
1,534±0,458 |
1,557±0,442 |
0,818 |
|
СИ, 5–7-е сут |
1,706±0,646 |
1,833±0,779 |
0,627 |
|
СИ, 21-е сут |
1,968±0,889 |
1,997±1,088* |
0,857 |
|
УПС, 1-е сут |
60,27±20,67 |
58,897±16,12 |
0,837 |
|
УПС, 5–7-е сут |
57,913±22,06 |
55,115±25,47 |
0,560 |
|
УПС, 21-е сут |
56,108±27,49 |
49,75±18,5 |
0,782 |
|
ЧСС, 1-е сут |
78,5±7,78 |
83,67±22,37 |
0,564 |
|
ЧСС, 5–7-е сут |
74,11±8,36 |
68,11±11,93 |
0,147 |
|
ЧСС, 21-е сут |
65±22,87 |
74±14,2 |
0,408 |
Примечание: * – р<0,1, ** – р<0,05, *** – р<0,01 – достоверность различий изменения показателей по отношению к первым суткам ИМ; # – р<0,1, ## – р<0,05, ### – р<0,01 – достоверность различий изменения показателей по отношению к 5–7-м суткам ИМ.
Таблица 2
Изменение поперечных конечно-диастолических диаметров ЛЖ в исследуемых группах
|
Показатели |
Метопролол (n=17) M±SD |
Небиволол (n=19) M±SD |
р |
|
Di1 1-е сут, мм/м2 |
27,06±3,05 |
25,19±2,28 |
0,041 |
|
Di1 5–7-е сут, мм/м2 |
28,42±4,28 |
28,00±3,56** |
0,698 |
|
Di1 21-е сут, мм/м2 |
28,42±3,03** |
29,48±4,64 ##** |
0,816 |
|
Di2 1-е сут, мм/м2 |
23,45±3,14 |
21,46±2,23 |
0,159 |
|
Di2 5–7-е сут, мм/м2 |
23,54±4,90 |
24,05±2,94** |
0,438 |
|
Di2 21-е сут, мм/м2 |
24,89±3,56 |
25,04±3,99 # ** |
0,853 |
|
ИЭ 1-е сут |
1,16±0,096 |
1,176±0,06 |
0,526 |
|
ИЭ 5–7-е сут |
1,231±0,187 |
1,166±0,07 |
0,482 |
|
ИЭ 21-е сут |
1,2±0,142 |
1,157±0,07 |
0,798 |
Примечание: * – р<0,1, ** – р<0,05, *** – р<0,01 – достоверность различий изменения показателей по отношению к первым суткам ИМ, # – р<0,1 – достоверность различий изменения показателей по отношению к 5–7-м суткам ИМ.
Мы выявили отсутствие прироста Di1 и Di2 к концу первой недели ОИМ при приеме М и достоверное нарастание этих диаметров в эти же сроки при приеме Н. К концу третьей недели заболевания размер Di1, отражающий деформацию контура ЛЖ в зоне некроза при передних инфарктах, существенно увеличился по сравнению
Таблица 3
Изменение продольных конечно-диастолических размеров
ЛЖ в исследуемых группах
|
Показатели |
Метопролол (n=17) M±SD |
Небиволол (n=19) M±SD |
р |
|
di1 1-е сут, мм/м2 |
43,22±3,88 |
43,38±3,27 |
0,534 |
|
di1 5–7-е сут, мм/м2 |
43,40±3,98 |
45,28±3,95** |
0,159 |
|
di1 21-е сут, мм/м2 |
44,61±4,34 # * |
45,46±3,78** |
0,428 |
|
di2 1-е сут, мм/м2 |
21,51±4,13 |
19,53±3,63 |
0,565 |
|
di2 5–7-е сут, мм/м2 |
22,55±3,83** |
23,15±2,91*** |
0,497 |
|
di2 21-е сут, мм/м2 |
22,43±3,89 |
24,5±3,0 ## *** |
0,150 |
|
di3 1-е сут, мм/м2 |
15,71±3,47 |
15,40±2,53 |
0,908 |
|
di3 5–7-е сут, мм/м2 |
17,44±2,97*** |
17,85±2,44** |
0,719 |
|
di3 21-е сут, мм/м2 |
17,28±3,58*** |
18,32±4,17** |
0,564 |
|
ИС1 1-е сут |
2,054±0,288 |
2,253±0,341 |
0,300 |
|
ИС1 5–7-е сут |
1,958±0,265* |
1,944±0,219** |
0,872 |
|
ИС1 21-е сут |
2,027±0,268 |
1,872±0,18*** |
0,078 |
|
ИС2 1-е сут |
2,861±0,597 |
2,876±0,455 |
0,695 |
|
ИС2 5–7-е сут |
2,523±0,235*** |
2,557±0,203* |
0,643 |
|
ИС2 21-е сут |
2,639±0,33** |
2,578±0,51 |
0,540 |
Примечание: * – р<0,1, ** – р<0,05, *** – р<0,01 – достоверность различий изменения показателей по отношению к первым суткам ИМ, # – р<0,1 – достоверность различий изменения показателей по отношению к 5–7-м суткам ИМ.
с исходным в обеих группах. Увеличение размера Di2, отражающего дилатацию интактного миокарда, продолжалось и в дальнейшем при приеме Н. В группе же М этот размер к концу 3-й недели заболевания статистически достоверно не увеличился (рис. 3). Таким образом, мы наблюдали отсутствие экспансии инфаркта по этим показателям в течение первой недели заболевания в группе М и, наоборот, нарастание всех размеров (как экспансию зоны некроза, так и дилатацию непораженного миокарда) в группе Н.
В группе М увеличения продольного размера ЛЖ (di1), а также di2 к концу первого месяца заболевания не было. Деформация верхушки, в виде существенного нарастания di3, происходила в течение первой недели в обеих группах. В группе же Н di1 к концу первой недели заболевания увеличился значимо, индекс di2 также активно увеличивался в течение всего госпитального периода. Динамика ИС носила различный характер при лечении разными БАБ. Мы наблюдали нарастание регионарной сферичности (по динамике ИС2) при отсутствии динамики общей (ИС1) в группе М. В группе же Н более активно нарастала общая сферичность (ИС1), а регионарный ИС2 оставался псевдонормальным за счет увеличения как di1, так и di3 (рис. 4).
В работе Карповой Т.Р. с соавт. [2] при изучении динамики функциональных и структурных показателей ЛЖ у больных ОИМ на фоне реканализации ИСКА путем ТЛТ без применения β -АБ и ингибиторов АПФ было выявлено, что дилатация и нарастание сферичности ЛЖ происходит с 5–7-х суток заболевания. При этом увеличение КДО происходило преимущественно за счет прироста поперечных диаметров ЛЖ (Di1, Di2, di2, di3). Продольный размер ЛЖ (di1) на протяжении первого месяца постин-
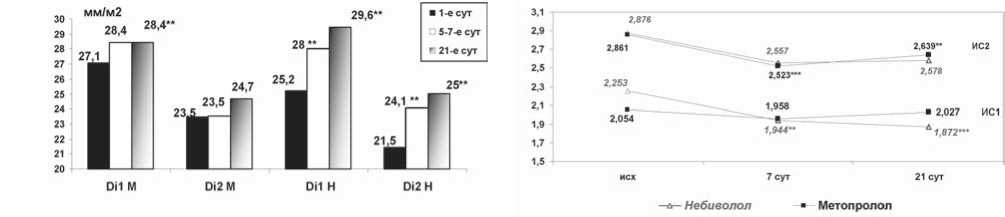
Рис. 3. Изменение поперечных конечно-диастолических диаметров. ** – р<0,05 – достоверность различий по отношению к исходному значению
Рис. 4. Изменение индексов сферичности в исследуемых группах: ** – р≤0,05; *** – р≤0,01 – достоверность различий по отношению к исходному значению фарктного периода практически не изменялся. За счет преобладания прироста поперечных размеров ЛЖ над продольными утрачивалась эллипсоидность ЛЖ. Существенное уменьшение ИС по срокам совпадало с приростом поперечных размеров ЛЖ, т.е. происходило с 5–7-х суток ОИМ. При этом степень прироста поперечных конечно-диастолических размеров ЛЖ на уровне поражения (di3) преобладала над приростом di2. Соответственно и регионарный ИС2 снижался в большей степени, чем стандартный ИС1. При этом улучшение и стабилизация насосной и сократительной функции ЛЖ происходили на фоне прогрессирующего расширения ЛЖ, что свидетельствовало о компенсаторной направленности выявленных изменений.
Отдаленные последствия постинфарктного ремоделирования миокарда были оценены в работе Рябова В.В. с соавт. [5], которые показали, что дилатация ЛЖ в ранние сроки (до 1 мес.) у пациентов с ОИМ расценивается как проявление острой компенсаторно-приспособительной реакции. В дальнейшем при 5-летнем наблюдении у выживших больных увеличения ЛЖ не наблюдалось, тогда как у умерших за этот период больных оно носило прогрессирующий дезадаптивный характер.
Мы выявили, что исследуемые β -АБ по-разному изменяют процессы постинфарктного ремоделирования ЛЖ. При приеме М наблюдалось отсутствие общего расширения ЛЖ в течение первой недели заболевания (не нарастали размеры Di1, Di2), хотя сферификация верхушки обнаруживалась достоверно. Прием Н приводил к раннему, уже с первой недели постинфарктного периода, нарастанию всех размеров ЛЖ как в зоне некроза, так и в области непораженного миокарда (значимое увеличение Di1, Di2, di1, di2, di3), т.е. активно нарастала общая сферичность ЛЖ. С этим механизмом (по закону Франка-Старлинга), вероятнее всего, связана стабилизация сократительной и улучшение насосной функции ЛЖ, наблюдавшаяся нами к концу третьей недели ОИМ в группе приема Н. Основным отличительным свойством Н является стимуляция им выработки NO. По-видимому, с этим механизмом связана миогенная дилатация ЛЖ в ранний постинфарктный период, которую мы наблюдали в группе приема Н. Клиническое значение этого воздействия на отдаленное постинфарктное ремоделирование ЛЖ остается неясным и требует дальнейшего изучения.
Выводы
-
1. К концу третьей недели после острого инфаркта миокарда на фоне приема небиволола существенного снижения сократительной функции ЛЖ не происходит. Одновременно улучшается его насосная функция. В эти же сроки при приеме метопролола достоверно снижается сократительная функция ЛЖ по сравнению с исходной (увеличивается КСИ на 22,4%). При этом насосная функция ЛЖ в этой группе существенно не изменяется.
-
2. Исследуемые препараты неодинаково влияют на процессы постинфарктного ремоделирования ЛЖ. Метопролол сдерживает дилатацию и сферификацию ЛЖ в течение первой недели заболевания. Небиволол же, напротив, усиливает раннее расширение и сфе-рификацию ЛЖ, что способствует более быстрому восстановлению его функционального состояния в ранний постинфарктный период.
Список литературы Сравнение влияния селективных β^ адреноблокаторов небиволола и метопролола на раннее ремоделирование левого желудочка у больных острым инфарктом миокарда
- Демографический ежегодник России: статистический сборник. Госкомстат России. -М.: 2006. -580 с.
- Карпова Т.Р. Клиникоэхокардиографическая характеристика параметров геометрии и функции левого желудочка у больных острым инфарктом миокарда: дис. …канд. мед. наук. -Томск, 2000. -194 с.
- Российский статистический ежегодник. -М.: Росстат, 2007. -825 с.
- Соколов А.А., Карпова Т.Р. Ремоделирование левого желудочка у больных острым инфарктом миокарда (Обзор литературы)//Сибирский медицинский журнал (Томск). -1998. -Т. 13, № 3-4. -С. 97-104.
- Тетёркина Т.В., Рябов В.В., Рябова Т.Р. и др. Ремоделирова ние левого желудочка в отдаленный 5-летний период переднего инфаркта миокарда//Сибирский медицинский журнал (Томск). -2008. -Т. 23, № 4. -С. 35-39.
- Feigenbaum H. Echocardiography. 5th. ed. -Philadelphia: Lea & Febiger, 1994. -695 р.
- Gillum R. F. et al. International criteria for acute myocardial infarction and acute stroke//American Heart Journal. -1984. -Vol. 108. -P. 150-158.
- Killip T., Kimball J.T. A survey of the coronary care unit: concepts and results//Progr. Cardiovasc. Disease. -1968. -Vol. 11. -P. 45-51.
- Lomas G.A., Pfeffer M.A. Left ventricular remodeling after acute myocardial infarction: clinical course and beneficial effects of angiotensinconverting enzyme inhibition//Am. Heart J. -1991. -Vol. 121, No. 4. -Рart 1. -Р. 1194-1202.
- McKay R.G., Pfeffer M.A., Pasternak R.C. et al. Left ventricular remodeling after myocardial infarction: a corollary to infarct expansion//Circulation. -1986. -Vol. 74, No. 4. -Р. 693-702.
- Pfeffer M.A., Braunwald E. Ventricular remodeling after myocardial infarction. Experimental observations and clinical implications//Circulation. -1990. -Vol. 81, No. 4. -Р. 1161-1172.
- Popovic A.D., Neskovic A.N., Marinkovic J. et al. Acute and long term effects of thrombolysis after anterior wall acute myocardial infarction with serial assessment of infarct expansion and late ventricular remodeling//Am. J. Cardiol. -1996. -Vol. 77, No. 7. -Р. 446-450.
- Schiller N.B., Shah P.M., Crawford M. et al. Recommendations for quantitation of the left ventricle by twodimensional echocardiography//J. Am. Soc. Echocardiogr. -1989. -Vol. 2. -P. 358-368.
- Wagner G., Freye C., Palmari S. et al. The evaluation of a QRS scoring system for estimating myocardialinfarct size I. Specificity and observer afreement//Circulation. -1982. -Vol. 65. -P. 342-347.
- Weisman H.F., Busb D.E., Mannisi J.A. et al. Cellular mechanisms of myocardial infarct expansion//Circulation. -1988. -Vol. 78. -Р. 186-201.
- World Health Organization. World health statistics 2008. -Geneva: World Health Organization, 2008. -110 p.


