Сравнительная характеристика протективного действия терапии белково-пептидным секретомом эмбриональной ткани и трансплантации ткани неонатальной почки при острой постишемической почечной недостаточности
Автор: Кирпатовский Владимир Игоревич, Сивков А.В., Голованов С.А., Дрожжева В.В., Фролова Е.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Введение. Регенеративная медицина является активно развивающимся направлением. Изучаются возможности терапии хронических заболеваний с помощью пересадки низкодифференцированных стволовых клеток и терапии продуктами их секреции. В данном исследовании сравнили эффективность терапии крыс с тяжелой степенью острой почечной недостаточности (ОПН) с помощью курсового введения белково-пептидного секретома (БПС), выделенного из головного мозга эмбрионов свиней и путем пересадки гомогената ткани неонатальных почек новорожденных крысят. Материалы и методы исследования. В экспериментах на 36 белых беспородных крысах моделировали ОПН путем односторонней нефрэктомии и 90-минутной ишемии оставшейся почки. В 1-й серии (10 крыс) терапии не проводили, во 2-й серии (10 крыс) сразу после восстановления кровотока в почке подкожно вводили БПС в дозе 0,1 мг/кг с последующим ежедневным введением препарата в течение 10 суток, а в 3-й серии (10 крыс) перед восстановлением кровоснабжения почки под ее капсулу вводили гомогенат ткани почки новорожденных крысят...
Острая почечная недостаточность, регенеративная медицина, стволовые клетки, секретом, терапия
Короткий адрес: https://sciup.org/142224040
IDR: 142224040 | DOI: 10.29188/2222-8543-2020-12-1-28-35
Текст научной статьи Сравнительная характеристика протективного действия терапии белково-пептидным секретомом эмбриональной ткани и трансплантации ткани неонатальной почки при острой постишемической почечной недостаточности
экспериментальная и клиническая урология № 1 2 0 2 0
Comparative analisis of the protective therapectic effect between embryonic tissue secretome – mixture proteins and peptides – and transplantation of neonatal kidney tissue in acute post-ishemic renal failure
V.I. Kirpatovskiy, A.V. Sivkov, S.A. Golovanov, V.V. Drozhzheva, E.V. Frolova
N.A. Lopatkin Scientific Research Institute of Urology and Interventional Radiology – Branch of the National Medical Research Centre of Radiology of the Ministry of Health of Russian Federation, 105425, 3-rd Parkovaya st., 51, Moscow, Russia
Introduction. Regenerative medicine is an actively developing field. The possibility of treating chronic diseases with stem cell transplantation and therapy with products of their secretion is being studied. In this study, we compared the effectiveness of therapy in rats with severe acute renal failure (ARF) using course administration of protein-peptide secretome (PPS) isolated from the brain of pig embryos and by transplanting tissue homogenate of neonatal kidneys of newborn rats.
Materials and methods. In experiments on 36 white male rats, ARF was simulated by unilateral nephrectomy and 90-minute ischemia of the remaining kidney. In the 1st series (10 rats), therapy was not performed, in the 2nd series (10 rats), immediately after restoring blood flow in the kidney PPS was subcutaneously administered at a dose of 0.1 mg/kg followed by daily administration of the drug for 10 days, and in the 3rd series (10 rats) before restoring blood supply to the kidney, a homogenate of the kidney tissue of newborn rats was injected under its capsule. The animals were examined at 3, 7, and 14 days after the ARF simulation. Six rats were a control group.
Results. PPS therapy has been shown to reduce the severity of metabolic disorders (less polyuria, increasing concentrations of creatinine and urea in the blood, decreasing glomerular filtration and reabsorption of sodium and calcium) from 3 days. In experiments with neonatal kidney tissue transplantation, improvement of functional parameters compared to the control was noted only on the 7th day, but the degree of improvement was higher than in PPS therapy. The severity of fermenturia, as an indicator of the destruction of the epithelium of the renal tubules, was also the lowest in experiments with neonatal kidney tissue transplantation. Conclusion. The results of the study indicate different dynamics of restoring the function of the damaged kidney in the studied variants of ARF therapy, which may be due to the peculiarities of delivering the embryonal (or neonatal) stem cells secretome to the organ (long-term through the circulatory system or once directly to the organ). The question of the significance of the organ-specific secretome for the therapeutic effect requires further study.
С тимуляция регенерации поврежденных органов является перспективным направлением современных экспериментальных исследований, направленных на изучение возможностей сохранения или восстановления их функционального состояния, в том числе при острой или хронической почечной недостаточности (ОПН и ХПН, соответственно). Если изначально основное внимание было привлечено к использованию низкодифференцированных стволовых или прогениторных клеток различного происхождения (мезенхимных и гемопоэтических клеток костного мозга, мезенхимных клеток подкожной жировой клетчатки, стволовых клеток пуповинной крови и пупочного канатика) [1-4], которые сами по себе обладают высоким регенераторным потенциалом, а также способны активировать регенерацию поврежденных клеточных структур за счет секреции комплекса биологически активных веществ, включающих в себя цитокины, факторы роста и так называемые сигнальные молекулы, регулирующие клеточные метаболические процессы, то в последнее время внимание исследователей привлечено к оценке эффективности использования самих гуморальных факторов, за счет которых реализуется стимуляция регенерации клеток [5,6]. Накапливается все больше экспериментальных данных, свидетельствующих, что эффективность так называемой «бесклеточной терапии» (обогащенной среды культивирования стволовых клеток, секретома эмбриональных тканей, внеклеточных микровезикул, содержащих микроРНК) при лечении животных с индуцированной ОПН или ХПН сопоставима с эффектом пересадки самих стволовых клеток [7-9].
Ранее проведенное нами исследование показало, что терапия крыс белково-пептидным секретомом (БПС), выделенным из эмбрионального головного мозга свиней (активный компонент препарата «Целлекс»), при индуцировании ОПН с умеренной степенью выраженности функциональных нарушений, ускоряет регенерацию почечных структур (клубочков и эпителия канальцев), уменьшает выраженность морфологических изменений и способствует восстановлению нарушенных показателей функционального состояния поврежденного органа [10].
Учитывая сложности культивирования стволовых клеток в условиях их направленной дифференцировки в нужном направлении и выделение и кондиционирование их секретома, альтернативным источником биоматериала для стимуляции поврежденных органов может служить использование плодных или неонатальных тканей, в которых низкодифференцированные клетки в высокой концентрации окружены специфическим микроокружением (нишей), которая в значительной степени и определяет направленность дифференцировки стволовых клеток в нужном направлении. В ранее проведенных нами исследованиях было показано, что фрагменты ткани неонатального яичка после их трансплантации под капсулу почки или под белочную оболочку яичка длительно приживают и при пересадке в крипторхиро-ванное яичко способствуют восстановлению нарушенного сперматогенеза и синтеза тестостерона [11,12]. При этом в пересаженной неонатальной ткани формируются органоподобные структуры (семенные канальцы со сперматогенным эпителием, элементы придатка яичка, семявыносящий проток), а интерстициальные клетки синтезируют тестостерон [12]. То есть, при эктопической пересадке незрелая неонатальная ткань способна дифференцироваться в зрелые органные структуры и стимулировать регенерацию поврежденных органов.
Пересадка гомогената ткани гипофиза и гипоталамуса в яичко мужчин с андрогенным дефицитом и бесплодием способствовало возрастанию концентрации тестостерона в крови и улучшению эректильной функции и показателей сперматогенеза [13,14).
С точки зрения сравнительной оценки эффективности этих видов регенеративной терапии («бесклеточная» и тканевая) важно проведение исследований на одной экспериментальной модели и с использованием одних и тех же методов оценки.
В соответствии с этой задачей мы провели исследование влияния трансплантации ткани неонатальных почек, полученной от новорожденных крысят, на динамику восстановления функциональных показателей у крыс с моделированной постишемической ОПН. Полученные результаты сравнивали с протективным эффектом терапии БПС эмбрионального головного мозга, эффективность которой была доказана в предыдущих исследованиях [10]. При этом была выбрана «жесткая» модель ОПН (90-минутная ишемия единственной почки), при которой развиваются тяжелые функциональные расстройства [15].
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены на 36 белых беспородных крысах-самцах массой 290-330 г. и 10 новорожденных крысятах в возрасте 1-2 суток. У подопытных крыс вызывали ОПН путем правосторонней нефрэктомии и пережатием сосудистой ножки левой почки на 90 минут. Проведено 3 серии экспериментов (по 10 крыс в каждой серии). В 1-й серии (контрольной) никаких терапевтических воздействий не проводили. Во 2-й серии сразу после восстановления кровотока в левой почке подкожно вводили БПС в дозе 0,1 мг/кг (активный компонент препарата «Целлекс» 0,1 мл/кг) и инъекции препарата продолжали ежедневно 5 раз в неделю, 10 инъекций на курс. Этот препарат представляет собой хроматографически выделенную фракцию белков и пептидов с мол. массой от 10 до 250 кДа, относящихся к факторам роста и дифференцировки клеток, из ткани головного мозга эмбрионов свиней. В 3-й серии перед восстановлением кровоснабжения почки под ее капсулу через пластиковый экспериментальная и клиническая урология № 1 2 0 2 0 катетер вводили гомогенат ткани почек новорожденных крысят, приготовленный непосредственно перед использованием в соотношении ткань/физ. раствор 1:1 (рис. 1 а,б).
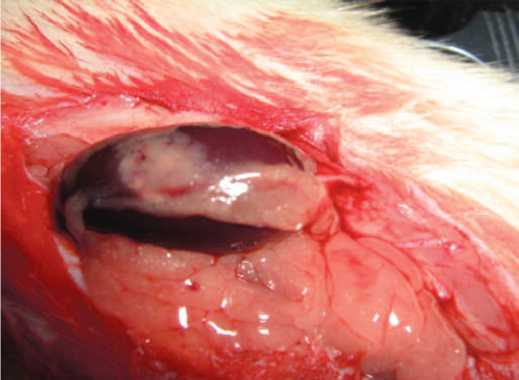
Рис. 1. А – удаленные почки новорожденных крысят. Б – трансплантат ткани неонатальных почек под капсулой ишемизированной почки
Fig. 1. A – removed kidneys of newborn rats. Б – neonatal kidney tissue graft under the capsule of an ischemic kidney
Шесть интактных крыс служили контролем для получения нормальных значений биохимических показателей крови и мочи.
Оценку выраженности функциональных нарушений проводили на 3-и, 7-е и 14-е сутки после моделирования ОПН. Для этого крыс помещали в обменные клетки на сутки для сбора суточной мочи и брали пробы крови из хвостовой вены для биохимического исследования. Исследование крови и мочи проводили на биохимическом анализаторе «ADVIA-2000» («Bayer-Simmens”, ФРГ) с определением следующих показателей: концентрация креатинина, мочевины, натрия и кальция в крови и моче. На основании биохимических данных рассчитывали показатели функционального состояния почек – клубочковую фильтрацию, канальцевую реабсорбцию натрия и кальция, фильтрационный заряд.
Статистический анализ цифровых данных проводили с помощью программ MS Exel и Statistica 6.0. Опре- деляли средние значения показателей в группах и ошибку средней (М±m). Для определения достоверности различий между группами использовали критерий Стьюдента. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Все животные выжили после операции. У крыс всех 3-x серий развивалась ОПН, но выраженность функциональных нарушений и динамика их восстановления были различными. Через 3 суток в 1-й (контрольной) и 3-й (пересадка ткани неонатальной почки) сериях отмечалась выраженная полиурия, достигающая 40,3±1,4 и 41,5±0,3 мл/сутки, соответственно, при нормальных значениях 11,5±0,5 мл/сутки. Во 2-й серии степень полиурии была существенно меньше (19,4± 1,2 мл/сутки) (рис. 2). В дальнейшем выраженность полиурии уменьшалась, но в обеих опытных сериях более выражено, чем в контроле, причем в 3-й серии (пересадка неонатальной ткани) на 7-е и 14-е сутки происходила полная нормализация диуреза, тогда как в остальных сериях диурез был выше нормы.
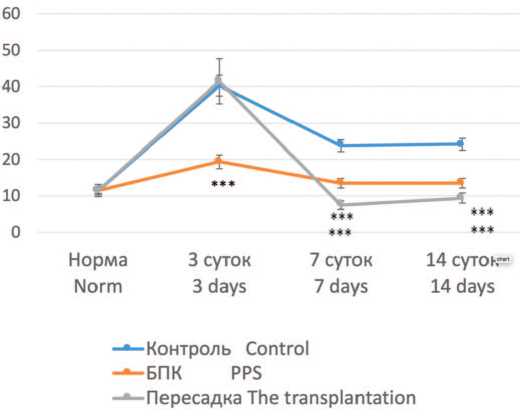
Рис. 2. Динамика диуреза (мл/сутки) у крыс с ОПН в разных сериях
Fig. 2. Dynamics of diuresis (ml / day) in rats with acute renal failure in different series
Концентрация мочевины и креатинина в крови крыс контрольной группы через 3 суток после моделирования резко возрастала (мочевина с 7,8±0,3 до 56,1±2,1 ммоль/л, креатинин – с 65±1 до 393±4 мкмоль/л) с последующей тенденцией к нормализации этих показателей. В опытах с терапией БПС выраженность изменений была значительно меньше (мочевина на 3-и сутки возрастала лишь до 12,0±0,3 ммоль/л, а креатинин – до 110±5 мкмоль/л). В более отдаленном периоде эти показатели также снижались до значений, близких к норме, и достоверно не отличались от значений в контрольных опытах (табл. 1). В опытах с пересадкой ткани неонатальной почки на 3-и сутки значения мочевины и креатинина крови резко возрастали и даже превышали значения, полученные в контрольной серии. Однако уже через 7 суток уровень мочевины полностью нормализовался (4,5±0,2 ммоль/л) и сохранялся на нормальных значениях через 14 суток. Динамика концентрации креатинина крови через 7 и 14 суток была такой же, как в контрольной серии.
При анализе расчетных показателей функционального состояния почки было установлено, что клубочковая фильтрация в 1-й (контрольной) серии на 3-и сутки уменьшалась почти в 7 раз, но в последующем этот показатель возрастал до 65% от нормы к 7 суткам и до 85% от нормы к 14-м суткам (табл. 2). Во 2-й серии с терапией БПС на 3-и сутки клубочковая фильтрация снижалась всего на 35%, с сохранением более высоких значений показателя по сравнению с контролем на 7-е сутки и его стабилизацией до 14 суток после ишемии. В 3-й серии (пересадка ткани неонатальной почки) через 3 суток клубочковая фильтрация снижалась в такой же степени, что и в контрольных опытах, однако через 7 суток отмечался резкий рост данного показателя, достигая значений не только выше значений в других сериях, но даже выше нормальных показателей. Через 14 суток клубочковая фильтрация вновь снижалась до значений ниже контрольных.
В отношении канальцевой реабсорбции натрия в контрольной серии также отмечено резкое ее снижение на 3-и сутки при нормализации показателя через 7 суток и с некоторым ее ухудшением к 14-м суткам. Во 2-й серии реабсорбция натрия на 3-и сутки после ишемии оставалась в пределах нормы, а в последующем несколько ухудшалась, оставаясь на субнормальных значениях. В 3-й серии на 3-и сутки реабсорбция натрия резко ухудшалась даже в большей степени, чем в контрольных опытах, но через 7 суток значения показателя значительно возрастали, превышая даже нормальные значения, с сохранением нормального уровня реабсорбции натрия через 14 суток.
Таблица 1. Динамика концентрации мочевины и креатинина крови в разных сериях опытов
Table 1. The dynamics of the concentration of blood urea and creatinine in different series of experiments
|
Показатели |
Норма |
Серии |
3 суток |
7 суток |
14 суток |
|
|
Characteristics |
Norm |
Series |
3 days |
7 days |
14 days |
|
|
Уровень мочевины в крови (ммоль/л) Blood urea (mmol/l) |
7,8±0,3 |
Контроль Терапия БПС |
Control PPS therapy |
56,1±2,1 12,0±0,3*** |
9,1±0,4 7,8±0,3* |
8,2±0,4 8,9±0,4 |
|
Пересадка |
Transplantation |
85±0,2* |
4,5±0,2** |
8,7±0,1 |
||
|
Уровень креатинина в крови |
Контроль |
Control |
393±4 |
103±2 |
77±2 |
|
|
(мкмоль/л) |
65±1 |
Терапия БПС |
PPS therapy |
110±5*** |
80±2* |
83±2 |
|
Blood creatinine (μmol /l) |
Пересадка |
Transplantation |
586±16* |
126±5 |
94±4 |
Достоверность различий по сравнению с контрольной серией: * – p <0,05, ** – p <0,01, *** – p <0,001 Significance of differences compared with the control series: * – p <0.05, ** – p <0.01, *** – p <0.001
Таблица 2. Динамика расчетных показателей функционального состояния почки у крыс с ОПН при разных вариантах терапии Table 2. The dynamics of the calculated indicators of the functional state of the kidney in rats with acute renal failure with different treatment options
|
Показатели Characteristics |
Норма Norm |
Серии Series |
3 суток 3 days |
7 суток 7 days |
14 суток 14 days |
|
|
Клубочковая фильтрация (мл/мин) Glomerular filtration (ml/min) |
1,44±0,03 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
0,23±0,03 0,93±0,05*** 0,27±0,03 |
0,94±0,03 1,06±0,03* 3,59±0,52*** |
1,22±0,06 1,08±0,03 0,71±0,02* |
|
Реабсорбция натрия (%) Sodium reabsorption (%) |
99,32±0,04 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
97,99±0,08 99,47±0,06*** 96,80±0,05* |
99,15±0,15 99,17±0,07 99,82±0,06*** |
98,96±0,02 99,03±0,07 99,58±0,04*** |
|
Реабсорбция кальция (%) Calcium reabsorption (%) |
99,68±0,02 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
89,04±0,57 99,02±0,24*** 93,42±0,23** |
96,46±0,45 98,20±0,42 98,57±0,16* |
97,42±0,25 98,23±0,08* 98,69±0,21* |
|
Фильтрацион-ный заряд Na (мкмоль/мин) Na filtration charge (μmol / min) |
200±17 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
33±2 136±11*** 42±5 |
137±6 156±2 516±58*** |
172±13 147±5 108±19 |
|
Фильтрацион-ный заряд Са (мкмоль/мин) Ca filtration charge (μmol / min) |
3,74±0,06 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
0,53±0,04 2,25±0,24*** 0,68±0,11 |
2,23±0,08 2,55±0,02* 8,69±1,24*** |
2,89±0,21 2,64±0,08 1,61±0,18* |
|
Экскреция креатинина (мг/сутки) Creatinine excretion (mg / day) |
130±8 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
128±18 139±8 137±27 |
138±2 122±2 63±5* |
134±14 123±6 87±9* |
|
Протеинурия (мг/сутки) Proteinuria (mg / day) |
11,4±0,3 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
14,1±1,9 11,5±0,8 22,1±3,9 |
11,5±0,8 8,8±0,4 10,4±1,7 |
11,4±1,1 9,1±0,2 10,5±0,3 |
Достоверность различий по сравнению с контрольной серией: * – p <0,05, ** – p <0,01, *** – p <0,001 Significance of differences compared with the control series: * – p <0.05, ** – p <0.01, *** – p <0.001

В отношении реабсорбции кальция наблюдалась близкая динамика: в контрольной серии значительное ухудшение на 3-и сутки с постепенным восстановлением через 7 и 14 суток, во 2-й серии – сохранение значений на 3-и сутки на субнормальным уровне с некоторым ухудшением в более отдаленном периоде, а в 3-й серии – сохранение реабсорбции кальция на близких к норме значениях на всех сроках наблюдения.
В соответствии с динамикой клубочковой фильтрации происходили изменения в показателях фильтрационного заряда натрия и кальция, характеризующих количество профильтрованных электролитов. В контрольной серии этот показатель в отношении обоих катионов резко снижался с постепенным возрастанием до субнормальных значений к 14-му дню. В опытах с терапией БПС фильтрационный заряд электролитов на 3 сутки сохранялся на высоких значениях, хотя и ниже нормы и этот уровень оставался примерно на тех же значениях до конца срока наблюдения. В 3-й серии с пересадкой ткани неонатальной почки в ранние сроки существенных различий с контрольными опытами не отмечено, но на 7-е сутки фильтрационный заряд натрия и кальция резко возрастал, превышая нормальные значения с его снижением в более отдаленные сроки.
Суточная экскреция креатинина в 1-й и 2-й группах достоверно не отличалась от нормальных значений при всех сроках наблюдения, тогда как в 3-й серии опытов она достоверно снижалась через 7 и 14 суток после ишемии, а выраженность протеинурии во всех сериях не отличалась от нормы.
Важным параметром оценки выраженности повреждения почки является выраженность ферменту-рии, характеризующая при определенных условиях анализа степень необратимого повреждения клеток канальцевого эпителия. Поскольку выраженность фер-ментурии связана как с попаданием ферментов из крови в первичную мочу вследствие клубочковой фильтрации, так и вследствие деструкции клеток канальцевого эпителия, то для интерпретации данных необходимо сравнение уровней ферментемии и фер-ментурии.
Анализ динамики активности ферментов в крови крыс с ОПН показал, что в контрольных опытах активность всех исследованных ферментов в крови не возрастала при всех сроках наблюдения (табл. 3). В серии с терапией БПС отмечена тенденция к более низким показателям активности ферментов, которые фиксировались для разных ферментов в разные сроки наблюдения.
Таблица 3. Динамика активности ферментов в крови крыс с ОПН в разных сериях опытов
Table 3. Dynamics of blood enzyme activity in the rats with acute renal failure in different series of experiments
|
Показатели Characteristics |
Норма Norm |
Серии Series |
3 суток 3 days |
7 суток 7 days |
14 суток 14 days |
|
|
Аспартатаминотрансфераза (АСТ) Aspartate aminotransferase (АSТ) |
68±2 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
66±3 59±2 105±6** |
71±3 81±4 114±7* |
81±6 65±3 79±4 |
|
Аланинаминотрансфераза ( АЛТ) Alanine aminotransferase (ALT) |
36±3 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
22±2 21±1 21±2 |
25±2 23±2 21±3 |
40±2 29±1* 18±2** |
|
Щелочная фосфотаза (ЩФ) Alkaline phosphatase (AP) |
169±8 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
281±9 115±7*** 232±9 |
202±8 158±8* 439±23*** |
358±38 219±31 404±54 |
|
Лактатдегидрогеназа (ЛДГ) Lactate Dehydrogenase (LDH) |
320±22 |
Контроль Терапия БПС Пересадка |
Control PPS therapy Transplantation |
260±18 292±20 559±26** |
327±16 132±12** 962±133** |
336±18 387±23 456±78 |
Достоверность различий по сравнению с контрольной серией: * – p <0,05, ** – p <0,01, *** – p <0,001 Significance of differences compared with the control series: * – p <0.05, ** – p <0.01, *** – p <0.001
Таблица 4. Динамику суточной ферментурии у крыс с ОПН в разных сериях опытов
Table 4. The dynamics of daily fermentation in rats with acute renal failure in different series of experiments
|
Показатели Characteristics |
Норма Norm |
Серии Series |
3 суток 3 days |
7 суток 7 days |
14 суток 14 days |
|
Экскреция АСТ (МЕ/сутки) Excretion of AST (IU / day) |
74,3±9,8 |
Контроль Control Терапия БПС PPS therapy Пересадка Transplantation |
63,7±8,1 78,7±11,4 34,3±3,5* |
86,3±12,3 63,7±9,1 40,5±4,3* |
73,2±7,6 50,1±9.3 51,5±3,2* |
|
Экскреция АЛТ (МЕ/сутки) Excretion of ALT (IU / day) |
45,5±8,1 |
Контроль Control Терапия БПС PPS therapy Пересадка Transplantation |
115,3±6,1 58,7±0,9*** 62,2±1,1** |
53,7±4,2 50,9±5,4 50,5±4,3 |
48,3±5,4 49,7±9,3 47,5±3,2 |
|
Экскреция ЩФ (МЕ/сутки) Excretion of AP (IU / day) |
128±10 |
Контроль Control Терапия БПС PPS therapy Пересадка Transplantation |
98±22 123±41 244±42* |
85±21 73±15 28±3** |
309±59 201±17 80±17** |
|
Экскреция ЛДГ (МЕ/сутки) Excretion of LDH (IU / day) |
116±12 |
Контроль Control Терапия БПС PPS therapy Пересадка Transplantation |
91±15 104±15 82±31 |
127±2 94±4* 18±1*** |
167±20 118±8 51±2*** |
Достоверность различий по сравнению с контрольной серией: * – p <0,05, ** – p <0,01, *** – p <0,001 Significance of differences compared with the control series: * – p <0.05, ** – p <0.01, *** – p <0.001
В то же время в опытах с пересадкой неонатальной ткани отмечался выраженный рост активности АСТ на 3-и сутки, ЩФ – на 7-е сутки и ЛДГ на 3-и и 7-е сутки.
Таким образом, только в 3-й серии повышение активности ряда ферментов в крови может потенциально влиять на выраженность ферментурии.
Анализ динамики суточной экскреции ферментов с мочой показал, что в контрольной серии возросла экскреция АЛТ на 3-и сутки после ишемии и ЩФ – на 14-е сутки, тогда как экскреция остальных ферментов оставалась в пределах нормальных значений (табл. 4). В серии опытов с терапией БПС роста экскреции АЛТ не происходило, а динамика экскреции остальных ферментов была такой же, как в контрольных опытах. В серии с пересадкой неонатальной ткани суточная экскреция всех ферментов была ниже, чем в 1-й и 2-й сериях.
Таким образом, трансплантация ткани неонатальной почки наряду с улучшением функциональных показателей способствует снижению выраженности фер-ментурии у крыс с ОПН, тогда как терапия БПС оказывает менее выраженное влияние на этот показатель. Изменение активности изучаемых ферментов в крови не влияет на уровень ферментурии.
ОБСУЖДЕНИЕ
Использование клеточных технологий как с самими стволовыми клетками, так и продуктами их метаболизма и секреции, для стимуляции регенерации поврежденных органов при острых и хронических заболеваниях является бурно развивающимся направлением экспериментальных исследований. Имеется множество публикаций, свидетельствующих, что пересадка мезенхимных стволовых клеток при экспериментально вызванной острой (постишемической или токсической) и хронической почечной недостаточности способствует уменьшению выраженности функциональных расстройств и морфологических признаков повреждения органа [1,3,6,15-17].
При этом показано, что не более 1% пересаженных клеток встраивается в почечные структуры, замещая поврежденные клетки, а основной механизм действия связан с их паракринным влиянием, с одной стороны активирующим резидентные стволовые клетки клубочков и канальцев, а с другой стороны – стимулирующим регенерацию клеток через механизм дедифференци-ровки/редифференцировки [7,18,19].
Учитывая эти данные, параллельным направлением является использование бесклеточных технологий с терапией биоактивными факторами, секретируемыми мезенхимными стволовыми клетками, называемыми секретомом (комплекс белков, пептидов, микровезикул, содержащих РНК, в том числе некодирующих микро-РНК, и липидных медиаторов) [7,9,20-22]. Эти гуморальные факторы можно концентрировать, замораживать и лиофилизировать без изменения их биологической активности, что позволяет их использовать в терапевтических целях при необходимости в любое время, что выгодно отличает эту стратегию от стратегии использования криоконсервиро-ванных стволовых клеток, которая требует специальной аппаратуры для хранения клеток в жидком азоте и специальной инфраструктуры для их деконсервации [23].
Уменьшение выраженности повреждения почек при терапии мезенхимными стволовыми клетками связывают также с противовоспалительным действием продуктов их секреции, уменьшением оксидативного стресса, повреждения митохондрий и иммуномодулирующим действием, обеспечивающим цитопротективный эффект секретома [17,24-26].
Учитывая потенциальную перспективность использования «бесклеточной терапии» в клинике для стимуляции регенерации поврежденных органов, ранее мы провели исследование по оценке протективного эффекта БПС эмбриональных клеток головного мозга свиней (препарат Целлекс) при моделировании ОПН у крыс [10]. Предпосылками для его проведения были данные литературы о стимуляции восстановления нарушенной функции головного мозга у больных с цереброваскулярными заболеваниями [27,28]. Хотя БПС является препаратом, содержащим ксеногенные белки и пептиды, потенциально способные вызывать аллергические реакции, тем не менее опыт клинического использование препарата Целлекс не выявил таких побочных реакций [27,28]. Мы предположили, что аналогичный стимулирующий эффект может проявляться и в отношении других органов. Результаты исследования подтвердили это предположение: терапия БПС эмбриональных клеток головного мозга свиней ослабляет выраженность структурно-функционального повреждения почки при моделировании постишемической ОПН умеренной степени выраженности (60-минутная ишемия единственной почки) [10]. Однако с клинической точки зрения более важно было исследовать, сохранится ли про-тективное действие этого препарата при более тяжелом повреждении почки, приводящем к резко выраженным функциональным нарушениям на грани совместимости с жизнью (90-минутная ишемия единственной почки).
Другой задачей нашего исследования было оценить эффективность альтернативного варианта – пересадки в поврежденный орган гомогената ткани неонатальной почки. При этом мы предполагали выяснить следующие вопросы: 1) имеются ли различия в эффективности тканевой и бесклеточной терапии; 2) влияет ли органоспецифичность источника стволовых клеток или продуктов их секреции на эффективность терапии.
Результаты исследования показали, что динамика реализации терапевтического эффекта при обоих вариантах регенеративной терапии существенно различаются. Если в серии опытов с использованием БПС уже с 3-х суток после моделирования ОПН отмечали улучшение всех функциональных показателей (диурез, концентрация креатинина и мочевины в крови, клубочковая фильтрация, экспериментальная и клиническая урология № 1 2 0 2 0 реабсорбция натрия и кальция), то в опытах с пересадкой ткани неонатальной почки в этот срок различий с контрольными экспериментами (без терапии) не было получено. Однако через 7 суток отмечали нормализацию большинства параметров, а значения клубочковой фильтрации более чем в 2 раза превышали нормальные значения, тогда как при терапии БПС ряд функциональных показателей, хотя и приближался к нормальным значениям, но все же оставался ниже нормы. Через 14 суток различия между сериями по большинству показателей нивелировались.
Такие различия в динамике восстановления функциональных показателей ишемизированной почки могут свидетельствовать, что при пересадке ткани неонатальной почки стимулирующий регенерацию эффект, может быть связан с деструкцией пересаженных клеток вследствие иммунного отторжения, которая развивается в течение нескольких дней, и приводящая к высвобождению внутриклеточных компонентов, которые и оказывают паракринный эффект на поврежденный орган. Подобный механизм описан в работах [29, 30]. Массивное выделение гуморальных факторов может быть причиной столь резкой стимуляции функциональной активности органа. Возможно, такой эффект связан со значительной интенсификацией микроциркуляции в почке, в том числе в клубочковых капиллярах, в период гибели пересаженных клеток и выброса вазоактивных молекул, входящих в состав секретома стволовых клеток, что и приводит к значительному росту клубочковой фильтрации. Подобное влияние секретома описано в работе [8]. Однако клубочковая фильтрация в этой серии опытов через 14 суток снижалась даже ниже значений, полученных не только в серии с терапией БПС, но и в контрольной серии опытов (без терапии), что может быть связано с компенсаторной вазоконстрикцией почечных сосудов в ответ на ранее вызванную значительную вазодилатацию.
Косвенным свидетельством деструкции пересаженных клеток является возрастание активности ряда внут- риклеточных ферментов в крови животных, в частности, АСТ и ЛДГ. Однако на показатели функциональной активности и сохранности эпителия почечных канальцев этот факт не оказывал негативного влияния. Более того, канальцевая реабсорбция натрия и кальция через 7 и 14 дней после моделирования ОПН оказалась ближе к норме, чем в опытах с БПС. Экскреция ферментов с мочой также оказалась наиболее низкой в серии опытов с пересадкой ткани неонатальной почки, особенно в отношении ЩФ и ЛДГ, экскреция которых с мочой оказалась ниже, чем в опытах с терапией БПС.
ЗАКЛЮЧЕНИЕ
Таким образом, как терапия БПС, так и терапия с использованием пересадки ткани неонатальной почки способствуют уменьшению выраженности функциональных и биохимических расстройств при моделировании постишемической ОПН тяжелой степени. При этом терапия БПС оказывает протективный эффект уже в ранние сроки (через 3 дня), тогда как защитный эффект пересадки ткани неонатальной почки реализует позднее (через 7 и 14 суток). Однако использование БПС предусматривает возможность при необходимости проведения повторных курсов парентеральной терапии, тогда как повторная пересадка неонатальной ткани ввиду ин-вазивности методики имеет существенные ограничения.
Выраженное ускорение функциональной полноценности почки в условиях ОПН при терапии БПС, который является секретомом внепочечного происхождения, может свидетельствовать что значимость органоспецифичности комплекса гуморальных факторов стволовых клеток не имеет существенного значения для реализации протективного эффекта терапии, однако, более выраженное улучшение ряда функциональных и биохимических показателей при пересадке ткани неонатальной почки все же указывает на определенное значение этого фактора. Для уточнения этого вопроса требуются дополнительные исследования.
Список литературы Сравнительная характеристика протективного действия терапии белково-пептидным секретомом эмбриональной ткани и трансплантации ткани неонатальной почки при острой постишемической почечной недостаточности
- Li JS, Li B. Renal Injury Repair: How About the Role of Stem Cells. Adv Exp Med Biol 2019;1165:661-670. 10.1007/978-981-13-8871 -2_32. DOI: 10.1007/978-981-13-8871-2_32
- Selim RE, Ahmed HH, Abd-Allah SH, Sabry GM, Hassan RE, Khalil WKB, Abouhashem NS. Mesenchymal stem cells: a promising therapeutic tool for acute kidney injury. Appl Biochem Biotechnol 2019;189(1):284-304. DOI: 10.1007/s12010-019-02995-2
- Rota C, Morigi M, Imberti B. Stem cell therapies in kidney diseases: progress and challenges. Int J Mol Sci 2019; 20: 2790. DOI: 10.3390/ijms20112790
- Rota C, Morigi M, Cerullo D, Introna M, Colpani 0, Corna D, et al. Therapeutic potential of stromal cells of non-renal or renal origin in experimental chronic kidney disease. Stem Cell Res. Ther 2018;9(1):220. DOI: 10.1186/s13287-018-0960-8
- Bi B, Schmitt R, Israilova M, Nishio H, Cantley LG. Stromal cells protect against acute tubular injury via an endocrine effect. J Am Soc Nephrol 2007;18(9):2486-96. 10.1681/ ASN.2007020140 DOI: 10.1681/ASN.2007020140
- Fan M, Zhang J, Xin H, He X, Zhang X. Current perspectives on role of MSC in renal pathophysiology. Front Physiol 2018;9(Article 1323).
- DOI: 10.3389/fphys.2018.01323
- Beer L, Mildner M, Ankersmit HJ. Cell secretome based drug substances in regenerative medicine: When regulatory affairs meet basic science. Ann Transl Med 2017;5:170.
- DOI: 10.21037/atm.2017.03.50
- Golle L, Gerth HU, Beul K, Heitplatz B, Barth P, Fobker M, et al. Bone marrow-derived cells and their conditioned medium induce microvascular repair in uremic rats by stimulation of endogenous repair mechanisms. Sci Rep 2017;7(1):9444.
- DOI: 10.1038/s41598-017-09883-x
- Vizoso FJ, Eiro N, Cid S, Schneider, Perez-Fernandez R. Mesenchymal stem cell secretome: toward cell-free therapeutic strategies in regenerative medicine. Int J Mol Sci 2017;18:1852.
- DOI: 10.3390/ijms18091852
- Кирпатовский В.И., Сивков А.В., Голованов С.А., Дрожжева В.В., Самойлова С.И., Рабинович Э.З., и др. Профилактика развития острой постишемической почечной недостаточности с использованием белково-пептидного комплекса эмбриональной ткани. Экспериментальная и клиническая урология 2019;(3):32-39.
- Кирпатовский В.И., Ефремов Г.Д., Фролова Е.В., Кудрявцева Л.В. Стимуляция сперматогенеза и синтеза тестостерона путем аллотрансплантации неонатальной тестикулярной ткани под белочную оболочку крипторхированного яичка. Бюллетень экспериментальной биологии и медицины 2018;166(10):495-501.
- Кирпатовский В.И., Ефремов Г.Д., Фролова Е.В. Эктопический органогенез при аллотрансплантации ткани свежеудаленного или криоконсервированного неонатального яичка под капсулу почки крыс. Бюллетень экспериментальной биологии и медицины 2018;166(8):230-235.
- Кирпатовский И.Д., Дендеберов Е.С. Способ лечения вторичного гипогонадизма. Патент на изобретение RUS № 2177735.
- Дендеберов В.С. Аллотрансплантация гипофиза в эксперименте и клинике: автореф. дис. д-ра. мед. наук: Москва, 2002. 29 с. [Dendeberov VS. Pituitary allotransplantation in experiment and clinic: Dr.Med.Sci [thesis]: Moscow, 2002. 29 p. (In Russian)
- Кирпатовский В.И., Казаченко А.В., Плотников Е.Ю., Марей М.В., Мусина Р.А., Конькова Т.А., и др. Функциональные последствия интрапаренхиматозного введения фетальных стволовых клеток и прогениторных клеток человека при хронической и острой почечной недостаточности у крыс. Клеточные технологии в биологии и медицине 2006;(2):70-76.
- Perico L., Morigi M., Rota C., Breno M., Mele C., Noris M., et al. Human mesenchymal stromal cells transplanted into mice stimulate renal tubular cells and enhance mitochondrial function. Nat Commun 2017;8(1):983.
- DOI: 10.1038/s41467-017-00937-2
- Yun CW, Lee SH. Potential and therapeutic efficacy of cell-based therapy using mesenchymal stem cells for acute/chronic kidney disease. Int J. Mol Sci 2019;20(7):pii: E1619.
- DOI: 10.3390/ijms20071619
- Humphreys BD, Czerniak S., DiRocco DP, Hasnain W., Cheema R., Bonventre JV. Repair of injured proximal tubule does not involve specialized progenitors. Proc Natl Acad Sci USA 2011;108(22):9226-31.
- DOI: 10.1073/pnas.1100629108
- Meyer-Schwesinger C. The role of renal progenitors in renal regeneration. Nephron 2016;132:101-109.
- DOI: 10.1159/000442180
- Grange C., Skovronova R., Marabese F., Bussolati B. Stem cell-derived extracellular vesicles and kidney regeneration. Cells 2019;8(10):pii: E1240.
- DOI: 10.3390/cells8101240
- Bochon B., Kozubska M., Surygata G., Witkowska A., Kuzniewicz R., Grzeszczak W., et al. Mesenchymal stem cells-potential applications in kidney diseases. Int J. Mol Sci 2019;20(10): pii: E2462.
- DOI: 10.3390/ijms20102462
- Phelps J., Sanati-Nezhad A., Ungrin M., Duncan NA, Sen A. Bioprocessing of mesenchymal stem cells and their derivatives: toward cell-free therapeutics. Stem Cells Int 2018; 2018: Article ID 9415367.
- DOI: 10.1155/2018/9415367
- Bogatcheva NV, Coleman ME. Conditioned medium of mesenchymal stromal cells: a new class of therapeutics. Biochemistry (Mosc) 2019;84(11):1375-1389.
- DOI: 10.1134/S0006297919110129
- Lee KH, Tseng WC, Yang CY, Tarng DC. The anti-inflammatory, anti-oxidative, and anti-apoptotic benefits of stem cells in acute ischemic kidney injury. Int J. Mol Sci 2019;20(14):pii: E3529.
- DOI: 10.3390/ijms20143529
- Zhao L., Hu C., Zhang P., Jiang H., Chen J. Mesenchymal stem cell therapy targeting mitochondrial dysfunction in acute kidney injury. J. Transl Med 2019;17(1):142.
- DOI: 10.1186/s12967-019-1893-4
- Mata-Miranda MM, Bernal-Barquero CE, Martinez-Cuazitl A., Guerrero-Robles CI, Sanchez-Monroy V., Rojas-Lopez M., et al. Nephroprotective effect of embryonic stem cells reducing lipid peroxidation in kidney injury induced by cisplatin. Oxid Med Cell Longev 2019;2019:5420624.
- DOI: 10.1155/2019/5420624
- Камчатнов П.Р., Измайлов И.А., Соколов М.А. Результаты применения препарата Целлекс у больных с цереброваскулярными заболеваниями. Нервные болезни 2018;(1):26-30.
- Хасанова Д.Р., Данилова Т.В., Демин Т.В., Книи К.С., Гайфутдинова Л.В. Влияние препарата целлекс на восстановление двигательных и речевых функций в ранней нейрореабилитации пациентов, перенесших ишемический инсульт. Медицинский совет 2018;(9):14-19.
- Campanholle G., Mittelsteadt K., Nakagawa S., Kobayashi A., Lin SL, Gharib SA, et al. TLR-2/TLR-4 TREM-1 signaling pathway is dispensable in inflammatory myeloid cells during sterile kidney injury. PLoS One 2013;8(7):e68640.
- DOI: 10.1371/journal.pone.0068640
- Nakagawa S., Omura T., Yonezawa A., Yano I., Nakagawa T., Matsubara K. Extracellular nucleotides from dying cells act as molecular signals to promote wound repair in renal tubular injury. Am J. Physiol Renal Physiol 2014;307(12): F1404-F1411.
- DOI: 10.1152/ajprenal.00196.2014


