Сравнительная оценка антиишемической эффективности коронарного стентирования у больных ишемической болезнью сердца со сниженной фракцией выброса левого желудочка и консервативной медикаментозной терапии
Автор: Тепляков А.Т., Тарасов Н.И., Торим Ю.Ю., Крылов А.Л., Кривоносов Д.С., Рыбальченко Е.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1-2 т.23, 2008 года.
Бесплатный доступ
По данным 12 мес проспективного наблюдения проведена оценка клинического течения, эффективности стентирования коронарных артерий и медикаментозного лечения у 86 больных ишемической болезнью сердца на фоне стенозирующего коронарного атеросклероза со сниженной и с сохраненной фракцией выброса левого желудочка (ФВЛЖ). Установлено, что за 12 мес наблюдения число случаев смерти от сердечно-сосудистых причин в группе со сниженной ФВЛЖ и консервативной терапией было статистически значимо выше в сравнении с пациентами с низкой ФВЛЖ и стентированием коронарных артерий.
Ишемическая болезнь сердца, коронарное стентирование, медикаментозное лечение, низкая фракция выброса
Короткий адрес: https://sciup.org/14918835
IDR: 14918835 | УДК: 616.12-008.331.1:615.22
Текст научной статьи Сравнительная оценка антиишемической эффективности коронарного стентирования у больных ишемической болезнью сердца со сниженной фракцией выброса левого желудочка и консервативной медикаментозной терапии
КЛИНИЧЕСКИЕИССЛЕДОВАНИЯ
А.Т. Тепляков*, Н.И. Тарасов**, Ю.Ю. Торим*, А.Л. Крылов*, Д.С. Кривоносов**,Е.В. Рыбальченко*
E-mail: ytorim@list.ru
СРАВНИТЕЛЬНАЯ ОЦЕНКА
АНТИИШЕМИЧЕСКОЙ ЭФФЕКТИВНОСТИ КОРОНАРНОГО СТЕНТИРОВАНИЯ
У БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА СО СНИЖЕННОЙ ФРАКЦИЕЙ ВЫБРОСА ЛЕВОГО ЖЕЛУДОЧКА
И КОНСЕРВАТИВНОЙ МЕДИКАМЕНТОЗНОЙ ТЕРАПИИ
-
*ГУ НИИ кардиологии Томского научного центра СО РАМН;
-
**ГУ Кемеровский кардиологический центр
В настоящее время хроническая сердечная недостаточность (ХСН) является одной из главных проблем здравоохранения экономически развитых стран и России [1-5]. Несмотря на существенные достижения, произошедшие за последние годы в лечении больных этим заболеванием, ХСН остается одной из основных причин смерти, при этом 60-70% случаев ХСН приходится на долю ИБС (E. Braunwald, 1992; А.Т. Тепляков, А.А. Гарганеева, 1994; Д.М. Аронов, 1988, 2000; Ю.Н. Беленков, 2000, 2001). Больные с ишемической кардиомиопатией имеют наихудший прогноз выживаемости в сравнении с группами пациентов с сердечной недостаточностью другой этиологии [6, 7]. Отдаленный прогноз у пациентов с ХСН крайне неблагоприятен: 5-летняя выживаемость составляет лишь 35% (Роттердамское исследование, 2004), что требует внедрения в клиническую практику современных высокоинформативных методов диагностики и эффективного лечения (В.Ю. Мареев, 2003).
Наличие у пациента тяжелой ишемической дисфункции, как правило, ассоциированной с синдромом сердечной недостаточности (СН), до недавнего времени являлось относительным противопоказанием для проведения эндоваскулярной ангиопластики (Л.А. Бо- керия, В.С. Работников, Ю.И. Бузиашвили, 2001). С появлением коронарных эндопротезов стентирование стало успешно применяться на различных стадиях и при различных клинических проявлениях ИБС – у пациентов с нестабильной стенокардией, острым инфарктом миокарда, ишемической дисфункцией миокарда со сниженной фракцией выброса левого желудочка (ФВЛЖ), при многососудистом поражении коронарных артерий (КА) [8, 9]. Актуальным и недостаточно освещенным в современной научной литературе является вопрос о влиянии коронарного стентирования на сроки и частоту рецидивов стенокардии, частоту повторного инфаркта миокарда, регресс дисфункции гибернированного миокарда и динамику ФВЛЖ и, самое главное, на показатели выживаемости в отдаленные сроки после вмешательства.
Цель исследования: по данным длительного (12 мес) проспективного клинико-коронароангиографического исследования оценить антиишемическую эффективность коронарного стентирования в сравнении с консервативной медикаментозной терапией у больных ИБС со сниженной ФВЛЖ (менее 45%).
МАТЕРИАЛ И МЕТОДЫ
В исследование включены 86 пациентов ИБС в возрасте от 42 до 79 лет с низкой ФВЛЖ (менее 45%) и сохраненной ФВЛЖ. Из исследования исключались пациенты с опасными для жизни желудочковыми нарушениями ритма сердца, АВ-блокадой II и III степеней, тяжелым сахарным диабетом II типа и эффективно не корригируемой артериальной гипертензией. Все пациенты, вошедшие в исследование, дали своё информированное письменное согласие на эндоваскулярные лечебные процедуры и длительное проспективное наблюдение.
В соответствии с показателем ФВЛЖ и тактикой проводимого лечения больные разделены на три группы. В 1-ю группу (n=23) включены пациенты со сниженной ФВЛЖ (35,6±6,3%) и эндоваскулярной реваскуляризацией КА (современная комбинированная медикаментозная терапия, выполнение коронарогра-фического (КГ) обследования с последующим стентированием гемодинамически значимых атеросклеротических поражений). Вторую группу (n=23) составили пациенты с сохраненной ФВЛЖ (62,2±5,5%) и стентированием КА. В 3-ю группу (n=35) вошли пациенты со сниженной ФВЛЖ (35,2±1,6%) и консервативной медикаментозной тактикой лечения. По всем основным клинико-демографическим показателям, а также комбинированной антиишемической медикаментозной терапии статистически значимых различий между группами не было (табл. 1).
Клинико-функциональная диагностика в динамике включала регистрацию ЭКГ в 12-стандартных отведениях, ультразвуковое исследование сердца, пробу с дозированной физической нагрузкой, сцинтиграфию миокарда с 199Tl или Тс99mMYOVIEW и контрольную КГ через 12 мес после стентирования.
Клиническая характеристика больных в исследованных группах
|
Показатель |
1-я группа (n=23) |
2-я группа (n=28) |
3-я группа (n=35) |
Р |
|
Возраст, годы |
56,5±9,3 |
54,4±6,1 |
62,6±7,3 |
нд |
|
Пол (муж/жен), % |
91,4 / 8,6 |
92,9 / 7,1 |
82,9 /17,1 |
нд |
|
Стаж ИБС, мес |
74,9±8,0 |
41,0±5,3 |
69,6±7,4 |
нд |
|
Критерии включения, % |
||||
|
НС |
26,1 |
21,4 |
22,9 |
нд |
|
Подострый ИМ |
21,7 |
14,3 |
17,1 |
нд |
|
Стенокардия напряжения: II ФК III ФК |
8,7 43,5 |
17,9 46,4 |
11,4 48,6 |
нд нд |
|
Факторы риска, % |
||||
|
Курение |
73,9 |
64,3 |
74,3 |
нд |
|
АГ II-III степеней |
78,3 |
78,6 |
80 |
нд |
|
СД II тип |
8,7 |
10,7 |
8,6 |
нд |
|
ОХС>6,3 ммоль/л |
52,2 |
35,7 |
42,8 |
нд |
|
Ожирение |
26,1 |
35,7 |
34,3 |
нд |
|
Перенесенный ИМ |
95,6 |
35,7 |
100 |
<0,001 |
|
Постинфарктная аневризма ЛЖ |
56,5 |
7,1 |
48,6 |
<0,001 |
|
ХСН: II ФК по NYHA III ФК по NYHA |
34,8 65,2 |
85,7 14,3 |
34,3 65,7 |
<0,05 <0,05 |
|
Медикаментозное лечение, % |
||||
|
Аспирин |
86,9 |
85,7 |
88,6 |
нд |
|
Плавикс |
100 |
100 |
0 |
<0,001 |
|
Варфарин |
17,4 |
7,1 |
20,0 |
нд |
|
Диуретики |
65,2 |
14,3 |
71,4 |
<0,05 |
|
в-адреноблокаторы |
86,9 |
64,3 |
71,4 |
нд |
|
Антагонисты Са |
34,8 |
7,1 |
28,6 |
нд |
|
Ингибиторы АПФ |
86,9 |
64,3 |
71,4 |
нд |
|
Статины |
78,3 |
60,7 |
57,1 |
нд |
|
Дигоксин |
8,7 |
0 |
11,4 |
<0,05 |
Примечание. НС – нестабильная стенокардия; ИМ – инфаркт миокарда; ФК – функциональный класс; АГ – артериальная гипертония; СД – сахарный диабет; ОХС – общий холестерин; ЛЖ – левый желудочек; ХСН – хроническая сердечная недостаточность; Са – кальций; АПФ – ангиотензин превращающий фермент; нд – различия недостоверны (статистически незначимы).
Диагностическая коронаровентрикулография выполнялась по стандартной методике на ангиографической установке Coroscop (Siemens, Германия). Эндоваскулярное лечение проводилось с использованием голометаллических стентов и/или стентов с лекарственным покрытием Cypher (активное вещество – сиролимус, Cordis, США). После эндоваскулярной реваскуляризации все пациенты получали стандарт-6
Таблица 1
ную дезагрегантную (аспирин 125 мг/сут и клопидогрел 75 мг/сут) и антикоагулянтную (гепарин 1000 ЕД/час внутривенно в течение первых суток, со вторых суток пациенты с острым коронарным синдромом и/или с двумя и более имплантированными стентами переводились на подкожное введение гепарина в дозе 20000 ЕД/сут в течение 5 суток и 10000 ЕД/ сут в течение последующих двух суток под контролем АЧТВ и уровня тромбоцитов крови) терапию.
Клиническая оценка антиишемической эффективности лечения в группах с инвазивной и консервативной тактикой осуществлялась при контрольном обследовании через 12 мес либо при рецидиве стенокардии. Контрольная коронаровентрикулография выполнялась всем пациентам через 1 год после стентирования или при рецидиве стенокардии. В случае обнаружения в месте установки стента в КА сужения ≥ 70% оно расценивалось как in stent рестеноз.
Статистический анализ проводили с использованием программы статистической обработки Statistica 6.0. Количественные данные представлены как M±m (среднее значение ± стандартная ошибка среднего). В работе анализ материала проводился с использованием t-критерия Стьюдента для количественных признаков. Для анализа качественных признаков использован непараметрический критерий χ 2 и точный критерий Фишера. Анализ выживаемости проводился методом Каплана-Мейера.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клиническая и демографическая характеристика пациентов представлена в таблице 1. Больные всех трех групп фактически не различались по возрасту, полу, основному заболеванию и сопутствующей патологии. Однако количество пациентов с ранее перенесенным инфарктом миокарда (ИМ) было статистически значимо выше в 1-й и 3-й группах в сравнении со 2-й группой (95,6% и 100% против 35,7%, соответственно, р<0,001). Кроме того, у пациентов с низкой ФВЛЖ чаще диагностировали хронические постинфарктные аневризмы ЛЖ (в 1-й группе – 56,5%, в 3-й группе – 48,6%), в сравнении со 2-й группой с сохраненной ФВЛЖ (7,1%). Вместе с тем у больных 1-й и 3-й групп почти в 4,5 раза чаще по сравнению со 2-й группой регистрировалась тяжелая резистентная к медикаментозной терапии ХСН III ФК по NYHA.
При выполнении коронарного стентирования пациентам 1-й группы имплантировано 45 стентов, преобладали (57,8%) стенты Cypher. Полная рева-
Частота приступов стенокардия
исходно выписка 12 мес
ФВ<45%+стент ФВ сохр. +стент ФВ<45%+МТ
А
ФВ<45%+стент ФВ сохр. +стент ФВ<45%+МТ
Б
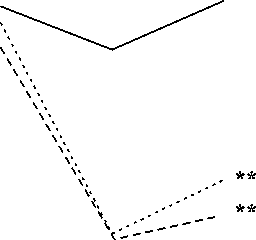
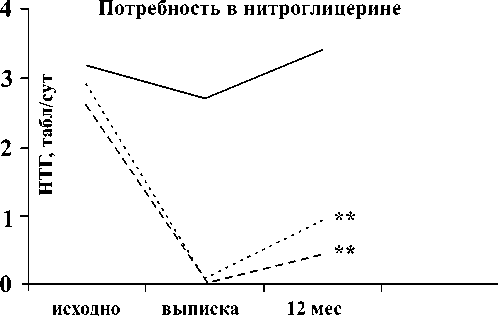
Рис. 1. Антиишемическая эффективность эндоваскулярного стентирования в сравнении с консервативной терапией: А - регресс стенокардии; Б - снижение суточной потребности в нитроглицерине (НТГ). ФВ - фракция выброса левого желудочка; МТ - медикаментозная терапия. **p<0,0001.
скуляризация осуществлена у 7 (30,4%) пациентов. Первичный ангиографический успех составил 100%. У подавляющего большинства – 20 (86,9%) больных – после стентирования отсутствовали приступы стенокардии и регрессировали симптомы ишемии миокарда. При проведении стентирования в 1-й группе наблюдались следующие осложнения: у 1 (4,3%) пациента с подострым ИМ развился острый тромбоз голометаллического стента; у другого пациента на вторые сутки после стентирования диагностировано наружное кровотечение из места пункции бедренной артерии, потребовавшее переливания крови. Инфарктов миокарда и летальных исходов во время эндоваскулярного вмешательства у пациентов с низкой ФВЛЖ не возникло.
Во 2-й группе имплантировано 59 стентов. Преобладали стенты Cypher – 45 (76,3%) случаев. Полная реваскуляризация осуществлена у 19 (67,8%) пациентов. Первичный ангиографический успех составил 100%. У подавляющего большинства больных – 25 (89,3%) достигнуто полное купирование стенокардии непосредственно после стентирования. Нами отмечены следующие процедуральные побочные эффекты: в 2 (7,1%) случаях при имплантации стента в бифуркационное поражение за счет смещения атероматозной бляшки окклюзирована смежная КА бифуркации (обе артерии имели диаметр <1,5 мм). Инфарктов миокарда и летальных исходов за время первичной госпитализации не зарегистрировано.
Таким образом, эндоваскулярная коронарная реваскуляризация у пациентов как 1-й, так и 2-й групп оказалась высокоэффективной и не была сопряжена с особыми техническими сложностями.
Регресс коронарной недостаточности через 12 мес проспективного наблюдения пациентов после стентирования сопровождался снижением частоты приступов стенокардии и потребности в нитроглицерине.
Так, в 1-й группе частота приступов стенокардии через 12 мес снизилась на 71,9%, суточная потребность в нитроглицерине снизилась на 69%. Во 2-й группе частота и тяжесть приступов стенокардии регрессировали на 85,7% с пропорциональным снижением суточной потребности в нитроглицерине на 84,6%. В 3-й группе на фоне медикаментозной терапии в течение всего периода наблюдения сохранялись частые приступы стенокардии с высокой (до 3,4±0,9 табл.) потребностью в нитроглицерине (рис. 1 А, Б).
У пациентов 1-й группы при проведении велоэрго-метрии исходно регистрировалось значительное снижение толерантности к физической нагрузке (ТФН). Через год после реваскуляризации у пациентов с систолической дисфункцией левого желудочка (1-я группа) ТФН возросла почти в два раза, в то время как у пациентов, получавших только медикаментозную терапию (3-я группа), не отмечено статистически значимых изменений ТФН (рис. 2).
90 Вт.
Толерантность к физической нагрузке
81,8 *
62,9
61,3
32,8

исходно
34,2
12 мес
ФВ<45%+стент ФВ сохр. +стент ФВ<45%+МТ
Рис. 2. Динамика показателей физической толерантности по данным велоэргометрии (результаты 12-месячного наблюдения). ФВ - фракция выброса левого желудочка; МТ - медикаментозная терапия. *p<0,05.
Таблица 2
и манометрии полости левого желудочка
|
Показатель |
1-я группа (n=23) |
2-я группа (n=28) |
3-я группа (n=35) |
|
ФВЛЖ (м-реж.), % - исходно - через 12 мес |
39,9±6,7 44,1±8,6 (р=0,09) |
63,7±4,8 63,7±4,1 (р=0,9) |
38,3±1,6 37,6±2,0 (р=0,06) |
|
ФВЛЖ (в-реж.), % - исходно - через 12 мес |
35,6±6,3 44,5±8,9 (р=0,001) |
62,2±5,5 63,1±5,7 (р=0,4) |
35,2±1,6 34,8±2,5 (р=0,4) |
|
КДР, мм - исходно - через 12 мес |
61,3±6,5 59,9±5,1 (р=0,3) |
48,2±3,4 48,2±3,1 (р=0,4) |
64,9±3,0 65,1±3,0 (p=0,7) |
|
КСР, мм - исходно - через 12 мес |
53,6±12,0 51,4±10,7 (р=0,2) |
31,2±2,7 31,4±3,2 (р=0,6) |
52,4±2,6 52,8±2,6 (р=0,07) |
|
КДО, мл - исходно - через 12 мес |
174,3±22,1 180,8±30,7 (р=0,06) |
107,9±21,4 110,7±13,8 (р=0,1) |
222,2±22,5 226,2±22,2 (р=0,01) |
|
КСО, мл - исходно - через 12 мес |
110,8±16,6 100,7±17,1 (р=0,7) |
46,7±8,4 42,4±8,8 (р=0,5) |
132,6±14,2 133,6±12,9 (р=0,06) |
|
ЛП, мм - исходно - через 12 мес |
42,5±5,9 43,9±5,7 (р=0,3) |
39,1±5,2 40,4±5,0 (р=0,2) |
41,9±4,3 42,5±4,0 (р=0,03) |
|
КДД ЛЖ, мм рт. ст. - исходно - через 12 мес |
26,5±7,6 20,0±6,9 (р=0,6) |
18,0±6,4 15,3±4,8 (р=0,2) |
Примечание. КДР – конечный диастолический размер левого желудочка; КСР – конечный систолический размер левого желудочка; КДО – конечный диастолический объем левого желудочка; КСО – конечный систолический объем левого желудочка; ФВЛЖ – фракция выброса левого желудочка; ЛП – размер левого предсердия; КДДЛЖ – конечное диастолическое давление в левом желудочке; реж. – режим.
Изменение основных показателей гемодинамики по данным ЭХО-КГ
При проведении сцинтиграфии миокарда с 199Tl или 99mТс у пациентов 1-й группы (с ФВЛЖ менее 45%) до стентирования диагностировано выраженное нарушение миокардиальной перфузии (преходящий дефект перфузии (ПДП) – 33,3±3,0%, стабильный дефект перфузии (СДП) – 29,6±4,1%). Через 12 мес после реваскуляризации в 1-й группе отмечена тенденция к улучшению показателей перфузии миокарда (ПДП – 29,6±4,1%, p=0,07; СДП – 26,6±4,1%, p=0,8). Во 2-й группе пациентов через 12 мес после стентирования диагностировано статистически значимое уменьшение размеров ПДП с 21,1±2,9% до 7,6±1,8%, р=0,028 и СДП с 13,4±2,3% до 5,7±1,3%, р=0,015.
При проведении Эхо-КГ у пациентов со сниженной ФВЛЖ через 12 мес после стентирования отмечено статистически значимое улучшение насосной функции ЛЖ (с 35,6±6,3% до 44,5±8,9%, р=0,001). Этому сопутствовала тенденция к снижению конечного диастолического давления в левом желудочке на 24,5% у пациентов 1-й группы и на 15% у пациентов 2-й группы (табл. 2).
В 1-й группе через 12 мес после стентирования рецидивы стенокардии развились у 6 (26,1%) пациентов, и безболевая ишемия миокарда диагностирована ещё в 1 (4,3%) случае. В этой группе за 3 мес наблюдения у 1 (4,3%) пациента зарегистрирована смерть в результате повторного ИМ. Во 2-й группе через 1 год после вмешательства рецидивы стенокардии развились у 9 (32,2%) пациентов, и безболевая ишемия диагностирована ещё в 4 (14,3%) случаях. Кроме того, у 1 (3,6%) пациента из 2-й группы в результате рестеноза стента через 3 мес после реваскуляризации диагностирован ИМ. Летальных исходов во 2-й группе не было. У пациентов 3-й группы ИМ диагностирован у 16 (45,7%) больных, из них в 9 (25,7%) случаях развился фатальный ИМ (табл. 3 и 4).
В целом в процессе проспективного 12-месячного наблюдения у подавляющего большинства пациентов 1-й и 2-й групп (69,6% и 53,5% соответственно) отсутствовали клинические проявления рецидивов стенокардии и признаки безболевой ишемии миокарда. По данным контрольной КГ, у этих пациентов не отмечено ангиографических признаков рестеноза стентов и прогрессирования атеросклероза нативных КА.
К настоящему времени благодаря комбинированной терапии ХСН, состоящей из ингибиторов АПФ, диуретиков, β -адреноблокаторов, препаратов с положительным инотропным действием, удалось
Таблица 3
Клинико-ангиографическая динамика в группах после стентирования по данным проспективного 12-месячного наблюдения
|
Показатель |
1-я группа (n=23) |
2-я группа (n=28) |
|
Рецидив стенокардии:
|
6 (26,1%) 2 (8,7%) 3 (13,1%) 1 (4,3 %) |
9 (32,2%) 4 (14,3%) 4 (14,3%) 1 (3,6%) |
|
Безболевая ишемия:
|
1 (4,3%) 1 (4,3%) |
4 (14,3%) 3 (10,7%) 1 (3,6%) |
|
Положительная клинико-ангиографическая динамика |
16 (69,6%) |
15 (53,5%) |
Таблица 4
Развитие неблагоприятных клинических событий в группах после стентирования в сравнении с консервативной терапией по данным проспективного 12-месячного наблюдения
|
Показатель |
1-я группа (n=23) |
2-я группа (n=28) |
3-я группа (n=35) |
|
Общая смертность |
1 (4,3%) |
— |
9 (25,7%)* |
|
Летальный исход от сердечнососудистых причин |
1 (4,3%) |
— |
9 (25,7%)* |
|
Рецидив стенокардии |
6 (26,1%) |
9 (32,2%) |
34 (97,2%)** |
|
Безболевая ишемия |
1 (4,3%) |
4 (14,3%) |
1 (2,8%) |
|
Инфаркт миокарда |
1 (4,3%) |
— |
16 (45,7%)* |
|
Повторная ангиопластика: - рекомендовано - выполнено |
7 (30,4%) 3 (13,0%) |
13 (46,5%) 12 (42,8%) |
6 (17,1%)* |
*р<0,05, **р<0,001.
снизить смертность больных ХСН на 34% (результаты международного многоцентрового исследования COPERNICUS, 2000). Говоря об особенностях лечения ХСН у больных ИБС в последнее время, следует отметить следующее: лечение должно быть направлено не только на процессы ремоделирования сердца (лекарственная терапия), но и на восстановление эффективной перфузии ишемизированного миокарда. Без адекватной реваскуляризации сердечной мышцы трудно добиться успеха в предупреждении и лечении недостаточности кровообращения у больных ИБС, развившейся в результате многососудистого стенозирующего коронарного атеросклероза. В последнее время считается, что эффективность адекватной медикаментозной терапии в отдельных группах больных ИБС сравнима с эффективностью операций, направленных на восстановление реваскуляризации миокарда [10]. Поэтому реваскуляризация миокарда чаще всего показана при неэффективности адекватной медикаментозной терапии. К сожалению, многоцентровые исследования, как правило, не включают пациентов с выраженными симптомами ХСН и сниженной инотропной функцией ЛЖ в исследования по изучению эффективности реваскуляризации миокарда. Учитывая высокий индивидуальный риск нарушений гемодинамики во время эндоваскулярного вмешательства у таких пациентов, рекомендуется проводить гемодинамическую поддержку [11,12]. Однако вопрос о прогнозе и профилактике гемодинамических нарушений вызывает противоречивые мнения. Ранние исследования, посвященные применению чрескожной сердечно-легочной поддержки при эндоваскулярном вмешательстве у пациентов высокого риска, показали что, несмотря на большую начальную вероятность успеха, частота сосудистых осложнений остается достаточно высокой (43%) [13, 14]. Сегодня эта проблема нуждается в более подробном изучении, так как ни в одном исследовании не содержится данных, подтверждающих стратификацию факторов риска. С появлением новых данных, раскрывающих неизвестные ранее звенья патогенеза ХСН, можно ожидать дальнейших успехов в лечении этой патологии.
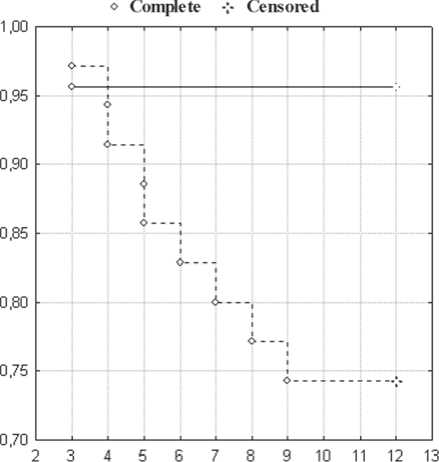
Как показывают результаты нашего исследования, современный уровень развития эндоваскулярных технологий позволяет проводить вмешательство у больных со сниженной ФВЛЖ с высокой эффективностью и безопасностью. Восстановление коронарного кровотока после стентирования у пациентов, прежде всего с низкой ФВЛЖ и с сохраненной ФВЛЖ, положительно влияет на клиническое состояние больных, снижает тяжесть коронарной недостаточности, редуцируя частоту и тяжесть стенокардии, потребность в нитроглицерине, и повышает физическую толерантность. При анализе сократимости миокарда в отдаленном периоде у больных 1-й группы с исходно сниженной ФВЛЖ получено статистически значимое увеличение ФВЛЖ (на 25% по сравнению с исходным показателем) после реваскуляризации. В то время как в 3-й группе на фоне консервативной терапии сохранялась не только тяжелая коронарная недостаточность с частыми приступами стенокардии и высокой ежедневной потребностью в нитроглицерине, но и смертность от сердечно-сосудистых причин оказалась высокой – 25,7% против 4,3% в 1-й группе и отсутствие летальных исходов во 2-й группе (р<0,035) (рис. 3).
Кумулятивный показатель
Продолжительность наблюдения, мес
-- ФВ<45% + стент - - - ■ ФВ<45% + МТ
Рис. 3. Анализ частоты возникновения смертельных исходов в отдаленные сроки наблюдения у пациентов со сниженной фракцией выброса (ФВ) левого желудочка после стентирования в сравнении с консервативной медикаментозной терапией (МТ).
ВЫВОДЫ
-
1. Эндоваскулярная коронарная реваскуляризация у больных ИБС сопровождается высокой клинической эффективностью: регрессом стенокардии непосредственно после стентирования на 97,8% в 1-й группе и на 98,2% во 2-й группе с одновременным снижением суточной потребности в нитроглицерине на 97,2% и 98,5% соответственно.
-
2. Успешное коронарное стентирование у пациентов 1-й группы со сниженной ФВЛЖ повышает на 25% сократительную способность миокарда ЛЖ.
-
3. Применение инвазивной стратегии с использованием стентирования КА оказалось высокоэффективным и безопасным, обеспечивая снижение относительного риска летальных исходов на 21,4% у больных 1-й группы с постинфарктной дисфункцией сердца, низкой ФВЛЖ (35,6±6,3%) и симптомами ХСН по сравнению с такими больными 3-й группы с консервативной медикаментозной тактикой лечения.
Список литературы Сравнительная оценка антиишемической эффективности коронарного стентирования у больных ишемической болезнью сердца со сниженной фракцией выброса левого желудочка и консервативной медикаментозной терапии
- Аронов Д.М. Лечение и профилактика атеросклероза. -М.: ТриадаХ, 2000. -412 с.
- Международное руководство по сердечной недостаточности/Пер. с англ.; Под ред. С.Дж. Болл. -М.: Медиа Сфера, 1995. -89 с.
- Khand A.U., Gemmell I., Rankin A.C., Clelaid J.G. Clinical events leading to the progression of heart failure: insights from a national date base of hospital discharges//Eur. Heart J. -2001. -Vol. 22. -P. 153-164.
- Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. -М.: Медиа Медика, 2000. -266 с.
- Калюжин В.В., Тепляков А.Т., Калюжин О.В. Сердечная недостаточность у больных ишемической болезнью сердца: факты, предположения и спекуляции: Учеб. пособие. -Томск, 2002. -54 с.
- Braunwald E., Bristow M.R., Congestive heart failure: fifty years of progress. Circulation 2000;102:14-23.
- Felker G.M., Shaw L.K., O`Connor C.M. A standardized definition of ischemic cardiomyopathy for use in clinical research. J Am Coll Cardiol 2002; 39:210-218.
- Sawada Y., Nosaka H., Kimura T., et al. Initial and six-month outcome of Ralmaz-Schatz stent implantation: STRESS/BENESTENT equivalent versus nonequivalent lesions. J Am Coll Cardiol 1996; 27(suppl A):252A.
- Macaya C, Serruys PW, Ruygrok P, et al. Continued benefit of coronary stenting versus balloon angioplasty: One-year clinical follow-up of the BENESTENT-II pilot study. Circulation 1996; 93:412-422.
- Coronary angioplasty versus medical therapy for angina: the second Randomized Intervention Treatment of Angina (RITA-2) trial. RITA-2 trial participants. Lancet 1997; 350:461-468.
- Hartzler G.O., Rutherford B.D., McConahay D.R., Jonson W.L., Giorgi L.V. «High-risk» percutaneous transluminal coronary angioplasty. Am J Cardiol 1988; 61:33G-7G.
- Bergelson B.A., Jacobs A.K., Cupples L.A. et al. Prediction of risk for hemodynamic compromise during percutaneous transluminal coromaey angioplasty. Am J Interv Cardiol 1992; 70:1540-1545.
- Vogel R.A., Tommaso C.L., Gundry S.R. Initial experience with coronary angioplasty and aortic valvuloplasty using elective semipercutaneous cardiopulmonary support. Am J Cardiol 1988; 62:811-813.
- Shawl F.A., Domanski M.J., Hernandez T.J., Punja S. Emergency percutaneous cardiopulmonary bypass support in cardiogenic shock from acute myocardial infarction. Am J Cardiol 1989; 64:967-970.


