Сравнительная оценка подвижности и концентрации сперматозоидов трутней медоносной пчелы методом традиционной микроскопии и CASA
Автор: Гулов А.Н., Колчаева И.Н., Шестакова А.И., Брандорф А.З.
Журнал: АгроЗооТехника @azt-journal
Рубрика: Разведение, селекция и генетика сельскохозяйственных животных
Статья в выпуске: 4 т.6, 2023 года.
Бесплатный доступ
Изучение качества спермы трутней медоносных пчел представляет собой комплексный анализ, требующий оценки множества характеристик сперматозоидов. Такой анализ на сегодняшний день осуществляется методом традиционной глазомерной микроскопии. Существует также аппаратный метод оценки качества спермы с помощью CASA (Computer-aided sperm analyses). Наиболее широкое распространение метод CASA получил в животноводстве. Цель настоящего исследования - определить различия в оценке подвижности и концентрации сперматозоидов трутней медоносной пчелы методом глазомерной микроскопии и CASA. Сперму отбирали методом искусственной стимуляции выворачивания эндофаллоса у половозрелых трутней в возрасте 22-30 суток с помощью оборудования для искусственного осеменения SCHLEY-System модель 1.04. Методом CASA качественные характеристики спермы трутней оценивали с помощью анализатора класса спермы Sperm Class Analyzer (SCA) MICROPTIC S.L. Сперматозоиды оценивали на подвижность и концентрацию. Различия между исследуемыми группами сравнивали с помощью t-критерия Стьюдента для независимых выборок. Результаты исследований демонстрируют возможность оценки подвижности и концентрации сперматозоидов трутней медоносной пчелы методом CASA в сочетании с фазово-контрастной микроскопией (Ph+). При оценке CASA концентрация сперматозоидов составила в среднем 4,6 млн/мкл, что на 0,4 млн меньше по сравнению с оценкой методом традиционной глазомерной микроскопии и не является достоверно значимой разницей. Общая подвижность сперматозоидов, оцениваемая методом CASA, достоверно отличалась (t = 2,8) от визуальной оценки в среднем на 16,7%. В частности, на определении общей подвижности сперматозоидов трутней методом глазомерной микроскопии сказалась субъективная оценка оператора.
Трутень, подвижность сперматозоидов, концентрация сперматозоидов, casa
Короткий адрес: https://sciup.org/147242479
IDR: 147242479 | УДК: 638.145.43 | DOI: 10.15838/alt.2023.6.4.4
Текст научной статьи Сравнительная оценка подвижности и концентрации сперматозоидов трутней медоносной пчелы методом традиционной микроскопии и CASA
Медоносные пчелы являются важным элементом экологической системы, так как на их долю приходится 80–90% опыляемых энтомофильных растений. Биоразнообразие пчел в жизни человека имеет экологическое, социальное, экономическое и эстетическое значение. Сохранение биоразнообразия медоносных пчел выступает актуальной проблемой растущего экологического кризиса. И независимо от основных причин, вызывающих гибель пчелиных семей, только эффективное размножение медоносных пчел имеет основополагающее значение для восполнения этих потерь (Yaniz et al., 2020). Восполнение утраченной численности пчелиных семей возможно с применением таких биотехнологических методов, как биобанкинг спермы трутней и искусственное осеменение пчелиных маток. Ключевым фактором успешного воспроизводства пчелиных семей служит качество спермы трутней.
Основными показателями качества спермы трутней медоносных пчел являются подвижность, жизнеспособность и концентрация сперматозоидов. Подвижность и концентрация обычно считаются одними из наиболее важных характеристик, связанных с фертильностью сперматозоидов. Показатель подвижности – это выражение структурной целостности сперматозоида (Gil et al., 2009). Изучение функциональной целостности мембран выступает в качестве контроля точности оценки подвижности сперматозоидов (Науменкова и др., 2020). Но скорость оплодотворения более тесно коррелирует с морфологией сперматозоидов (Duncan et al., 1993; Hinting et al., 1990). Немаловажным показателем качества спермы трутней является оценка дисперсии хроматина сперматозоидов с помощью теста на фрагментацию ДНК сперматозоидов (SDF-тест). Недавно проведенные исследования по адаптации SDF-теста в пчеловодстве (Borsuk et al., 2018) подтвердили гипотезу о том, что инфекционное за- болевание медоносных пчел, вызванное возбудителем Nosema ceranae, способствует повреждению ДНК сперматозоидов трутней. Таким образом, оценка качества спермы трутней медоносных пчел есть комплексный анализ, требующий оценки множества характеристик сперматозоидов. Такой анализ на сегодняшний день осуществляется преимущественно методом глазомерной микроскопии (визуальной оценки). Существует также аппаратный метод оценки качества спермы с помощью CASA (Computer-aided sperm analyses). Наиболее широкое распространение метод CASA получил в животноводстве. В пчеловодстве первые успешные попытки по адаптации компьютерного анализа к сперме трутней были предприняты А. Inour-Iskounen (Inour-Iskounen, 2020) и J. Murray (Murray, 2022). Авторы применили метод CASA к оценке общей подвижности сперматозоидов и ее кинематических параметров (VAP, VSL, LIN, ALH, BCF). Система CASA включает ряд аналитических программ, позволяющих провести анализ спермы по многим параметрам:
– mot (motility) – аналитическая программа оценки подвижности и ее кинематических параметров, включает также подсчет концентрации сперматозоидов;
– mrf (morphology) – морфологический анализ структуры сперматозоидов;
– vit (vitality) – программа по исследованию жизнеспособности сперматозоидов, то есть целостности их мембран и акро-сом;
– dna (deoxyribonucleic acid) – аналитическая программа по изучению дисперсии хроматина или фрагментации ДНК сперматозоидов;
– leu (leukocyte formula) – лейкограмма или лейкоцитарная формула; аналитическая программа по исследованию различных видов лейкоцитов.
Отсутствие популярности данного метода в пчеловодстве объясняется не- которыми трудностями, связанными с идентификацией системой CASA головок сперматозоидов трутней (Yaniz et al., 2020). Помимо этого, сперматозоиды медоносных пчел осуществляют движения, весьма отличные от сперматозоидов млекопитающих, имея тенденцию к быстрой вибрации и движению по относительно круговой схеме (Yaniz et al., 2020). Однако компьютерный анализ позволяет избежать рутинной практики и быстро оценить большой объем образцов.
В российском пчеловодстве компьютерный анализ спермы трутней медоносных пчел проводится впервые.
Цель настоящего исследования – определить различия в оценке подвижности и концентрации сперматозоидов трутней медоносной пчелы методом глазомерной микроскопии и CASA. Предполагается решить следующие задачи:
-
1) провести оценку качества спермы трутней методом традиционной глазомерной микроскопии и CASA;
-
2) оценить различия в оценке качественных характеристик спермы трутней исследуемых методов.
Материалы и методы исследований
Исследование проводили на экспериментальной пасеке ФГБНУ «Федеральный научный центр пчеловодства» (Россия, г. Рыбное) в период активного сезона (июль – август) 2022 года.
Объектом исследований являлась сперма трутней внутрипородного типа среднерусской породы пчел «Приокский» (А.с. № 5818 от 21.10.1992), который был выведен на основе скрещивания среднерусской и серой горной кавказской пород сотрудниками ФГБНУ «ФНЦ пчеловодства».
Подвижность и концентрацию сперматозоидов в счетной камере Горяева (МиниМед, Россия) методом глазомерной микроскопии оценивали на светодиодном флуоресцентном микроскопе Альтами-ЛЮМ 1 (Альтами, Россия) при увеличении ×400. Общую подвижность сперматозоидов (ОП, %) оценивали в 10 полях зрения микроскопа. Учитывали прямолинейно-поступательное движение спермиев, манежное и колебательное (вибрация). Для определения общей подвижности использовали следующую формулу: общая подвижность сперматозоидов (%) = (общее количество сперматозоидов – неподвижные сперматозоиды / общее количество сперматозоидов) × 100%.
Концентрацию спермы определяли по формуле (Милованов, 1962):
С = h×5000×400 / 80×0,1×1000000, где:
С – искомое количество сперматозоидов – млн шт. в 1 мкл спермы;
h – количество сперматозоидов в 80 малых квадратах;
5000 – степень разбавления;
400 – площадь малого квадрата, мм2;
80 – число сосчитанных малых квадратов; 0,1 – глубина малого квадрата сетки, мм;
1000000 – множитель, приводящий результат к объему 1 мкл.
Методом CASA качественные характеристики спермы трутней оценивали с помощью анализатора класса спермы Sperm
Class Analyzer (SCA) версия 2 (MICROPTIC S.L., Barcelona, Spain). Система оснащена цифровой камерой Basler acA 1920-155uc USB 3.0 (Basler AG, Germany), установленной на микроскопе Nikon Eclipse Ci-L (Nikon, Tokyo, Japan). Сперматозоиды трутней изучали с помощью положительной фазово-контрастной микроскопии (конденсор микроскопа в положении Ph+). Общую подвижность (TM, %) и концентрацию сперматозоидов изучали в 10 мкл разбавленной спермы с использованием камеры Маклера. В каждом образце анализировали три микроскопических поля с помощью фазово-контрастного объектива (10,25). Полученное количество спермиев умножали на коэффициент разведения (5000) и выражали концентрацию сперматозоидов в миллионах на миллилитр (в соответствии с инструкцией камеры Маклера) или в миллионах на микролитр.
Статистический анализ проводили на программном обеспечении Statistica для Windows версия 13 (StatSoft, Россия). Различия между исследуемыми группами сравнивали с помощью t -критерия Стьюдента для независимых выборок. Влияние считалось значимым при p < 0,05. Нормальность распределения проверяли с помощью статистики Шапиро – Уилка.
Результаты исследований
Концентрация сперматозоидов в 1 мкл свежеотобранной спермы находилась в интервале от 2,5 до 9,1 млн, в среднем 5,0 млн при глазомерном методе оценки (табл.) . Общая подвижность сперматозоидов в среднем 58,1% соответственно.
При оценке методом CASA концентрация сперматозоидов составила в среднем 4,6 млн/мкл, что на 0,4 млн меньше по сравнению с оценкой методом глазомерной микроскопии и не является достоверно значимой разницей. Общая подвижность сперматозоидов, оцениваемая методом CASA, достоверно отли-
Таблица. Сравнительная оценка методов изучения качественных характеристик спермы трутней (n = 51–52, г. Рыбное, Рязанская обл.), 2022 год
|
Метод оценки |
Качественные характеристики |
|||||
|
концентрация, млн/мкл |
общая подвижность, % |
|||||
|
M±m (Lim) |
σ |
Cv, % |
M ± m (Lim) |
σ |
Cv, % |
|
|
CASA, n = 51 |
4,6 ± 0,3 (0,9–9,6) |
2,2 |
47,9 |
74,8 ± 3,7а (0–100) |
26,1 |
34,9 |
|
Визуальная, n = 52 |
5,0 ± 0,2 (2,5–9,1) |
1,6 |
31,5 |
58,1 ± 4,8а (0–100) |
34,5 |
59,3 |
Примечание: а – существенные различия при р < 0,05. Источник: результаты исследований авторов.
чалась ( t = 2,8) от визуальной оценки в среднем на 16,7%.
Компьютерная оценка качества спермы позволяет определять прогрессивную подвижность сперматозоидов (PR, %); быстро-прогрессивную (R, %) и среднепрогрессивную (MR, %). Метод CASA способен анализировать кинематические параметры подвижности сперматозоидов: прямолинейную скорость (VSL, мкм/с) – среднюю скорость прохождения головки сперматозоида по прямой линии от ее первого до последнего положения; среднюю скорость прохождения (VAP, мкм/с) – среднюю скорость головки сперматозоида по его средней траектории; процент линейности (LIN, %) – соотношение между VSL и фактической скоростью перемещения сперматозоида по траектории (параметр VCL). В ходе проводимых нами исследований отмечено, что сперматозоиды трутней медоносной пчелы, принимая форму колец, совершают в камере Маклера преимущественно (в 90% случаев) манежное движение. В остальных случаях – это колебательные движения (вибрация). Известно, что глубина и конструкция камеры могут оказывать влияние на подвижность сперматозоидов, вызывая ограничение их перемещения от взаимодействия со стенками камеры (Verstegen et al., 2002). Глубина камеры Маклера (рис. 1) , составляющая 10 мкм, очевидно, не позволяет сперми-

Рис. 1. Общий вид камеры Маклера
Источник: результаты исследований авторов.

Рис. 2. Сперматозоиды трутней медоносной пчелы в счетной камере Горяева
Источник: результаты исследований авторов.
ям медоносной пчелы, длина которых составляет 250–270 мкм (Peng, 1993), совершать поступательные движения. Поступательное движение спермиев медоносной пчелы, как известно, проходит по спирали (Yaniz et al., 2020).
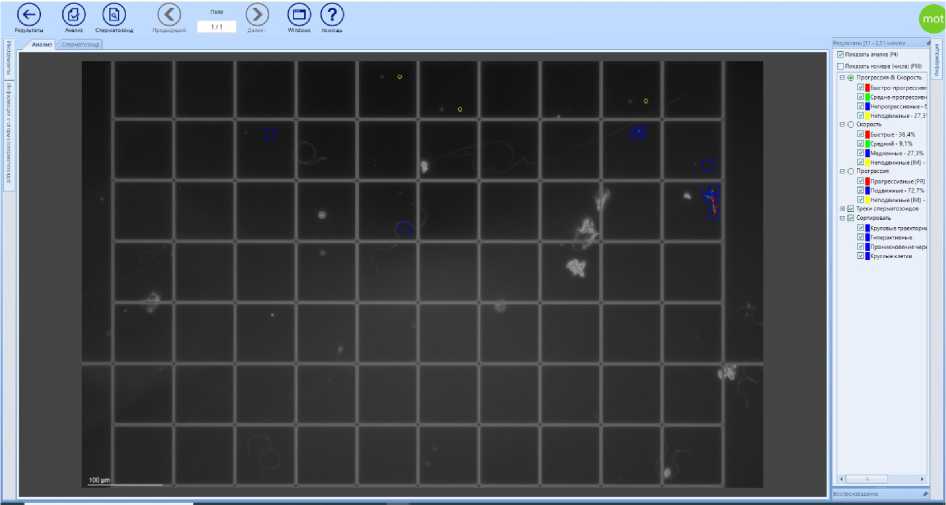
Рис. 3. Анализ CASA сперматозоидов трутней и посторонних объектов в счетной камере Маклера Источник: результаты исследований авторов.
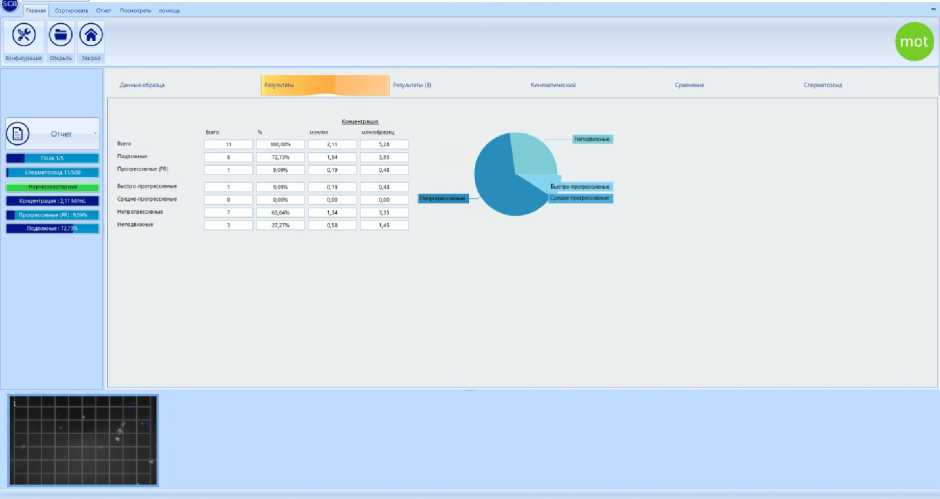
Рис. 4. Результаты оценки сперматозоидов и посторонних объектов с помощью CASA
Источник: результаты исследований авторов.
В счетной камере Горяева (рис. 2) , глубина которой составляет 100 мкм, сперматозоиды трутней осуществляют все известные виды подвижности. Однако в данном случае усложняется анализ всех гамет, поскольку они двигаются в разных фокальных плоскостях (Yaniz et al., 2019).
Немаловажное значение для анализа имеет степень разбавления спермы. С помощью оборудования для искусственного осеменения маток от одного половозрелого трутня удается получить 1 мкл спермы (Бородачев, Бородачева, 1989). Именно такой объем лежит в основе определения
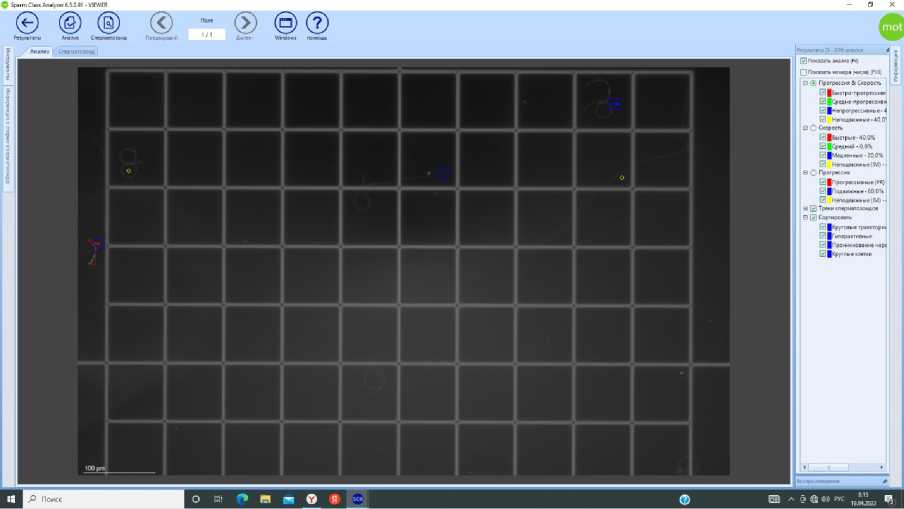
Рис. 5. Анализ системой CASA подвижности и концентрации сперматозоидов трутней в камере Маклера
Источник: результаты исследований авторов.
концентрации сперматозоидов. И в этой единице объема (1 мкл) при данной технологии отбора может содержаться 1,5– 7,3 млн сперматозоидов (Yaniz et al., 2020). Степень разбавления в 5000 раз позволяет добиться такого результата, когда в поле зрения микроскопа мы можем наблюдать единичные сперматозоиды (4–10 гамет), свободно совершающие различные виды движения. Это, в свою очередь, дает возможность как оператору, так и компьютерной системе проводить корректный анализ изображения. Система CASA не анализирует изображения, содержащие сдвоенные или соприкасающиеся сперматозоиды. По ходу собственных исследований система CASA часто анализировала в поле зрения объектива микроскопа посторонние объекты, не являющиеся сперматозоидами трутней (рис. 3, 4) .
Одной из причин появления посторонних объектов в поле зрения выступает недостаточная подготовка к работе поверхностей стекла камеры Маклера. После тщательного удаления высохших разво- дов жидкости и пыли система проводила более корректный анализ (рис. 5, 6).
Возможно, данное обстоятельство связано с настройками спецификации системы относительно исследуемого объекта. Система CASA использует головки сперматозоидов в качестве точки отсчета для анализа (Lu et al., 2014). Головки сперматозоидов у трутней медоносной пчелы, без предварительной фиксации и окрашивания, не имеют четких границ на теле спермия. По данным S.Y.C. Peng (Peng et al., 1993) ширина головки спермиев трутней 0,4–0,5 мкм, а остальной части тела 0,7 мкм. В связи с этим исследование CASA невозможно с помощью фазово-контрастной микроскопии, так как головка сперматозоида не может быть четко идентифицирована системой для отслеживания движения (Yaniz et al., 2020; Murraya et al., 2022). Авторами была применена флуоресцентная микроскопия с использованием флюорохрома SYBR-14 и цифровой камеры Маклера.
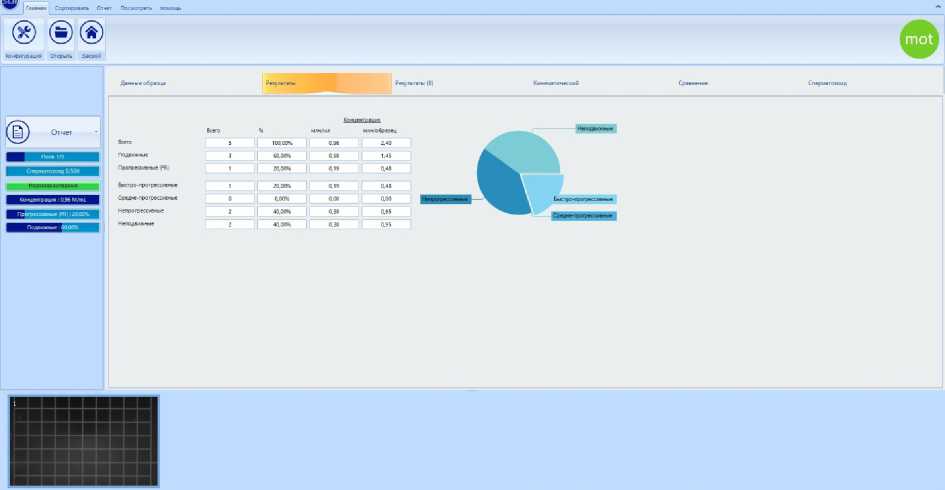
Рис. 6. Результаты оценки сперматозоидов трутней с помощью CASA
Источник: результаты исследований авторов.
Inouri-Iskounen с соавторами в ходе работы по изучению воздействия инсектицида имидаклоприд (IMD) на подвижность сперматозоидов трутней использованы система CASA с отрицательной фазово-контрастной микроскопией (конденсор микроскопа в положении Ph-) и традиционный глазомерный метод оценки (Inouri-Iskounen et al., 2020). Наряду с общей характеристикой подвижности спермиев авторы исследовали кинематические параметры подвижности, но только контрольных образцов спермы, не подвергшихся воздействию IMD. В результате общая подвижность (TM, %) составила 57–58%, а скорость сперматозоидов трутней оказалась самой низкой в сравнении с различными видами животных.
В работе J. Murraya общая подвижность (91,9%), показатели прямолинейной скорости (VSL, %) и средней скорости прохождения (VAP, %), напротив, оказались значительно выше (Murraya et al., 2022).
Показатель общей подвижности (74,8%), полученный методом CASA в ходе наших исследований, занимает промежуточное положение относительно результатов, опубликованных вышеуказанными авторами.
В недавнем исследовании (Yaniz et al., 2019) было продемонстрировано достаточно серьезное влияние состава разбавителя на подвижность сперматозоидов трутней медоносной пчелы. Наибольшее признание среди ученых мира и, соответственно, широкое распространение приобрел Kiev буфер (Collins, 2005): цитрат натрия Na3C6H5O7 – 2,43 г; бикарбонат натрия NaНCO3 – 0,21 г; хлорид калия KCl – 0,41 г; D-глюкоза – 0,3 г, на 100 мл деионизированной дистиллированной воды. Оригинальный Kiev разбавитель с низкой осмолярностью впервые описал Ф. Руттнер (Руттнер, 1975). Но, по мнению исследователей (Yaniz et al., 2019), этот вариант разбавителя в большинстве случаев вызывает у сперматозоидов трутней осмотический шок. По данным Л. Верма (Верма, 1977), осмолярность спермы трутней и ее семенной плазмы составляет 467 и 325 мосмоль/л. Модифицированный Kiev разбавитель, описанный A. Collins, занимает промежуточное значение в этом диапазоне и составляет 384 мосмоль/л.
Несмотря на небольшие различия в составе Kiev буфера, применяемого в работах J. Murraya и A. Inouri-Iskounen, авторам удалось получить практически идентичные результаты оценки общей подвижности сперматозоидов трутней методом традиционной микроскопии – 85,5 и 78,5% соответственно.
В нашем исследовании показатель общей подвижности, полученный методом субъективной визуальной оценки, оказался значительно ниже (58,1%). В оценке подвижности сперматозоидов текущего исследования принимали участие два оператора, один из которых изучал качественные характеристики методом глазомерной микроскопии. В частности, опыт оператора отразился на полученных результатах, весьма отличных от данных других авторов (Murraya et al., 2022; Inouri-Iskounen et al., 2020).
В своей работе мы избежали изучения кинематических параметров подвижности сперматозоидов. После естественного спаривания или искусственного осеменения пчелиная матка нагнетает из парных яйцеводов в семяприемник необходимый объем спермы для последующего хранения. Нагнетание спермы, то есть ее движение в половом пути пчелиной матки, осуществляется группами мышц на каждом участке этого пути. Из семяприемника сперма подается на яйцо в виде пучка, состоящего из 8–12 сперматозоидов (Руттнер, 1975). Сокращение и расслабление мышц полностью кон- тролируется пчелиной маткой. По этой причине изучение кинематических параметров подвижности сперматозоидов трутней может представлять интерес лишь в исследовательских целях, тогда как для повседневной рутинной работы достаточно оценки общей подвижности сперматозоидов.
Безусловно, метод CASA – современный объективный метод оценки подвижности сперматозоидов. Минусами этого метода являются высокая стоимость оборудования CASA (Атрощенко и др., 2018) и использование флюорохромов (SYBR-14), не безопасных для жизни человека.
Выводы
Результаты исследований демонстрируют возможность оценки подвижности и концентрации сперматозоидов трутней медоносной пчелы методом CASA в сочетании с фазово-контрастной микроскопией (Ph+). При оценке CASA концентрация сперматозоидов составила в среднем 4,6 млн/мкл, что на 0,4 млн меньше по сравнению с оценкой методом традиционной глазомерной микроскопии и не является достоверно значимой разницей. Общая подвижность сперматозоидов, оцениваемая CASA, достоверно отличалась ( t = 2,8) от визуальной оценки в среднем на 16,7%. В частности, на определении общей подвижности сперматозоидов трутней методом глазомерной микроскопии сказалась субъективная оценка оператора.
Список литературы Сравнительная оценка подвижности и концентрации сперматозоидов трутней медоносной пчелы методом традиционной микроскопии и CASA
- Атрощенко М.М., Никиткина Е.В., Калашников В.В. [и др.] (2018). Оценка подвижности сперматозоидов жеребцов методом CASA // Коневодство. № 6. С. 30–33.
- Бородачев А.В., Бородачева В.Т. (1989). Технология инструментального осеменения пчелиных маток. Рыбное: НИИ пчеловодства. 33 с.
- Верма Л. (1977). Влияние ионов жидкости семяприемника и продолжительности хранения спермы на потребление кислорода сперматозоидами и их подвижность // Генетика, селекция и репродукция пчел. Бухарест: Апимондия. 280 с.
- Милованов В.К. (1962). Биология воспроизведения и искусственное осеменение животных. Москва. 696 с.
- Науменкова В.А., Атрощенко М.М., Гулов А.Н., Широкова О.В., Фролова Н.А. (2020). Сравнительная оценка определения целостности мембран спермиев жеребцов различными методами // Российская сельскохозяйственная наука. № 3. С. 45–48.
- Руттнер Ф. (1975). Инструментальное осеменение пчелиных маток / Международный институт технологии и экономики пчеловодства. Бухарест: Апимондия. 128 с.
- Borsuk G., Kozłowska M., Anusiewicz M., Paleolog J. (2018). Nosema ceranae changes semen characteristics and damages sperm DNA in honeybee drones. Invertebrate Survival Journal, 15, 197–202. Available at: https://www.isj.unimore.it/index.php/ISJ/article/download/425/405/832
- Collins A.M. (2005). Insemination of honey bee, Apis mellifera, queens with non-frozen stored semen: Sperm concentration measured with a pectrophotometer. Journal of Apicultural Research, 44 (4), 141–145. DOI: 10.1080/00218839.2005.11101168
- Duncan W., Glew M., Wang X., Flaherty S., Matthews C. (1993). Prediction of fertilization rates from semen variables. Fertility Sterility, 59, 1233–1238. DOI: 10.1016/s0015-0282(16)55982-2
- Gil M.C., Garcia-Herreros M., Baron F.J., Aparicio I.M., Santos A.J., Garcia-Marin L.J. (2009). Morphometry of porcine spermatozoa and its functional significance in relation with the motility parameters in fresh semen. Theriogenology, 71, 254–263. DOI: 10.1016/jtheriogenology.2008.07.2007
- Hinting A., Comhaire F., Vermeulen L. [et al.] (1990). Value of sperm characteristics and the result of in vitro fertilization for predicting the outcome of assisted reproduction. International Journal Andrology, 13, 59–64. DOI: 10.1111/j.1365-2605.1990.tb00960.x
- Inouri-Iskounen A., Sadeddine-Zennouchec O., Nait Moulouda M., Kebiecheb M., Iguer-Ouadaa M. (2020). In vitro effects of imidacloprid on honey bee sperm: evaluation using computer-aided sperm analysis (CASA). Journal of Apicultural Research, 59 (4), 343–349. DOI: 10.1080/00218839.2020.1775017
- Lu J.C., Huang Y.F., Lu N.Q. (2014). Computer-aided sperm analysis: Past, present and future. Andrologia, 46 (4), 329–338. DOI: 10.1111/and.12093
- Murraya J.F., Horsta G.D., Allsoppb M., Christina R., Kotzea M. (2022). A new fluorescent method to determine honey bee sperm motility parameters with computer-aided sperm analysis. Journal of Apicultural Research, 1, 1–9. DOI: 10.1080/00218839.2022.2090729
- Peng C.Y.-S., Yin C., Yin L.R.S. (1993). Ultrastructure of honey bee, Apis mellifera, sperm with special emphasis on the acrosomal complex following high-pressure freezing fixation. Physiol. Èntomol., 18, 93–101. DOI: 10.1080/00218839.2022.2090729
- Rhodes J.W. (2008). Semen Production in Drone Honeybees. Rural Industries Research and Development Corporation. Available at: https://rirdc.infoservices.com.au/downloads/08-130
- Verstegen J., Iguer-Ouada M., Onclin K. (2002). Computer assisted semen analyzers in andrology research and veterinary practice. Theriogenology, 57, 149–179. Available at: https://www.sciencedirect.com/science/article/pii/S0093691X01006641
- Yaniz J., Palacin I., Santolaria P. (2019). Effect of chamber characteristics, incubation, and diluent on motility of honey bee (Apis mellifera) drone sperm. Apidologie, 50, 472–481. Available at: https://hal.science/hal-02889952/document
- Yaniz J., Silvestre M.A., Santolaria P. (2020). Sperm quality assessment in honey bee drones. Biology, 9 (7), 174. Available at: https://doi.org/10.3390/biology9070174


