Сравнительная оценка сорбционных материалов для удаления трихотеценов
Автор: Мишина Н.Н., Семенов Э.И., Алеев Д.В., Ерохондина М.А., Валиев А.Р.
Статья в выпуске: 2 т.254, 2023 года.
Бесплатный доступ
Трихотеценовые микотоксины (фумонизин В1 и дезоксиниваленол) это соединения семейства сесквитерпеноидов, продуцируемые грибами рода Fusarium proliferatum и Fusarium verticillioides. Данные микотоксины играют ключевую роль в различных патологических воздействиях на клеточные системы организма и весь организм в целом. Наиболее удобным и эффективным способом нейтрализации их воздействия на организм является использование различных сорбентов. Целью наших исследований было проведение сравнительной оценки различных сорбционных материалов для удаления трихотеценовых микотоксинов в условиях in-vitro . Нами исследовалась способность дрожжевых и растительных β-глюканов, лигнина (сорбентов растительного происхождения), цеолита, шунгита (минеральных сорбентов) связывать трихотеценовые микотоксины фумонизин В1 и дезоксиниваленол. Адсорбцию этих веществ оценивали по методике, имитирующей условия желудочно-кишечного тракта. В результате эксперимента было установлено, что лидерами сорбции к дезоксиниваленолу, являются дрожжевой β-глюкан (щелочной гидролиз) сорбировавший - 94,6 % микотоксина, растительный β-глюкан - 91,5 % и шунгит - 78,4 %. К микотоксину фумонизину В1, наилучшую сорбцию показал шунгит - 98,0 %, цеолит - 77,0 % и лигнин - 64,8 %. Остальные сорбенты проявили себя в меньшей степени. В целом сорбенты растительного происхождения лучше сорбировали дезоксиниваленол, а природные сорбенты показали лучшую сорбционную способность к фумонизину В1.
Дезоксиниваленол, фумонизин в1, in vitro, адсорбция, десорбция, β-глюканы, цеолит, шунгит, лигнины
Короткий адрес: https://sciup.org/142238107
IDR: 142238107 | УДК: 619:615.9:636.5 | DOI: 10.31588/2413_4201_1883_2_254_174
Текст научной статьи Сравнительная оценка сорбционных материалов для удаления трихотеценов
Трихотеценовые микотоксины – органические соединения семейства сесквитерпеноидов, они содержат в своей структуре 12,13-эпоксидное кольцо, которое способствует их биологической и токсической активности. К трихотеценам относится целый ряд близкородственных соединений, из которых наибольший интерес представляют фумонизин В1 и дезоксиниваленол [11].
Микотоксин фумонизин В1 (FUM, IUPAC name: 2-[2-({19-amino-6-[(3,4-dicarboxybutanoyl) oxy ] – 11, 16, 18-trihydroxy - 5,9 - dimethylicosan - 7- yl}oxy) -2-oxo ethyl]butanedioic аcid) является канцерогенным метаболитом грибов рода Fusarium proliferatum и Fusarium verticillioides [10] , имеет длинную цепочечную углеводородную единицу (аналогичную сфингозину и сфинганину), играющую главную роль в цитотоксическом, иммунодепрессивном, эстрогенном, нейротоксическом, мутагенном и канцерогенном действиях на живой организм [13]. Дезоксиниваленол (DON, IUPAC name: 3,7,15-Trihydroxy-12,13-epoxytricho thec-9-en-8-one ) относится к трихотеценовым микотоксинам типа B, и является наиболее часто обнаруживаемым микотоксином данной группы. В острых, умеренных или низких дозах также вызывает токсическое и иммунотоксическое действие в различных клеточных системах организма [14].
Эффективным и наиболее удобным способом нейтрализации микотоксинов в настоящий момент является использование в качестве терапии соединений с сорбционными свойствами. Для защиты от интоксикации и предотвращения микотоксикозов животных, предложен целый ряд сорбентов различного происхождения. Из-за химических особенностей трихотеценовых микотоксинов в настоящее время нет данных по одновременному исследованию фумонизина В1 и дезоксиниваленола по отношению к сорбционным материалам органического и неорганического происхождения, поэтому актуальность поиска новых сорбентов и их комбинаций остается открытой.
С этой целью нами поставлена задача провести сравнительную оценку различных сорбционных материалов для удаления трихотеценовых микотоксинов в условиях in-vitro .
Материал и методы исследований. Работа выполнена на базе лаборатории микотоксинов отделения токсикологии ФГБНУ «Федеральный центр токсикологической, радиационной и биологической безопасности» (г. Казань). Объектом исследования являлась способность сорбционных материалов связывать трихотеценовые микотоксины: дезоксиниваленол и фумонизин В1 in vitro. В качестве сорбционных материалов
(адсорбентов) использовались: β-глюканы растительного происхождения, Шатрашанского Республики
и дрожжевого цеолит Татарско- месторождения
Татарстан, шунгит
Зажогинского месторождения (Карельский шунгитовый завод, Россия) и лигнин [1, 4, 5, 8, 9, 15]. Дрожжевые β-глюканы получены из хлебопекарных прессованных дрожжей S. cerevisiae. Образцы растительных β-глюканов представлены в виде концентратов, выработанных из овсяных отрубей методом, описанным Гематдиновой В.М. (2018) [1, 3, 6, 12]. В работе использовали 98 % стандарты дезоксиниваленола и фумонизина В1 производства Sigma Aldrich (США), которые растворяли в метаноле с получением исходного раствора (1 мкг/мкл). Адсорбционную способность трихотеценовых микотоксинов оценивали по двухфазной методике, описанной ранее Крюковым В.С. с соавт. (1992) [7]. Измерения проводили в трех повторностях. Содержание микотоксинов определяли методом конкурентного иммуноферментного анализа с помощью тест-систем «Ridascreen» (R-Biopharm, Германия). Модели эксперимента представлены в таблице 1.
Таблица 1 – Схема эксперимента
|
Номер модели |
Название модели in vitro |
|
1 |
Дрожжевой β-глюкан (солевой гидролиз) + дезоксиниваленол |
|
Дрожжевой β-глюкан (солевой гидролиз) + фумонизин В1 |
|
|
2 |
Дрожжевой β-глюкан (щелочной гидролиз) + дезоксиниваленол |
|
Дрожжевой β-глюкан (щелочной гидролиз) + фумонизин В1 |
|
|
3 |
Растительный β-глюкан + дезоксиниваленол |
|
Растительный β-глюкан + фумонизин В1 |
|
|
4 |
Цеолит + дезоксиниваленол |
|
Цеолит + фумонизин В1 |
|
|
5 |
Шунгит + дезоксиниваленол |
|
Шунгит + фумонизин В1 |
|
|
6 |
Лигнин + дезоксиниваленол |
|
Лигнин + фумонизин В1 |
Полученные экспериментальные данные обрабатывали общепринятым методом вариационной статистики с применением критерия достоверности по Стьюденту с использованием специальных программ.
Результат исследований.
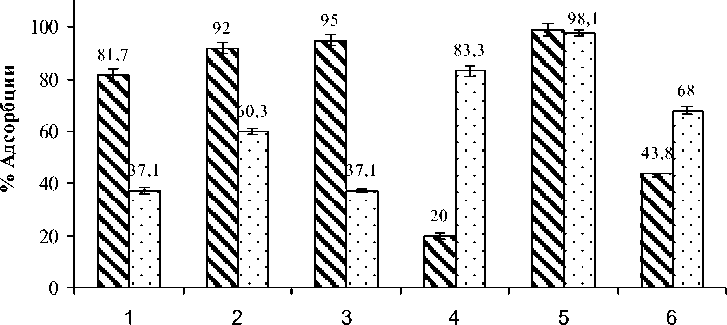
Результаты сравнительной адсорбционной способности группы сорбентов к дезоксиниваленолу и фумонизину В1 в кислой среде (рН=2) при температуре 37 °С (имитация условий желудка) представлены на рисунке 1.
По данным рисунка 1 видно, что в кислой среде (условия желудка) в пятой группе выявлена достаточно высокая сорбция дезоксиниваленола шунгитом и этот показатель составил (99,2±2,5) %. Использование остальных сорбентов показало более низкие результаты. Так, у образцов под номерами 6, 4, 3, 2, 1 адсорбция дезоксиниваленола была ниже на 55,4; 79,2; 4,2; 7,2; 17,5 %, соответственно. Адсорбция фумонизина В1 в этих же условиях выражена сильнее у образцов, имеющих в своем составе силикаты - цеолит (83,3±2,1) % и шунгит (98,1±1,2) %. У остальных образцов установлена адсорбционная способность в следующей последовательности: первой и третьей группах – 37,1 %, во второй группе – 60,3 %, и в шестой группе – 68,0 %.
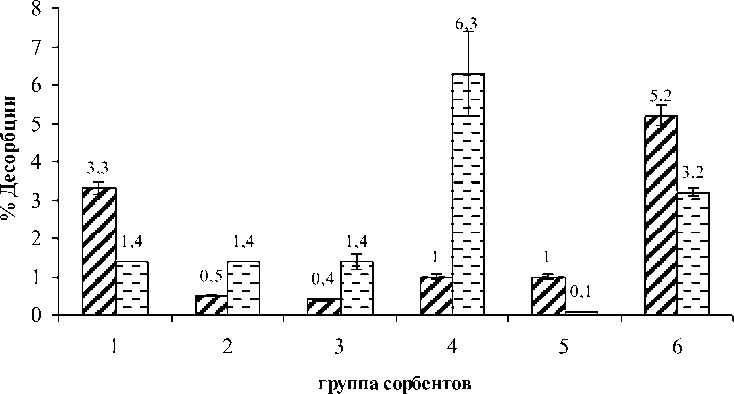
Результаты постановки эксперимента по определению процента десорбции группы сорбентов к дезоксиниваленолу и фумонизину В1 в щелочной среде при рН=8 и температуре 37 °С (условия кишечного тракта) представлены на рисунке 2.
99,2
□ Дезоксиниваленол
□ Фумонизин В1
группа сорбентов
Рисунок 1 – Процент
адсорбции энтеросорбентов
в отношении дезоксиниваленола и
фумонизина В1
и Дезоксиниваленол
□ Фумонизин В1
Рисунок 2 – Процент десорбции энтеросорбентов в отношении дезоксиниваленола и фумонизина В1
Таблица 2 – Истинная сорбция in vitro к трихотеценовым микотоксинам (n=3)
|
Номер модели |
Наименование сорбентов |
Дезоксини-валенол |
Фумонизин В1 |
|
1 |
Дрожжевые β-глюканы (солевой гидролиз) |
78,4±1,2 |
35,7±1,8 |
|
2 |
Растительные β-глюканы |
91,5±2,6 |
58,9±1,6 |
|
3 |
Дрожжевые β-глюканы (щелочной гидролиз) |
94,6±1,1 |
35,7±0,4 |
|
4 |
Цеолит |
19,0±0,9 |
77,0±1,4 |
|
5 |
Шунгит |
98,2±2,1 |
98,0±2,1 |
|
6 |
Лигнин |
38,6±0,8 |
64,8±2,4 |
Результаты исследования процента десорбции показали (рисунок 2), что максимальную десорбцию дезоксиниваленола продемонстрировал лигнин (5,2±0,3) %, чуть ниже β-глюканы
(дрожжевые, солевой гидролиз) – (3,3±0,2) %, у остальных варьировала от 0,4 % до 1 %. Наибольшее количество фумонизина В1 при переходе в условия pH кишечника утратил цеолит – 6,3 %, меньше лигнин 3,2 %, β-глюканы – 1,4 % и шунгит – 0,1 %.
Показатели истинной сорбционной емкости исследуемых групп сорбентов к дезоксиниваленолу и фумонизину В1 представлены в таблице 2.
Из таблицы 2 видно, что способность образцов к элиминации дезоксиниваленола была самой высокой у пятой группы «шунгит» – (98,2±2,1) %, также в первой, второй и третьей группах «β-глюканы различного происхождения» от (94,6±1,1) % до (78,4±1,2) %. Самой низкой была сорбционная способность к дезоксиниваленолу у лигнина (38,6±0,8) % и цеолита (19,0±0,9) %. Количество прочно сорбированного фумонизина В1 установлено в следующей последовательности, у сорбентов первой и третьей группы по 35,7 %, во второй, четвертой, пятой и шестой группах – (58,9±1,6) %, (77,0±1,4) %, (98,0±2,1) %, (64,8±2,4) %, соответственно. По результатам подсчета истинной сорбционной емкости к микотоксинам дезоксиниваленолу и фумонизину В1 с наилучшими показателями лидируют вторая (растительный β-глюкан) и пятая (шунгит) модели.
Заключение. Учитывая числовые значения показателей сорбции к трихотеценовому микотоксину дезоксиниваленолу, лидерами являются дрожжевой β-глюкан (щелочной гидролиз) сорбировавший – 94,6 % микотоксина, растительный β-глюкан – 91,5 % и шунгит – 78,4 %. К микотоксину фумонизину В1 наилучшую сорбцию показал шунгит – 98,0 %, цеолит – 77,0 % и лигнин – 64,8 %. Остальные сорбенты проявили себя в меньшей степени. В целом сорбенты растительного происхождения лучше сорбировали дезоксиниваленол, а природные сорбенты показали лучшую сорбционную способность к фумонизину В1.
Резюме
Трихотеценовые микотоксины (фумонизин В1 и дезоксиниваленол) это соединения семейства сесквитерпеноидов, продуцируемые грибами рода Fusarium proliferatum и Fusarium verticillioides. Данные микотоксины играют ключевую роль в различных патологических воздействиях на клеточные системы организма и весь организм в целом. Наиболее удобным и эффективным способом нейтрализации их воздействия на организм является использование различных сорбентов. Целью наших исследований было проведение сравнительной оценки различных сорбционных материалов для удаления трихотеценовых микотоксинов в условиях in-vitro . Нами исследовалась способность дрожжевых и растительных β-глюканов, лигнина (сорбентов растительного происхождения), цеолита, шунгита (минеральных сорбентов) связывать трихотеценовые микотоксины фумонизин В1 и дезоксиниваленол. Адсорбцию этих веществ оценивали по методике, имитирующей условия желудочно-кишечного тракта. В результате эксперимента было установлено, что лидерами сорбции к дезоксиниваленолу, являются дрожжевой β-глюкан (щелочной гидролиз) сорбировавший – 94,6 % микотоксина, растительный β-глюкан – 91,5 % и шунгит – 78,4 %. К микотоксину фумонизину В1, наилучшую сорбцию показал шунгит – 98,0 %, цеолит – 77,0 % и лигнин – 64,8 %. Остальные сорбенты проявили себя в меньшей степени. В целом сорбенты растительного происхождения лучше сорбировали дезоксиниваленол, а природные сорбенты показали лучшую сорбционную способность к фумонизину В1.
Список литературы Сравнительная оценка сорбционных материалов для удаления трихотеценов
- Адсорбция микотоксинов техническими лигнинами / З. А. Канарская, А. В. Канарский, Ю. Г. Хабаров [и др.] // Химия растительного сырья. – 2011. – № 1. – С. 59-63.
- Гематдинова, В. М. Получение концентрата бета-глюкана из овсяных отрубей для функциональных продуктов питания / В. М. Гематдинова, З. А. Канарская, А. В. Канарский // Пищевая промышленность. – 2018. – № 3. – С. 19-22.
- Грачева, О. А. Продуктивность, качество мяса и яиц кур-несушек при скармливании «Янтовета» / О. А. Грачева, Л. Ф. Якупова // Ученые записки Казанской государственной академии ветеринарной медицины им. Н. Э. Баумана. – 2016. – Т. 226. – № 2. – С. 48-51.
- Изучение сорбционной активности биосорбентов по отношению к Т-2 токсину / А. Ш. Садыкова, Е. Ю. Тарасова, Л. Е. Матросова [и др.] // Ветеринарный врач. – 2021. – № 3. – С.45-52.
- Изучение сорбционной активности потенциальных средств профилактики микотоксинов в отношении афлатоксинов / Е. Ю. Тарасова, Э. И. Семенов. Л. Е. Матросова [и др.] // Ветеринарный врач. – 2020. – № 2. – С. 51-58.
- Камалиев, А. Р. Ветеринарно- санитарная оценка качества мяса кроликов после применения полисахаридного препарата «Гемив» / А. Р. Камалиев, Р. А. Асрутдинова, М. Г. Сагитова [и др.] // Ученые записки Казанской государственной академии ветеринарной медицины им. Н. Э. Баумана. – 2015. – Т. 223. – № 3. – С. 87-90.
- Мишина, Н. Н. Профилактическая эффективность лигнин- и полисахаридсодержащих энтеросорбентов при сочетанном Т-2 токсикозе: специальность 16.00.04 «Ветеринарная фармакология с токсикологией»: автореф. дис. … канд. биол. наук / Мишина Наиля Наримановна. – Казань, 2009. – 24 с.
- Обоснование введения в рацион животных комбинации сорбентов неорганической и органической природы при Т-2 токсикозе / Н. Н. Мишина, Э. И. Семенов, К. Х. Папуниди [и др.] // Ветеринарный врач. – 2019. – № 2. – С. 30-37.
- Перфилова, К. В. Обоснование компонентного состава комплексного средства «Цеапитокс» в отношении Т-2 токсина в опытах in vitro / К. В. Перфилова, Н. Н. Мишина, Э. И. Семенов // Ученые записки Казанской государственной академии ветеринарной медицины им. Н. Э. Баумана. – 2021. – Т. 247. – № 3. – С. 208–212.
- Потехина, Р. М. Грибы рода Aspergillus – возбудители болезней животных и птиц / Р. М. Потехина, Е. Ю. Тарасова, Л. Е. Матросова – Казань: Федеральный центр токсикологической, радиационной и биологической безопасности, 2020. – 21 с.
- Экспериментальный сочетанный микотоксикоз свиней на фоне инфекционной нагрузки / Э. И. Семенов, Л. Е. Матросова, С. А. Танасева [и др.] // Сельскохозяйственная биология. – 2022. – Т. 57. – № 2. – С. 371-383.
- Catalli, A. Chitin and β-glucan polysaccharides as immunomodulators of airway inflammation and atopic disease / A. Catalli, M. Kulka // Metabolic & Immune Drug Discovery. – 2010. – Vol. 4. – P. 175-189.
- Juan-Garcia, A. Cytotoxicity, genotoxicity and disturbance of cell cycle in HepG2 cells exposed to OTA and BEA: single and combined actions Toxins / A. Juan-Garcia, J. Tolosa, C Juan, M.J. Ruiz // Toxins. – 2019. – Vol. 11 (6). – Р. 341.
- Krysinska-Traczyk, E. Levels of fungi and mycotoxins in the samples of grain dust collected from five various cereal crops in eastern Poland / E. Krysinska-Traczyk, J. Perkowski, J. Dutkiewicz // Ann. Agric. Environ. Med. – 2007. – Nо 14 – P. 159-167.
- Liu, Q. Zheng Lignins: biosynthesis and biological functions in plants / Q. Liu, L. Luo, L. Zheng // Int. J. Mol. Sci. – 2018. – Nо 19. – P. 335.


