Сравнительная оценка возможности заселения клеточного материала в матриксы, изготовленные методами электроспиннинга и аэродинамического формирования в турбулентном газовом потоке
Автор: Афанасьев С.А., Муслимова Э.Ф., Нащекина Ю.А., Никонов П.О., Роговская Ю.В., Больбасов Е.Н., Твердохлебов С.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: В помощь практическому врачу
Статья в выпуске: 3 т.32, 2017 года.
Бесплатный доступ
Введение. Методы электроспиннинга и аэродинамического формирования (АЭРДФ) в газовом потоке позволяют изготавливать синтетические структуры, подобные межклеточным матриксам. Но важной является оценка пригодности таких структур для заселения клеточным материалом. Материал и методы. Рассмотрено 2 типа матрикса из полимолочной кислоты. Матрикс № 1 получен методом электро-спиннинга, матрикс № 2 - методом АЭРДФ. Структуру матриксов оценивали на электронном микроскопе. В матриксы методом динамического заселения вносили стромальные клетки костного мозга (СККМ) кролика с последующим (3 суток) культивированием матриксов в СО2-инкубаторе при 37 °С. Присутствие клеток в матриксах оценивали с помощью флуоресцентной микроскопии. Данные представляли как среднее ± стандартное отклонение. Результаты. Матрикс № 1 сформирован волокнами правильной цилиндрической формы (диаметр 1,5±0,7 мкм) без собственного рельефа. Средняя пористость составила 67±3%. В структуре матрикса № 2 имеются жгуты (диаметр 27,5±17,4 мкм), сформированные направленными волокнами (диаметр 0,44±0,14 мкм) с развитым рельефом поверхности. Средняя пористость составила 55±3% (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Нетканые материалы, электроспиннинг, аэродинамическое формирование, культура клеток
Короткий адрес: https://sciup.org/149125174
IDR: 149125174 | DOI: 10.29001/2073-8552-2017-32-3-71-76
Текст научной статьи Сравнительная оценка возможности заселения клеточного материала в матриксы, изготовленные методами электроспиннинга и аэродинамического формирования в турбулентном газовом потоке
Работы в области клеточных технологий тесным образом связывают в себе фундаментальные и прикладные аспекты. Именно это обстоятельство может обеспечить успех их практической реализации, в том числе в направлении регенеративной медицины [1]. Так, очевидно, что биомеханический подход к регенерации костной ткани, основанный на применении методик накостного и чре-скостного остеосинтеза, при многих патологиях достиг предела своих возможностей [2, 3]. Дальнейшее совершенствование возможно при использовании тканевой инженерии и факторов, способных индуцировать процесс регенерации ткани [4].
Одним из ключевых элементов, необходимых для успешной реализации стратегии тканевой инженерии, являются искусственно созданные тканевые эквиваленты (матриксы, scaffolds), в пределах которых тем или иным способом возможно наращивать объем ткани. Искусственные матриксы формируют субстрат и определяют форму и комплекс свойств восстанавливаемой ткани или органа. Волокнистые матриксы — наиболее перспективный тип для регенерации костной ткани, они изготовлены из композиционных материалов на основе биорезорбируемых полимеров и фосфатов кальция [5]. Такие матриксы обладают высокой эластичностью, достаточной механической прочностью, высокой открытой пористостью, что не только способствует протеканию процессов интеграции костной ткани с матриксом с образованием системы «кар-кас-костная ткань», но и обеспечивает возможность насыщения такого каркаса фармакологическими препаратами и клеточными материалами [6].
Среди многочисленных методов изготовления волокнистых композиционных матриксов [7] наибольшее внимание исследователей привлекают два способа их формирования — электроспиннинг [8] и АЭРДФ в турбулентном газовом потоке [9].
Следует отметить, что для приложений тканевой инженерии одним из определяющих свойств матрикса является его способность к заселению клетками. Таким образом, цель исследования: оценить пригодность матриксов, сформированных методами электроспиннинга и АЭРДФ, для заселения клеточным материалом.
Материал и методы
Для исследований использованы два типа пористых матриксов диаметром 20 мм и толщиной 150 мкм, изготовленных из композиционного материала на основе полимолочной кислоты PURASORB® PL 38 (Purac, Нидерланды) и мелкодисперсного гидроксиапатита (Ca10(PO4)6(OH)2) дисперсностью <40 мкм, полученного из биогенного сырья методом высокотемпературного отжига с последующей многократной промывкой и просеиванием (кафедра «Технологии силикатов и наноматериалов» ТПУ). Композитный материал готовили растворением полимолочной кислоты (4 масс. %) в хлороформе («Экрос», Россия) в герметичном реакторе при комнатной температуре и постоянном перемешивании. Далее в раствор добавляли дисперсию порошка гидроксиапатита в хлороформе таким образом, чтобы массовое содержание неорганической фазы по отношению к полимолочной кислоте составило 25 вес. %.
Матрикс № 1 получен методом электроспиннинга на установке NANON-NF 01 (Япония) при следующих параметрах: размер сборочного коллектора — длина 200 мм, диаметр — 100 мм, частота вращения — 50 об/мин, игла — 18 G, расход полимерного раствора — 3,5 мл/ч, расстояние от иглы до сборочного коллектора — 16 см, напряжение — 25 кВ. Матрикс № 2 получен методом АЭРДФ на установке собственной конструкции. Формирование структуры матрикса осуществлялось при следующем режиме: давление сжатого воздуха — 3,5 атм, расход раствора полимера — 30 мкл/мин, диаметр сопла для пода- чи полимерного раствора — 0,7 мм, диаметр сопла для подачи сжатого воздуха — 1 мм, расстояние от сопла до сборочного коллектора — 400 мм.
Исследование структуры матриксов проводили на электронном микроскопе ESEM Quanta 400 FEG (FEI, США), используя режим низкого вакуума в атмосфере паров воды. Изображения получали при следующих условиях: остаточное давление в камере — 60 Па, ускоряющее напряжение — 20 кВ, ток пучка — 3,5 мкА.
Матриксы заселяли клеточным материалом методом динамического заселения [10, 11]. С помощью перистальтического насоса через матриксы пропускали 15 мл суспензии, содержащей 0,6 x 10 5 кл/мл стромальных клеток костного мозга (СККМ) кролика. Заселенные клетками матриксы помещали в среду DMEM (Gibco, США), содержащую 1% HEPES буфера, 10% эмбриональной бычьей сыворотки, 1% L-глутамина, 100 ед/мл пенициллина, 0,1 мкг/мл стрептомицина, 0,1 мкг/мл амфотерицина В (Sigma Aldrich, США), и культивировали в течение 3 суток в СО2-инкубаторе при температуре 37 °С. Ранее было показано, что количество клеток вокруг матрикса, появляющихся в первые 3 суток культивирования, является объективным показателем эффективности посева клеточного материала [10].
Присутствие клеток в структуре матриксов оценивали с помощью флуоресцентной микроскопии. Для этого матриксы помещали в раствор ядерного красителя Dapi на 45 мин, затем промывали в буфере PBS, переносили на стекло и исследовали с помощью микроскопа Axio Imager M2 (Carl Zeiss, Германия) при следующих параметрах: Excition Wavelength, 353 Emission Wavelength 465, х400. В 2D-режиме количество клеток считали на площади 348,79 х 263,03 мкм. Изображения 3D были получены с помощью камеры Axocam503 mono и программного обеспечения ZEN 2 pro (функция Z-stek). Каждый объект был исследован на толщину 19,8 мкм (37 фотографий). Для определения количества клеток в 3D-режиме клетки тоже считали на площади 348,79 х 263,03 мкм, но в каждой из 37 фотографий. Подсчет клеток проводили в 10 случайных полях зрения.
Статистическую обработку результатов исследований проводили с использованием пакета программ STATISTICA (StatSoft, Dell). Для оценки нормальности распределения использовали критерий Колмогорова– Смирнова. Во всех случаях мы имели нормальное распределение и для оценки значимости различий выборок использовали t-критерий Стьюдента. Критический уровень значимости p принимался равным 0,05. Данные представляли как среднее ± стандартное отклонение.
Результаты
Согласно данным микроскопического исследования, матриксы существенно отличались друг от друга по своей структуре. Матрикс № 1 был сформирован отдельными волокнами правильной цилиндрической формы средним диаметром 1,5±0,7 мкм, хаотически перепутанными между собой. На поверхности волокон отсутствовал собственный рельеф (рис. 1а). При значительном увеличении (рис. 1б) в структуре обнаруживались единичные включения частиц гидроксиапатита средним диаметром 1,8±0,6 мкм. Средняя пористость сформированного матрикса составила 67±3%.

Рис. 1а Рис. 1б
Рис. 1. Структура матрикса, сформированного методом электроспиннинга
Примечание: а — увеличение 500x; б — увеличение 5000x.

Матрикс № 2 отличался более сложной пространственной организацией. В ней можно выделить макроуровень, который представлен жгутами средним диаметром 27,5±17,4 мкм (рис. 2а). Эти жгуты в свою очередь сформированы направленными волокнами (рис. 2б). Диаметр волокон составлял в среднем 0,44±0,14 мкм, что значимо (р<0,05) меньше, чем в матриксе, полученном методом электроспиннинга. Еще одной особенностью этих волокон являлось то, что у них присутствовал развитый рельеф поверхности. Средняя пористость матрикса № 2 была значимо (р<0,05) меньше, чем матрикса № 1 и составила 55±3%. В структуре матрикса № 2 присутствовали и частицы гидроксиапатита, они были распределены более равномерно с отсутствием значи- тельных скоплений. Значительное количество частиц гидроксиапатита расположено между волокнами. Однако присутствуют частицы, которые, как и в матриксе № 1, заключены в структуру волокна. Площадь свободной поверхности матрикса № 2 превышала площадь свободной поверхности матрикса № 1 не менее чем в 8 раз.

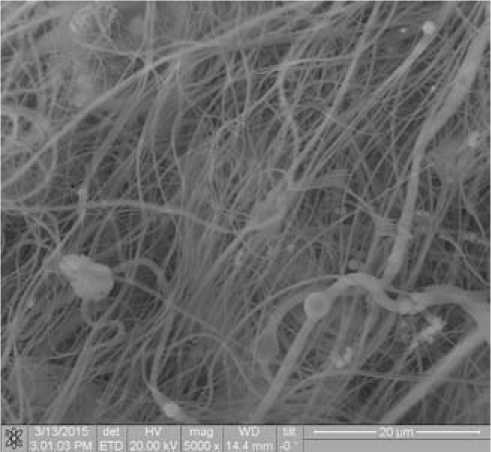
Рис. 2б
Рис. 2а
Рис. 2. Структура матрикса, сформированного методом АЭРДФ Примечание: а — увеличение 300x; б — увеличение 5000x.
Далее была проведена оценка пригодности матриксов для заселения клеточным материалом. Оказалось, что рассматриваемые матриксы статистически значимо (р<0,05) различались по среднему количеству выявленных клеток. Так, для матрикса № 1 это значение составило 56±9 клеток против 81±6 клеток для матрикса № 2
в 2D-режиме. В 3D-режиме различие между матриксами было еще более явным (рис. 3). В матриксе № 1 среднее число выявляемых клеток составляло 120±40, тогда как в матриксе № 2 этот показатель был уже почти в 2 раза выше и составлял 215±18 клеток.
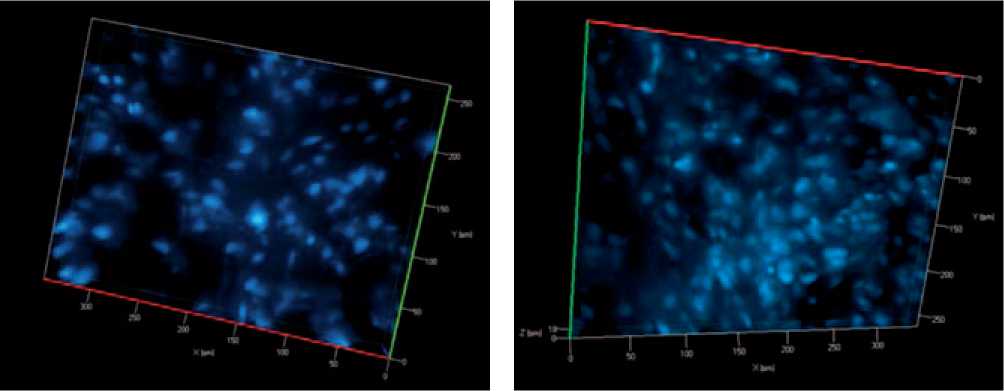
Рис. 3б
Рис. 3а
Рис. 3. Типичный вид 3D-изображения клеток, заселенных в матриксы на основе полимолочной кислоты (ядерный краситель Dapi, увеличение 400х)
Примечание: а — матрикс, сформированный методом электроспиннинга; б — матрикс, сформированный методом АРДФ.
Обсуждение
Проведена сравнительная оценка структуры матриксов, полученных методом электроспиннинга и методом АЭРДФ. Сформированные нетканые материалы существенно отличались по своей структуре. Так, матрикс № 2, полученный методом АЭРДФ, отличался более сложной пространственной организацией, меньшим средним диаметром волокон и большей площадью свободной поверхности, чем матрикс № 1, сформированный методом электроспиннинга.
Обнаруженные различия в морфологии рассматриваемых матриксов можно объяснить особенностями процесса формирования волокон, из которых они образованы. Действительно, в случае электроспиннинга происходит расщепление струи прядильного раствора на некотором расстоянии от сопла из-за высокой концентрации одноименных электрических зарядов. Процесс расщепления струи прядильного раствора носит многократный характер и продолжается до тех пор, пока капиллярное давление на поверхности дочерних струй прядильного раствора не скомпенсирует электрические силы или струя при испарении растворителя не превратится в твердое волокно [12, 13]. При использовании метода АЭРДФ струя прядильного раствора ускоряется и растягивается высокоскоростным газовым потоком. В зоне газового потока, отличающегося высокой турбулентностью, происходит изгиб и запутывание струи, что увеличивает вероятность перепутывания соседних струй [14, 15]. Это приводит к образованию волокон сложной пространственной организации. В дополнение к этому струя прядильного раствора подвергается растягивающим воздействиям со стороны потока твердых частиц, которые способны покидать струю за счет кинетической энергии и вытягивать за собой прядильный раствор, становясь центрами создания дочерних струй. Наличие такого механизма в свою очередь является мощным фактором уменьшения диаметра формируемых волокон.
Далее была проведена оценка возможности заселения матриксов СККМ. Надо отметить, что в работе был использован динамический способ заселения клеток. Данный метод обеспечивает распределение клеток по всему объему матрикса в отличие от статического способа заселения, при котором суспензию клеток наносят на поверхность материала [10, 11].
Полученные результаты свидетельствуют о том, что СККМ успешно фиксировались в объеме рассматриваемых матриксов. Этот факт является подтверждением того, что оба типа матриксов биосовместимы. Однако мы обнаружили, что матрикс, полученный методом АЭРДФ, в равных условиях способен адгезировать значимо большее количество СККМ. Такой результат, по всей видимости, обусловлен более высоким значением площади свободной поверхности. Кроме того, известно, что поверхности с большей шероховатостью являются предпочтительными для адгезии клеток [16], можно предположить, что развитая поверхность волокон, сформированных методом АЭРДФ, стимулирует прикрепление клеток. Также на более эффективное заселение клеток в матрикс № 2 могло повлиять наличие в его структуре свободных частиц фосфатов кальция, так как насыщение жидкости вокруг частиц и порового пространства матрикса биологически активными ионами кальция и фосфора оказывает синергетический эффект и усиливает адгезию.
Таким образом, в отличие от метода электроспиннинга метод АЭРДФ в газовом потоке позволяет получать матриксы с более оптимальной пространственной организацией, что обеспечивает их лучшее заселение клеточным материалом.
Финансирование: исследование поддержано Российским научным фондом (проект № 16-13-10239).
Список литературы Сравнительная оценка возможности заселения клеточного материала в матриксы, изготовленные методами электроспиннинга и аэродинамического формирования в турбулентном газовом потоке
- Попов С.В., Рябов В.В., Суслова Т.Е. и соавт. Фундаментальные и прикладные аспекты клеточных технологий в кардиологии и кардиохирургии // Бюллетень СО РАМН. - 2008. - Т. 28(4). - С. 5-15.
- Aranovich A., Popkov A., Barbier D., Popkov D. Femoral lengthening by combined technique in melorheostosis: a case report // Eur. Orthop. Traumatol. - 2014. - Vol. 5. - P. 175-179- DOI: 10.1007/s12570-013-0220-4
- Popkov D., Journeau P., Popkov A. et al. Ollier's disease limb lenghtening: Should intramedullary nailing be combined with circular external fixation? // Orthop. Traumatol. Surg. Res. - 2010. - Vol. 96. - P. 348-353- DOI: 10.1016/j.otsr.2010.01.002
- Petite H., Viateau V., Bensaïd W. et al. Tissue-engineered bone regeneration // Nat. Biotechnol. - 2000. - Vol. 18. - P. 959-963- DOI: 10.1038/79449
- Boccaccini A.R., Blaker J.J. Bioactive composite materials for tissue engineering scaffolds // Expert Rev. Med. Devices. - 2005. - No. 2. - P. 2303-2317- DOI: 10.1586/17434440.2.3.303
- Santoro M., Shah S.R., Walker J.L., Mikos A.G. Poly(lactic acid) nanofibrous scaffolds for tissue engineering // Adv. Drug Deliv. Rev. - 2016. - Vol. 107. - P. 206-212-
- DOI: 10.1016/j.addr.2016.04.019
- Tamayol A., Akbari M., Annabi N. et al. Fiber-based tissue engineering: Progress, challenges, and opportunities // Biotechnol. Adv. - 2013. - Vol. 31. - P. 669-687-
- DOI: 10.1016/j.biotechadv.2012.11.007
- Jiang T., Carbone E.J., Lo K.W.-H., Laurencin C.T. Electrospinning of Polymer Nanofibers for Tissue Regeneration // Prog. Polym. Sci. - 2014. - Vol. 46. - P. 1-24-
- DOI: 10.1016/j.progpolymsci.2014.12.001
- Daristotle J.L., Behrens A.M., Sandler A.D., Kofinas P. A Review of the Fundamental Principles and Applications of Solution Blow Spinning // ACS Appl. Mater. Interfaces. - 2016. - No. 8. - P. 34951-34963- 10.1021/ acsami.6b12994.
- DOI: 10.1021/acsami.6b12994
- Нащекина Ю.А., Никонов П.О., Михайлов В.М. и др. Зависимость заполнения стромальными клетками костного мозга трехмерной матрицы от способа посева клеток и типа модификации поверхности матрицы // Цитология. - 2014. - Т. 56(4). - С. 283-290.
- Nashchekina Y.A., Nikonov P.O., Mikhailov V.M. et al. Distribution of bone-marrow stromal cells in a 3D scaffold depending on the seeding method and the scaffold inside a surface modification // Cell tissue biol. - 2014. - Vol. 8(4). - P. 313-320.
- Filatov Y., Budyka A., Kirichenko V. Electrospinning of Micro- and Nanofibers: Fundamentals in Separation and Filtration Processes. - New York: Begell House Inc., 2007. - 404 p.
- Reneker D.H., Chun I. Nanometre diameter fibres of polymer, produced by electrospinning // Nanotechnology. - 1996. - Vol. 7(3). - P. 216-223.
- Daristotle J.L., Behrens A.M., Sandler A.D. et al. A Review of the Fundamental Principles and Applications of Solution Blow Spinning // ACS Appl. Mater. Interfaces. - 2016. - Vol. 8(51). - P. 34951-34963.
- Tomecka E., Wojasinski M., Jastrzebska E. et al. Poly(l-lactic acid) and polyurethane nanofibers fabricated by solution blow spinning as potential substrates for cardiac cell culture // Mater. Sci. Eng. C. - 2017. - Vol. 75. - P. 305-316.
- Faia-Torres A.B., Charnley M., Goren T. et al. Osteogenic differentiation of human mesenchymal stem cells in the absence of osteogenic supplements: A surface-roughness gradient study // Acta Biomater. - 2015. - Vol. 28. - P. 64-75.


