SSR-анализ геномной ДНК ЦМС-линий подсолнечника
Автор: Усатов А.В., Маркин Н.В., Горбаченко Ф.И., Федорова М.А., Тихобаева В.Е., Горбаченко О.Ф., Азарин К.В.
Статья в выпуске: 1 (146-147), 2011 года.
Бесплатный доступ
В результате анализа полиморфизма микросателлитных локусов ядерного генома 16-И генотипов ЦМС-линий (селекционный материал ДОС им. Л.А. Жданова) определены 35 аллельных вариантов. Для каждого генотипа построена аллельная формула, которая может быть использована в качестве его молекулярно-генетического паспорта. По результатам микросателлитного анализа построена UPGMA-дендрограмма, отражающая генетическое сходство между изученными линиями.
Полиморфизм, ssr-маркеры, upgma-дендрограмма, цмс линии подсолнечника
Короткий адрес: https://sciup.org/142150979
IDR: 142150979 | УДК: 575.12:633.854.78
Текст научной статьи SSR-анализ геномной ДНК ЦМС-линий подсолнечника
Введение. Основной задачей гетерозисной селекции сельскохозяйственных культур является создание гибридов с высокой продуктивностью и комплексной устойчивостью к биоти- ческим и абиотическим факторам среды. Успех селекции на гетерозис во многом зависит от того, насколько богат генетический потенциал родительских линий, используемых для получения гибридов.
При создании самоопыленных линий подсолнечника первостепенное внимание уделяют селекции автофертильных форм, которые завязывают большое количество семян даже без дополнительного искусственного опыления. На Донской опытной станции им. Л.А. Жданова ВНИИМК путем самоопыления и отбора были получены высокоурожайные линии, отличающиеся выравненностью по основным морфологическим признакам [1]. Лучшие по комбинационной способности были переведены на стерильную основу H. petiolaris , которая легко передает мужскую стерильность создаваемым аналогам и обеспечивает высокую за-вязываемость семян не только под изоляторами, но и при свободном цветении. В настоящее время на станции получены и включены в селекционную программу экспериментальных гибридов несколько десятков ЦМС линий.
С введением ДНК-маркеров в практику биологических исследований, появились новые возможности изучения генетического разнообразия организмов [2; 3]. С целью интенсификации и снижения трудоемкости селекционного процесса для получения перспективных гибридных комбинаций в настоящее время проводят анализ полиморфизма ДНК инбредных линий различных культур. В частности, SSR, или микросателлитный анализ, эффективен для решения такого рода задач [4; 5; 6]. Микроса-теллитные локусы в основном представлены некодирующими участками ДНК и, следовательно, не попадают под прямое действие естественного отбора. В них накапливаются мутации, что и обусловливает высокий уровень полиморфизма. Чаще всего микросателлитные локусы обладают кодоминантным типом наследования. Идентификация сортов подсолнечника с помощью микросателлитов, впервые проведенная Брюнелем [7], показала, что мик-росателлитные локусы, представленные множественными аллелями и характеризуемые сравнительно высокой гетероген-ностью, являются удобным и перспективным инструментом для анализа полиморфизма геномной ДНК.
В связи с этим целью работы является исследование с помощью микросателлитного анализа полиморфизма геномной ДНК ЦМС- линий подсолнечника ДОС ВНИИМК, а также составление их генетических паспортов.
Материалы и методы. Объектом исследования служил селекционный материал Донской опытной станции масличных культур им. Л.А. Жданова ВНИИМК, представленный ЦМС линиями подсолнечника (табл. 1).
Геномную ДНК выделяли из первой пары настоящих листьев проростков по методу Р. Бума [8] c нашими модификациями. В SSR-анализе использовали одиннадцать пар праймеров, отобранных нами по данным литературы и в результате предварительных исследований (табл. 2) [9; 10].
Для проведения полимеразной цепной реакции использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16 мМ (NH 4 ) 2 SO 4 , 2,5 мМ MgSO 4 , 0,1 мМ меркаптоэтанола, 0,25 мМ каждого Д НТФ ( Д АТФ, Д ЦТФ, Д ТТФ, Д ГТФ), по 10 пМ праймеров; 2,5 ед. Taq-полимеразы, 30 нг выделенной ДНК. Амплификацию проводили в термоциклере Palm Cycler (Corbett Research, Австралия).
Термальный режим реакций подбирали для каждой пары праймеров с учетом их нуклеотидного состава. Для большинства проведенных реакций оптимальным оказался терморежим с начальной денатурацией при 96 °С в течение 2 мин, затем 30 циклов при соблюдении температурно-временного режима: отжиг при 55-60 °С в течение 40 сек, элонгация – 1 мин при 70 °С, денатурация при 94 °С – 30 сек, финальная элонгация – 2 мин.
Продукты реакции амплификации разделяли электрофоретически в 2 % агарозном геле с бромистым этидием (1 мкг/мл), используя трис-боратный буфер. После окончания электрофореза гели переносили на трансиллюминатор и фотодокументировали с помощью видеосистемы (GelDoc 2000, BioRad, США). В качестве маркеров массы использовали набор маркеров GeneRuler 100 bp DNA Ladder (Fer-mentas) и pUC Mix Marker, 8 (Fermentas).
Индекс полиморфного информационного содержания (PIC) вычисляли по формуле:
PICi = 1 - ∑nj=1Pji2, где Р – частота j паттерна для локуса i и суммирование распространяется на n паттернов [11].
Анализ генетического сходства образцов подсолнечника производили с использованием коэффициента Жаккарда. Дендрограмму строили с помощью метода иерархического кластерного анализа (UPGMA).
Таблица 1 – Характеристика ЦМС - линий подсолнечника по селекционно ценным признакам Донской опытной станции ВНИИМК
ДОС ВНИИМК, 2000 – 2010 гг.
|
Название линии |
Годы испытания |
Вегетационный период, дни, от всходов до |
Урожайность семян, ц/га |
Маслич-ность, % |
Лузжис-тость, % |
Масса 1000 семян, г |
Высота растения, см |
Диаметр корзинки, см |
|
|
цветения |
созревания |
||||||||
|
ВД 255 |
2000-2008 |
53 |
87 |
9,6 |
39,1 |
23,6 |
52,4 |
91 |
12,7 |
|
ВД 22 |
2001-2010 |
56 |
90 |
12,2 |
41,3 |
26,9 |
50,7 |
76 |
11,3 |
|
ВД 149 |
2000-2008 |
55 |
88 |
9,4 |
41,8 |
22,0 |
50,9 |
90 |
12,2 |
|
ВД 356 |
2000-2010 |
60 |
92 |
11,8 |
46,0 |
23,3 |
58,9 |
129 |
12,3 |
|
ВД 350 |
2000-2010 |
59 |
91 |
11,8 |
47,2 |
22,9 |
61,2 |
116 |
11,9 |
|
ВД 354 |
2000-2010 |
55 |
88 |
8,4 |
44,5 |
25,4 |
55,3 |
102 |
10,7 |
|
ЭД 869 |
2001-2010 |
56 |
91 |
11,5 |
44,5 |
23,5 |
59,2 |
92 |
12,0 |
|
ВД 151 |
2000-2010 |
57 |
90 |
10,3 |
46,7 |
20,9 |
62,3 |
103 |
10,9 |
|
ВД 344 |
2001-2010 |
61 |
87 |
12,0 |
49,9 |
21,6 |
54,7 |
132 |
15,0 |
|
ЭД 95 |
2001-2010 |
55 |
89 |
14,1 |
43,3 |
25,3 |
59,1 |
117 |
14,2 |
|
ЭД 77 |
2003-2010 |
59 |
94 |
11,6 |
40,8 |
22,7 |
44,9 |
115 |
12,3 |
|
ВД 1448 |
2000-2010 |
62 |
97 |
11,2 |
50,3 |
22,0 |
57,7 |
133 |
10,5 |
|
ЭД 73 |
2009-2010 |
53 |
88 |
13,4 |
43,5 |
24,7 |
57,4 |
115 |
12,8 |
Таблица 2 – Праймеры, использованные в SSR-анализе
|
Название локуса |
Повтор |
Последовательность фланкирующих праймеров 5ˈ–3ˈ |
Кол-во аллелей |
PIC* |
Размер амплифи-цированных фрагментов, п.н. |
|
Ha 432 |
GT |
CTT TAT CCC CCA CCC CCT CC GGG TTT AGT GGC CAG TAG TTG TC |
4 |
0,73 |
180-690 |
|
Ha 1442 |
ATT |
GCT TAT GTG CTT ACG TGT TCC TG CTA AAC AGT TCG GCG AGT GTA GG |
5 |
0,67 |
170-240 |
|
Ha 1608 |
ATT |
GAT CTT AGG TCC GCC AC GAT GGC ATT TGG CTA GAC |
3 |
0,52 |
220-250 |
|
IUB 4 |
AT |
GGC CAT GAT TTA TTC ACT CAG ACA GAT GAG AGG CGT TCT CAC |
2 |
0,50 |
130-190 |
|
ORS 509 |
AT GT |
CAA CGA AAA GAC AGA ATC GAA A CCG GGA ATT TTA CAA GGT GA |
3 |
0,43 |
190-210 |
|
Ha 514 |
GA |
GGT CAA CGG ATT TAG AGT C GTA TTG ATT CCA ACA TCC AG |
3 |
0,63 |
180-200 |
|
IUB 6 |
GT |
TCG GTA TCG TTT GCT AAT GG GGT AAC TCT AAA GCT CTG TC |
2 |
0,36 |
350-370 |
|
ORS 6 |
AGG |
GTG GAG AGA GGT GTA GAG AGC CAC CCC TCA CCC TGA CAC |
2 |
0,21 |
250-260 |
|
Ha 1287 |
GA |
GAT ATG AGC CCA TCA CTC ATC GAA GAT ATG TCA GGT CAC ACC C |
5 |
0,72 |
220-510 |
|
HNCA 2 |
GT |
TGA GAC AAG CAT AAG CAC TAG ACA AGA CAA GGG ACT |
2 |
0,36 |
210-340 |
|
OSU 1 |
GGG |
ACA AGT CGG CTG GTG AGC ACA TGA AAC ACG AGC TAA ACC A |
4 |
0,70 |
150-160 |
|
Среднее значение |
3,2 |
0,53 |
|||
* PIC – индекс полиморфного информационного содержания.
Результаты и обсуждение. В результате SSR-анализа 16-и ЦМС линий подсолнечника были получены специфические и хорошо воспроизводимые фрагменты ДНК. Для каждой линии определены индивидуальные SSR-спектры, различающиеся числом ампликонов, их размерами и степенью выраженности на электрофореграммах (рис. 1).
В результате исследования по 11 микроса-теллитным локусам было выявлено 35 аллелей. Их число на локус варьировало от 2 до 5, а размеры амплифицированных фрагментов находились в пределах от 130 до 690 п.н.
Основным показателем информативности микросателлитных локусов является индекс полиморфного информационного содержания (PIC).
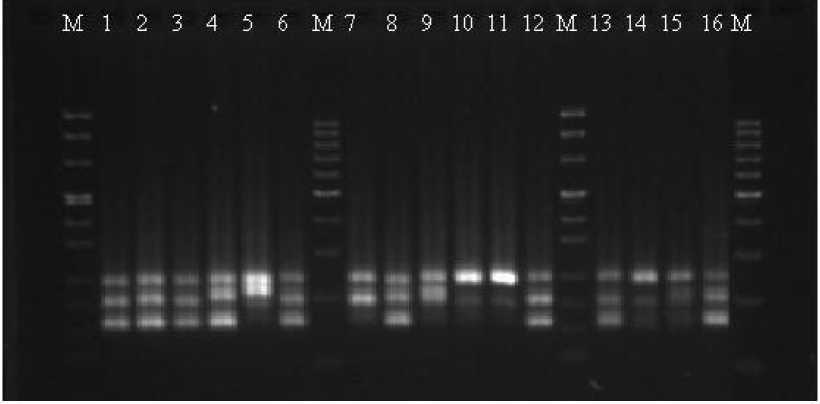
Рисунок 1 – Электрофореграмма продуктов амплификации геномной ДНК ЦМС-линий подсолнечника с праймером На 1442. Цифрами обозначены пробы согласно таблице 3; М – маркер массы
т аблица 3 – Генетические формулы ЦМС-линий подсолнечника
|
№№ п/п |
Формы |
Формулы* |
|
1 |
ВД 1448 |
A 3 B 2 C 1 C 3 C 4 D 1 E 1 E 3 F 2 G 2 H 3 I 3 J 0 K 1 L 1 L 2 |
|
2 |
ЭД 169 |
A 1 A 3 B 3 C 1 C 3 C 4 D 2 E 1 E 3 F 2 G 2 H 2 I 2 J 4 K 1 L 1 L 2 |
|
3 |
ВД 344 |
A 3 B 1 C 1 C 3 C 4 D 2 E 2 E 3 F 2 G 2 H 2 I 0 J 0 K 1 L 1 L 2 |
|
4 |
ВД 22 |
A 1 A 2 A 3 B 3 C 1 C 2 C 4 D 1 E 1 E 3 F 2 G 2 H 2 I 3 J 0 K 1 L 1 L 2 |
|
5 |
ЭД 869 |
A 1 A 2 A 3 B 3 C 1 C 2 D 1 E 1 E 3 F 2 G 2 H 3 I 1 J 4 K 1 L 1 L 2 |
|
6 |
ВД 151 |
A 1 A 3 B 3 C 1 C 3 C 4 D 2 E 1 E 3 F 2 G 2 H 2 I 2 J 3 K 1 L 2 |
|
7 |
ЭД 236 |
A 1 A 3 B 1 C 1 C 3 D 1 E 2 E 3 F 2 G 2 H 2 I 2 J 4 K 1 L 2 |
|
8 |
ЭД 77 |
A 1 A 2 A 3 B 3 C 1 C 3 C 4 D 1 E 2 E 3 F 2 G 2 H 2 I 1 J 4 K 1 L 1 L 2 |
|
9 |
ЭД 95 |
A 2 A 3 B 2 C 1 C 3 D 1 D 2 E 1 E 3 F 2 G 2 H 1 I 1 J 0 K 1 L 1 L 2 |
|
10 |
ВД 354 |
A 2 A 3 B 3 C 1 C 3 D 1 E 2 E 3 F 2 G 2 H 2 I 3 J 3 K 1 L 1 L 2 |
|
11 |
ВД 255 |
A 1 A 3 B 2 C 1 C 3 D 1 E 2 E 3 F 2 G 2 H 3 I 3 J 1 J 2 K 1 L 2 |
|
12 |
ВД 350 ** |
A 3 B 1 C 1 C 3 C 4 D 1 E 1 E 3 F 1 G 2 H 2 I 1 J 4 K 1 L 1 L 2 |
|
13 |
ВД 356 ** |
A 3 B 1 C 1 C 3 C 4 D 1 E 1 E 3 F 1 G 2 H 2 I 1 J 4 K 1 L 1 L 2 |
|
14 |
ВД 149 |
A 1 A 3 B 2 C 1 C 3 C 4 D 2 E 2 E 3 F 1 G 1 H 2 I 2 J 0 K 1 L 2 |
|
15 |
ЭД 73 |
A 2 A 3 B 3 C 1 C 2 C 4 D 2 E 1 E 3 F 1 G 1 H 3 I 2 J 4 K 1 L 1 L 2 |
|
16 |
ЭД 931 |
A 1 A 3 B 2 C 1 C 3 C 4 D 1 E 2 E 3 F 2 G 2 H 2 I 3 J 0 K 1 L 1 L 2 |
* Примечание : код праймера A-Ha 432; B-Ha 514; C-Ha 1442; D-Ha 1608; E-IUB 4; F-IUB 6; G-ORS 6; H-ORS 509;I-OSU 1; J-Ha 1287; K-HNCA 1; L-HNCA 2 . ** Генетические формулы оказались сходными.
Этот показатель характеризует дискриминационную силу локуса не только по количеству выявленных аллелей, но и по относительным частотам их встречаемости. Значение PIC приближается к единице, если локус имеет множество аллелей с приблизительно равной частотой встречаемости, и равен 0, если локус мономорфный [11].
Для отобранных нами локусов значения PIC варьировали от 0,21 для праймера ORS 6 до 0,73 для Ha 432 (табл. 2). Праймер HNCA 1 по результатам предварительных исследований оказался мономорфным (PIC равен 0) и был исключен из данной маркерной системы [9]. Значения PIC для локусов ORS 6 , ORS 509 , IUB 6 и HNCA 2 находятся в пределах 0,21-0,43, что достаточно для идентификации и паспортизации изучаемых форм. Остальные 7 локусов с показателями PIC более 0,5 наиболее эффективны для дифференциации изученной группы генотипов.
В результате проведенного SSR-анализа для каждого генотипа подсолнечника на основании полученного набора аллелей микросателлит-ных локусов были составлены молекулярногенетические паспорта (табл. 3), или генетические формулы их генотипов. Большими буква ми латинского алфавита обозначены прайме-
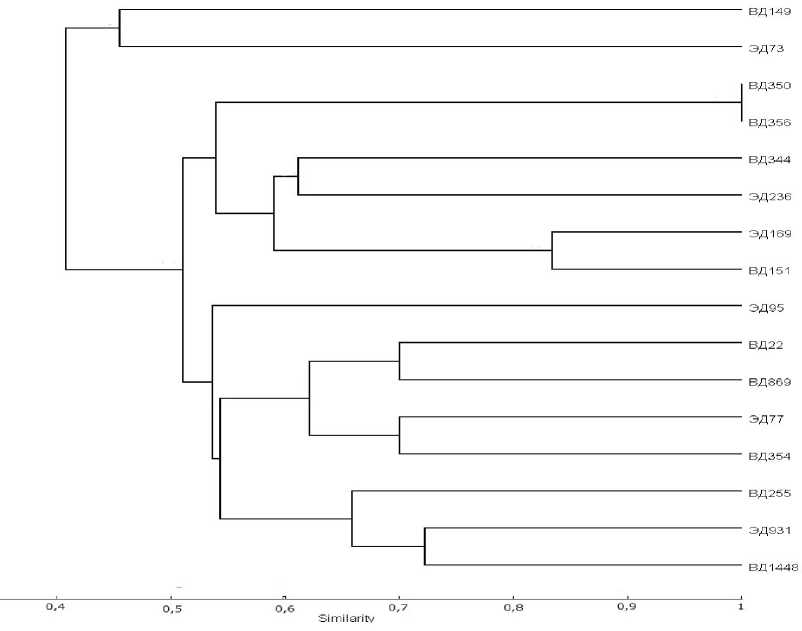
Рисунок 2 – Дендрограмма генетического сходства 16-ти ЦМС линий подсолнечника, построенная по результатам SSR-анализа
ры, нижний индекс определяет аллельное состояние локуса, который он маркирует.
В данной маркерной системе ЦМС-линии ВД 350 и ВД 356 по набору аллелей оказались идентичными, поэтому для их идентификации необходим дополнительный поиск ДНК маркеров.
На основании полученных данных была построена UPGMA-дендрограмма, отражающая генетическое сходство между изученными генотипами подсолнечника.
Заключение. В результате анализа полиморфизма микросателлитных локусов ядерно-го генома 16-и генотипов ЦМС-линий (селекционный материал ДОС им. Л.А. Жданова ВНИИМК) определены 35 аллельных вариантов. Для каждого генотипа построена аллельная формула, которая может быть использована в качестве его молекулярно-генетического паспорта.
Дискриминационный потенциал изученной маркерной системы для идентификации и паспортизации ЦМС-линий культурного подсолнечника оказался достаточно высоким. Однако из-за генетического сходства по изученным мик-росателлитным локусам двух ЦМС-линий необходим дополнительный подбор SSR-маркеров.
Исследование выполнено при финансовой поддержке Федеральной целевой программы Министерства образования и науки РФ «Научные и научно-педагогические кадры инновационной Ро-сии» (2009-2013)» № 141-005-066.


