SSR и SCAR генотипирование коллекции отечественных селекционных образцов подсолнечника, устойчивых и восприимчивых к расе Е Orobanche cumana Wallr
Автор: Гучетль С.З., Челюстникова Т.А., Арасланова Н.М., Антонова Т.С.
Рубрика: Селекция и семеноводство
Статья в выпуске: 1 (150), 2012 года.
Бесплатный доступ
С помощью 3 SSR и 3 SCAR локусов были генотипированы 32 генотипа подсолнечника коллекции ВНИИМК, устойчивых и восприимчивых к расе Е заразихи. Выявлены образцы подсолнечника с контрастными аллельными SSR и SCAR локусами, среди устойчивых и восприимчивых к расе Е заразихи, что в дальнейшем позволит маркировать ген Or5 в материале отечественной селекции. Дискриминационный потенциал данной молекулярной системы проявил себя как невысокий. Среднее число аллелей на локус составило 2,3. Значения эффективного числа аллелей варьировали от 1,50 у локуса RTS40 до 2,43 у RTS28, со средним значением 1,70. Значения PIC находились в диапазоне от 0,17 у локуса RTS40 до 0,59 у RTS28. Среднее значение индекса полиморфного информационного содержания для изученной группы генотипов 0,39. Уникальность коллекции составила 59 %.
Подсолнечник, заразиха, устойчивость, ssr- и scar-маркеры, паспортизация
Короткий адрес: https://sciup.org/142151053
IDR: 142151053 | УДК: 633.854.78:631.52
Текст научной статьи SSR и SCAR генотипирование коллекции отечественных селекционных образцов подсолнечника, устойчивых и восприимчивых к расе Е Orobanche cumana Wallr
Паспортизация и идентификация сельскохозяйственных культурных растений, маркер-опосредованная селекция всегда актуальны при создании новых сортов. Маркирование сортов и гибридов подсолнечника с помощью молекулярногенетических маркеров проводится в биотехнологических и селекционных центрах как у нас в стране, так и за рубежом. Так, в ГНУ «Институт генетики и цитологии НАН Беларуси» создан Центр ДНК-биотехнологий с целью внедрения современных достижений генетики и геномики в практику сельского хозяйства. Одной из задач центра является определение ДНК-маркеров для идентификации и паспортизации сортов сельскохозяйственных культур. В Украине объединенными усилиями трех научных центров: Института растениеводства им. В.Я. Юрьева (г. Харьков),
Селекционно-генетического института (г. Одесса) и Института масличных культур НААН (г. Запорожье) молекулярногенетические маркеры используются как инструмент для детального маркирования морфологических, селекционно-ценных признаков подсолнечника и создания нормативно-правовой базы паспортизации образцов подсолнечника, что обеспечит права селекционеров на научнотехнические разработки [1; 2; 3]. В нашей стране наиболее крупными центрами по изучению и идентификации биоразнообразия растительных культур являются ВНИИР им. Н.И. Вавилова, Центр молекулярной биотехнологии РГАУ-МСХА им. К.А. Тимирязева и др. Проводятся исследования по сопровождению селекционного процесса сельскохозяйственных культур ДНК-маркерами генов устойчивости к болезням и вредителям. Выполняется ДНК-паспортизация сортов, линий и доноров хозяйственно ценных признаков культурных растений; определение идентичности сортов и гибридов и сортовой чистоты; оценка внутри- и межпопуляционного генетического разнообразия видов растений [4; 5; 6; 7].
В лаборатории иммунитета и электрофореза ВНИИМК на протяжении многих лет апробированы и признаны пригодными как маркеры для идентификации и паспортизации линий и гибридов подсолнечника изоферментные системы, RAPD и SSR-производные амплифицированные фрагменты ДНК [8; 9; 10]. Согласно исследованиям других авторов, ДНК-локусы, ассоциированные с селекционноценными признаками, также являются эффективными для идентификации генотипов [11].
В данной работе мы поставили цель провести оценку коллекции перспективных селекционных образцов подсолнечника ВНИИМК, устойчивых и восприимчивых к расе Е заразихи (то есть, несущим ген Or5 и or5 соответственно), методом полимеразной цепной реакции амплификации ДНК по SSR- и SCAR-маркерам, сцепленным с разной частотой рекомбинации с Or5, описанным в литературе [12; 13].
Материалы и методы. Материалом исследования служили 32 образца отдела селекции гибридного подсолнечника ВНИИМК. 27 из них представляли генотипы, устойчивые к расе Е заразихи, а 5 – восприимчивые (табл. 1). Для определения однородности генотипов отбирали по 5 индивидуальных растений каждого образца.
ДНК подсолнечника выделяли из смеси верхушечных листьев молодых побегов вегетирующих растений: в одну пробирку отбирали по одинаковому кусочку листа от пяти растений каждого образца. Выделение проводили по методу Saghai-Maroof et аl. (1984) [14]. Поскольку в тканях вегетирующих растений подсолнечника высокое содержание растительных пигментов и фенольных соединений, затрудняющих очистку нуклеиновых кислот, для получения качественных препаратов на одном из этапов использовали активированный уголь, как предлагает Vroh et аl. (1996) [15].
Для проведения полимеразной цепной реакции использовали 25 мкл реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 1,5-3 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM дезоксирибонуклеозидфосфатов; по 10 пМ праймеров; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Москва, ГосНИИгенетика). Амплификацию проводили в приборе Терцик (ДНК-технология, Россия). Термальный режим реакций подбирали для каждой пары праймеров с учетом их нуклеотидного состава. Для большинства проведенных реакций с SSR и SCAR-праймерами оптимальным оказался терморежим с начальной денатурацией при 96 °С в течение 2 мин., затем 30 циклов при соблюдении температурно-временного режима: денатурация при 94 °С – 30 сек., отжиг при 60 °С в течение 40 сек., элонгация – 1 мин. при 70 °С, финальная элонгация – 2 мин.
Для ПЦР анализа использовали 2 типа праймеров:
-
- SCAR (sequence characterized ampli-
- fied region): RTS05, RTS28, RTS40 [12];
-
- SSR (simple sequence repeat): ORS 1036, ORS1112, ORS 1021 [13].
Электрофорез продуктов амплификации проводили в агарозном геле (2 %-ная агароза, 1х ТАЕ-буфер) с использованием камеры для горизонтального электрофореза (SE.2, ДНК-технология, Россия) в течение 1-1,5 ч при силе тока 50-58 mA и напряжении 80-100 V. Последующее окрашивание осуществляли бромистым этидием. Документирование результатов электрофореза обеспечивалось при помощи системы цифровой документации видеоизображения BIO-PRINT (Vilber Lourmat, Франция). Для определения различий между образцами подсолнечника данные ПЦР анализа были обработаны методом Ward. Кластерный анализ выполнили с помощью пакета программ (Statistica 6.0). Генетические дистанции рассчитаны с помощью Евклидово расстояния. Индекс полиморфного содержании (PIC) [16] и эффективное число аллелей (n e ) [17] вычисляли по формулам:
PICi =1-∑ 1=1р ij2
где – частота j паттерна для локуса i и суммирование распространяется на n паттернов:
n e =1/ ∑ 1=1 р ij2
где n e – эффективное число аллелей.
Результаты и обсуждение. В отечественной селекции в настоящее время существует проблема выявления доноров устойчивости к высоковирулентным расам заразихи: F, G, H, распространившимся в последние годы в регионах Юга Российской Федерации. В коллекциях инбредных линий также ограничено число образцов, устойчивых к расе Е. Использование же селекционного материала с доминантным геном Or5 , придающим устойчивость сразу к пяти расам заразихи (A, B, C, D и Е), ускорит создание селекционных линий с комплексной устойчивостью к новым расам заразихи.
Коллективом лаборатории иммунитета и электрофореза подсолнечника ВНИИМК исследуется расовый состав популяций заразихи, поражающей подсолнечник на территории Ростовской и Волгоградской областей, Ставропольского и Краснодарского краёв. Установлено, что наряду с популяциями с преобладанием высоко вирулентных рас, имеются более благополучные, где расы F, G, Н ещё не получили широкого распространения. К ним, например, относятся популяции заразихи Привольненской из Краснодарского края, вирулентность которой обусловлена наличием преимущественно расы Е с незначительной примесью расы F и заразихи, собранной в Краснодарском крае возле станицы Копанская Ейского района. Эта заразиха показала несколько большую вирулентность [18; 19]. Выращивание в таких районах гибридов и сортов, устойчивых к расе Е заразихи, позволит избежать массового поражения посевов этим злостным растением-паразитом и получить качественный урожай семян подсолнечника.
Для маркирования гена Or5 , обусловливающего устойчивость к расе Е заразихи, и паспортизации с помощью молекулярных маркеров селекционного материала подсолнечника отечественного происхождения нами проведена оценка коллекции 32 линий и образцов подсолнечника ВНИИМК, устойчивых и восприимчивых к расе Е заразихи по трем SSR и трем SCAR-маркерам. Как было отмечено выше, данные локусы сцеплены с разной частотой рекомбинации с геном Or5 [12; 13].
Выявлены образцы с контрастными аллельными SSR и SCAR-локусами среди устойчивых и восприимчивых к расе Е заразихи, которые в дальнейшем будут использованы как родительские пары при проведении анализа сцепления и определении частоты рекомбинации гена Or5 с маркерными ДНК локусами у отечественных генотипов подсолнечника (табл. 1).
Таблица 1
SSR и SCAR генотипирование образцов подсолнечника коллекции ВНИИМК, устойчивых и восприимчивых к расе Е заразихи
|
№ |
Происхождение |
SCAR и SSR локусы |
|||||
|
RTS05 |
RTS28 |
RTS40 |
ORS 1036 |
ORS 1112 |
ORS 1021 |
||
|
Устойчивые генотипы |
|||||||
|
1 |
Л1778 |
* - |
- |
370** |
245** |
345** |
250** |
|
2 |
Л1779 |
+* |
- |
- |
245 |
345 |
250 |
|
3 |
ВК 900Б |
+ |
520 |
370 |
245 |
345 |
250 |
|
4 |
ВК 903Б |
+ |
- |
370 |
245 |
345 |
250 |
|
5 |
ВК 905Б |
+ |
520 |
370 |
245 |
345 |
250 |
|
6 |
ВК 934Б |
+ |
520 |
370 |
245 |
345 |
250 |
|
7 |
СЛ-24Б |
- |
520 |
370 |
245 |
345 |
250 |
|
8 |
СЛ-ЗУ-11-4-2 |
+ |
520 |
370/510 |
245 |
345 |
250 |
|
9 |
ВК 653В |
- |
520 |
370 |
245 |
345 |
250 |
|
10 |
СЛ 01 3854В |
+ |
520 |
370 |
245 |
345 |
276 |
|
11 |
ВА 330В |
- |
- |
370 |
245 |
373 |
250 |
|
12 |
ВА 330А |
- |
- |
370 |
245 |
373 |
250 |
|
13 |
ВК 860А |
+ |
- |
370 |
245 |
345 |
250 |
|
14 |
СЛ 01 3828А |
+ |
- |
370 |
245 |
345 |
250 |
|
15 |
СЛ 01 3844А |
+ |
- |
370 |
245 |
345 |
250 |
|
16 |
ВК 653А |
+ |
520 |
- |
245 |
345 |
250 |
|
17 |
ВК 868А |
- |
520 |
370 |
245 |
345 |
250 |
|
18 |
ВК 869А |
- |
520 |
370 |
245 |
345 |
250 |
|
19 |
ВК 871В |
+ |
520 |
- |
245 |
373 |
250 |
|
20 |
ВК 864А |
- |
520 |
370 |
245 |
345 |
250 |
|
21 |
ВК 866А |
+ |
520 |
- |
255 |
345/373 |
250 |
|
22 |
СЛ 01 3856А |
+ |
520 |
370 |
245 |
345 |
250 |
|
23 |
ВК 870А |
+ |
- |
370 |
245 |
345 |
250 |
|
24 |
СЛ 01 3857А |
+ |
520 |
370 |
245 |
345/373 |
250 |
|
25 |
ВК 654В |
+ |
520 |
370 |
245 |
345 |
250 |
|
26 |
СЛ 05 4766В |
+ |
520 |
370 |
245 |
373 |
276 |
|
27 |
ВК678 х Сур I 6 |
+ |
520 |
370/510 |
245 |
345 |
250/276 |
|
Восприимчивые генотипы |
|||||||
|
28 |
ВА77А |
- |
- |
370 |
245 |
345/373 |
250/276 |
|
29 |
ВК678 х Енисей I 4 |
+ |
400 |
- |
245 |
345/373 |
250 |
|
30 |
Л1772 |
- |
400 |
370 |
255 |
345/373 |
250 |
|
31 |
F5 Сирня156058 х ВК680Б |
+ |
520 |
370/510 |
255 |
345 |
250 |
|
32 |
I6СЛ- Лакомка 1 |
+ |
400 |
370 |
255 |
345 |
250 |
*(-) отсутствие, (+) наличие фрагмента ДНК
** - количество пар нуклеотидов ДНК
Для обозначения аллельных вариант использовали количество пар нуклеотидных оснований (пн) фрагмента ДНК. Знаками (+) и (-) обозначали соответственно наличие или отсутствие амплифициро-ванного ДНК-фрагмента. У некоторых генотипов (СЛ013857А, СЛ013854В, Л1772 и др.) были обнаружены гетерозиготные спектры, т.е. спектры, в которых присутствовали компоненты двух разных аллелей. В таблице 1 такие спектры обозначены двумя числами, разделенными косой чертой «/». Наличие у генотипов подсолнечника гетерогенности объясняется, скорее всего, тем, что не все они являются выровненными (рис. 1). Поскольку ДНК для анализа выделялась из смеси растений, то в случае гетерозиготности хотя бы одного из них, возможно попадание в анализируемый образец разнородной ДНК.
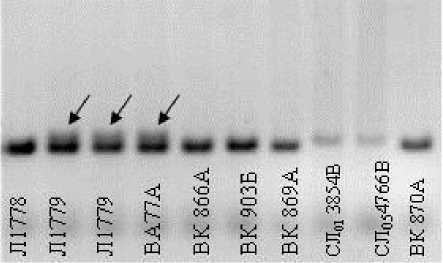
Рисунок 1 – Электрофоретические спектры фрагментов ДНК подсолнечника, амплифи-цированные с праймером ORS 1021. Стрелками обозначены образцы с двумя типами фрагментов ДНК
SCAR-праймеры с высокой специфичностью и воспроизводимостью обычно амплифицируют один фрагмент ДНК. Но у некоторых образцов 2 SCAR-праймера – RTS28 и RTS40, амплифицируют больше одной фракции ДНК, что, вероятно, связано с особенностью изучаемых генотипов подсолнечника.
Кроме маркирования гена Or5 , данная система ДНК-маркеров может применяться для паспортизации и идентификации линий подсолнечника. Сербскими учеными система из 11 SSR-локусов, картированных на той же LG 3 хромосоме, что и Or5 , была использована для паспортизации 20 линий подсолнечника с различиями как по устойчивости к O. cumana , так и по происхождению. Их исследование выявило, что молекулярные профили изученных линий существенно отличаются, но не коррелируют с наличием Or5 гена [11].
Для определения дискриминационного потенциала использованной системы маркеров нами были рассчитаны наблюдаемое и эффективное число аллелей и индекс полиморфного информационного содержания (PIC) (табл. 2).
Таблица 2
Показатели информативности ДНК локусов, использованных в работе
|
Локус |
Наблюдаемое число аллелей |
Эффективное число аллелей |
PIC |
|
RTS05 |
2 |
1,75 |
0,43 |
|
RTS28 |
3 |
2,43 |
0,59 |
|
RTS40 |
3 |
1,50 |
0,36 |
|
ORS 1036 |
2 |
1,21 |
0,17 |
|
ORS1112 |
2 |
1,66 |
0,40 |
|
ORS 1021 |
2 |
1,75 |
0,43 |
|
Среднее |
2,3 |
1,70 |
0,39 |
Среднее число аллелей на локус составило 2,3. Значения эффективного числа аллелей (число аллелей, встречающихся в популяции с равной частотой и при случайном скрещивании обеспечивающих заданную гетерозиготность) варьировали от 1,50 у локуса RTS40 до 2,43 у RTS28, со средним значением 1,70. Значения PIC находились в диапазоне от 0,17 у локуса RTS40 до 0,59 у локуса RTS28. Среднее значение индекса полиморфного информационного содержания для изученной группы генотипов 0,39. Данный индекс позволяет вычислить дискриминационную силу локуса не только по количеству аллелей, но также и по относительным частотам встречаемости этих аллелей и его значения варьируют от 0 (мономорфный локус) до 1 (высокодифференцированный локус с множеством аллелей при равной частоте встречаемости) [16]. Полученные нами величины характеризуют полиморфизм исследованных образцов коллекции как невысокий. Уровень информативности использованной системы как маркерной не позволил дифференцировать все образцы. Проведенный кластерный иерархический анализ показал, что часть образцов имеет сходный генотип (рис. 2). Процент уникальности у изученных образцов (т. е. образцы, имеющие молекулярную формулу, отличную от других) составляет около 59. Частично это связано с тем, что некоторые линии имеют общее происхождение или являются аналогами (например, ВА 330В и ВА 330А). С другой стороны, большинство отобранных образцов подсолнечника объединяет общее качество – устойчивость к расе Е заразихи, а маркеры для паспортизации – локализация в одной группе сцепления.
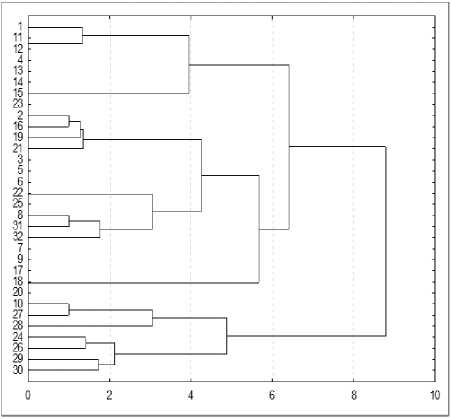
Рисунок 2 – Дендрограмма генетических взаимоотношений между 32 генотипами селекции ВНИИМК на основе SSR и SCAR-маркеров
Обозначения: по оси ординат устойчивые генотипы: 1 – Л1778; 2 – Л1779; 3 – ВК 900Б; 4 – ВК 903Б; 5 – ВК 905Б; 6 – ВК 934Б; 7 – СЛ-24Б; 8 – СЛ-ЗУ-11-4-2; 9 – ВК 653В; 10 – СЛ 01 3854В; 11 – ВА 330В; 12 – ВА 330А; 13 – ВК 860А; 14 – СЛ 01 3828А; 15 – СЛ 01 3844А; 16 – ВК 653А; 17 – ВК 868А; 18 – ВК 869А; 19 – ВК 871В; 20 – ВК 864А;
21 – ВК 866А; 22 – СЛ 01 3856А; 23 – ВК 870А; 24 – СЛ 01 3857А; 24 – ВК 654В; 25 – ВК 654В; 26 – СЛ 05 4766В; 27 – ВК678 х Сур I 6 ; восприимчивые генотипы: 28 – ВА77А; 29 – ВК678 х Енисей I 4 ; 30 – Л1772; 31– F5Сирня156058хВК680Б; 32 – I6СЛ-Лакомка 1; по оси абцисс – генетические дистанции между образцами, выраженные в условных единицах
Результаты кластерного анализа показали, что нет прямой связи с наличием у генотипов подсолнечника гена Or 5 и группировкой в кластеры.
Так, восприимчивые образцы подсолнечника ВА77А, ВК678 × Енисей I 4 , Л1772, сгруппированы в одном кластере, но F5Сирня156058хВК680Б, I6СЛ-Лаком-ка 1 – оказались в другом, с генетической дистанцией между ними 8,8 условных единиц. Различия в происхождении генотипов более существенны, чем наличие признака устойчивости к расе Е заразихи. Вместе с тем, мы обнаружили 2 фактора, которые связывают все изученные образцы из группы устойчивых генотипов. Фрагменты амплифицированной ДНК 400 п.н. у локуса RTS 28 и 255 п.н. у локуса ORS 1036 встречались лишь у трех восприимчивых генотипов и ни у одного из 27 устойчивых.
Таким образом, с помощью 3 SSR и 3SCAR локусов нами были паспортизированы 32 генотипа подсолнечника коллекции ВНИИМК, устойчивых и восприимчивых к расе Е заразихи. Выявлены образцы подсолнечника с контрастными аллельными SSR и SCAR локусами, среди устойчивых и восприимчивых к расе Е заразихи, что в дальнейшем позволит маркировать ген Or5 в материале отечественной селекции. Уникальность коллекции составила 59 %.
Исследования выполнены при финансовой поддержке РФФИ, грант № 11-0496502.
Авторы выражают признательность сотрудникам отдела селекции гибридного подсолнечника Волгину В.В., Савченко В.Д. и заведующему лабораторией создания исходного селекционного материала Гончарову С.В. за предоставление селекционного материала.


