Структура микробиома в установках замкнутого водоснабжения и их связь с возникновением инфекционной патологии осетровых рыб
Автор: Сергалиев Н.Х., Какишев М.Г., Залялов И.Н., Гинаятов Н.С., Нуржанова Ф.Х.
Статья в выпуске: 3 т.243, 2020 года.
Бесплатный доступ
В статье приведены результаты учета температурного режимами воды в УЗВ, а также анализа заболеваемости и летальности при инфекционной патологии, вызываемой условнопатогенной микрофлорой, среди осетровых рыб, на основании которых выявлена закономерность возникновения патологий в замкнутых условиях. Определен микробиомный состав всех этапов очистки оборотной воды в системе УЗВ, используемой при выращивании осетровых рыб, с применением методов метагеномики. Представлено научное обоснование влияния коррекции сезонных биоритмов, микробной структуры в системе УЗВ на заболеваемость осетров псевдомонозом. В ходе таксономического анализа полученных библиотек определены наиболее превалирующие доминанты микробных сообществ, также при проведении попарных сравнений сходных фаз очистки в различных резервуарах установлены специфические таксоны. Полученные данные демонстрируют важный феномен: различия по структуре микробиомов, как между фазами очистки воды в пределах одного резервуара, так и между аналогичными показателями при различных температурных режимах, что подчеркивает важность анализа микробиоты в условиях промышленной аквакультуры, так как ее влияние может оказаться существенным на здоровье и продуктивность выращиваемых рыб.
Осетровые, микробное обсеменение, микробиом, метагеномика, псевдомоноз, установка замкнутого водоснабжения
Короткий адрес: https://sciup.org/142226014
IDR: 142226014 | УДК: 575.17:597.423:639.31 | DOI: 10.31588/2413-4201-1883-243-3-237-245
Текст научной статьи Структура микробиома в установках замкнутого водоснабжения и их связь с возникновением инфекционной патологии осетровых рыб
В мировой практике все большую популярность набирает техногенный способ выращивания осетровых рыб и их гибридов в условиях установок замкнутого водоснабжения (УЗВ), в которых при создании наиболее оптимальных условий для рыб уменьшается период восстановления организма после прижизненного сцеживания икры, что позволит увеличить объем получаемой продукции по сравнению с естественной добычей. Развитие данного альтернативного способа позволяет сохранить и восстановить запасы осетровых рыб в естественных водоемах путем снижения промыслового давления на их популяции [2, 8].
Аквариальный комплекс представляет собой многокомпонентную систему, включающую рабочие блоки (посадочные бассейны, механическая и биологическая фильтрации, обеззараживание и озонирование оборотной воды). Это таит в себе серьезную опасность в виде накопления потенциальных возбудителей инфекции, следовательно, в промышленных условиях не всегда удается контролировать уровень обсеменения микроорганизмами, увеличение концентрации которых в обитаемой среде ведет к возникновению и распространению среди осетров патологии инфекционного характера [9, 11, 12].
Микробное разнообразие на различных этапах фильтрации оборотной воды в системе УЗВ имеет широкий спектр, которое варьирует в зависимости от множества факторов. Плотность посадки выращиваемых гидробионтов, загрязнение воды отходами жизнедеятельности рыб и остатками корма, рН воды, а также ее химические показатели (уровень содержания нитратов, нитритов и т.д.), могут влиять на структуру бактериального сообщества [3, 15]. Кроме того, значимую роль в формировании микробного состава играет температура воды в УЗВ, при грамотном управлении которой оптимизируется процесс получения икры [5]. В связи со специфичностью формирования микробной струк- туры в зависимости от вышеизложенных факторов возрастает роль изучения бактериологического состава на различных этапах температурного режима в системе УЗВ, что послужило целью исследований.
Материал и методы исследований. Научно-исследовательская работа выполнена в аквариальном комплексе Западно-Казахстанского аграрнотехнического университета имени Жангир хана.
Объектом для исследований послужили резервуары системы УЗВ, предназначенные для выращивания осетровых рыб, а в качестве исходного материала использованы образцы из плавающих нагрузок биологического фильтра (Sh), кварцевого фильтра (K), осадка из отстойника (О), из посадочного бассейна (В) до и после финальной очистки (F), взятые при температуре воды в системе 8 °С в период искусственной зимовки (1) и при оптимальной температуре содержания – 18 °С (2).
Для установления закономерностей и сезонной динамики возникновения инфекционной патологии среди осетров, выращиваемых в условиях УЗВ, произведен учет за регулировкой температуры воды при «искусственной зимовке» для получения икры. Для оценки интенсивности эпизоотического процесса проводился анализ заболеваемости и летальности среди осетров в исследуемый период. Физиологическое состояние оценивали с помощью клинического осмотра рыб, при котором учитывались основные показатели (изменения в поведении рыб, снижение аппетита и дальнейшее прекращение питания), а также проявление клинических признаков: образование язвенных поражений на различных участках тела, воспаление ануса, экзофтальмия и т.д. [1].
Выделение из образцов бактериальной ДНК было произведено согласно инструкции производителя набором реактивов (NucleoSpin) компании MACHEREY-NAGEL (Германия). Для приготовления ампликонных библиотек методом ПЦР в каждой пробе проводили амплификацию с универсальными праймерами на вариабельный участок гена 16S рРНК v3-v4, специфичными для широкого круга микроорганизмов, включая бактерии и археи (F515; GTGCCAGCMGCCGCGGTAA и R806; GGACTACVSGGGTATCTAAT; Batesetal., 2010).
ПЦР была проведена в 15 мкл реакционной смеси, содержащей 0,5-1,0 единицу активности полимеразы PhusionHotStart II High-Fidelitypolymerase и 1X Phusionbuffer (ThermoFisherScientific), по 5 пкМ прямого и обратного праймеров, 10 нг ДНК-матрицы и 2 нМ каждого dNTP (LifeTechnologies). Смесь денатурировали при 94 °С 1 мин, после чего следовало 35 циклов: 94 °С – 30 с, 50 °С – 30 с, 72 °С – 30 с.
Финальная элонгация проводилась при 72 °С 3 мин. ПЦР продукты очищали по рекомендованной Illumina методике с использованием AM Pure XP (BeckmanCoulter). Дальнейшая подготовка библиотек выполнена в соответствии с инструкцией производителя MiSeq Reagent Kit Preparation Guide (Illumina). Библиотеки секвенировали в соответствии с инструкцией изготовителя на приборе IlluminaMiSeq с использованием набора реактивов MiSeq® ReagentKit v3 (600 cycle) с двусторнним чтением (2*300 н).
Таксономический анализ нуклеотидных последовательностей ампликонных библиотек осуществляли с помощью компьютерного программного модуля QIIME (версия 1.7.0).
При анализе проводили распределение библиотек по идентификаторам, проверку секвенирования и фильтрацию нуклеотидных последовательностей, объединение последовательностей в операционные таксономические единицы (ОТЕ) с использованием 97% порога сходства, выравнивание нуклеотидных последовательностей методом Unclust. При таксономической идентификации ОТЕ использовали банк данных RDP (http://rdp.cme.msu.edu/) .
Результаты исследований. В ходе изучения закономерностей возникновения инфекционной патологии среди осетровых и учета терморегуляции воды в системе УЗВ установлено, что основные вспышки бактериозов приходятся в периоды так называемых «искусственных зимовок», когда для оптимизации работы эндокринной системы в преднерестовый период, рыб содержали в специально оборудован- воды до 8 ºС постепенно, в течение десяти дней, на 1 ºС в сутки. При 8 ºС рыб выдерживали в течение 30 дней, затем постепен-
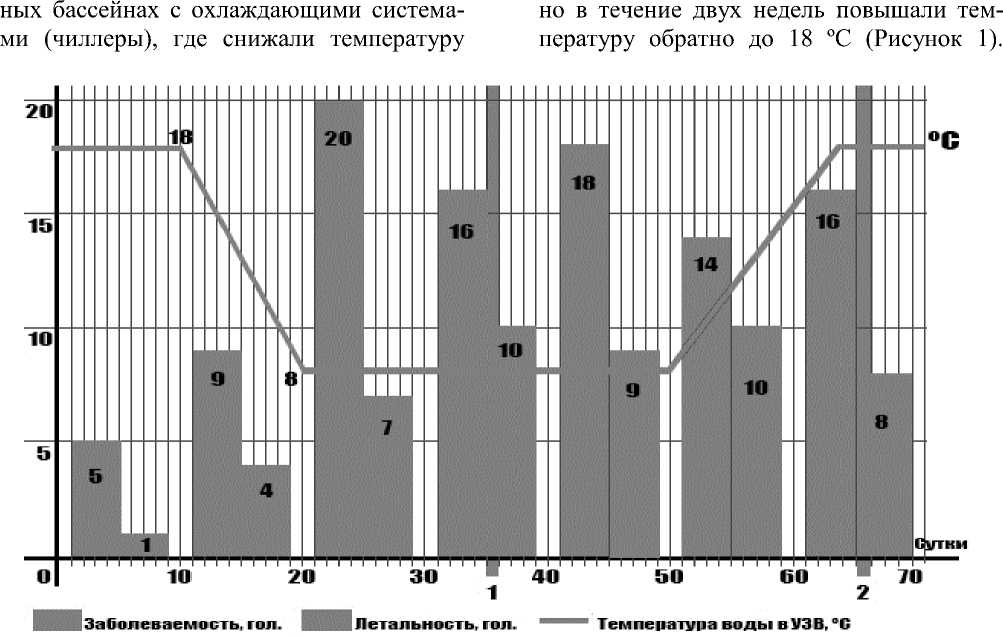
Рисунок 1 – Влияние коррекции сезонных осетровых рыб, выращиваемых в УЗВ биоритмов на заболеваемость псевдомонозом
При анализе заболеваемости псев-домонозом установлено увеличение данного показателя при снижении температуры водной среды на 75 % по сравнению с периодом температурного оптимума. Далее наблюдается снижение заболеваемости, связанное с адаптацией осетров к условиям «искусственной зимовки», но увеличение уровня летальности в связи с переходом болезни в генерализованную форму. Возникновение псевдомоноза в условиях УЗВ среди осетров наблюдалась также после нормализации условий содержания до 18 °С, это объясняется снижением общей резистентности организма осетров после прижизненного сцеживания икры.
Диагноз псевдомоноз установлен на основании комплекса бактериологических исследований; эпизоотологических данных, выявленных клинических признаков у рыб в виде язвенных поражений на поверхности кожного покрова (Рисунок 2); патологоанатомических изменений, таких как одно- или двусторонняя экзофтальмия, спленомегалия, множественные геморрагии на желудочно-кишечном тракте; результатов биологической пробы на естественно восприимчивых животных.
Таким образом, вспышки псевдо-моноза напрямую связаны со снижением температуры воды в системе УЗВ, где активизируются бактерии-психрофилы, а род Pseudomonas как раз является ярким представителем данной группы, служащие этологией псевдомоноза рыб [10].
Для изучения микрофлоры в системе УЗВ образцы исходного материала взяты на 35 день с начала опытов – в период искусственной зимовки при 8 °С (1) и на 5 день после нормализации температуры содержания рыб до 18 °С (2), из которых была выделена ДНК, качество выделения было проверено электрофоретически. Далее были получены ампликоны гена 16S рРНК.
Выход ДНК составил 50 мкл с концентрацией 20-50 нг/мкл, а количество нуклеотидных последовательностей на библиотеку составило от 10 до 20 тыс. После удаления минорных компонентов количество выявленных прокариотных таксонов составило 352. Доминантами микробного сообщества во всех случаях оказались представители фил Proteobacteria, Firmicutes, Bacteroidetes, Fusobacteria, Actinobacteria, а также существенная фракция неклассифицируемых прокариот.
Следует отметить, что в микробных сообществах резервуаров и линий очистки также были выявлены представители ар-хеотной филы Thaumarchaeota, это касается в особенности микробиоты ила из биофильтров, где ее доля может составлять до 5%.
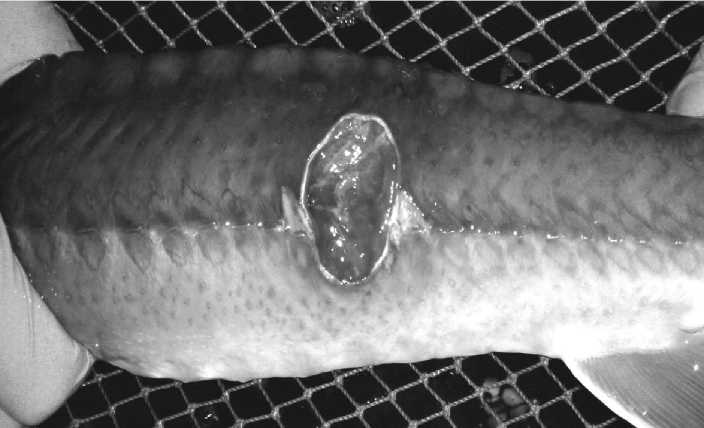
Рисунок 2 – Язвенное поражение в дорсальной части тела осетра
Для определения отношений род-ства/сходства между сообществами был выполнен анализ β-разнообразия с использованием метрики сходства сообществ по Брэю-Кертису, по результатам которого установлены несколько принципиально важных феноменов: наибольшая степень различий выявлена между различными температурными режимами, так как при них имеются четкие отличия в каждом звене очистки оборотной воды. Например, микробные сообщества из плавающих нагрузок биофильтров имеют сходные или даже большие различия между периодом искусственной зимовки и оптимумом, чем с другими стадиями очистки. Это обстоятельство подчеркивает важность анализа микробиоты в ходе промышленного производства, так как ее влияние может оказаться существенным на здоровье и продуктивность рыб.
Очевидные различия по структуре микробных сообществ между различными фазами очистки воды – наиболее обособленное положение, и тем самым, наиболее специфичное микробное сообщество ха- рактерно для отстойников, где отмечено повышенное содержание архей. Вместе с тем, микробные сообщества бассейнов, кварцевых фильтров и финальной стадии очистки имеют существенное сходство между собой (хотя и имеют ясные различия) и, по всей видимости, различаются лишь в количественных показателях.
В таблице 1 приведены основные показатели микробного разнообразия сообществ (усредненные по повторностям). В соответствии с приведенными данными существенные особенности коэффициентов разнообразия демонстрируют микробные сообщества отстойников, в которых детектированы самые низкие значения по всем коэффициентам.
Для того чтобы более детально проанализировать таксономические особенности резервуаров, были проведены попарные сравнения сходных фаз очистки в различных резервуарах, в ходе которых установлено: 1. Специфическими таксонами, преобладающими в посадочных бассейнах в период «искусственной зимовки» явля- ются Pseudomonas, Cetobacterium, Lactococcus; при температурном оптимуме – неклассифицируемые прокариоты, Xanthomonadaceae и Flavobacterium. Оче- видно, что есть еще существенная фракция минорных компонентов, представляющих собой специфические таксоны для каждого из этапов фильтрации оборотной воды;
Таблица 1 – Коэффициенты α-разнообразия микробных сообществ
|
Образцы |
Филогенетическое разнообразие |
Видовое разнообразие |
Универсальный коэффициент |
«Ровность» распределения |
||||
|
8 °С |
18 °С |
8 °С |
18 °С |
8 °С |
18 °С |
8 °С |
18 °С |
|
|
Посадочные бассейны (В) |
80,90 |
72,97 |
824,75 |
808,45 |
7,66 |
7,48 |
0,99 |
0,98 |
|
Финальная очистка (F) |
80,01 |
86,65 |
748,17 |
984,78 |
7,78 |
7,90 |
0,99 |
0,99 |
|
Кварцевый фильтр (K) |
83,52 |
62,60 |
901,16 |
659,13 |
7,64 |
7,28 |
0,99 |
0,98 |
|
Осадок из отстойника (О) |
32,69 |
43,14 |
298,45 |
416,11 |
5,18 |
6,46 |
0,91 |
0,96 |
|
Нагрузки биологического фильтра (Sh) |
87,11 |
71,32 |
968,05 |
843,03 |
8,22 |
7,85 |
0,99 |
0,99 |
-
2. После финальной очистки оборотной воды в резервуарах при общем сходстве сообществ имеются некоторые отличия, например, более высокая доля архейного таксона Nitrocosmicus при температуре 18°С. Это различие, хотя и в меньшей степени, сохраняется и после финальной очистки. Данный таксон относится к археям, окисляющим аммоний, и высокое содержание данного компонента в исследуемом бассейне установлено в ходе гидрохимического анализа (Таблица 2);
-
3. При сравнении микробных сообществ оборотной воды в бассейнах установлена высокая степень схожести с разницей высокого титра Pseudomonas и Thiothrix в бассейне при снижении температуры воды до 8 °С, в то время как
Aeromonas и Cetobacterium преобладали при нормализации температуры воды. Аналогичные соотношения выявлены и в структуре микробиома на этапе обеззараживания оборотной воды.
Полученные результаты свидетельствуют, что изменяется таксономический состав воды в резервуарах в процессе очистки, т.е. сопоставлены исходная и финальная стадии очистки по резервуарам (приведены доминантные прокариотные таксоны, доля которых уменьшается в процессе очистки). Такая специфичность резервуаров, очевидно, связана с исходной разнородностью микробных сообществ. Выше уже были приведены различия между резервуарами.
Таблица 2 – Результаты мониторинга уровней гидрохимических показателей в УЗВ
|
Участки УЗВ |
Средний показатель |
|||||||
|
В период «искусственной зимовки» |
При температурном оптимуме |
|||||||
|
NH 4 |
NO 2 |
NO 3 |
PO 4 |
NH 4 |
NO 2 |
NO 3 |
PO 4 |
|
|
Посадочные бассейны (В) |
0,3 |
0,1 |
20 |
1 |
0,2 |
0,09 |
20 |
2 |
|
Финальная очистка (F) |
0,4 |
0,1 |
35 |
5 |
0,8 |
0,09 |
35 |
2 |
|
Кварцевый фильтр (K) |
0,1 |
0,09 |
45 |
2 |
0,3 |
0,09 |
40 |
5 |
|
Осадок из отстойника (О) |
0,4 |
0,08 |
15 |
5 |
0,1 |
0,09 |
15 |
5 |
|
Биологический фильтр (Sh) |
0,2 |
0,06 |
15 |
2 |
0,1 |
0,09 |
35 |
2 |
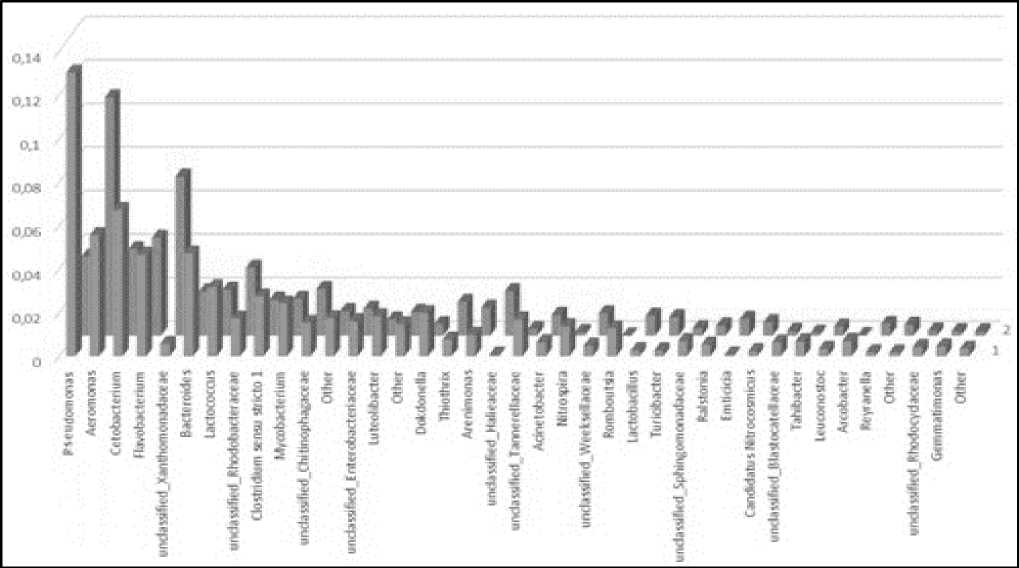
Рисунок 3 – Сравнение микробиомов в период «искусственной зимовки» (1) и при температурном оптимуме в УЗВ (2)
Из рисунка 3 следует, что в структурную картину включены только те таксоны, по которым выявлена максимальная разница в различных температурных режимах в УЗВ. Среди таксонов, численность которых существенно различается в периоды снижения и нормализации температуры воды в УЗВ в ходе настоящего исследования стоит отметить бактерии рода Pseudomonas. При оптимальных условиях содержания рыб в УЗВ бактерии рассматриваемого рода участвуют в процессе нитрификации и самоочищения воды, однако при снижении температуры воды в системе их концентрация возрастает до 5-6 раз, плюс период «акклиматизации» у осетров, что в конечном в итоге ведет к вспышке и массовому распространению бактериоза [4, 6, 13].
Заключение. По результатам проведенных исследований выявлена закономерность возникновения инфекционной патологии, вызываемой условнопатогенной микрофлорой (псевдомоноз) среди осетровых рыб, выращиваемых в условиях УЗВ. Так, основные вспышки псевдомоноза приходятся на период «искусственных зимовок», при снижении температуры водной среды до 8 ºС, где концентрация этиологии бактериоза превышает допустимые показатели микробного обсеменения [7, 14].
Данное влияние коррекции сезонных биоритмов на заболеваемость осетров псевдомонозом объясняется результатами определения микробной структуры на различных этапах фильтрации оборотной воды и самих посадочных бассейнов, где в основном установлено доминирование сообществ, в частности родов Pseudomonas, Proteobacteria, Firmicutes, Bacteroidetes, Fusobacteria, Actinobacteria, а также присутствует существенная фракция неклас-сифицируемых прокариот. В микробных сообществах резервуаров и линий очистки также были выявлены представители ар-хеотной филы Thaumarchaeota. В ходе изучения различий в структурах микробных сообществ между фазами очистки воды выявлено специфичное микробное сообщество характерное для отстойников – Pseudomonas, Cetobacterium, Lactococcus – в период «искусственной зимовки», и не-классифицируемые прокариоты, Xan-thomonadaceae и Flavobacterium – при температурном оптимуме в системе УЗВ. Кроме того, определена доля архейного таксона Nitrocosmicus – на стадии финаль- ной очистки при оптимальной температуре она оказалась выше, чем при низкой температуре среды в системе УЗВ.
В совокупности полученные данные демонстрируют целый ряд важных феноменов: различия по структуре микробиомов, как между фазами очистки воды в пределах одного резервуара, так и между сходными фазами очистки между различными резервуарами.
Следовательно, мониторинг над состоянием естественной микробиомы в УЗВ с помощью метагеномного анализа, позволяет определить вариацию микробного состава в системе в зависимости от типов фильтрации, температурных режимов и т.д., оценить уровень риска возникновения инфекционной патологии, вызываемой группой условно-патогенной микрофлоры, что позволяет разработать, и корректировать лечебно-профилактические мероприятия.
Исследовательская работа выполняется в рамках бюджетной программы 217 «Развитие науки», по подпрограмме 102 «Грантовое финансирование научных исследований», по приоритету : 4. Науки о жизни и здоровье, по подприоритету: 4.1 Фундаментальные и прикладные исследования в области биологии. Проблемы экологии. Оценка состояния и проблемы сохранения биоразнообразия растительного и животного мира Республики Казахстан. Научные основы рационального использования и воспроизводства биологических ресурсов. В рамках проекта АР05135817 «Применение методов метагеномики в оценке состояния микробиома осетровых видов рыб и биофильтров установок замкнутого водоснабжения»
Резюме
В статье приведены результаты учета температурного режимами воды в УЗВ, а также анализа заболеваемости и летальности при инфекционной патологии, вызываемой условнопатогенной микрофлорой, среди осетровых рыб, на основании которых выявлена закономерность возникновения патологий в замкнутых условиях.
Определен микробиомный состав всех этапов очистки оборотной воды в системе УЗВ, используемой при выращивании осетровых рыб, с применением методов метагеномики. Представлено научное обоснование влияния коррекции сезонных биоритмов, микробной структуры в системе УЗВ на заболеваемость осетров псевдомонозом. В ходе таксономического анализа полученных библиотек определены наиболее превалирующие доминанты микробных сообществ, также при проведении попарных сравнений сходных фаз очистки в различных резервуарах установлены специфические таксоны.
Полученные данные демонстрируют важный феномен: различия по структуре микробиомов, как между фазами очистки воды в пределах одного резервуара, так и между аналогичными показателями при различных температурных режимах, что подчеркивает важность анализа микробиоты в условиях промышленной аквакультуры, так как ее влияние может оказаться существенным на здоровье и продуктивность выращиваемых рыб.
Список литературы Структура микробиома в установках замкнутого водоснабжения и их связь с возникновением инфекционной патологии осетровых рыб
- Бормотова, С.В. Санитарное состояние аквакультуры осетровых и среды их обитания / С.В. Бормотова, Л.В. Ларцева, И.Ю. Рогаткина // Рыбное хозяйство. Серия: Аквакультура. - М.: ВНИЭРХ, 1995. - Вып. 2. - С. 1-7.
- Гинаятов, Н.С. Выявление в участках УЗВ резервуаров возбудителя инфекционной патологии осетровых рыб / Н.С. Гинаятов, И.Н. Залялов, Н.Х. Сергалиев // Материалы международной научнопрактической конференции студентов, аспирантов и молодых ученых "Знания молодых для развития ветеринарной медицины и АПК страны". - 2016. - С.49-50.
- Гинаятов, Н.С. Сравнительная оценка эффективностей методов обеззараживания воды в установках замкнутого водоснабжения / Н.С. Гинаятов, И.Н. Залялов, Г.Г. Абсатиров, М.Г. Какишев, А.М. Жунусов // Ученые записки Казанской государственной академии ветеринарной медицины имени Н.Э. Баумана. - 2017. -№ 232 (IV). - С.43-46.
- Гинаятов, Н.С. Идентификация возбудителя инфекционной патологии осетровых рыб в условиях УЗВ / Н.С. Гинаятов, И.Н. Залялов, Г.Г. Абсатиров // Материалы международной научной конференции "Современные проблемы ветеринарной и аграрной науки и образования", посвященной 150-летию образования Государственной ветеринарной службы России. - 2016. - С.42-45.
- Голованов, В.К. Температура и здоровье рыб. Этиологические, физиологобиохимические и иммунологические аспекты / В.К. Голованов // Расширенные материалы IV Международной конференции "Проблемы патологии, иммунологии и охраны здоровья рыб и других гидробионтов", - М.: Борок. - 2015. - С. 11-19.
- Гридина, Т.С. Особенности микрофлоры биологической системы установки замкнутого водообеспечения // Материалы Международной научной конференции "Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России". - Ростов н/Д. - 2014. - С. 108-109.
- Казарникова, А.В. Заболевания осетровых рыб при искусственном воспроизводстве и товарном выращиваний / А.В. Казарникова, Е.В. Шестаковская. -Апатиты: Изд-во Кольского научного центра РАН. - 2005. - С. 179.
- Пономарева, Е.Н. Состояние и особенности товарной аквакультуры в Южном макрорегионе России / Е.Н. Пономарева, М.Н. Сорокина, В.А. Григорьев // Материалы Международной научной конференции "Актуальные вопросы рыбного хозяйства и аквакультуры бассейнов южных морей России". - Ростов н/Д. - 2014. -С. 232-236.
- Arndt, D. METAGEN assist: a comprehensive web server for comparative metagenomics / D. Arndt, J. Xia, Y. Liu [et al.] // Nucleic Acids Research. - 2012. - V. 40 (1). - P. 88-95.
- Brunetti, R. Pseudomonas fluo-rescens infection in farmed Siberian sturgeon (Acipencer baerii) / R. Brunetti, F. Gasparri, S. Marturano [et al.] // Ittiopatologia. - 2006. - V. 3. - Р. 221-226.
- Donkin, M.J. Bulking in aerobic biological systems treating dairy processing wastewaters / M.J. Donkin // Int. J. Dairy Technol. - 1997. - V. 50. - P. 67-72.
- Edgar, R.C. Search and clustering orders of magnitude faster than / R.C. Edgar // BLAST. Bioinformatics. - 2010. - V. 26(19). - P. 2460-2461.
- Gulsen, T.A Study on bacterial hemorrhagic septicemia in farmed young Russian sturgeon in Turkey (Acipenser guel-denstaedtii) / T. Gulsen, T. Akayli, J. Korun [et al.] // Journal of Fisheries & Aquatic Sciences. - 2010. - V. 25(1). - P. 19-27.
- Julia, W.P. Major bacterial diseases in aquaculture and their vaccine development / W.P. Julia, P.H. Klesius // CAB Reviews. - 2012. - V. 7 (48). - P. 1-16.
- Hu, L. Study on performance characteristics of SBR under limited dissolved oxygen / L. Hu, J. Wang, X. Wen [et al.] // Process Biochemistry. - 2005. - V. 40 (1). -P. 293-296.


