Структура нарушений обмена железа у больных лимфомами в дебюте заболевания и в динамике терапии
Автор: Бабаева Татьяна Николаевна, Маринкин Игорь Олегович, Серегина Ольга Борисовна, Мезит Елена Викторовна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.32, 2017 года.
Бесплатный доступ
Нарушения обмена железа, проявляющиеся в виде развития дефицитной анемии или формирования избытка железа, способны модифицировать риск развития злокачественных новообразований и более агрессивный их клинический фенотип. В контексте изучения связи патологии обмена железа и канцерогенеза было обследовано 98 пациентов со злокачественными лимфомами. Структура нарушений обмена железа в обследуемой группе в дебюте заболевания была представлена несколькими вариантами: опухолеассоциированным повышением уровня ферритина - в 32,6% случаев, анемией хронических заболеваний - в 41,8% наблюдений, латентным дефицитом железа - в 14,2% и железодефицитной анемией в 2,1% случаев. В процессе химиотерапии было отмечено изменение структуры нарушений феррокинетики за счет прироста доли лиц с анемией, индуцированной полихимиотерапией до 38,8%, тогда как другие варианты нарушения обмена железа встречались с меньшей частотой (анемия хронических заболеваний - в 18,38% случаев, опухолеассоциированное повышение уровня ферритина - в 18,4% и латентный дефицит железа в 10,2% наблюдений).
Анемия, анемия хронических заболеваний, лимфома, феррокинетика, ферритин, гиперферритинемия, варианты нарушений обмена железа, абсолютный дефицит железа, функциональный дефицит железа
Короткий адрес: https://sciup.org/14920208
IDR: 14920208 | УДК: 616.15;
Текст научной статьи Структура нарушений обмена железа у больных лимфомами в дебюте заболевания и в динамике терапии
Нарушения обмена железа – один из наиболее распространенных вариантов патологии в популяции. Наиболее часто изменение метаболизма железа проявляется течением анемии, которая может быть изолированным нарушением, а может и сопровождать течение опухолевого, инфекционно-воспалительного или аутоиммунного заболевания. Частота анемического синдрома как ос- ложнения широко варьирует и может достигать от 30 до 90% в зависимости от заболевания и вариантов сопутствующего ему лечения [9].
Известно, что для злокачественных новообразований характерно сочетание двух и более патогенетических механизмов в развитии анемии, таких как перераспределение железа, абсолютный дефицит железа, гемолиз, недостаточность костномозгового кроветворения при метастазировании. Различные нарушения метаболизма железа наиболее актуальны для гематологических нозологий, не имеющих первичной костномозговой локализации, тогда как при острых лейкозах, миелодиспластических синдромах анемия зачастую выступает в качестве самостоятельного синдрома заболевания [16].
Отрицательные эффекты анемии и гипоксии на течение опухолевого заболевания известны: усиление инвазивного метастатического и ангиогенного потенциала, повышение клональной гетерогенности опухоли и снижение возможностей восстановления клеточного повреждения, усиление клеточной пролиферации и нарушение фармакодинамики химиотерапевтических агентов [1]. Все эти эффекты связаны и с дефицитом железа – абсолютным или функциональным. С другой стороны, увеличение пула железа также неблагоприятно. Способность приобретать и терять электроны, которая делает железо активным ферментативно, также позволяет ему принимать участие в реакциях генерации свободных радикалов, что влияет не только на липиды и белковые структуры, но также вызывает окислительное повреждение ДНК и является потенциально мутагенным фактором [15]. Реактивные радикалы кислорода и азота провоцируют эпигенетические изменения, приводя к мутациям и инактивации тумор-супрессорных генов или активации протоонкогенов, что может индуцировать бесконтрольную клеточную пролиферацию, приводя к развитию злокачественной опухоли [5, 13].
Таким образом, патология метаболизма железа является одним из аспектов канцерогенеза [14], что делает актуальным изучение структуры нарушений феррокинетики при заболеваниях системы крови.
Цель исследования: на основе изучения клинико-биохимических особенностей феррокинетики у пациентов с лимфомами выделить основные варианты нарушения обмена железа в исследуемой группе в дебюте заболевания и в динамике терапии.
Материал и методы
В качестве основной группы пациентов с гемобластозами обследовано 98 пациентов со злокачественными лимфомами, госпитализировавшихся в специализированное отделение гематологии ГБУЗ НСО “Городская клиническая больница № 2” (Городской гематологический центр) г. Новосибирска в период 2012–2014 гг.
Средний возраст пациентов составил 50,68±17,1 лет, по полу распределение было следующим: 48 (49%) мужчин, 50 (51%) женщин. В анализируемой группе диагноз В-клеточной неходжкинской злокачественной лимфомы (НХЗЛ) высокой степени злокачественности (диффузная В-крупноклеточная лимфома у 86,1% больных и лимфо- ма зоны мантии у 13,9% лиц с НХЗЛ) был установлен у 72 (73,5%) пациентов, и у 26 (26,5%) больных диагностирована лимфома Ходжкина (ЛХ). У подавляющего большинства пациентов (77,5%) регистрировались продвинутые (III–IV) стадии заболевания. При оценке индекса IPI неблагоприятный прогноз имели 56,9% больных НХЗЛ. Те или иные симптомы опухолевой интоксикации в общей группе пациентов с лимфомами имели две трети обследованных – 66,3%.
Все пациенты, включенные в исследование, получили от 4 до 6 курсов полихимиотерапии (ПХТ). В терапии НХЗЛ использовались протоколы R-CHOP, R-CHOEP, R-DHAP, в терапии лимфомы Ходжкина – BEACOPP-14, BEACOPP-21, BEACOPP-escalated.
Обязательный комплекс исследований включал стандартное клиническое и лабораторно-инструментальное обследование, в том числе исследование показателей миелограммы, гистологическое исследование костного мозга и биоптатов лимфоузлов, иммуноморфологичес-кое иссследование, компьютерную томографию костного мозга [7]. Обследование проводилось дважды: в дебюте заболевания до начала специфической терапии и после 4–6 курсов ПХТ в период достижения частичной или полной клинико-гематологической ремиссии.
Для определения патогненетических вариантов анемического синдрома у всех пациентов исследовались показатели феррокинетики (уровень железа сыворотки (СЖ), общая и латентная железосвязывающая способность сыворотки (ОЖСС/ЛЖСС), коэффициент насыщения трансферрина (КНТ), уровень ферритина, гепсиди-на, растворимых рецепторов трансферрина (sTfR), эритропоэтина сыворотки (ЭПО), содержание витамина В12 и фолиевой кислоты.
Для количественного определения гепсидина, ферритина растворимых рецепторов трансферрина (sTfR), эритропоэтина (ЭПО) в сыворотке крови использовался “сэндвич” – вариант твердофазного иммуноферментно-го анализа (ИФА). Определение концентрации ферритина и sTfR выполнено при помощи наборов реагентов для количественного ИФА “Ферритин-ИФА-БЕСТ” и “Растворимый рецептор трансферрина-ИФА-БЕСТ” компании ЗАО “Вектор-Бест” (Россия, п. Кольцово). Для количественного определения биологически активной формы человеческого ЭПО в сыворотке крови применялась тест-система “Biomerica EPO ELISA” (США). Для количественного определения гепсидина-25 в сыворотке крови методом ИФА без экстракции применялась тест-система “Peninsula Laboratories International, Inc.” (США). Для оценки концентрации гепсидина сыворотки крови в качестве критерия нормативных значений были использованы данные группы контроля. На момент забора материала никто из пациентов, участвующих в исследовании, не получал терапию препаратами железа и ЭПО. Группу контроля составили 18 здоровых добровольцев, имеющих аналогичное гендерное и возрастное распределение.
При оценке количественных признаков использовали вычисление средней арифметической (M) и ее ошибки (m), использовались методы корреляционного анализа данных – коэффициент корреляции Пирсона и непараметрический коэффициент корреляции Спирмена. Для определения достоверности различий средних для двух выборок, имеющих нормальное распределение, применялся t-критерий Стъюдента. Для анализа независимых выборок с распределением отличным от нормального применялся критерий χ2, при ожидаемых значениях менее 5 – тест Фишера. Сравнение независимых малых выборок проводили с помощью теста Манна–Уитни. Для оценки различий между двумя зависимыми выборками использовался Критерий Уилкоксона. Взаимодействие между независимыми категориальными переменными оценивалось методом таблиц сопряженности, сравнительный анализ проводился также с помощью точного теста Фишера или теста χ2. Результаты считались статистически значимыми при р<0,05.
Учитывая общность полученных результатов, группы пациентов с неходжкинскими злокачественными лимфомами и лимфомой Ходжкина были объединены и оценивались совместно. Больные с характерными чертами дефицита витамина В12 и гемолиза не включались в исследование на этапе скрининга.
Результаты и обсуждение
При анализе особенностей гемограммы больных до начала специфической терапии анемия была выявлена у 43 (43,9%) первичных больных лимфомами. При этом анемия легкой степени регистрировалась у 37 (86%) больных, средней степени у 3 (7%) пациентов и тяжелой степени также у 3 (7%) человек. Выявленные анемии носили нормохромный характер у 21 (48,8%) больных (MCH30,2±2,16) и у 22 (51,2%) пациентов была определена гипохромная анемия (MCH20,4±4,54 пг). Гиперхром-ная анемия не определялась ни в одном случае. Нормальные показатели гемоглобина имели 55 (56,1%) пациентов до начала терапии.
Исследование показателей обмена железа в дебюте заболевания выявило несколько характерных вариантов нарушения феррокинетики. Среди пациентов с анемией преобладающим вариантом была анемия хронических заболеваний (АХЗ), в структуре которой в 16,3% (n=5) случаев встречался вариант абсолютного дефицита железа, в 83,7% (n=36) – функционального дефицита железа. Принципиальная разница между абсолютным (истинным) или функциональным дефицитом железа состоит в том, что при абсолютном дефиците назначение препаратов железа приводит к быстрому его потреблению эритроидными клетками-предшественниками и активирует эритропоэз, что приводит к компенсации анемии. У пациентов с функциональным дефицитом железа такое назначение не будет эффективным, несмотря на то, что имеются признаки нехватки железа. Ранее считалось, что это принципиально разные состояния, но в настоящее время существуют мнения, что они часто сочетаются, т.е. наличие функционального дефицита железа не исключает наличия истинного, и наоборот [8].
В числе характерных признаков АХЗ с абсолютным дефицитом железа (n=5) было сочетание критериев АХЗ в виде тенденции к росту уровня гепсидина (62,4±16,2 нг/мл, p<0,001 в сравнении с группой контроля), субнормального уровня ЭПО (64,12±12,34 мЕд/мл, p<0,005), присутствие нормальных запасов железа, измеренных по сывороточному ферритину (114,9±81,79 нг/мл), и критериев дефицита железа. На наличие абсолютного дефицита железа указывали изменения эритроцитарных индексов (MCV 68,14±4,8 фл, MCH 24,7±2,43 пг), показателей циркулирующего пула железа: sTfR –7,2±6,48 мкг/мл (p<0,05), КНТ – 11±4,24% (p<0,05), ОЖСС 78,2±16,3 мкмоль/л (p<0,05 в сравнении с контролем). Концентрация sTfR в данной подгруппе значимо отличалась от показателей контрольной группы – 7,2±6,48 мкг/мл (p<0,05), хотя результаты продемонстрировали значительную гетерогенность. Уровень сывороточного ферритина, прямо коррелирующий у здоровых лиц с объемом запасного внутриклеточного железа, у пациентов со злокачественными новообразованиями является одновременно острофазовым ферропротеидом и не может считаться адекватным критерием дефицита железа. Поэтому в качестве диагностически значимых показателей абсолютного дефицита железа нами использовались sTfR, КНТ, признаки гипохромии и микроцитоза (MCV, MCH), а также анамнестические данные (эвакуаторные и резорбтивные нарушения со стороны желудочно-кишечного тракта, рецидивирующих малообъемные кровопотери). В определении варианта дефицита железа также может использоваться и уровень гепсидина. При высокой его концентрации можно предполагать, что имеется нехватка железа и эритропоэз работает в условиях его дефицита.
Анемия хронических заболеваний с вариантом функционального дефицита железа (n=36) была выявлена у больных без признаков абсолютного дефицита, но имеющих характерные для АХЗ низкое насыщение трансферрина (14±2,7%, p<0,05 в сравнении с контрольной группой), повышенные уровни гепсидина (67,8±7,19 нг/мл, p<0,001 в сравнении с контролем), содержание ЭПО, не соответствующее компенсаторному (18,18±10,15 мЕд/ мл), что отражает искаженный биологический ответ на гипоксию пациентов с АХЗ, и присутствие адекватных концентраций сывороточного ферритина, несмотря на то, что они продемонстрировали некоторую гетерогенность (114,9±81,79 нг/мл).
Железодефицитная анемия (ЖДА) была диагностирована у 2 пациентов на основании наличия в анамнезе факторов, способствующих формированию железодефицитных состояний (хронический гастроэнтерит, хронический геморрой с кровотечениями в период обострения), гипохромии и микроцитоза при оценке эритроцитарных индексов (MCH 20,7±6,21пг, MCV 62,14±11,4 фл), изменений феррокинетики: ЖС 5,95±1,77 мкмоль/л, ОЖСС – 79,05±17,3 мкмоль/л, КНТ –15,2±3,8%, ферритин – 9,1±2,68 нг/мл, sTfR – 15,7±1,39 мкг/мл, гепсидин 0,69±0,41 нг/мл.
Отдельно среди пациентов с АХЗ с преобладающим вариантом функционального дефицита железа была выделена подгруппа лиц, у которых признаки АХЗ сочетались с избытком железа в дебюте заболевания (n=21) – ферритин 652,26±131,57 нг/мл (p<0,001).
В общей сложности лабораторные признаки гипер-ферритинемии до начала терапии продемонстрировали более половины пациентов без анемического синдрома
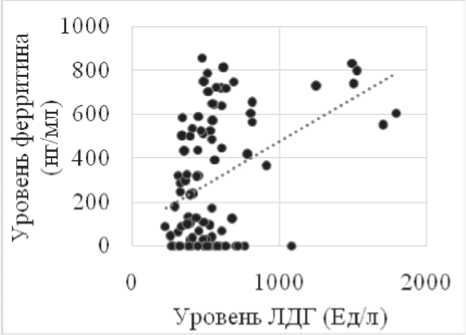
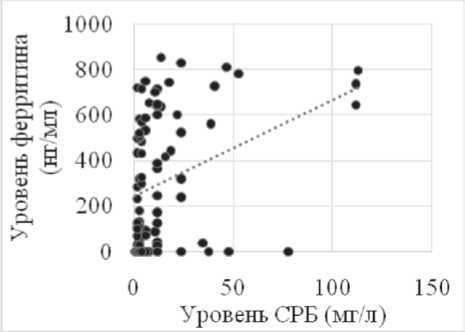
(58,2%, n=32). Изолированный прирост уровня ферритина сыворотки (652,26±131,57 нг/мл, p<0,001 в сравнении с показателями контрольной группы), с учетом отсутствия у пациентов гемотрансфузий в анамнезе, был расценен нами в качестве опухолеассоциированного явления. Связь уровня ферритина и активности процесса подтвердило наличие прямых корреляционных связей отношений между известными биохимическими опухолевыми маркерами – ЛДГ (r=0,45, p<0,001), СРБ (r=0,53, p<0,001). Также была установлена связь между концентрацией ферритина сыворотки, превышающей максимальные нормальные значения (>350 нг/мл) и принадлежностью к группам высокого/промежуточного и высокого риска в соответствии с IPI (r=0,45; p<0,05), а также наличием клинических симптомов опухолевой интоксикации (r=0,76; p<0,05), (рис. 1).
У 14 пациентов с нормальным уровнем гемоглобина изменения феррокинетики расценивались как проявление латентного дефицита железа: MCH 23,42±4,18 пг (p<0,05), MCV 70,12±5,14 фл (p<0,05), СЖ14,55±4,3 мкмоль/л, ОЖСС 69,6±12,3 мкмоль/л (p<0,05), КНТ
12,15±7,2% (p<0,05), ферритин 78,7±45,13 нг/мл, sTfR5,28±2,8 мкг/мл(p<0,05), гепсидин 29,22±19,7 нг/мл (рис. 2).
Следует отметить, что пациенты, включенные в исследование, кроме впервые диагностированного лимфопролиферативного заболевания, имели и различную соматическую патологию [3, 11, 12]. Это особенно характерно для НХЗЛ, где средний возраст заболеваемости лимфомами предполагает 2 и более сопутствующие нозологические формы [4]. Таким образом, закономерно преобладание в структуре анемического синдрома до начала применения химиотерапии анемии хронических заболеваний. С другой стороны, изолированная выраженная гиперферритинемия не может быть интерпретирована только как перераспределение железа при АХЗ и указывает на вклад активности опухолевого заболевания в па-тоненез нарушения метаболизма железа.
При обследовании пациентов в динамике противоопухолевой терапии отмечалось увеличение частоты развития анемии, однако, без углубления степени ее тяжести (табл. 1).
а)
Рис. 1. Корреляционная зависимость уровня ферритина от ЛДГ (а), СРБ (б) у больных лимфомами в дебюте заболевания (n=98)
б)
-
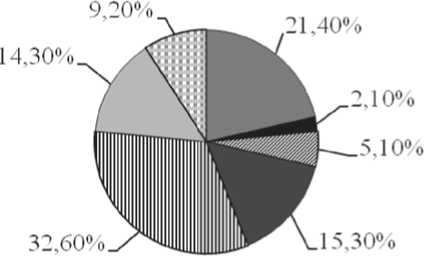
■ АХЗ+ опухолеассощшрованное повышение уровня ферритина
-
■ ЖДА
^ АХЗ с вариантом абсолютного дефицита железа
-
■ АХЗ
ил опухолеассощшрованное повышение уровня ферритина
-
□ латентный дефицит железа
-
□ разнонаправленные нарушения метаболизма железа
Рис. 2. Основные варианты нарушений метаболизма железа у больных лимфомами в дебюте заболевания
Пациенты обследовались повторно в период достижения частичной или полной клинико-гематологической ремиссии, что подразумевало значительное уменьшение объема опухолевой массы и суммарного воздействия про-воспалительных цитокинов (таких как ИЛ-1, ИЛ-6, ФНО, гамма-ИНФ), на что указывают выполненные ранее работы Н.В. Скворцовой [10], А.С. Лямкиной [6]. Доля лиц с лабораторными признаками анемии хронических заболеваний в динамике терапии уменьшилась с 41,8% (n=41) до 18,38% (n=18) (p<0,001), что подтверждает значительный вклад опухоли в генез данного нарушения обмена железа.
В то же время на фоне проводимой ПХТ выделилась группа больных (n=38) с анемией, индуцированной химиотерапией, т.е. являющейся следствием прямого мие-лотоксического действия химиотерапевтических агентов. Основной отличительной особенностью в данной подгруппе было вновь диагностированное ограничение эрит-рона при исследовании пунктата костного мозга. По данным миелограммы, до начала ПХТ сужение эритроидного ростка костного мозга было отмечено у 25,5% пациентов, тогда как после 4–6 курсов ПХТ сужение эритрона при подсчете миелограммы регистрировалось у 73,5% лиц. Данный факт, а также отсутствие других причин для
Таблица 1
Частота выявления и степень тяжести анемии у больных лимфомами на момент установления диагноза и в динамике противоопухолевой терапии (n=98)
Среди пациентов без анемического синдрома в динамике ПХТ также была выделена подгруппа с превышением уровня ферритина (n=18) до 532,84±120,03 нг/мл в сравнении с контрольной группой. Учитывая, что пациенты данной подгруппы имели в дебюте заболевания В-симптомы, лабораторные признаки активности и не достигли полной ремиссии на момент повторного исследования показателей обмена железа, высокий ферритин оценивался нами в качестве показателя острой фазы. Сохраняющаяся опухолевая активность подтверждалась повышением уровня других маркеров системного воспаления (ЛДГ, СРБ) и наличием прямых корреляционных отношений между уровнем ферритина и ЛДГ (r=0,44, p<0,05), СРБ (r=0,42, p<0,05), принадлежностью к группам высокого/промежуточного и высокого риска в соответствии с IPI (r=0,46; p<0,05) (рис. 3).
Выводы
Таким образом, структура нарушений обмена железа у больных злокачественными лимфомами в дебюте заболевания представлена несколькими вариантами: опухолеассоциированным повышением уровня ферритина – в 32,6% случаев, анемией хронических заболеваний – в 41,8% наблюдений, латентным дефицитом железа – в 14,2% и железодефицитной анемией в 2,1% случаев. В динамике полихимиотерапии прослеживается изменение структуры нарушений феррокинетики: отмечается тенденция к увеличению доли лиц с анемией, индуцированной полихимиотерапией (до 38,8%), и снижению частоты встречаемости других вариантов нарушений обмена железа (анемия хронических заболеваний – в 18,38% случаев, опухолеассоциированное повышение уровня ферритина – в 18,4% и латентный дефицит железа – в 10,2% наблюдений).
Варианты анемии хронических заболеваний и повышения уровня ферритина сыворотки являются преобла-
-
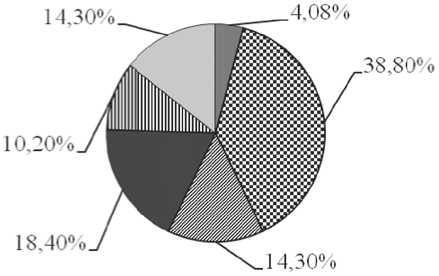
■ АХЗ с вариантом абсолютного дефицита железа
0 анемия, индуцированная ПХТ
^ АХЗ + опухолеассощпфованное повышение уровня ферритина
-
■ опухолеассощпфованное
повышение уровня ферритина
Ш) латентный дефшцп железа
-
□ разнонаправленные нарушения метаболизма железа
Рис. 3. Основные варианты нарушений метаболизма железа у больных лимфомами после 4–6 курсов ПХТ, на этапе клиникогематологической ремиссии.
дающими на этапе первичной постановки диагноза у больных лимфомами. Гиперферритинемия до начала ПХТ встречается как изолированно, так и в сочетании с картиной АХЗ и обусловлена активностью опухоли, где ферритин выступает в качестве острофазового маркера. Учитывая, что ферритин не может являться адекватным критерием абсолютного дефицита железа у больных со злокачественными новообразованиями, для повышения точности лабораторной диагностики и оценки запасного пула железа в организме следует использовать эритроцитарные индексы и повышение уровня растворимых рецепторов трансферрина (sTfR).
При повторном обследовании группы пациентов после завершения 4–6 курсов ПХТ доля лиц с анемическим синдромом увеличивается преимущественно за счет вновь развившейся анемии легкой степени тяжести. Учитывая отсутствие зарегистрированных кровопотерь, гемолиза и значимых отклонений феррокинетики, наряду с подтвержденным сужением эритрона в миелограмме, возможно выделять анемию, индуцированную миелоток-сическим действием химиотерапевтических агентов, в самостоятельный вариант в структуре анемического синдрома у пациентов на фоне проводимой химиотерапии.
Список литературы Структура нарушений обмена железа у больных лимфомами в дебюте заболевания и в динамике терапии
- Карева Н.П., Лосева М.И., Ефремов А.В. и др. Нарушения антиоксидантного статуса у больных лимфомами и возможности его коррекции//Сибирский научный медицинский журнал. -2005. -Т. 25, № 3. -C. 30-36.
- Ковынев И.Б., Поспелова Т.И., Агеева Т.А. и др. Частота и структура неходжкинских злокачественных лимфом в новосибирске, НСО и городах Сибирского федерального округа//Сибирский научный медицинский журнал. -2006. -Т. 26, № 4. -C. 175-181.
- Лосева М.И., Поспелова Т.И., Солдатова Г.С. Полиорганная патология у больных гемобластозами в отдаленном периоде лечения//Терапевтический архив. -1999. -№ 7. -C. 39.
- Лямкина А.С., Поспелова Т.И., Обгольц Ю.Н. и др. Патогенез и современная терапия анемического синдрома у пожилых больных лимфопролиферативными заболеваниями//Бюл. СО РАМН. -2013. -Т. 33, № 1. -С. 54-60.
- Поспелова Т.И., Воевода В.И., Воропаева Е.Н. Значение конституционных полиморфизмов гена p53 у больных неходжкинскими злокачественными лимфомами//Бюллетень сибирской медицины. -2008. -Т. 7, № 3. -C. 56.
- Поспелова Т.И., Лямкина А.С. Анемия при лимфомах/ГОУ ВПО "Новосибирский государственный университет" Росздрава, ГУ научный центр клинической и экспериментальной медицины СО РАМН. -Новосибирск: НГМУ, 2008. -183 с.
- Аль-Ради Л.С., Барях Е.А., Белоусова И.Э. и др. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний//Современная онкология. -2014. -С. 6-126.
- Рукавицин О.А. Анемия хронических заболеваний: отдельные аспекты патогенеза и пути коррекции//Онкогематология. -2016. -Т. 11, № 1. -С. 37-46.
- Руководство по гематологии/под ред. А.И. Воробьева. -М.: Ньюдиамед, 2005. -Т. 3. -415 с.
- Скворцова Н.В., Поспелова Т.И., Ковынев И.Б. и др. Клиническое значение некоторых цитокинов и их прогностическая роль у пациентов с неходжкинскими злокачественными лимфомами//Бюллетень сибирской медицины. -2008. -№ 3. -C. 63-70.
- Сукманова И.А., Яхонтов Д.А., Поспелова Т.И. и др. Клиническая картина, морфофункциональные параметры и функция эндотелия у пациентов с систолической ХСН разных возрастных групп//Цитокины и воспаление. -2010. -Т. 9, № 3. -C. 30-34.
- Сукманова И.А., Яхонтов Д.А., Поспелова Т.И. Метаболические нарушения и функция эндотелия при диастолической ХСН в разных возрастных группах//Журнал сердечная недостаточность. -2010. -Т. 11, № 2. -C. 116-119.
- Fischer-Fodor E., Miklasova N., Berindan-Neagoe I. et al. Iron, inflammation and invasion of cancer cells//Clujul Medical. -2015. -Vol. 88, No. 3. -P. 272-277.
- Honaus S., Massini G., Giachelia M. et al. Anemia in Hodgkin's Lymphoma: The Role of Interleukin-6 and Hepcidin//Journal of Clinical Oncology: official journal of the American Society of Clinical Oncology. -2010. -Vol. 28, No. 15. -P. 2538-2543.
- Torti S.V., Torti F.M. Iron and cancer: more ore to be mined//Nature reviews. Cancer. -2013. -Vol. 13, No. 5. -P. 342-355.
- Yang S., Jun M., Hong-Li Z. et al. A multi-center open-labeled study of recombinant erythropoietin-beta in the treatment of anemic patients with multiple myeloma, low-grade non-Hodgkin's lymphoma, or chronic lymphocytic leukemia in Chinese population//Int. J. Hematol. -2008. -Vol. 88, No. 2. -P. 139-144.


