Структура сорта масличного льна Ы 117 на основе полиморфных микросателлитных локусов
Автор: Челюстникова Т.А., Гучетль С.З.
Рубрика: Селекция, семеноводство и биотехнология сельскохозяйственных растений
Статья в выпуске: 2 (194), 2023 года.
Бесплатный доступ
Лен масличный является востребованной, высокорентабельной культурой. Современные стандарты селекции и семеноводства предполагают генетическую паспортизацию селекционных достижений. Микросателлитные последовательности ДНК являются эффективным инструментом для проведения работ по паспортизации сортового материала. Известно, что сорта-самоопылители масличного льна могут обладать внутрисортовой гетерогенностью. В связи с этим была выполнена оценка генетической структуры сорта Ы 117 масличного льна селекции ВНИИМК с использованием системы микросателлитных ДНК-маркеров. Оценку генетической структуры сорта проводили на выборке из 40 отдельных растений. Для работы использовано 16 микросателлитных маркеров. Анализ продуктов ПЦР показал, что выборка растений однородна по 13 локусам. По две аллели выявлены у локусов Lu3, Lu21ˊ и Lu27b. Анализ аллельного состояния отдельных растений сорта по этим трем полиморфным локусам выявил четыре группы растений с различным типом сочетания аллелей (биотипов): А (Lu3175Lu21ˊ109Lu27b135), В (Lu3166 Lu21ˊ117Lu27b142), С (Lu3166Lu21ˊ109Lu27b135) и D (Lu3175,166Lu21ˊ109 Lu27b135), с частотой 57,5 %; 37,5; 2,5 и 2,5 % соответственно. Полученные нами результаты показывают, что сорт Ы 117 можно рассматривать как совокупность биотипов. Основные биотипы А и В суммарно составляют 95 % выборки. Биотипы D и С (суммарно 5 % выборки), возможно, являются результатом переопыления между растениями биотипов А и B. В силу происхождения анализированного сорта из нескольких уникальных по устойчивости к льноутомлению растений количество выявленных биотипов невелико. Однако, принимая во внимание допустимый уровень перекрестного опыления внутри сорта, со временем возможен сдвиг в соотношении биотипов и некоторое увеличение их числа. Соотношение биотипов может служить параметром для контроля стабильности сорта, которая является одним из определяющих критериев сорта согласно требованиям Международного союза защиты сортов растений (UPOV).
Масличный лен, сорт, днк, ssr, полимеразная цепная реакция, генетическая структура
Короткий адрес: https://sciup.org/142238718
IDR: 142238718 | УДК: 633.854.54:633.52:575 | DOI: 10.25230/2412-608X-2023-2-194-13-19
Текст научной статьи Структура сорта масличного льна Ы 117 на основе полиморфных микросателлитных локусов
Введение. Масличный лен является востребованной, высокорентабельной культурой, ареал возделывания которой стабильно расширяется. Популярность льна обусловлена ценными пищевыми и лечебно-профилактическими свойствами льняного масла, его уникальным жирнокислотным составом. В последнее десятилетие в РФ значительно увеличились площади, отводимые под посевы льна. По данным Росстата, с 2010 по 2020 гг. посевные площади под масличным льном возросли с 267 до 1030 тыс. га [1]. В связи с этим расширяется сортимент культуры, создаются новые сорта с комплексом признаков, повышающих адаптивность к стрессовым факторам и стабилизирующих высокую урожайность.
Современные стандарты селекции и семеноводства предполагают генетическую паспортизацию селекционных достижений. Генетический паспорт является обязательной составляющей новых сортов сельскохозяйственных культур. Его данные востребованы при сертификации и коммерческом распространении семян. Генетические паспорта дают возмож-ность регистрировать сорта, в дальнейшем их идентифицировать, контролировать их генетическую чистоту, проводить мониторинг этапов селекции и семеноводства [2].
Ранее методы паспортизации в основном базировались на морфологических и биохимических признаках. Однако при-14
менение морфологических признаков ограничено временем и четкостью их проявления, существенно зависящих от условий произрастания объектов исследования. Паспортизация по биохимическим признакам ограничивается количеством полиморфных биохимических маркеров. Полиморфизм молекулы ДНК признан оптимальным источником для изучения генетического разнообразия биологических объектов и их идентификации [3; 4]. Микросателлитные последовательности (SSR) с высоким уровнем полиморфизма, широко распространенные в геноме, являются эффективным инструментом для проведения работ по паспортизации сортового материала сельскохозяйственных культур [5]. Для льна создана обширная база данных микросателлитных локусов [6; 7]. Разработаны системы SSR-маркеров, которые используются для изучения генетического разнообразия культурного льна и идентификации его сортов [8; 9]. Известно, что некоторые сорта-самоопылители масличного льна обладают определенным внутрисортовым генетическим разнообразием [10]. Но не для всех сортов масличного льна селекции ВНИИМК это разнообразие было изучено.
Целью данной работы является оценка генетической структуры сорта Ы 117 масличного льна селекции ВНИИМК с использованием системы микросателлит-ных ДНК-маркеров.
Материалы и методы. Материалом для исследования служил сорт масличного льна Ы 117 селекции ВНИИМК.
Оценку генетической структуры сорта проводили на выборке из 40 отдельных растений, которые были этикированы и распределены в четыре объединенные пробы (по 10 случайных растений в каждой) (табл. 1).
Таблица 1
Формирование объединенных проб ДНК
|
№ пробы |
№ растений |
|
I |
1–10 |
|
II |
11–20 |
|
III |
21–30 |
|
IV |
31–40 |
ДНК выделяли СТАВ-методом [11]. Для работы использован набор из 16 пар праймеров, фланкирующих полиморфные микросателлитные локусы сортов масличного льна [9; 12]. Амплификацию ДНК проводили в реакционной смеси следующего состава: 67 мМ трис-HCl, рН 8,8; 16,6 мM сульфата аммония; 3 мM MgCl 2 ; 0,01 % Tween 20; по 0,2 мM каждого из дезоксирибонуклеозидфосфатов; 10 пМ праймера; 10 нг матричной ДНК и 1 ед. рекомбинантной термостабильной ДНК полимеразы (Сибэнзим, Москва). Полимеразные цепные реакции проходили в термоциклере S1000тм (BioRad, США) при соблюдении режима смены температур, оптимального для нуклеотидной последовательности праймеров. Электрофоретическое разделение продуктов амплификации проводили в 8%-ном полиакриламидном геле, приготовленном на 1хТБЕ буфере, в камере для вертикального электрофореза VЕ-20 (Хеликон, Россия). Окрашивание гелей проведено в водном растворе бромистого этидия. Визуализировали фрагменты ДНК и определяли их размер с использованием программного обеспечения трансиллюминатора BioPrint (Vilber Lourmat, Франция) относительно маркера длины фрагментов ДНК GeneRuler 100 bp DNA Ladder Thermo Scientific (Сибэнзим, Россия). В качестве положительного контроля использовали ДНК растения сорта Снегурок, для которого был установлен линейный характер [10].
Результаты и обсуждение. Для оценки генетической однородности объединенных проб провели реакции амплификации ДНК каждой пробы с набором из 16 пар праймеров, фланкирующих микросателлитные локусы. В большинстве случаев у ДНК объединенной пробы амплифицировался один фрагмент, что расценивалось как идентичность включенных в пробу растений по данному локусу. Генетическая неоднородность пробы по SSR-локусу прояв- лялась амплификацией более одного фрагмента. На рисунке 1 представлены фореграммы продуктов амплификации ДНК объединенных проб с праймерами Lu18 и Lu27.
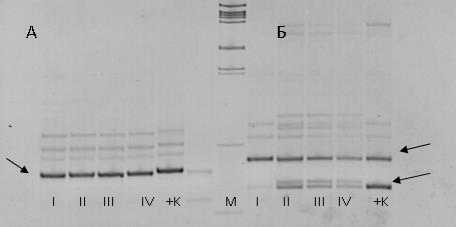
Рисунок 1 – Продукты ПЦР с праймерами Lu18 (А) и Lu27 (Б).
Дорожки: I, II, III, IV – объединенные пробы ДНК растений сорта Ы 117;
+ К – положительный контроль;
М – маркер молекулярного веса.
Стрелками показаны информативные зоны
Продуктом амплификации с праймером Lu18 для каждой из четырех проб (I–IV) явился единый фрагмент размером 170 пар нуклеотидов, что указывает на однородность выборки из 40 растений по данному локусу.
Анализ хромосомной локализации фланкирующих нуклеотидных последовательностей локуса Lu27 определил их расположение на хромосомах 2 и 13 в референсном геноме L. usitatissimum (13), и, как следствие, при проведении ПЦР ам-плифицируется два маркерных локуса, обозначенные как Lu27a и Lu27b. В данном исследовании для локуса Lu27а продемонстрирована амплификация фрагмента размером 180 пар нуклеотидов (п.н.) в каждой из четырех проб. У локуса Lu27b было выявлено две аллели (135 п.н. и 140 п.н.) в пробах II, III, IV. В пробах I и положительного контроля амплифициро-ван один аллель размером 135 п.н. (рисунок).
Анализ продуктов ПЦР четырех объединенных проб с 16 парами праймеров показал, что пробы однородны по большей части локусов. По две аллели выявлены у локусов Lu3, Lu21ˊ и Lu27b (табл. 2).
Таблица 2
Оценка однородности объединенных проб с использованием 16 SSR-локусов
|
Локус |
Проба |
|||
|
I |
II |
III |
IV |
|
|
Lu1 |
173 |
173 |
173 |
173 |
|
Lu2 |
170 |
170 |
170 |
170 |
|
Lu3 |
175, 166 |
175, 166 |
175, 166 |
175, 166 |
|
Lu6 |
156 |
156 |
156 |
156 |
|
Lu7 |
151 |
151 |
151 |
151 |
|
Lu8 |
160 |
160 |
160 |
160 |
|
Lu9 |
113 |
113 |
113 |
113 |
|
Lu10 |
164 |
164 |
164 |
164 |
|
Lu11 |
118 |
118 |
118 |
118 |
|
Lu18 |
170 |
170 |
170 |
170 |
|
Lu21ˊ |
109, 117 |
109, 117 |
109, 117 |
109, 117 |
|
Lu24 |
183 |
183 |
183 |
183 |
|
Lu25 |
140 |
140 |
140 |
140 |
|
Lu27b |
140 |
140, 135 |
140, 135 |
140, 135 |
|
Lu31 |
135 |
135 |
135 |
135 |
|
Lu37 |
127 |
127 |
127 |
127 |
Для определения генетической структуры сорта были проведены ПЦР с ДНК отдельных растений с маркерами Lu3, Lu21ˊ и Lu27b, по которым определена неоднородность аллельного состава. Результаты отражены в таблице 3.
Таблица 3
Аллельное состояние отдельных растений по полиморфным локусам
|
№ растения |
Локус |
||
|
Lu3 |
Lu21ˊ |
Lu27b |
|
|
1 |
2 |
3 |
4 |
|
1 |
175 |
109 |
135 |
|
2 |
166 |
117 |
142 |
|
3 |
175 |
109 |
135 |
|
4 |
166 |
117 |
142 |
|
5 |
175 |
109 |
135 |
|
6 |
175 |
109 |
135 |
|
7 |
175, 166 |
109 |
135 |
|
8 |
175 |
109 |
135 |
|
9 |
175 |
109 |
135 |
|
10 |
175 |
109 |
135 |
|
11 |
166 |
117 |
142 |
|
12 |
166 |
117 |
142 |
|
13 |
166 |
117 |
142 |
|
14 |
175 |
109 |
135 |
|
15 |
175 |
109 |
135 |
|
16 |
175 |
109 |
135 |
|
17 |
175 |
109 |
135 |
|
18 |
166 |
117 |
142 |
|
19 |
175 |
109 |
135 |
|
20 |
175 |
109 |
135 |
|
21 |
166 |
117 |
142 |
|
22 |
166 |
117 |
142 |
|
23 |
166 |
117 |
142 |
|
24 |
175 |
109 |
135 |
|
25 |
175 |
109 |
135 |
|
26 |
175 |
109 |
135 |
|
27 |
166 |
117 |
142 |
Продолжение таблицы 3
|
1 |
2 |
3 |
4 |
|
28 |
175 |
109 |
135 |
|
29 |
175 |
109 |
135 |
|
30 |
166 |
117 |
142 |
|
31 |
166 |
117 |
142 |
|
32 |
166 |
117 |
142 |
|
33 |
166 |
117 |
142 |
|
34 |
175 |
109 |
135 |
|
35 |
166 |
109 |
135 |
|
36 |
166 |
117 |
142 |
|
37 |
175 |
109 |
135 |
|
38 |
175 |
109 |
135 |
|
39 |
175 |
109 |
135 |
|
40 |
166 |
117 |
142 |
Анализ аллельного состояния отдельных растений сорта по полиморфным локусам выявил четыре группы растений (биотипов) с различным типом сочетания аллелей (табл. 4). Биотип Lu3 175 Lu21ˊ 109 Lu27b 135 , обозначенный как А, определен у 23 растений, что составляет 57,5 % от всех анализированных растений выборки. Биотип Lu3 166 Lu21ˊ 117 Lu27b 142 , обозначенный как В, выявлен у 15 растений, что составляет 37,5 %. Биотип Lu3 166 Lu21ˊ 109 Lu27b 135 , обозначенный как С, определен у одного растения, что составляет 2,5 %. Биотип Lu3 175,166 Lu21ˊ 109 Lu27b 135 , обозначенный как D, также определен у одного растения с такой же частотой встречаемости, как у предыдущего.
Таблица 4
Частота встречаемости биотипов растений масличного льна сорта Ы 117
|
Биотип |
Локус |
Число растений |
% |
||
|
Lu3 |
Lu21ˊ |
Lu27b |
|||
|
A |
175 |
109 |
135 |
23 |
57,5 |
|
B |
166 |
117 |
142 |
15 |
37,5 |
|
C |
166 |
109 |
135 |
1 |
2,5 |
|
D |
175, 166 |
109 |
135 |
1 |
2,5 |
Сорт масличного льна Ы 117 является результатом адаптивной селекции масличного льна на льноутомление, выведен методом индивидуального отбора из линии на жестком фоне после 3-летней монокультуры льна. В эпицентре очага фузариозного увядания были обнаружены и отобраны несколько растений без признаков болезни. Эти растения явились источником для получения сорта, который характеризуется полной устойчивостью ко льноутомлению и высокой полевой устойчивостью к фузариозному увяданию [13]. Индивидуальный отбор является основным методом отбора у самоопылителей. В результате его применения создаются сорта, выровненные по морфологическим и основным хозяйственно важным признакам. Однако изучение сортов культур-самоопылителей показывает, что многие из них представляют собой смесь биотипов [14; 15]. Полученные нами результаты демонстрируют, что сорт Ы 117 можно рассматривать как совокупность биотипов. Основные биотипы А и В суммарно представляют 95 % выборки. Для масличного льна, который является самоопылителем, вероятность перекрестного опыления составляет 1–5 % [16]. Биотипы D и С, возможно, являются результатом переопыления между растениями биотипов А и B. В силу происхождения анализированного сорта из нескольких уникальных по устойчивости к льноутомлению растений, количество выявленных биотипов невелико. Например, для сортов-самоопылителей ярового рапса по микросателлитным маркерам было выявлено по пять биотипов [15]. Однако, принимая во внимание допустимый уровень перекрестного опыления внутри сорта, со временем возможен сдвиг в соотношении биотипов и некоторое увеличение их числа. Так, исследованные нами ранее сорта Нилин, Август и Даник представляли собой популяции, состоящие из набора генотипов с различной частотой встречаемости без четко выраженных биотипов [10]. Соотношение биотипов может служить параметром для контроля стабильности сорта, которая является одним из определяющих критериев сорта согласно требованиям Международного союза защиты сортов растений (UPOV). Выявление биотипов в структуре сорта может послужить начальным этапом в создании сублиний, или в случае с культурами-самоопылителями, сортов, если выделенные биотипы различаются по каким-либо хозяйственно ценным признакам. С этой целью необходимо проводить сравнительную оценку биотипов с исходным сортом по показателям основных признаков. Биотипы, превосходящие исходные варианты, в дальнейшем могут быть использованы для создания нового селекционного материала [15].
Заключение . Проведена работа по молекулярной паспортизации сорта масличного льна Ы 117. В качестве инструмента использован набор из 16 микросателлит-ных локусов. Определено, что 13 локусов мономорфны, три локуса полиморфны. С учетом полиморфных локусов в сорте выявлено четыре варианта генотипов: А (Lu3 175 Lu21ˊ 109 Lu27b 135 ), В (Lu3 166 Lu21ˊ 117 Lu27b 142 ), С (Lu3 166 Lu 21ˊ 109 Lu27b 135 ) и D (Lu3 175,166 Lu21ˊ 109 Lu27b 135 ). Генотипы А и В представляют генетическую основу сорта, так как в сумме эти биотипы составляют 95 %.
Список литературы Структура сорта масличного льна Ы 117 на основе полиморфных микросателлитных локусов
- Сельское хозяйство в России 2021: Стат. сбор. / Под редакцией К.Э. Лайменко. -М., Росстат, 2021. - 100 с.: [Электронный ресурс]. - Режим доступа: https://rosstat. gov.ru/storage/mediabank/S-X_2021.pdf.
- Сухарева А.С., Кулуев Б.Р. ДНК-маркеры для генетического анализа сортов культурных растений // Биомика. - 2018. -Т. 10. - № 1. - С. 69-84. DOI. 10/31301/2221 -6197.bmcs.2018-15.
- Gasi F., Sehic J., Grahic J., Hjeltnes S.H., Ordidge M., Benedikova D., Blouin-Delmas M., Drogoudi P., Giovannini D., Hofer M., Kahu K., Kovacs S., Lacis G., Lateur M., Toldam-Andersen T.B., Ognjanov V., Nybom H. Genetic assessment of the pomological classification of plum Prunus domestica L. accessions sampled across Europe // Genetic Resources and Crop Evolution. - 2020. - V. 67. - Р. 11371161. DOI: 10.1007/s 10722-020-00901 -y.
- Леонова И.Н. Молекулярные маркеры: использование в селекции зерновых культур для идентификации, интрогрессии и пирамидирования генов // Вавиловский журнал генетики и селекции. - 2013. - Т. 17. - № 2. - С. 314-323.
- Косолапое В.М., Козлов Н.Н., Клименко И.А., Золотарев В.Н. Генетическая паспортизация селекционных достижений кормовых культур // Вестник Российской сельскохозяйственной науки. - 2020. - № 5. - С. 40-46. DOI: 10.30850/vrsn/2020/5/40-46.
- Varshney R.K., Glaszmann J.-C., Leung H., Ribaut J. -M. More genomic resources for less-studied crops // Trends Biotechnol. - 2010. -28 (9). - Р. 450-460. DOI: 10.1016/ j .tibtech.2010.06.007.
- А. Chan Liu, Qing Tang, Chaohua Cheng, Yi Xu, Zemao Yang, Zhigang Dai and Jianguang Su. Mining, characterization and application of transcriptome-based SSR markers in Chinese jiaotou // Plant Genetic Resources. - 2018. - Vol. 16. - Is. 4. - P. 306-314. DOI: 10.1017/S14792621170003388.
- Базаное Т.А., Ущапоеский И.В., Логинова Н.Н., Смирнова Е.В., Михайлова П.Д. Формирование системы генетической паспортизации масличного льна // Аграрная наука. - 2020. - № 7-8. - С. 80-83. DOI: 10.32634/0869-8155-2020-340-7-80-83.
- Гучетль С.З., Челюстникова Т.А. Ге-нотипирование сортов льна масличного с использованием системы микросателлит-ных ДНК маркеров // Аграрная наука Евро-Северо-Востока. - 2020. - Т. 21. - № 5. - С. 531-539. DOI: 10.30766/2072-9081.2020.21. 5.531-539.
- Гучетль С.З., Челюстникова Т.А., Аверина А.А. Анализ структуры сортов масличного льна на основе полиморфных микросателлитных локусов // Аграрная наука Евро-Северо-Востока. - 2022. - Т. 23. - № 2. -С. 184-193. DOI: 10.30766/2072-9081.2022. 23.2.184-193.
- Saghai-Maroof M.A., Soliman K.M., Jorgensen R A., Allard R.W. Ribosomal DNA spacer-length polymorphisms in barley: Men-delian inheritance, chromosomal location, and population dynamics // PNAS USA. - 1984. -V.81. - P. 8014-8018.
- Челюстникова Т.А., Аверина А.А ., Гу-четль С.З., Золотавина М.Л., Рамазанова С.А., Волошко А.А., Логинова Е.Д. Оптимизация маркерной системы для генотипиро-вания сортов льна масличного коллекции ВНИИМК // Аграрная наука. - 2022. - № 4. - С. 57-61. DOI: 10.32634\0869-8155-2022-358-410.
- Зеленцов В.С., Рябенко Л.Г., Зеленцов С.В., Мошненко Е.В., Овчарова Л.Р., Скляров С.В. Сорт масличного льна Ы 117 // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2018. - Вып. 4 (176). - С. 181184. DOI: 10.25230/241-608Х-2018-4-176-181-18-57-61.
- Пухальский В.А. Проблемы генетической теории селекции растений // Вестник ВОГиС. - 2005. - Т. 9. - № 3. - C. 306-316.
- Рогожина Т.Г., Анискина Ю.В., Кар-пачев В.В., Шилов И.А. Использование микросателлитного анализа для выявления биотипов у сортов ярового рапса (Brassica napus L.) // Масличные культуры. Науч.-тех. бюл. ВНИИМК. - 2015. - Вып. 2 (162). -С. 27-33.
- Зеленцов С.В., Мошненко Е.В., Рябенко Л.Г., Овчарова Л.Р. Типы и способы естественного опыления льна обыкновенного Linum usitatissimum L. // Масличные культуры. Науч.-тех. бюл. ВНИИМК. -2018. - Вып. 1 (173). - С. 105-113. DOI: 10.25230/2412-608X-2018-1-173-105-113.


