Структурно-функциональное состояние гемоглобина у телят-гипотрофиков (Bos taurus) под влиянием препарата интерамина
Автор: Шабунин С.В., Востроилова Г.А., Паршин П.А., Сулин В.Ю., Мартынова А.В., Хохлова Н.А., Шабанов Д.И., Пархоменко Ю.С., Вели А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Тканевые препараты
Статья в выпуске: 2 т.60, 2025 года.
Бесплатный доступ
Коррекция морфофункциональной незрелости телят с признаками антенатальной гипотрофии и коморбидными патологиям остается одной из актуальных проблем в животноводстве. Структурно-функциональные изменения гемоглобина (Hb) служат важными диагностическими критериями физиологического состояния животного в процессе роста. У телят-гипотрофиков наблюдается нарушение обменных процессов и кислородтранспортной функции крови, что способно приводить к замедлению замены фетального гемоглобина (HbF) на дефинитивный гемоглобин взрослых животных (HbA). Коррекция таких состояний с помощью различных препаратов и механизмы их действия продолжают оставаться предметом изучения. Мы впервые выявили влияние препарата интерамин, содержащего гидрофильную криофракцию селезенки крупного рогатого скота, рекомбинантные видоспецифичные (бычьи) альфа- и гамма-интерфероны (IFN-α и IFN-γ) и витамины А, Е, на состояние кроветворной системы у телят-гипотрофиков, которое оценивали по спектральным характеристикам гемоглобина в гемолизате периферической крови. Содержание фетального гемоглобина в крови телят определяли спектрофотометрически по локальным максимумам светопоглощения растворов гемоглобина в ультрафиолетовом диапазоне. С использованием базы данных Uniprot проведен сравнительный анализ ароматических аминокислотных остатков в первичной структуре β- и γ-субъединиц гемоглобинов Bos taurus и установлено различие в количественном содержании триптофана в обеих молекулах. В результате исследования впервые установлены изменения максимумов светопоглощения в УФ-диапазоне гемоглобина телят-гипотрофиков при применении интерамина. При подкожном введении новорожденным телятам-гипотрофикам интерамина в дозе 1 мл/10 кг массы животного впервые зарегистрировано смещение локального максимума светопоглощения гемоглобина в УФ-диапазоне от 270 нм к 275 нм. При этом такое изменение локальных максимумов наблюдалось уже на 7-е сут у телят-гипотрофиков, которым начали вводить комплексный препарат, в то время как применение препарата сравнения - Биферона-Б телятам-гипотрофикам по такой же схеме индуцировало смещение локального максимума светопоглощения гемоглобина только к 30-м сут неонатального развития и не наблюдалось к этому времени у телят-гипотрофиков без применения препаратов. Основываясь на данных литературы, предложен гипотетический механизм обнаруженных явлений. Возможно, что интерамин благодаря иммуномодулирующему эффекту ускоряет замещение фетального гемоглобина на дефинитивный у телят-гипотрофиков и оказывает корректирующее действие на кислородтранспортную функцию крови.
Телята-гипотрофики, фетальный гемоглобин, уф-спектры поглощения, иммуномодуляция, тканевые препараты, рекомбинантные интерфероны, интерамин, ароматические аминокислоты
Короткий адрес: https://sciup.org/142245115
IDR: 142245115 | УДК: 636.28:619:615.36 | DOI: 10.15389/agrobiology.2025.2.382rus
Текст научной статьи Структурно-функциональное состояние гемоглобина у телят-гипотрофиков (Bos taurus) под влиянием препарата интерамина
Перинатальные патологии у крупного рогатого скота, возникающие вследствие дисфункции системы мать—плацента—плод, остаются одним из негативных факторов в животноводстве (1). Клинически такие патологии проявляются рождением морфологически и функционально незрелого потомства с признаками антенатальной гипотрофии и коморбидных нарушений — анемии и иммунодефицитов (2, 3). В связи с высокими экономическими затратами при воспроизводстве крупного рогатого скота коррекция морфофункциональных патологий у молодняка и его дальнейшее использование в хозяйственном процессе представляется актуальной задачей (1).
Фетальный гемоглобин (HbF, fetal) — главный гемоглобин плода. Глобиновая часть HbF структурно представлена двумя α - и двумя γ -цепями. Экспрессия фетального гемоглобина служит ткане- и стадийно-специфическим маркером онтогенеза у крупных млекопитающих (4). У новорожденного теленка доля HbF составляет около 70 %. Затем в течение примерно
60 сут неонатального периода фетальный гемоглобин замещается на дефинитивный (HbA, adult) (5-7). При патологиях, сопряженных с нарушением обменных процессов и кислородтранспортной функции крови, к которым относят анемию новорожденных телят, в неонатальном периоде у животных наблюдается высокое содержание HbF и происходит замедление процессов его замены на взрослый гемоглобин (8, 9). В условиях гипоксии на фоне значительного усиления эритропоэза возникает адаптивная реакция эритроцитов, связанная с активацией гена γ -цепи глобина (фетальной γ -субъеди-ницы) индуцируемым гипоксией фактором 1 (hypoxia-inducible factor 1, HIF-1), что приводит к повышению количества HbF (9-11). В связи с этим выявление HbF в крови может быть использовано для диагностики патологий, сопряженных с гипоксией (12, 13).
Таким образом, структурно-функциональные изменения гемоглобина (Hb) рассматриваются как начальные проявления ряда патологических процессов и важные критерии физиологического состояния животного в процессе роста (14). При этом закономерности изменения форм гемоглобина у животных как при патологии, так и при ее фармакокоррекции остаются до конца не выясненными.
В представленной работе нами впервые проведен сравнительный анализ спектров поглощения гемоглобина телят-гипотрофиков в неонатольный период при курсовом применении комплексного препарата интерамина. Исследуемый комплексный препарат интерамин (разработан в ФГБНУ Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии) содержит гидрофильную криофракцию селезенки крупного рогатого скота, рекомбинантные видоспецифичные (бычьи) альфа- и гамма-интерфероны (IFN- α и IFN- γ ) и витамины А и Е. В качестве препарата сравнения мы использовали Биферон-Б (разработка ООО Научно-производственный центр «ПроБиоТех», Республика Беларусь), учитывая сходство действующих веществ, входящих в его состав и содержащихся в исследуемом нами препарате, и присутствие цитокинового компонента (в 1 см3 биопрепарата содержится не менее 1,0½104 МЕ суммарной антивирусной активности смеси белков альфа- и гамма-интерферонов бычьих рекомбинантных).
Цель работы заключалась в определении влияния комплексного препарата интерамина на структурно-функциональное состояние гемоглобина и содержание фетального гемоглобина в крови телят-гипотрофиков как показателя развития кроветворной системы.
Методика. Эксперимент проводили на телятах красно-пестрой масти голштинской породы ( n = 40), принадлежащих ООО «ЭкониваАгро» (с. Коршево, Бобровский р-н, Воронежская обл.). Отобранных животных с признаками антенатальной гипотрофии 2-й степени разделили по принципу парных аналогов на три группы по 10 гол. в каждой. В IV группу вошли 10 телят-нормотрофиков. Условия опыта соответствовали действующим международным и российским законодательным актам (Директива 2010/63/EU от 22.09.2010; Европейская конвенция ETS 123, Strasbourg, 1986; ГОСТ 332162014), а также требованиям биоэтической комиссии ФГБНУ ВНИВИПФиТ.
Телятам из I группы ( n = 10, гипотрофики) вводили подкожно комплексный препарат интерамин (1 мл на 10 кг массы животного, 4-кратно, 1-е, 3-и, 8-14-е, 18-24-е сут жизни), телятам из II группы ( n = 10, телята-гипотрофики) — подкожно препарат Биферон-Б по той же схеме; в III ( n = 10, контроль 1, телята-гипотрофики) и IV ( n = 10, контроль 2, телята-нормотрофики) группах препараты не применяли.
У всех телят на 1-е, 7-е и 30-е сут жизни в утреннее время до кормления брали кровь в объеме 10 мл из яремной вены с помощью вакуумной системы отбора в пробирки с К3 EDTA. Полученные образцы помещали в термостабильный контейнер с температурой +4-6 °С и транспортировали до места исследования в течение 2 ч с момента отбора.
Для получения водных растворов гемоглобина венозную кровь (2 мл) разбавляли до 10 мл изотоническим раствором NaCl (154 мМ). Суспензию эритроцитов центрифугировали (10 мин, 5500 об/мин, +12 ° С), супернатант удаляли. Процедуру отмывания эритроцитов в 10 мл физиологического раствора повторяли трижды. После осмотического гемолиза 0,5 мл отмытых эритроцитов в 5,5 мл дистиллированной воды в течение 20 мин мембраны эритроцитов осаждали центрифугированием при 5500 об/мин 30 мин. После центрифугирования супернатант, содержащий гемоглобин, переносили в пробирки и разбавляли до рабочих концентраций, используя 0,01 М фосфатный буфер (рН = 7,0) (8).
Спектры поглощения водных растворов гемоглобина регистрировали на спектрофотометре Shimadzu UV-1700 (PC) («Shimadzu», Япония) в диапазоне длин волн 240-320 нм со спектральной шириной щели 1 нм и шагом сканирования 0,1 нм.
Статистическая обработка данных включала расчет средних значений длин волн локальных максимумов УФ-светопоглощения ( М) и их среднеквадратического отклонения ( ± SD). Для обоснования межгрупповых различий локальных максимумов УФ-светопоглощения в области 270 нм и 275 нм использовали критерий χ 2 для многопольных таблиц. В результатах исследования представлены межгрупповые различия локальных максимумов УФ-светопоглощения гемоглобина в области 270 нм и 275 нм для критического χ 2 = 16,27 при df = 3 на уровне значимости p < 0,001.
Результаты. Анализ базы данных Uniprot аминокислотных последовательностей в первичной структуре у-глобина HbF и р-субъединицы HbA показал различия по остаткам 22 аминокислот, в том числе по ароматическим аминокислотам, которые относят к хромофорам II типа, обладающим светопоглощением в УФ-диапазоне (табл.).
Количественные различия в содержании ароматических аминокислотных остатков в р -субъединице дефинитивного гемоглобина HbA и у -субъединице фетального гемоглобина HbF коров ( Bos taurus ), оказывающие влияющие на спектральные свойства в УФ-диапазоне
Субъединица Phe Tyr Trp
Р -Субъединица HbA 10 2 2
у -Субъединица HbF 10 2 1
Примечание. Показатели получены с использованием базы данных Uniprot
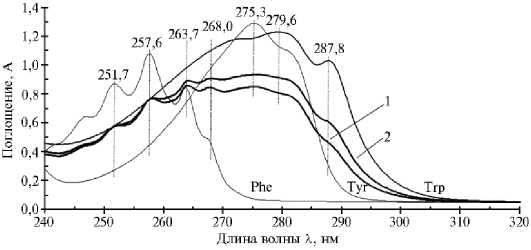
Рис. 1. Характерные спектры светопоглощения (A — оптическая плотность) 0,01 М водных растворов фенилаланина (Phe) , тирозина (Tyr) и триптофана (Trp) и аддитивных моделей у-субъеди-ницы HbF (Phe+Tyr+Trp) (1) и р-субъединицы HbA (Phe+Tyr+Trp+Trp) (2 ), определяющие особенности светопоглощения HbF и HbA. Спектрофотометр Shimadzu UV 1700 (PC) («Shimadzu», Япония).
Поскольку максимум светопоглощения в области 240-300 нм обусловлен суперпозицией хромофоров боковых групп ароматических и гетероциклических аминокислотных остатков, входящих в состав гемоглобина (15), мы провели спектральный анализ водных растворов этих аминокислот. В результате зарегистрированы максимумы светопоглощения водных растворов (pH = 7,0) ароматических аминокислот при следующих длинах волн: для фенилаланина (Phe) λ max = 257,6 нм с двумя выраженными пиками в области 251,5 нм и 263,7 нм, для тирозина (Tyr) λ max = 275.,3 нм, для триптофана (Trp) λ max = 279,6 нм и пиком при 287,8 нм (рис. 1).
По результатам сравнительного анализа УФ-спектров водных растворов ароматических аминокислот и их аддитивных спектров можно предположить, что пики при 251,7 нм, 257,6 нм и 263,7 нм обусловлены светопоглоще-нием фенилаланина. Локальные максимумы с длинами волн λ max = 268,0 нм и λ max = 275,3 нм и перегибы при λ = 279,6 нм и λ = 287,8 нм формируются как суперпозиции максимумов светопоглощения тирозина и триптофана (см. рис. 1).
Учитывая, что γ -субъединица фетального бычьего гемоглобина содержит только один остаток триптофана, а в β -субъединице взрослого бычьего гемоглобина два остатка триптофана, можно предположить, что УФ-спектры растворов фетального и взрослого гемоглобинов будут иметь разные максимумы светопоглощения в области 240-320 нм.
Ранее мы выявили различия спектральных характеристик водных растворов оксигемоглобина телят в неонатальный период при нормотрофическом и гипотрофическом развитии (8). К возрасту 1 мес у клинически здоровых телят-нормотрофиков максимум УФ-светопоглощения в коротковолновом диапазоне смещается к 274,8 нм и приближается к параметрам HbA. У телят с гипотрофическим развитием по данным спектрального анализа максимум спектра поглощения не изменяется и соответствует 269,8 нм, что, по нашему мнению, свидетельствует о сохранении в эритроцитах телят-гипотрофиков фетального гемоглобина (8). Снижение интенсивности све-топоглощения в коротковолновом диапазоне у телят с гипотрофией, по всей видимости, связано с развитием анемии.
Проведенный нами анализ спектров поглощения водных растворов гемоглобина телят в ранний постнатальный период (до 30 сут) в диапазоне длин волн 240-320 нм выявил два локальных максимума в области около 270 нм и 275 нм. Таким образом, мы получили подтверждение, что к 30-м сут развития у телят-нормотрофиков локальный максимум поглощения водных растворов гемоглобина в диапазоне длин волн 240-320 нм, отражающий структурные свойства Hb, смещался от 270 нм к 275 нм. Основываясь на аддитивной модели спектров гемоглобина, мы предполагаем, что первый локальный максимум в области 270 нм коррелирует с содержанием фетального гемоглобина HbF, второй в области 275 нм — дефинитивного HbA (8, 15).
На основании сравнительного анализа локальных максимумов в области 270 нм было установлено, что у телят-нормотрофиков и телят-гипо-трофиков, получавших Биферон-Б, указанный пик исчезает к 30-м сут развития. У гипотрофиков, получавших интерамин, максимум при λ max = 270 нм не регистрировался с 7-х сут развития. Учитывая связь между локальным максимумом в области 270 нм и наличием в крови фетального гемоглобина, можно предположить, что у нормотрофиков и гипотрофиков, которым вводили Биферон-Б, к 30-м сут жизни происходит постепенная замена HbF на взрослый гемоглобин HbA. У гипотрофиков, получавших интерамин, этот процесс ускоряется (рис. 2).
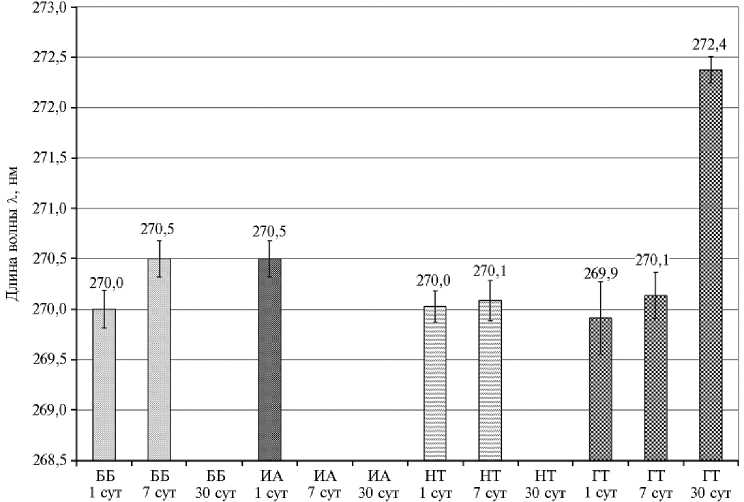
Рис. 2. Влияние гипотрофии и ее фармакокоррекции интерамином или Бифероном-Б на положение локальных максимумов светопоглощения водных растворов Hb в диапазоне длин волн 268272 нм : ИА — интерамин (I группа, n = 10); ББ — Биферон-Б (II группа, n = 10); ГТ — телята-гипотрофики (III группа, n = 10); НТ — телята-нормотрофики (IV группа, n = 10); 1, 7, 30 сут — время после начала применения препаратов; спектрофотометр Shimadzu UV 1700 (PC) («Shimadzu», Япония) ( M ±SD, телята красно-пестрой масти голштинской породы, Воронежская обл., 2022 год).
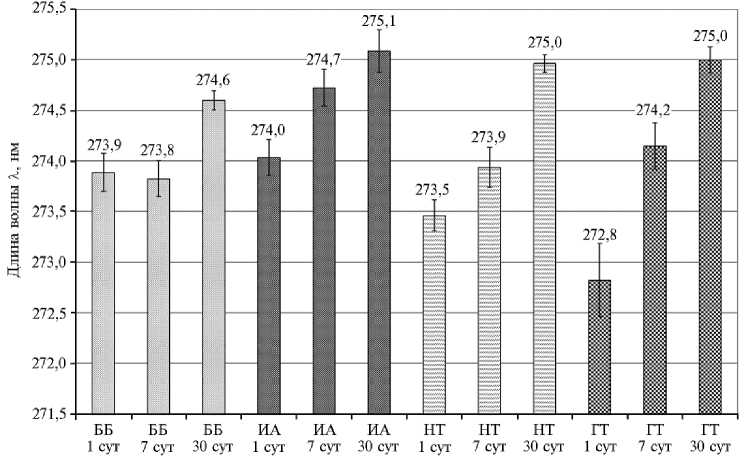
Рис. 3. Влияние гипотрофии и ее фармакокоррекции интерамином или Бифероном-Б на положение локальных максимумов светопоглощения водных растворов Hb в диапазоне длин волн 273275 нм : ИА — интерамин (I группа, n = 10); ББ — Биферон-Б (II группа, n = 10); ГТ — телята-гипотрофики (III группа, n = 10); НТ — телята-нормотрофики (IV группа, n = 10); 1, 7, 30 сут — время после начала применения препаратов; спектрофотометр Shimadzu UV 1700 (PC) («Shimadzu», Япония) ( M ±SD, телята красно-пестрой масти голштинской породы, Воронежская обл., 2022 год).
Сравнительный анализ второго локального максимума в области 275 нм показал, что у нормотрофиков (IV группа) и гипотрофиков (I группа) 386
при использовании интерамина, в отличие от животных, которые получали Биферон-Б (II группа), этот пик становится выраженным уже к 7-м сут развития. У нормотрофиков (IV группа) и гипотрофиков (III группа) локальный максимум в области 275 нм регистрировался к 30-м сут (рис. 3).
Таким образом, сравнение спектров поглощения водных растворов гемоглобина показало, что локальный максимум в области 270 нм у телят-нормотрофиков (IV группа) не регистрируется к 30-м сут жизни (см. рис. 2), а у телят-гипотрофиков (I группа) применение интерамина нивелирует первый локальный максимум в области 270 нм к 7-м сут и ускоряет смещение локальных максимумов в область 275 нм, которое происходит также на 7-е сут жизни (см. рис. 3). Анализ спектров в диапазоне длин волн 250-290 нм в целом позволяет заключить, что у телят-гипотрофиков интерамин сокращает сроки замены фетального гемоглобина на взрослый HbA.
У многих видов животных, в том числе у крупного рогатого скота, в неонатальный период онтогенеза в эритроцитах происходит переключение синтеза γ -цепи гемоглобина на β -цепь, благодаря чему число эритроцитов, продуцирующих HbF, постепенно уменьшается, в то время как число эритроцитов, синтезирующих HbA, возрастает (16). Конститутивность работы систем транскрипции и регуляции транскрипции генов Hb позволяет предполагать сходство этих процессов у многих животных разных видов (17). У млекопитающих наиболее изученным белком — репрессором синтеза γ -цепи гемоглобина является белок BCL11A (B cell lymphoma 11A), который способен изменять экспрессию генов через ремоделирование хроматина благодаря наличию в структуре BCL11A мотивов типа «цинковые пальцы». Помимо регуляции синтеза гемоглобинов, BCL11A влияет на развитие мозга, а также функционирование гематопоэтических и иммунных клеток. Исследования in vitro и in vivo показывают постепенное повышение активности BCL11A и его трансляции de novo в эритроидных клетках после рождения (16). Многие другие транскрипционные факторы (GATA1, KLF1, SOX6 и MYB6) и регуляторные микроРНК также способны влиять на транскрипцию γ - и β -цепи гемоглобинов и образование HbF как непосредственно, так и через воздействие на BCL11A (16-19). На синтез HbF также влияет парциальное давление O 2 в тканях. Так, в исследовании на эритропоэтических стволовых клетках человека in vitro при снижении содержания O 2 выявлено значимое повышение числа эритроцитов, содержащих HbF (20). Вероятно, такие изменения регулируются действием HIF-1 α , поскольку показано его влияние на некоторые транскрипционные факторы и медиаторы при эритропоэзе, например EPO (Erythropoietin) (21).
Одним из ключевых регуляторов многих эритроидных генов служит транскрипционный фактор KLF1 (Kruppel-like factor 1), который значительно повышает экспрессию β-цепей гемоглобинов и активирует белок-репрессор синтеза γ-цепи BCL11A (22). Исследования продемонстрировали отсутствие прямой зависимости экспрессии KLF1 от парциального давления О2 и действия HIF-1α (20). Таким образом, KLF1 потенциально мог бы выступать в качестве переключателя синтеза HbF на синтез HbA даже в условиях локальной гипоксии, поскольку сверхэкспрессия KLF1 приводит к более раннему переключению экспрессии генов γ-цепи гемоглобинов на экспрессию генов β-цепи (23). Кроме того, KLF1 является регулятором множества клеточных метаболических путей (клеточный цикл, апоптоз, регулирование цитоскелета, синтез гемма), необходим для дефинитивного эритропоэза и определяет первичный ответ клеток на стрессовые воздействия, активируя системы антитоксической защиты (цитохом P450-оксидо- редуктазу) (17). При этом увеличение экспрессии KLF1 возможно при воздействии активатора эритропоэза EPO (24).
Таким образом, задержка в переключении с синтеза γ -цепи на синтез β -цепь в эритроидных клетках у телят-гипотрофиков может быть вызвана состоянием анемии и гипоксии, поскольку антенатальная гипотрофия телят сопровождается нарушениями в кровеносной системе животных. Наблюдается диссеминированное внутрисосудистое свертывание крови, гипохромия и другие патологические состояния, которые возникают вследствие дисфункции кроветворных органов и трансмембранной потери гемоглобина (25). В свою очередь, нарушения в системе транспортировки кислорода могут поддерживаться воспалительной супрессией нормального эритропоэза со стороны иммунной системы (21). Так, IFN- β репрессирует развитие эритроидных клеток (26), а провоспалительный фактор TNF- α способен ингибировать эритропоэз посредством различных механизмов, например ингибируя экспрессию GATA1-зависимых генов, что приводит к снижению дифференцировки эритроцитов, регулируя экспрессию мРНК ЕРО в почках, блокируя передачу сигнала от HIF-1 α при HIF-1 α -индуцированной экспрессии ЕРО (21). При этом факторы регуляции транскрипции TGF β и SCF (Stem Cell Factor) индуцируют синтез γ -цепей гемоглобина и образование HbF (27). Поскольку при гипотрофии у новорожденных телят наблюдаются нарушения функций иммунной системы с образованием большого количества провоспалительных цитокинов и снижением содержания иммуннорегуля-торов (28), число эритроцитов c HbF у таких животных может оставаться высоким. Вероятные причины этого — продолжающаяся гипоксия, воспалительная репрессия ЕРО-индуцированного эритропоэза, сохранение продукции HIF-1 α , TGF β и SCF, что в эритроидных клетках приводит к снижению экспрессии KLF1 и уменьшению активности BCL11A, вследствие чего не подавляется синтез γ -цепей гемоглобина.
В настоящее время остается не до конца выясненным механизм воздействия интерамина на организм телят. Полученные данные позволяют предполагать влияние IFN- α и IFN- γ , поскольку применение содержащего их препарата Биферон-Б также приводило к коррекции положения характерных для HbF максимумов в спектре поглощения у телят-гипотрофиков. В то же время ускоренное по сравнению с нормотрофиками исчезновение пиков, характерных для HbF, уже на 7-е сут может свидетельствовать о иммуномодуляции и активации кроветворения и антиоксидантной системы интерамином благодаря тканевому компоненту препарата (29). Таким образом, возможно, интерамин благодаря своему влиянию на эритропоэз может индуцировать переключение экспрессии с γ -цепи гемоглобинов на β -цепи. Сообщалось, что такие иммуномодуляторы, как рапамицин, ресвератрол, талидомид, индуцировали образование HbF, подавляя или стимулируя эритропоэз (30). Тканевой иммуномодулирующий препарат аминоселетон на основе селезенки крупного рогатого скота также стимулировал эритропоэз и активность антиоксидантной защиты у коров и свиней (29). Иммунокорректоры Пролам и Иммунофан индуцировали снижение количества TNF α , но увеличивали концентрацию IL1 β в плазме крови у телят-гипотро-фиков. При этом наблюдались некоторые различия в уровнях других цитокинов при иммунном ответе (28).
Различия в действии препаратов на эритропоэз и продукцию цитокинов свидетельствуют о существовании разных механизмов, обеспечивающих иммуномодулирующий эффект и успешную коррекцию патологий крови и обмена кислорода. Один из гипотетических механизмов улучшения состояния телят при анемии и гипоксии под влиянием корректирующих препаратов предполагает прямое изменение концентрации цитокинов, например 388
снижение продукции TNF α , приводящее к увеличению синтеза EPO, стимуляции нормального эритропоэза, повышению парциального давления О 2 в тканях и, в итоге, к синтезу преимущественно HbA. Другим таким механизмом, вероятно, может выступать усиление стресс-индуцированного эритропоэза в SEP (stress erythroid progenitors), которые находятся в селезенке и обеспечивают альтернативные клеточные ответы при воздействии цитокинов (21). Так, провоспалительные цитокины TNF α и IL1 β увеличивают in vitro пролиферацию SEP (в отличие от эритроидных предшественников в костном мозге), а IFN- γ вовлечен в рекрутирование моноцитов для расширения ниши SEP в селезенке (21). Возможно, активность стресс-ин-дуцированного эритропоэза, которую стимулируют препараты-иммунномо-дуляторы, способна в некоторой степени компенсировать супрессию эритропоэза, вызванную острым воспалением, и улучшать состояние телят-гипо-трофиков при анемии и гипоксии, что снизит продукцию HIF-1 α и приведет к переключению программ транскрипции в клетках-предшественниках эритроцитов c синтеза HbF на HbA.
В наибольшей степени проблемы индуцированного гипоксией изменения содержания HbF и HbA в крови в настоящее время изучены у человека (13, 18, 31). Известно, что ряд таких факторов, как гестационный возраст, морфофункциональная зрелость ребенка, особенности внутриутробного развития, характер родоразрешения, течение периода ранней адаптации и воздействие токсических веществ оказывают влияние на сроки смены гемоглобина новорожденных детей (18, 31). Однако данных о причинах задержки смены HbF на HbA у новорожденных все еще недостаточно. Плацентарная недостаточность и хроническая внутриутробная гипоксия, которые могут сопровождать патологические состояния во время беременности, позволяют сделать заключение о неблагоприятном влиянии гипоксических состояний на эритропоэз плода (31). У новорожденных, подвергавшихся хронической внутриматочной гипоксии, и недоношенных детей наблюдалось достоверное увеличение содержания HbF в крови, при этом определение гемоглобинов различных форм может быть использовано в качестве чувствительного маркера при диагностике патологий кислородтранспортной системы и терапии пациентов в состоянии гипоксии (32, 33). Интересно, что условия высокогорной гипоксии вызывали созревание эритроцитов, содержащих HbF, у здоровых взрослых людей, а возвращение к нор-моксии приводило к статистически значимому снижению количества HbF уже через 72 ч (34). При этом процессы синтеза γ - и β -цепей гемоглобина зависели от содержания HIF-1 α и EPO в крови (34).
Представленные результаты исследования могут косвенно свидетельствовать в пользу полученных нами данных, поскольку демонстрируют диагностическую значимость определения HbF при некоторых патологиях кровеносной системы новорожденных, важную роль эритропоэза, выступающего в качестве компенсаторного механизма при гипоксических состояниях, а также возможность относительно быстрой замены HbF на HbA при достижении нормоксии.
Вместе с тем предложенные механизмы действия интерамина и других препаратов-иммуномодуляторов на процессы кроветворения и кисло-родообмена у коров изучены не в полной мере и во многом остаются гипотетическими. У телят недостаточно исследованы системы регуляции факторов транскрипции при эритропоэзе, в частности их сходство с такими системами у других млекопитающих. Также важно выяснить, можно ли использовать концентрацию HbF в крови телят-гипотрофиков в качестве маркера анемии и состояния системы кислородообмена. Эти вопросы пред- ставляют научно-практический интерес и требуют дальнейшего изучения.
Итак, мы впервые оценили влияние комплексного препарата инте-рамина на морфофункциональное состояние гемоглобинов незрелого молодняка крупного рогатого скота с признаками антенатальной гипотрофии и коморбидными патологиями (анемии, иммунодефицит, гипоксия). Установленные различия в УФ-спектрах гемоглобинов в положении локальных максимумов светопоглощения при длине волны 270 и 275 нм, соответствующих присутствию в крови фетального и дефинитивного гемоглобинов, свидетельствуют о том, что у телят-гипотрофиков интерамин ускоряет замещение фетального гемоглобина на дефинитивный уже на 7-е сут (в сравнении с телятами-гипотрофиками без лечения и получавшими препарат сравнения Биферона-Б). Обнаруженные изменения, которые происходят под действием интерамина, указывают на нормализацию кислородтранспортной функции крови у телят с гипотрофическим развитием. Эти процессы, по нашему мнению, могут происходить как вследствие прямого влияния компонентов интерамина на эритропоэз, так и через иммуномодулирующее действие исследуемого препарата за счет снижения содержания провоспалительных цитокинов в организме телят.


