Стволовые опухолевые клетки меланомы. Поражение костного мозга. Обзор и представление собственных данных
Автор: Чулкова С.В., Чернышева О.А., Маркина И.Г., Купрышина Н.А., Тупицын Н.Н.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Молекулярная медицина
Статья в выпуске: 4 т.19, 2019 года.
Бесплатный доступ
Меланома - агрессивная опухоль, отличающаяся ранним процессом метастазирования и лекарственной резистентностью, которую связывают с особой популяцией клеток - опухолевых стволовых клеток. Одним из органов, поражение которого установлено при меланоме, является костный мозг. Идентификация опухолевых стволовых клеток меланомы в костном мозге возможна на основании отличительных стволовоклеточных маркеров, одним из которых является CD133. В данном исследовании методом проточной цитометрии проанализировано 47 образцов костного мозга больных меланомой с различными стадиями процесса. Установлено наличие Syto41+CD45-HMB-45+ клеток (57,4%), среди которых обнаружена популяция Syto41+CD45-HMB-45+CD133+ клеток.
Стволовые опухолевые клетки, костный мозг, меланома, проточная цитометрия
Короткий адрес: https://sciup.org/149132116
IDR: 149132116
Текст научной статьи Стволовые опухолевые клетки меланомы. Поражение костного мозга. Обзор и представление собственных данных
Меланома кожи – это опухоль нейроэктодермального происхождения, которая возникает в результате трансформации меланоцитов кожи. На ее долю приходится около 4% от всех злокачественных новообразований кожи. Опухоль была впервые выделена в отдельную нозологическую форму в 1806 году Рене Лаэннеком, который описал несколько случаев «черной опухоли» и предложил для ее обозначения термин «les melanosis» (от греческого melas – черный). Опухоль характеризуется агрессивным течением, высокой степенью лимфогенного и гематогенного метастазирования. В настоящее время эта опухоль стала представлять реальную угрозу для значительного числа людей, поскольку темп прироста заболеваемости меланомой кожи за последние десятилетия относится к одним из самых высоких среди всех злокачественных новообразований [19]. В России за последние 10 лет заболеваемость меланомой выросла с 4,55 до 6,1 на 100000 населения. Эпидемиологические исследования свидетельствуют также о неуклонном росте заболеваемости меланомой в различных странах мира: в среднем на 10% в год [17]. Самая высокая заболеваемость зарегистрирована в США и Австралии. Составляя не более 4% от всех онкологических заболеваний, меланома ответственна за 80% смертей, приходящихся на данную группу опухолей.
Современные методы диагностики меланомы позволяют установить диагноз на ранних стадиях заболевания и выполнить радикальное хирургическое лечение. Значительную проблему представляет метастатическая меланома, поскольку она отличается высокой устойчивостью к современным методам лекарственной терапии. Средняя выживаемость пациентов с метастазами составляет немногим более года, а 10летний рубеж переживают не более 10% больных [28]. В последние годы достижения в области иммуноонкологии превзошли ожидания ученых. В арсенале врачей-онкологов появились новые иммунопрепараты, обладающие направленностью действия и значительной эффективностью, однако, как свидетельствуют статистические данные, 5летняя выживаемость больных с диссеминированным заболеванием не превышает 20 % [5].
В мировом научном сообществе ведутся многочисленные исследования и активные дискуссии о роли опухолевых стволовых клеток (ОСК) в развитии лекарственной устойчивости меланомы. Все больше появляется доказательств того, что особые маркеры клеточной поверхности ОСК и нарушения их сигнальных путей причастны к данному процессу. Наравне с этим важную роль приобретает микроокружение опухолевых клеток, так называемая метастатическая ниша. Микроокружение способно не только влиять на отдельные свойства опухолевых клеток, меняя их фенотип, но и полностью определять их дальнейшую судьбу [1]. Стромальные клетки, компоненты внеклеточного матрикса, факторы роста, особенности микроархитектуры самой ткани влияют на пролиферацию, дифференцировку ОСК. В этой связи изучение опухолевых клеток, выживших в кровотоке и достигших костного мозга, представляет значительный интерес и особую важность в решении вопроса поиска путей эффективного лечения меланомы.
Поражение костного мозга при меланоме
Считается, что источником возобновления опухолевого процесса являются злокачественные клетки, которые мигрируют с током крови еще до момента установки диагноза. Однако не все клетки, циркулирующие в кровотоке, выживают. Лишь небольшой процент злокачественных клеток, имеющих генотипические преимущества, достигают отдаленных органов. Одним из таких органов является костный мозг -важнейший орган кроветворной системы, осуществляющий гемопоэз. Анатомофизиологические особенности костного мозга создают предпосылки для довольно легкой экстравазации опухолевых клеток, созданию ими преметастатических ниш с последующей реализацией своего злокачественного потенциала. Хорошо васкуляризированный костный мозг с его смесью растворимых белковых факторов, интегринов, хемокинов, молекул клеточной адгезии является наиболее привлекательной нишей для опухолевых клеток [9]. Более 30 лет назад Arguello F. с соавторами в своем экспериментальном исследовании обратили внимание мирового научного сообщества на то, что именно гемопоэтический костный мозг наиболее часто колонизируется опухолевыми клетками. В ходе эксперимента взвесь культуры клеток меланомы В16 в разной концентрации вводилась подопытным мышам в кровоток. Метастатические очаги в костном мозге были обнаружены даже при низких концентрациях [6].
Жизнеспособные опухолевые клетки, осевшие в костном мозге, обладают особенным клеточным фенотипом, что позволяет им адаптироваться к новым условиям и формировать преметастатические ниши. Известно, что клетки, составляющие нишу, и сигнальные пути, контролирующие нормальную пролиферацию и миграцию стволовых клеток, также играют ключевую роль в инвазии, распространении и приживлении опухолевых клеток. В частности, клеточные компоненты ниши обеспечивают места для закрепления соматических стволовых клеток в костном мозге, где кроветворные стволовые клетки физически связаны с остеобластами [8, 32]. Этот процесс опосредован взаимодействием различных сигнальных молекул, включая b-катенин, сигнальный путь Wnt, аберрантная активация которого связана с прогрессированием меланомы [21].
Известно, что микросреда в метастатическом окружении значительно отличается от микросреды, в которой существует первичная опухоль. На опухолевые клетки влияют эпителиальные стволовые клетки, белки внеклеточного матрикса и ряд секретируемых факторов, включая bFGF, HIF, IGF-1, TGF-β и VEGF. Последние стимулируют пролиферацию опухолевых клеток. [4]. Факторы роста продуцируются N-кадгерин экспрессирующими эндотелиальными клетками, фибробластами. Такой сложной структурой отношений обеспечивается выживание опухолевых клеток в результате их взаимодействия со стромальным окружением. Таким образом, создавая уникальную микросреду для опухолевых клеток, костный мозг сохраняет их пролиферативный потенциал в течение многих лет.
Исследования костного мозга при меланоме установили четкую взаимосвязь между поражением костного мозга и прогнозом данного заболевания. Больные, у которых были обнаружены диссеминированные опухолевые клетки в костном мозге на фоне лекарственного лечения, хирургического лечения, демонстрировали существенное сокращение общей выживаемости [11, 25].
Для объяснения подобных наблюдений учеными была предложена концепция существования опухолевых стволовых клеток меланомы, которые, обладая отличительными фенотипическими свойствами, способны колонизировать отдаленные органы и приводить к гематогенной диссеминации спустя даже годы клинической ремиссии [26].
Опухолевые стволовые клетки
Одна из концепций, объясняющих гетерогенность опухоли – это теория опухолевых стволовых опухолевых клеток, также названная иерархической моделью. Согласно иерархической модели опухолевых стволовых клеток, рост и прогрессирование многих видов рака обусловлены небольшими субпопуляциями клеток, которые называют опухолевыми стволовыми клетками. ОСК обладают способностями к самообновлению и дифференцировке, а также к стимулированию роста и метастазирования опухолей, тогда как большинство опухолевых клеток имеют ограниченный пролиферативный потенциал [2, 13, 29]. По сравнению с доминирующим клоном опухолевых клеток и нормальными стволовыми клетками, ОСК имеют нарушение регуляции сигнальных путей и аберрантные фенотипы. Отличительный репертуар маркеров клеточной поверхности позволяет проводить идентификацию и выделение ОСК из популяции опухолевых клеток [3].
Фенотип меланомы описан как пластический и мультипотентный, аналогичный во многих отношениях фенотипу эмбриональных стволовых клеток [28]. Однако, для ОСК характерна абберантная активация сигнальных путей, что приводит к неконтролируемой пролиферации клеток, а также поддерживает их пластичность [14]. Некоторые агрессивные клоны меланомы демонстрируют эндотелиальный фенотип, экспрессируя CD144 – сосудистый эндотелиальный кадхерин. В своих исследованиях Hendrix MJC и соавторы установили, что только субпопуляции клеток меланомы экспрессировали маркер CD144, что приводило к образованию новых сосудистых сетей опухоли in vitro и in vivo
[10, 15, 16]. Один из маркеров меланомы, обладающий высокой чувствительностью и специфичностью – маркер цитоплазматического премелацитарного гликопротеина gp100 – НМВ45 [30]. Это позволяет использовать его для идентификации диссеминированных клеток меланомы [9]. В разных исследованиях сообщается о таких маркерах ОСК как CD271, ABCB5, CD20, CD133, экспрессия которых наблюдается при меланоме. Стволовоклеточный маркер CD133 первоначально был классифицирован как маркер гемопоэтических предшественников и нервных стволовых клеток. Хотя точная функция CD133 все еще остается неизвестной, экспериментальные данные последних лет показали, что CD133 является важным маркером ОСК при ряде типов опухолей, включая меланому [20, 22, 24]. В лаборатории иммунологии гемопоэза НИИ КО ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России проводится изучение стволовых гемопоэтических и опухолевых клеток в костном мозге онкологических больных. В рамках этой работы проведена оценка возможности выявления диссеминированных и стволовых опухолевых клеток в костном мозге у больных меланомой кожи.
Материалы и методы
Проанализировано 47 образцов костного мозга больных меланомой до начала лечения. У всех больных диагноз подтвержден гистологически. В соответствии с классификацией ТNM в 17,4% случаев была установлена первая стадия, в аналогичном проценте случаев – вторая стадия, у 21,7% больных диагностирована третья стадия. В остальном проценте наблюдений выявлена четвертая стадия заболевания. Среди больных незначительно преобладали женщины. Оценка популяции стволовых и диссеминированных опухолевых клеток проводилась иммунологически в реакции прямой иммунофлюоресценции с использованием тройной флюоресцентной метки. Результаты реакции учитывались на проточном цитометре FACS Canto II, США, программа Facs Diva. Обработка полученных данных проводилась с использованием приложений WinMDI 2.8 и FCS Express Version 3. Иммунофенотип клеток были охарактеризованы на основании экспрессии следующих антигенов: Syto41, CD45, HMB-45, СD133. Экспрессия указанных выше антигенов выявлялась моноклональными антителами, напрямую меченными различными флюорохромами (Табл. 1). Оценка экспрессии антигенов проводилась в пределах ядросодержащих клеток Syto41+. Статистический анализ проведен с использованием пакета SPSS 17 версии для Windows.
Таблица1. Моноклональные антитела
|
Антитело |
Флуоресцентная метка |
Производитель |
Функция |
|
CD45 |
FITC-A |
Becton Diskinson, США |
Общелейкоцитарный антиген |
|
Syto41 |
APCH7 |
Thermo Fisher Scientific, Walthem, MA, USA |
Ядерный краситель |
|
HMB-45 |
APC-A |
Santa Cruz, Biotechnology, Dallas, Tx, USA |
Маркер цитоплазматического премелацитарного гликопротеина gp100 |
|
CD133 |
PE-A |
Becton Diskinson, США |
Антиген гемопоэтических стволовых клеток |
Результаты и обсуждение
Среди оцененных образцов костного мозга больных меланомой установлено наличие Syto41+CD45-HMB-45+ клеток (Рис. 1). Клетки с указанным фенотипом были обнаружены более чем в половине исследуемых случаев (57,4%.) Следующим этапом было изучение экспрессии стволовоклеточного маркера CD133. Из экспериментальных данных известно, что CD133-экспрессирующие клетки из первичной опухолевой ткани меланомы обладают выраженной способностью образовывать опухоли у иммунодефицитных мышей [22]. Кроме того, существует клеточная линия меланомы WM115, которая характеризуется способностью образовывать множественные фенотипы, с выраженной экспрессией CD133, а также способна образовывать сфероиды в среде стволовых клеток [13]. Вместе с тем, принимая во внимание, что установлена взаимосвязь экспрессии CD133 с прогрессированием и развитием лекарственной резистентности меланомы [22, 24] в нашем исследовании была предпринята попытка выявления экспрессии данного маркера у больных меланомой до начала лечения. С этой целью были изучены 22 образца костного мозга. Несмотря на то, что в подавляющем большинстве случаев у больных имелась распространенная стадия меланомы, лишь в одном случае установлено наличие Syto41+CD45-HMB-45+CD133+ клеток (Рис. 2). Известно, что ОСК составляют лишь небольшой процент (0,05-1%) опухолевых клеток в опухолевой массе, содержащей гетерогенную популяцию опухолевых клеток [18]. Процент популяции Syto41+CD45-HMB-45+CD133+ клеток в данном образце составил 1,28% среди всех Syto41+CD45-HMB-45+ клеток меланомы. Следует отметить, что в ряде научных исследований сообщается, что опухолевые клетки не экспрессирующие CD133 могут также инициировать развитие опухоли [23]. В этой связи в группе больных с распространенной стадией меланомы наличие субпопуляции Syto41+CD45-HMB-45+CD133- клеток может служить подтверждением того, что CD133 негативные популяции также могут являться источником опухоли.
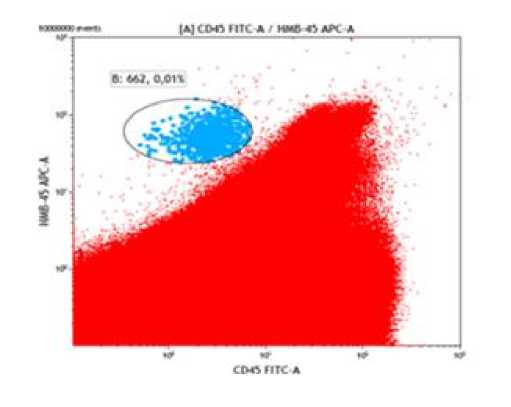
Рисунок 1. Syto41+CD45-HMB-45+ клетки в костном мозге больных меланомой
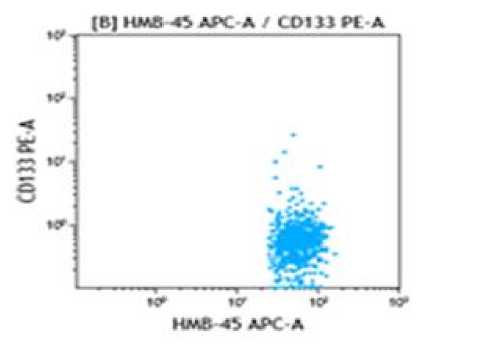
Рисунок 2. Syto41+CD45-HMB-45+CD133+ клетки в образце костного мозга больного меланомой
Следует обратить внимание, что по последним научным данным CD133 может выполнять роль не только маркера ОСК, но и быть важной терапевтической мишенью для метастатической меланомы [3]. В ходе своих исследований in vitro и in vivo к такому выводу пришли американские ученые [24]: ингибирование CD133 приводит к торможению роста опухолевых клеток и метастазирования. Поэтому возможно следует рассматривать больных, у которых выявляется популяция Syto41+CD45-HMB-45+CD133+ клеток, как потенциальных кандидатов для таргетной терапии. Ввиду малочисленности материала, безусловно, требуется дальнейшее исследование поражения костного мозга у больных меланомой, чтобы оценить частоту выявления ОСК и возможность
(перспективность) нацеливания на СD133 у данной категории больных. Особенно важно это для пациентов с диссеминацией опухолевого процесса, поскольку с данной популяцией ОСК меланомы связывают лекарственную устойчивость. В научном мировом сообществе уже сделано несколько попыток в этом направлении и сообщается о специфической терапии антителом/иммунотоксином против CD133, которая успешно проводилась в эксперименте с целью селективной эрадикации CD133 экспрессирующей популяции [7, 27]. Онколитические вирусы кори (MV-141.7 и MV-AC133) инфицировали и избирательно лизировали CD133+ субпопуляции опухолевых клеток [31]. Безусловно, такая потенциальная возможность вызывала крайний интерес ученых, и в настоящее время проводится семь клинических испытаний на ранней стадии, в которых активно исследуется влияние генетически модифицированного вакцинного штамма вируса кори (MV-Edm) на злокачественные опухоли [12].
Заключение
Метастатическая меланома представляет собой значительную проблему клинической онкологии. Ее отличает агрессивность и непредсказуемость течения, поскольку меланома имеет пластичный и мультипотентный фенотип. Поражение костного мозга при меланоме – процесс закономерный и ожидаемый, его результатом является прогрессирование опухоли, развивающееся даже спустя десятилетия стойкой клинической ремиссии. Наличие стволовых опухолевых клеток меланомы с отличительным репертуаром клеточных антигенов предполагает возможность их идентификации среди популяции опухолевых клеток. Одним из таких антигенов является СD133, изучение экспрессии которого в нашем исследовании установило наличие популяции Syto41+CD45-HMB-45+CD133+ клеток. В ряде исследований разработаны антитела против CD133, целью применения которых является элиминация субпопуляции ОСК CD133+.
Таким образом, установлено, что выявление опухолевых стволовых клеток в костном мозге возможно методом проточной цитометрии. Обнаружение ранней диссеминации опухолевого процесса может являться ступенью к индивидуализации лечения данной категории больных. Вместе с тем идентификация диссеминированных в костном мозге клеток с последующим тестированием на наличие антигенов ОСК открывает перспективы в разработке методов воздействия на ОСК меланомы.
Список литературы Стволовые опухолевые клетки меланомы. Поражение костного мозга. Обзор и представление собственных данных
- Чулкова С.В., Маркина И.Н., Антипова А.С. и др. Роль опухолевых стволовых клеток в прогнозе и канцерогенезе меланомы. Вестник РНЦРР. 2018. Т. 18. № 4. С. 100-116.
- Чулкова С.В. Биомаркеры стволовых клеток рака желудка. Вопросы биологической медицинской и фармацевтической химии. 2018. № 10. С. 11-18. DOI: 10.29296/25877313-2018-10-02
- Чулкова С.В., Маркина И.Г., Чернышева О.А. и др. Роль стволовых опухолевых клеток в развитии лекарственной резистентности меланомы. Российский биотерапевтический журнал. 2019. Т. 18. № 2. С. 6-15. 10.17650/1726-9784- 2019-18-2-6-14. DOI: 10.17650/1726-9784-2019-18-2-6-14
- Alessio A.L., Biagioni F., Bianchini S.Б., et al. Inhibition of uPAR-TGFβ crosstalk blocks MSC-dependent EMT in melanoma cells. J Mol Med (Berl). 2015. V. 93. No. 7. P. 783-794. DOI: 10.1007/s00109-015-1266-2
- American Cancer Society. Cancer Fact and Figures. 2018. (https://www.cancer.org/research/cancer-facts-statistics/all-cancer-facts-figures/cancerfacts-figures-2018.html)
- Argüello F., Baggs B.B., Frantz C.N. A murine model of experimental metastasis to bone and bone marrow. Cancer Res. 1988. V. 48. No. 23. P. 6876-6881.
- Bach P., Abel T., Hoffmann C., et al. Specific elimination of CD133+ tumor cells with targeted oncolytic measles virus. Cancer Res. 2013. V. 73. No. 2. P. 865-874.
- Calvi L.M., Adams G.B., Weibrecht K.W., et al. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature. 2003. V. 425. P. 841-846.
- DOI: 10.1038/nature02040
- Chernysheva O.A., Markina I., Demidov L., et al. Bone Marrow Involvement in Melanoma. Potentials for Detection of Disseminated Tumor Cells and Characterization of Their Subsets by Flow Cytometry. Cells. 2019. V. 8. No. 6. E627.
- DOI: 10.3390/cells8060627
- Demou Z.N., Hendrix M.J. Microgenomics profile the endogenous angiogenic phenotype in subpopulations of aggressive melanoma. J Cell Biochem. 2008. V. 105. No. 2. P. 562-573.
- DOI: 10.1002/jcb.21855
- Fodstad O., Faye R., Hoifodt H.K., et al. Immunobead-based detection and characterization of circulating tumor cells in melanoma patients. Recent Results Cancer Res. 2001. V. 158. P. 40-50.
- DOI: 10.1007/978-3-642-59537-0_5
- Galanis E., Hartmann L.C., Cliby W.A., et al. Phase I trial of intraperitoneal administration of an oncolytic measles virus strain engineered to express carcinoembryonic antigen for recurrent ovarian cancer. Cancer Research. 2010. V. 70. No. 3. P. 875-882.
- Hanahan D., Weinberg R.A. Hallmarks of cancer: the next generation. Cell. 2011. V.144. No. 5. P. 646-674.
- DOI: 10.1016/j.cell.2011.02.013
- Hendrix M.J.C., Seftor E.A., Hess A.R., Seftor R.E.B. Vasculogenic mimicry and tumour-cell plasticity: Lessons from melanoma. Nat Rev Cancer. 2003. V. 3. No. 6. P. 411-421.
- DOI: 10.1038/nrc1092
- Hendrix M.J., Seftor E.A., Meltzer P.S. Expression and functional significance of VEcadherin in aggressive human melanoma cells: Role invasculogenic mimicry. Proc Natl Acad Sci USA. 2001. V. 98. No. 14. P. 8018-8023.
- DOI: 10.1073/pnas.131209798
- Hendrix M.J., Seftor R.E.B., Seftor E.A., et al. Transendothelial function of human metastatic melanoma cells: Role of the microenvironment in cell-fate determination. Cancer Res. 2002. V. 62. No. 3. P.665-668.
- Jain D., Singh T., Kumar N., Daga M.K. Metastatic malignant melanoma in bone marrow with occult primary site: A case report with review of literature. Diagn Pathol. 2007. V. 2. Article ID 38.
- DOI: 10.1186/1746-1596-2-38
- Jordan C.T., Guzman M.L., Noble M. Cancer stem cells. New England Journal of Medicine. 2006. V. 355. No. 12. P. 1253-1261.
- DOI: 10.1056/NEJMra061808
- Karimkhani C., Green A.C., Nijsten T., et al. The global burden of melanoma: results from Global Burden of Disease study 2015. Br J Dermatol. 2017. V. 177. No. 1. P. 134-140.
- DOI: 10.1111/bjd.15510
- Klein W.M., Wu B.P., Zhao S., et al. Increased expression of stem cell markers in malignant melanoma. Mod Pathol. 2007. V. 20. No. 1. P. 102-107.
- Larue L., Delmas V. The WNT/Beta-catenin pathway in melanoma. Front Biosci. 2006. V. 11. P. 733-742. doi: 10.2741/1831.
- Monzani E., Facchetti F., Galmozzi E., et al. Melanoma contains CD133 and ABCG2 positive cells with enhanced tumourigenic potential. Eur J Cancer. 2007. V. 43. No. 5. P. 935-946.
- DOI: 10.1016/j.ejca.2007.01.017
- Quintana E., Shackleton M., Sabel M.S., et al. Efficient tumor formation by single human melanoma cells. Nature. 2008. V. 456. No. 7222. P. 593-598.
- DOI: 10.1038/nature07567
- Rappa G., Fodstad O., Lorico A. The stem cell-associated antigen CD133 (Prominin-1) is a molecular therapeutic target for metastatic melanoma. Stem Cells. 2008. V. 26. No.12. P. 3008-3017.
- DOI: 10.1634/stemcells.2008-0601
- Ronald A., Ghossein R.A., Coit D., et al. Prognostic Significance of Peripheral Blood and Bone Marrow Tyrosinase Messenger RNA in Malignant Melanoma. Clin Cancer Res. 1998. V. 4. No. 2. P. 419-428.
- Schatton T., Frank M.H. Cancer stem cells and human malignant melanoma. Pigment Cell Melanoma Res. 2008. V. 21. No. 1. P. 39-55. 10.1111/j.1755- 148X.2007.00427.x.
- DOI: 10.1111/j.1755-148X.2007.00427.x
- Schmohl J.U., Vallera D.A. CD133 Selectively Targeting the Root of Cancer. Toxins (Basel). 2016. V. 8. No. 6. E165.
- DOI: 10.1158/0008-5472.CAN-12-2221
- Strizzi L., Hardy K.M., Kirsammer G.T., et al. Embryonic signaling in melanoma: potential for diagnosis and therapy. Lab Invest. 2011. V. 91. No. 6. P. 819-824.
- DOI: 10.1038/labinvest.2011.63
- Wang Z., Ouyang G. Periostin: a bridge between cancer stem cells and their metastatic niche. Cells stem cells. 2012. V. 10. No. 2. P.111-112.
- DOI: 10.1016/j.stem.2012.01.002
- Wick M.R., Swanson P.E., Rocamora A. Recognition of malignant melanoma by monoclonal antibody HMB-45. An immunohistochemical study of 200 para n-embedded cutaneous tumors. J Cutan Pathol. 1988. V. 15. No. 4. P. 201-207. 10.1111/j.1600- 0560.1988.tb00544.x.
- DOI: 10.1111/j.1600-0560.1988.tb00544.x
- Yoo S.Y., Bang S.Y., Jeong S.N., et al. A cancer-favoring oncolytic vaccinia virus shows enhanced suppression of stem-cell like colon cancer. Oncotarget. 2016. V. 7. No. 13. P. 16479-16489.
- DOI: 10.18632/oncotarget.7660
- Zhang J., Niu C., Ye L., et al. Identification of the haematopoietic stem cell niche and control of the niche size. Nature. 2003. V. 425. No. 6960. P. 836-841.
- DOI: 10.1038/nature02041


