Сывороточный уровень остеопонтина ассоциирован с наличием мерцательной аритмии у больных с кальцинированным аортальным стенозом
Автор: Типтева Татьяна Алексеевна, Чумакова Ольга Сергеевна, Резниченко Наталия Евгеньевна, Сафарян Вахтанг Иванович, Бакланова Татьяна Николаевна, Волошина Наталья Михайловна, Затейщиков Дмитрий Александрович
Журнал: Клиническая практика @clinpractice
Рубрика: Передовая статья
Статья в выпуске: 2 (30), 2017 года.
Бесплатный доступ
Поиск факторов риска развития мерцательной аритмии (МА) у больных с кальцинированым аортальным стенозом (АС) остается актуальной задачей.Цель - изучить взаимосвязь уровней профибротических биомаркеров в периферической крови с наличием МА у больных с АС.Материалы и методы. 191 больной (29,8% мужчин, 77,7±0,59 лет) с АС (площадь аортального клапана (АК) ≤ 2,0 см2) были разделены на группы с МА и без. Проводилось сравнение клинических, эхокардиографических и биохимических параметров, а также сывороточных уровней биомаркеров фиброза: трансформирующего фактора роста β1 (TGFβ1) и остеопонтина (OPN).Результаты. МА была зарегистрирована у 83(36,5%) больных. Независимыми параметрами, ассоциированными с развитием МА стали: индекс площади АК (p=0,040), систолический объём левого предсердия (p=0,021), уровень OPN (р=0,009). При разделении всех больных с АС на две группы в зависимости от уровня OPN (больше или меньше 10,05 нг/мл) получено почти двукратное различие (53,8% и 29,2%, соответственно) в частоте встречаемости МА (p=0,020).Заключение. Профибротический биомаркер OPN ассоциирован с наличием МА у больных с АС независимо от степени тяжести порока, что может свидетельствовать о его участии в фиброзе предсердий.
Аортальный стеноз, мерцательная аритмия, остеопонтин, фиброз
Короткий адрес: https://sciup.org/143164636
IDR: 143164636
Текст научной статьи Сывороточный уровень остеопонтина ассоциирован с наличием мерцательной аритмии у больных с кальцинированным аортальным стенозом
Появление мерцательной аритмии (МА) у больного с кальцинированным аортальным стенозом (АС) повышает риск развития сердечной недостаточности (СН) в 4,1 раза, а негеморрагического инсульта в 4,8 раз[1].
Клапанные пороки сердца относятся к основным факторам риска развития МА наряду с возрастом, мужским полом, артериальной гипертензией (АГ), сахарным диабетом, перенесенным инфарктом миокарда (ИМ) и СН [2]. Ключевым патогенетическим условием развития МА при пороках является увеличение в размере левого предсердия (ЛП) вследствие нарушения гемодинамики. Однако, не у всех больных с АС, сопоставимых по основным факторам риска и имеющих схожие изменения геометрии ЛП, развивается МА [3].
Важным фактором для возникновения МА является предсердный интрамиокардальный фиброз [4], который интенсифицируется при АС. Сложность изучения процессов фиброза in vivo при АС заключается в параллельности процессов, как в клапане, так и в миокарде [5-7].
Трансформирующий фактор роста β1 (transforming growth factor beta1, TGFβ1), один из ключевых цитокинов, контролирующих производство белков экстрацеллюлярного матрикса (ЭЦМ) [4]. Повышенная экспрессия цитокина приводит к развитию фиброза и дисфункции различных органов, в том числе предсердий [8]. Остеопонтин (osteoponitin, OPN), белок костного ЭЦМ, имеет множество функций, одной из которых является реализация профибротиче-ских эффектов TGFβ1 и ангиотензина II в мио-карде[9].
Целью нашей работы б ыло изучить ассоциации уровней TGFβ1 и OPN в периферической крови больных с АС с фактом наличия МА.
Характеристика больных и методы исследования
В исследование был включен 191 больной (29,8% мужчин, средний возраст 77,7±0,59 лет) с установленным при эхокардиографическом (ЭХОКГ) исследовании диагнозом АС (площадь аортального клапана (АК) ≤ 2,0 см2). Все больные на момент включения в исследование находились на стационарном лечении в кардиологическом отделении ГБУЗ «Городская клиническая больница №17 ДЗМ». Критериями включения, помимо АС, были письменное согласие больного на использование данных в научных целях. В исследование не включались больные с двухстворчатым АК, другой значимой клапанной патологией, с подозрением на ревматический генез порока. Исследование было одобрено местным этическим комитетом.
При включении фиксировались данные общего осмотра, анамнеза, сведения о проводимой терапии, основные лабораторные параметры. Дополнительно производилось взятие крови для определения уровней TGFβ1 и OPN в сыворотке крови.
Трансторакальное ЭХОКГ исследование проводилось на ультразвуковом аппарате Vivid i фирмы General Electric с мультичастотным фазированным датчиком 3S-RS (1,7-4,0 МГц). Применялся стандартный протокол исследования, рекомендованный Американской Ассоциацией эхокардиографии [10]. Площадь АК высчитывалась с использованием уравнения непрерывности, согласно объединенным европейским и американским рекомендациям 2009 года: площадь АК 1,5-2,0 см2 соответствовала начальной степени, 1,0-1,5 см2 – умеренной, а <1,0 см2 – тяжелой степени АС, индекс площади АК рассчитывался как отношение к площади поверхности тела.
Трансформируюший фактор роста β 1. Измерение уровня TGFβ1 производилось c использованием иммуноферментного набора для количественного определения человеческого TGFβ1 в сыворотке крови (Bender MedSystems, Австрия). Для анализа была использована сыворотка крови, отделенная от сгустка эритроцитов сразу после свёртывания крови, аликвотирован-ная и замороженная при температуре – 200°С. Нормальное значение от 4639 до 14757 пг/мл.
Остеопонтин. Измерение уровня OPN производилось c использованием иммунофермент-ного набора для количественного определения человеческого OPN в сыворотке крови (Bender MedSystems, Австрия). Для анализа была использована сыворотка крови, отделенная от сгустка эритроцитов сразу после свёртывания крови, аликвотированная и замороженная при температуре – 200°С. Нормальное значение от 2,3-75,2 нг/мл.
Статистическую обработку результатов проводили с помощью стандартного статистического пакета программ IBM SPSS Statistics Version 22 для Windows. Распределение всех клинических параметров, оцененное по критерию Колмогорова-Смирнова, не соответствовало нормальному, поэтому для анализа применяли непараметрические методы расчета. Про-
Таблица 1
Сравнительная характеристика больных АС с и без мерцательной аритмии (n=191)
|
Параметр |
АС с МА (n=83) |
АС без МА (n=108) |
р |
|
Анамнез |
|||
|
Возраст, лет |
79,5±0,74 |
76,3±0,85 |
0,007 |
|
Пол мужской, n (%) |
25(30,1%) |
32(29,6%) |
нд |
|
Курение, n (%) |
12(14,5%) |
23(21,3%) |
нд |
|
Артериальная гипертония, n (%) |
81(97,6%) |
103(95,4%) |
нд |
|
Обмороки, n (%) |
17(20,5%) |
14(13,0%) |
нд |
|
Стенокардия, n (%) |
67(80,7%) |
85(78,7%) |
нд |
|
Инфаркт миокарда, n (%) |
46(56,1%) |
49(45,4%) |
нд |
|
Инсульт, n (%) |
15(18,1%) |
16(14,8%) |
нд |
|
Сахарный диабет, n (%) |
19(22,9%) |
26(24,1%) |
нд |
|
Атеросклероз периферических артерий, n (%) |
23(27,7%) |
22(20,4%) |
нд |
|
ХСН III-IV NYHA, n (%) |
32(38,6%) |
29(26,9%) |
нд |
|
Отеки, n (%) |
43(51,8%) |
49(45,4%) |
нд |
|
ИМТ, кг /м2 |
30,6±0,60 |
30,0±0,54 |
нд |
|
Ожирение (ИМТ>30 кг /м2) |
35(42,2%) |
48(44,4%) |
нд |
|
Лабораторные характеристики |
|||
|
Креатинин, мкмоль/л |
117,7±3,55 |
114,6±5,34 |
нд |
|
СКФ, мл/мин |
46,8±1,70 |
51,5±1,79 |
нд |
|
ОХС, ммоль/л |
5,0±0,15 |
5,4±0,12 |
0,025 |
|
ТГ, ммоль/л |
1,5±0,09 |
1,9±0,12 |
0,044 |
|
ЛНП, ммоль/л |
2,5±0,11 |
2,7±0,10 |
нд |
|
ЛВП, ммоль/л |
1,3±0,06 |
1,4±0,06 |
нд |
|
TGFβ1, пг/мл |
21227,8±1381,18 |
20581,5±1349,68 |
нд |
|
Остеопонтин нг/мл |
15,5±3,37 |
9,2±0,70 |
0,018 |
|
Эхокардиографические параметры |
|||
|
Площадь АК, см² |
0,9±0,05 |
1,1±0,04 |
нд |
|
Индекс площади АК, см2/ м² |
0,5±0,03 |
0,6±0,02 |
0,037 |
|
Индекс систолического объема ЛП,мл/м2 |
44,8±1,45 |
38,7±1,37 |
<0,0001 |
|
Систолический объем ЛП, мл |
80,5±2,52 |
68,8±2,20 |
<0,0001 |
|
ФВ ЛЖ, % |
59,5±1,53 |
64,5±1,19 |
0,005 |
|
ТМЖП |
12,6±0,28 |
12,6±0,29 |
нд |
|
Индекс ММ ЛЖ, г/м² |
123,3±4,21 |
116,7±3,74 |
нд |
|
Наличие нарушений локальной сократимости |
16(19,3%) |
12(11,1%) |
нд |
|
E/e’ |
12,4±0,57 |
14,3±0,74 |
нд |
|
Сопутствующая терапия |
|||
|
ИАПФ/БРА,n(%) |
66(79,5%) |
81(75,0%) |
нд |
|
Статины,n(%) |
30(36,1%) |
65(60,2%) |
0,001 |
|
β-блокаторы,n(%) |
62(74,7%) |
101(63,5%) |
нд |
|
Кордарон,n(%) |
10(12,0%) |
0 |
<0,0001 |
|
Нитраты,n(%) |
21(25,3%) |
25(23,1%) |
нд |
|
Са-блокаторы,n(%) (дигидропиридиновые) |
9(10,8%) |
42(26,4%) |
0,028 |
|
Са-блокаторы,n(%) (недигидропиридиновые) |
3(3,6%) |
5(4,6%) |
нд |
|
Варфарин/НОАК,n(%) |
12(14,5%) |
1(0,9%) |
<0,0001 |
|
Диуретики петлевые,n(%) |
45(54,2%) |
40(37,0%) |
0,018 |
|
Диуретики тиазидные,n(%) |
14(16,9%) |
38(35,2%) |
0,005 |
|
Антагонисты альдостерона,n(%) |
32(38,6%) |
36(33,3%) |
нд |
АС – аортальный стеноз, МА – мерцательная аритмия, ХСН – хроническая сердечная недостаточность, ИМТ – индекс массы тела, СКФ – скорость клубочковой фильтрации, рассчитанная по формуле Кокрофта-Голта, ОХС – общий холестерин, ТГ – триглицериды, ЛНП – липопротеины низкой плотности, ЛВП – липопротеины высокой плотности, АК – аортальный клапан, ЛП – левое предсердие, ФВ – фракция выброса, ЛЖ-левый желудочек, ТМЖП – толщина межжелудочковой перегородки, E/e’ – отношение пика Е трансмитрального кровотока к пику е скорости движения фиброзного кольца митрального клапана, ИАПФ– ингибиторы ангитензинпревращающего фермента, БРА – блокаторы рецепторов ангиотензина II, НОАК – новые оральные антикоагулянты тяженные переменные представляли в виде средних величин (M±SD). Различия протяженных переменных оценивали тестами Mann– Whitney и Kruskal–Wallis, дискретных – критерием χ2 Пирсона. Корреляционный анализ проводили с использованием коэффициента Спирмена (rs). Поиск ассоциаций клинических, инструментальных и лабораторных параметров c наличием МА проводился методом логистической регрессии. В регрессионный однофакторный анализ включались параметры, различавшиеся при простом сравнительном анализе между группами больных с и без МА. Оценка преди-кторного значения величин проводилось путем построения ROC кривой и вычисления площади под кривой (AUC).Для всех видов анализа статистически значимыми считали значения p < 0,05.
Результаты
Характеристика больных АС по данным клинического обследования представлена в таблице 1.
МА регистрировалась у 83 (36,5%) больных. По сравнению с больными без МА они были достоверно старше, имели более низкие уровни общего холестерина (ОХС) и триглицеридов (ТГ) и более высокий уровень OPN (15,5±3,37 нг/мл против 9,2±0,70 нг/мл, р=0,018). Из ЭХОКГ параметров у больных с МА были выше степень стеноза АК и систолический объем ЛП, а фракция выброса (ФВ) ЛЖ была ниже. Больные с МА реже получали статины и дигидропиридиновые антагонисты кальция и, наоборот, чаще кордарон, варфарин/новые оральные антикоагулянты, петлевые и тиазидные диуретики (табл.1).
В однофакторном анализе (таблица 2) показателями, ассоциированными с развитием МА стали: возраст (р=0,007), индекс площади АК (р=0,002), систолический объем ЛП (р<0,0001), ФВ ЛЖ (р=0,029) и уровень OPN в сыворотке крови (р=0,021).
Учитывая очевидную взаимосвязь площади АК и размера ЛП многофакторный анализ был проведен в два этапа с раздельным включением этих показателей (Таблица 2).
В результате независимыми параметрами, ассоциированными с наличием МА у больных с АС стали: в 1-й модели – индекс площади АК (р=0,040) и уровень OPN в сыворотке крови (р=0,009), во 2-й модели – систолический объем ЛП (р=0,021) и также уровень OPN в сыворотке крови (р=0,017).
Уровень ОПН ассоциировался с повышением риска развития МА (AUC 0,651 [0,5320,769], 95%ДИ, р=0,018) (Рисунок 1). По оптимальному соотношению чувствительности и специфичности была определена cut off уровня OPN (10,05 нг/мл), при повышении которого получено достоверное (р=0,020), почти двукратное различие (53,8% и 29,2%, соответственно) в частоте встречаемости МА (Рисунок 2).
По оптимальному соотношению чувствительности и специфичности была определена cut off уровня OPN (10,05 нг/мл), при повышении которого получено достоверное (р=0,020), почти двукратное различие (53,8% и 29,2%, соответственно) в частоте встречаемости МА (Рисунок 2).
Таблица 2
Влияние клинических, инструментальных и лабораторных параметров на риск развития мерцательной аритмии у больных с АС (логистическая регрессия)
|
Параметр |
Однофакторный анализ ОР (95%ДИ) |
р |
Многофакторный анализ OР [95% ДИ] с учетом площади АК |
р |
Многофакторный анализ OР [95% ДИ] с учетом объема ЛП |
р |
|
Возраст |
1,053[1,014-1,094] |
0,007 |
1,049[0,973-1,131] |
нд |
1,033[0,968-1,103] |
нд |
|
Индекс площади АК,см2/м² |
0,394[0,216-0,719] |
0,002 |
0,296[0,093-0,944] |
0,040 |
- |
- |
|
Систолический объем ЛП, мл |
3,959[2,156-7,268] |
<0,0001 |
- |
- |
3,3250[1,196-9,241] |
0,021 |
|
ФВ ЛЖ |
0,424[0,197-0,914] |
0,029 |
0,405[0,111-1,481] |
нд |
0,457[0,145-1,440] |
нд |
|
Остеопонтин, нг/мл |
2,833[1,169-6,867] |
0,021 |
4,506[1,447-14,036] |
0,009 |
3,326[1,245-8,887] |
0,017 |
|
ОХС, ммоль/л |
0,751[0,590-0,957] |
0,021 |
0,954[0,633-1,439] |
нд |
- |
- |
|
ТГ, ммоль/л |
0,658[0,453-0,954] |
0,027 |
0,823[0,417-1,624] |
нд |
- |
- |
АК – аортальный клапан, ЛП – левое предсердие, ФВ ЛЖ – фракция выброса ЛЖ, ОХС – общий холестерин, ТГ – триглицериды
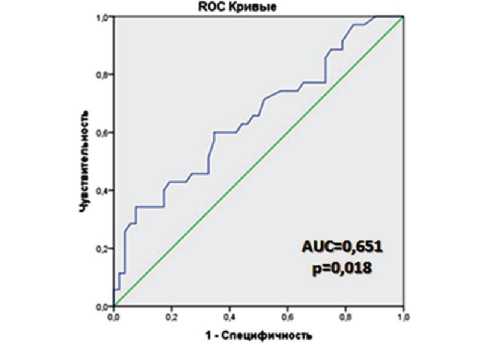
Рис. 1. Прогностическая значимость развития мерцательной аритмии у больных АС, в зависимости от уровня OPN
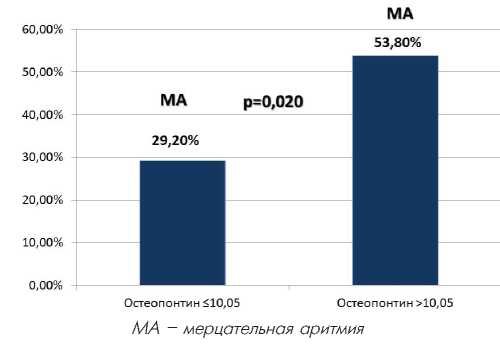
Рис. 2. Частота встречаемости мерцательной аритмии у больных с АС в зависимости от уровня остеопонтина > или ≤ 10,05 нг/мл
ОБСУЖДЕНИЕ
Большой разброс частоты встречаемости МА при АС, согласно предшествующим исследованиям (от 5% до 43,7%), указывает на недостаточность данных по этому вопросу [1, 11]. Частота выявления МА у больных с АС в нашем исследовании составила 36,5%, что наиболее вероятно, связано с преобладанием умеренной и тяжелой степени порока (86,4%). Кроме того, в нашей группе больных с увеличением степени тяжести АС возрастала и вероятность наличия МА, что не всегда демонстрировалось в других исследованиях [1, 2].
Связь объема ЛП с наличием МА доказана в многочисленных предшествующих работах на больных с различной патологией[12], и подтверждена в нашей работе у больных с АС.
Трансформирующий фактор роста β1 (TGFβ1) в норме выполняет защитную роль для нейронов центральной и периферической нервной систем, является мощным иммуносупрессором, стабилизирует атеросклеротические бляшки, путем ингибирования местной воспалительной реакции, и, наконец, способствует заживлению ран, стимулируя миграцию нейтрофилов, моноцитов и фибробластов. Однако, повышенная экспрессия TGFβ1 приводит к увеличению синтеза белков ЭЦМ, фиброзу и дисфункции соответствующего органа[8].
Повышенная экспрессия TGFβ1 в АК у больных с АС подтверждена в предыдущих исследованиях [13]. Повышенная экспрессия TGFβ1 в предсердиях и инициация фибротических процессов при МА продемонстрированы ранее в исследованиях на мышах [14]. Данные об уровне TGFβ1 в периферической крови у больных с АС противоречивы [13, 15]. В одних исследованиях уровень TGFβ1 снижается с увеличением степени стеноза, в других корреляция противоположная. Что касается МА, то по данным крупного мета-анализа, включившего 3354 больных с различной патологией, плазменный уровень TGFβ1 прямо коррелирует с риском развития МА[16]. Правда, из 13 вошедших в мета-анализ исследований, только одно было проведено на больных с клапанными заболеваниями сердца, среди которых было 10 больных АС. В нашей работе мы не получили корреляции между сывороточным уровнем цитокина и площадью АК. Также не было разницы в уровне TGFβ1 в группах с и без МА. Вероятно, активность TGFβ1 ограничивается локальными процессами в клапане и миокарде предсердий. Анализ периферической крови на уровень TGFβ1 мало информативен как в отношении степени тяжести порока, так и наличия МА.
Остеопонтин (OPN) изначально был открыт как белок, участвующий в процессах минерализации костей. Позднее было установлено, что OPN участвует в биоминерализации и других тканей, в том числе АК [17]. Одним из механизмов вовлеченности OPN в кальцификацию АК является его способность повышать секрецию HMGB1, провоспалительного цитокина, индуцирующего остеобластическую трансдифференцировку фибробластов [18, 19]. Определение OPN в периферической крови у больных с АС проводилось лишь в небольших исследованиях, в одних из которых уровень OPN прямо коррелировал с наличием и степенью тяжести порока [20], в других подобной взаимосвязи не отмечалось [21]. В нашей работе мы не получили связи уровня OPN с площадью АК, что может косвенно свидетельствовать о невысокой активности OPN в клапане на поздних стадиях АС.
В основе профибротических свойств OPN лежит активация 2х каскадов молекулярных путей: транскрипционного фактора AP-1 (активирующего протеина 1), который самостоятельно инициирует транскрипцию профибро-тических генов, и опосредовано –транскрипцию микроРНК-21[22], и фосфоинозитид-3-киназа/ Акt путь[23], приводящий в итоге к увеличению миграции, пролиферации и выживаемости фибробластов, и, как следствие, увеличению продукции белков ЭЦМ.
Результаты предшествующих исследований, изучавших экспрессию OPN в миокарде предсердий при МА противоречивы. В своей работе Grammer JB. и соавт. [24] упоминают собственные полученные данные предшествующей работы, где было выявлено увеличениие экспрессии OPN у больных с постоянной формой МА по сравнению с больными с синусовым ритмом. Позднее этой же группой ученых были получены противоположные результаты об отсутствии связи уровня экспрессии OPN в ушках предсердий с риском развития МА у больных в послеоперационном периоде [24].
По данным Güneş H.M. и соавт. Повышенный уровень цитокина перед процедурой криоабляции является предиктором рецидива МА после вмешательства [25].
Нами была выявлена независимая связь между более высоким уровнем OPN и МА, на основании чего, мы предполагаем, что процессы фиброза в предсердиях, приводящие к развитию МА, связаны именно с активностью OPN.
В нашей работе больные с МА почти в два раза реже получали статины (36% против 60%) и при этом имели достоверно более низкие уровни ОХС и ТГ. Клетки регулируют захват холестерина из внеклеточного пространства через рецептор-связанный эндоцитоз, причем этот захват увеличивается при его необходимости, как например, в поврежденных мембранах кардиомиоцитов предсердий при МА. Таким образом, объяснением факта снижения уровня липидов у больных с МА может быть эффект их повышенного потребления. В немногочисленных предшествующих работах были выявлены сходные с полученными нами результаты: пониженный уровень ОХС и ЛПНП ассоциирован с высоким риском МА[27].
ЗАКЛЮЧЕНИЕ
В настоящей работе изучена взаимосвязь биомаркеров фиброза с развитием МА у больных с АС. Независимыми факторами, ассоциированными с развитием МА у больных с АС стали: индекс площади АК, систолический объём ЛП и сывороточный уровень OPN. Независимая от степени тяжести порока ассоциация OPN с МА может свидетельствовать о его профибротиче-ских свойствах в миокарде ЛП.
Список литературы Сывороточный уровень остеопонтина ассоциирован с наличием мерцательной аритмии у больных с кальцинированным аортальным стенозом
- Greve AM, Gerdts E, Boman K, Gohlke-Baerwolf C, et al. Prognostic importance of atrial fibrillation in asymptomatic aortic stenosis: the Simvastatin and Ezetimibe in Aortic Stenosis study. International journal of cardiology 2013; 166(1):72-76.
- Kirchhof P, Lip GY, Van Gelder IC, et al. Comprehensive risk reduction in patients with atrial fibrillation: emerging diagnostic and therapeutic options-a report from the 3rd Atrial Fibrillation Competence NETwork/European Heart Rhythm Association consensus conference. Europace 2012; 14(1):8-27.
- Santos IJ, Rodes-Cabau J, Urena M, et al. Incidence, predictive factors, and prognostic value of new-onset atrial fibrillation following transcatheter aortic valve implantation. Journal of the American College of Cardiology 2012; 59(2):178-188.
- Драпкина ОМ, Емельянов АВ. Предсердный фиброз морфологическая основа фибрилляции предсердий. Рациональная фармакотерапия в кардиологии 2013; 9(4): 417-419.
- Dweck MR, Boon NA, Newby DE. Calcific aortic stenosis: a disease of the valve and the myocardium. Journal of the American College of Cardiology 2012; 60(19):1854-1863.
- Chotchaeva Z, Shcheglova EV, Boeva OI, Hait GY, et al. Matrix metalloproteinase 9 and tissue inhibitor of matrix metalloproteinases type 1 serum concentrations and genetic polymorphism in senile aortic stenosis. Advances in gerontology 2015; 28(2):222-227.
- Бабанин В.С., Докина Е.Д., Берестовая Н.А., Алексеева Л.А.: Распространенность кальцификации клапанных структур сердца у женщин с первичным остеопорозом. Кремлевская медицина Клинический вестник 2010;(3):32-34).
- Khan R, Sheppard R. Fibrosis in heart disease: understanding the role of transforming growth factor-β1 in cardiomyopathy, valvular disease and arrhythmia. Immunology 2006; 118(1):10-24.
- Lorenzen JM, Schauerte C, Hübner A, Kölling M, et al. Osteopontin is indispensible for AP1-mediated angiotensin II-related miR-21 transcription during cardiac fibrosis. European heart journal 2015; 36 (32): 2184-2196.
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography 2015; 28(1):1-39. e14.
- Tarantini G, Mojoli M, Windecker S, et al. Prevalence and Impact of Atrial Fibrillation in Patients With Severe Aortic Stenosis Undergoing Transcatheter Aortic Valve Replacement. An Analysis From the SOURCE XT Prospective Multicenter Registry 2016; 9(9):937-946.
- Bollmann A, Husser D, Steinert R, Stridh M, et al. Echocardiographic and electrocardiographic predictors for atrial fibrillation recurrence following cardioversion. Journal of cardiovascular electrophysiology 2003; 14(s10):S162-S165.
- Jian B, Narula N, Li Q-y, Mohler ER, III, Levy RJ. Progression of aortic valve stenosis: TGF-{beta}1 is present in calcified aortic valve cusps and promotes aortic valve interstitial cell calcification via apoptosis. Ann Thorac Surg 2003; 75(2):457-465.
- Verheule S, Sato T, Everett T, Engle SK, et al. Increased vulnerability to atrial fibrillation in transgenic mice with selective atrial fibrosis caused by overexpression of TGF-β1. Circulation research 2004; 94(11):1458-1465.
- Attaran S, Sherwood R, Dastidar MG, El-Gamel A. Identification of low circulatory transforming growth factor β-1 in patients with degenerative heart valve disease. Interactive cardiovascular and thoracic surgery 2010; 11(6):791-793.
- Li J, Yang Y, Ng CY, Zhang Z, Liu T, Li G. Association of plasma transforming growth factor-β1 levels and the risk of atrial fibrillation: a meta-analysis. PloS one 2016; 11(5):e0155275.
- O'Brien KD, Kuusisto J, Reichenbach DD, et al. Osteopontin Is Expressed in Human Aortic Valvular Lesions. Circulation 1995; 92(8):2163-2168.
- Passmore M, Nataatmadja M, Fung YL, Pearse B, Gabriel S, Tesar P, Fraser JF. Osteopontin alters endothelial and valvular interstitial cell behaviour in calcific aortic valve stenosis through HMGB1 regulation. European Journal of Cardio-Thoracic Surgery 2015; 48(3):e20-e29.
- Brown LF, Berse B, Van De Water L, Papadopoulos-Sergiou A, et al. Expression and distribution of osteopontin in human tissues: widespread association with luminal epithelial surfaces. Molecular biology of the cell 1992; 3(10):1169-1180.
- Yu P-J, Skolnick A, Ferrari G, Heretis K, et al. Correlation between plasma osteopontin levels and aortic valve calcification: potential insights into the pathogenesis of aortic valve calcification and stenosis. The Journal of thoracic and cardiovascular surgery 2009; 138(1):196-199.
- Sponder M, Fritzer-Szekeres M, Litschauer B, Binder T, Strametz-Juranek J. Endostatin and osteopontin are elevated in patients with both coronary artery disease and aortic valve calcification. IJC Metabolic & Endocrine 2015; 9:5-9.
- Thum T, Lorenzen JM. Cardiac fibrosis revisited by microRNA therapeutics. Circulation. 2012;126:800-802
- Rangaswami H, Bulbule A, Kundu GC. Osteopontin: role in cell signaling and cancer progression. Trends in cell biology 2006; 16(2):79-87.
- Grammer JB, Böhm J, Dufour A, Benz M, Lange R, Bauernschmitt R. Atrial fibrosis in heart surgery patients. Basic research in cardiology 2005; 100(3):288-294.
- Güneş HM, Babur Güler G, Güler E, et al. Relationship between serum osteopontin level and atrial fibrillation recurrence in patients undergoing cryoballoon catheter ablation. Turk Kardiyol Dern Ars 2017; 45(1):26-32.
- Rosenberg M, Zugck C, Nelles M, et al. Osteopontin, a New Prognostic Biomarker in Patients With Chronic Heart Failure CLINICAL PERSPECTIVE. Circulation: Heart Failure 2008; 1(1):43-49.
- Lopez FL, Agarwal SK, MacLehose RF, Soliman EZ, et al. Blood Lipid Levels, Lipid-Lowering Medications, and the Incidence of Atrial Fibrillation Clinical Perspective. Circulation: Arrhythmia and Electrophysiology 2012; 5(1):155-162.


