Технология получения пищевых добавок – гидролизованных лецитинов
Автор: Лисовая Е.В., Угрюмова Т.И., Данилейко Е.Р., Бородихин А.С., Викторова Е.П.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Пищевые технологии
Статья в выпуске: 9, 2025 года.
Бесплатный доступ
Цель исследований – разработка технологии получения пищевых добавок – гидролизованных жидких лецитинов с заданным содержанием лизофосфолипидов. Объекты исследований – гидролизованные жидкие лецитины, полученные в результате частичного ферментативного гидролиза фосфолипидов, содержащихся в подсолнечном обезжиренном лецитине. Гидролиз осуществляли в лабораторных условиях с помощью ферментного препарата ROHALASE PLXTRA, содержащего фосфолипазу А2 микробного происхождения. Реакционную среду для гидролиза готовили путем смешивания обезжиренного лецитина и дистиллированной воды, предварительно нагретой до 50 °С, в соотношении 1 : 4 (по массе), внесения буферного раствора для получения заданного значения рН среды и ферментного препарата в дозировке, рассчитанной с учетом содержания фосфолипидов в лецитине и активности фермента. Процесс гидролиза осуществляли при постоянном перемешивании и поддержании температуры на заданном уровне. Эффективность гидролиза оценивали по степени конверсии субстрата, т. е. фосфолипидов в лецитине, с учетом степени конверсии индивидуальных групп фосфолипидов, а также их суммарной конверсии. Установлена эффективность применения ROHALASE PLXTRA для получения гидролизованных лецитинов с заданным содержанием лизофосфолипидов. Варьирование значений рН реакционной среды в диапазоне от 3,5 до 4,0 и внесение в реакционную среду хлорида кальция в виде 0,1 и 0,4 М водных растворов не оказывают значимого влияния на эффективность процесса гидролиза. Определены эффективные режимы процесса гидролиза обезжиренного лецитина с применением ферментного препарата ROHALASE PLXTRA при его дозировке 1,0 % к массе лецитина. Получены гидролизованные жидкие лецитины с заданной степенью суммарной конверсии фосфолипидов 40 и 60 % и содержанием лизофосфолипидов (22,4 ± 1,0) и (32,9 ± 1,0) % соответственно. Дальнейшими перспективными направлениями являются исследования в области оценки эффективности и особенностей проявления свойств полученными пищевыми добавками для обоснования их применения в технологиях продуктов питания.
Обезжиренный лецитин, фосфолипиды, гидролиз, фосфолипаза А2, лизофосфолипиды, пищевые добавки, гидролизованные лецитины
Короткий адрес: https://sciup.org/140312356
IDR: 140312356 | УДК: 665.372 | DOI: 10.36718/1819-4036-2025-9-290-304
Текст научной статьи Технология получения пищевых добавок – гидролизованных лецитинов
Введение. Пищевые добавки – гидролизованные лецитины Е322 (ii), отличаются от стандартных лецитинов повышенным содержанием лизофосфолипидов (лизоФЛ).
Специфическое химическое строение молекул лизоФЛ обусловливает не только их уникальную биологическую активность – детергентное действие, способность изменять механические свойства липидных мембран, взаимодействовать с сопряженными G-белками и рецепторами [1, 2], но и технологические свойства, в первую очередь – эмульгирующие [3–5].
Более высокие эмульгирующие свойства гидролизованных лецитинов, по сравнению со стандартными лецитинами, обусловлены более сильным гидрофильным характером молекул лизоФЛ по сравнению с молекулами фосфолипидов (ФЛ) [4].
Известно, что чем выше содержание лизоФЛ в гидролизованных лецитинах, тем выше значение их гидрофильно-липофильного баланса (ГЛБ), а следовательно, и способность стабилизировать эмульсии «масло в воде». Это значительно расширяет область применения таких лецитинов в пищевых системах, содержащих преимущественно водную фазу [5, 6].
Так, значение ГЛБ стандартного жидкого лецитина не превышает 4, а значение ГЛБ частично гидролизованных лецитинов может варьироваться от 5 до 8 в зависимости от содержания лизоФЛ [7, 8].
В связи с этим гидролизованные лецитины, по сравнению со стандартными лецитинами, имеют значительные перспективы для широкого применения в качестве ПАВ и натуральных эмульгаторов в технологиях продуктов питания, так как в зависимости от количественного содержания в их составе лизоФЛ, обусловливаю- щих ГЛБ гидролизованных лецитинов, можно регулировать их растворимость в масляной и/или водной фазе пищевых систем [9].
Гидролизованные лецитины получают в промышленном масштабе с применением ферментов – фосфолипазы А1 (PLA1) и фосфолипазы А2 (PLA2), гидролизующих сложноэфирную связь в молекуле ФЛ в положении sn-1 или sn-2 соответственно, с образованием лизоФЛ и свободных жирных кислот (СЖК) [10].
Схематичное изображение реакции гидролиза с применением указанных фосфолипаз приведено на рисунке 1.
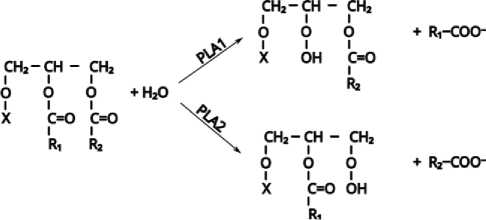
Рис. 1. Схематичное изображение реакции гидролиза ФЛ с применением фосфолипазы А1 (PLA1) и фосфолипазы А2 (PLA2): R 1 , R 2 – ацилы жирных кислот; Х – фосфатная группа с остатком холина/этаноламина/инозитола/ и др.
Schematic representation of the reaction of PL hydrolysis using phospholipase A1 (PLA1) and phospholipase A2 (PLA2): R1, R2 - fatty acid acyls; X - phosphate group with a choline/ethanolamine/inositol residue, etc.
Следует отметить, что в настоящее время на российском рынке присутствуют только импортные гидролизованные лецитины (в основном индийского и китайского производства), что связано с отсутствием отечественных, эффективно масштабируемых технологий их получения.
Это обусловлено многими факторами, в том числе и выбором экономически доступного фермента, выпускаемого в промышленных масштабах, а также достаточно трудно достижимой эффективностью процесса гидролиза ФЛ, который осуществляется на границе раздела фаз «ФЛ-вода», из-за низкой растворимости лецитина в воде.
Необходимо отметить, что в настоящее время широкий выпуск фосфолипаз для применения в промышленных целях преимущественно осуществляется за рубежом [11]. В нашей стране ГК «Эфко» сравнительно недавно налажен выпуск PLA2, которая обеспечивает внутренние потребности указанной компании в обработке яичного желтка при производстве майонеза.
Некоторые коммерчески доступные ферментные препараты с активностью PLA1 и PLA2 представлены в таблице 1.
Коммерческие ферментные препараты не только эффективны для проведения ферментативной гидратации растительных масел, обработки яичного желтка и т. д., но и могут быть использованы для получения гидролизованного лецитина.
В частности, в работе [12] показана эффективность применения ферментного препарата Lecitase Ultra с активностью PLA1 для гидролиза подсолнечного лецитина с получением гидролизованного лецитина.
Однако известно, что при гидролизе ФЛ с применением PLA1 возможна миграция ацила в молекуле лизоФЛ из положения sn-2 в положение sn-1 с последующим гидролизом и образованием нежелательных глицерилфосфорильных соединений [13].
Таблица 1
|
Коммерческое название |
Тип фос-фоли-пазы А |
Источник (организм/ штамм-продуцент) |
Производитель (страна производства) |
Применение в пищевой промышленности |
|
Lecitase 10 L |
PLA2 |
Поджелудочная железа свиньи |
Novozymes A/S (США) |
Ферментативная гидратация растительных масел |
|
Lecitase Ultra |
PLA1 |
Aspergillus oryzae |
Novozymes A/S (США) |
Ферментативная гидратация растительных масел |
|
Rohalase PL-XTRA |
PLA2 |
Trichoderma reesei |
AB Enzymes GmbH (США) |
Ферментативная гидратация растительных масел, модификация лецитинов |
|
Purifine PLA1 |
PLA1 |
Aspergillus niger |
DSM Food Specialties (США) |
Ферментативная гидратация растительных масел |
|
YieldMax |
PLA1 |
Aspergillus oryzae |
Novozymes A/S/Christian Hansen A/S (Дания) |
Ферментативный гидролиз молочного жира в производстве сыра |
|
Maxapal A2 |
PLA2 |
Aspergillus niger |
DSM Food Specialties (Нидерланды) |
Ферментативная обработка яичного желтка в производстве майонеза |
|
CAKEZYME SMART 5D |
PLA2 |
Aspergillus niger |
DSM Food Specialties-Firmenich (Германия) |
Снижение вязкости теста в производстве хлебобулочных и мучных кондитерских изделий |
Коммерчески доступные ферментные препараты фосфолипаз А1 и А2 Commercially available enzyme preparations phospholipases A1 and A2
Учитывая это, PLA1 преимущественно используются в комбинации с липазами для ферментативной переэтерификации ФЛ с определенными жирными кислотами (например, полиненасыщен-ными жирными кислотами) с целью получения гидролизованных лецитинов, предназначенных для фармацевтической промышленности.
Для получения пищевых добавок – гидролизованных лецитинов с улучшенными эмульгирующими свойствами наиболее широко приме- няются ферментные препараты, содержащие PLA2.
PLA2 гидролизует ФЛ в водном растворе только на поверхности раздела фаз «ФЛ–вода». Наиболее простым представлением механизма гидролиза ФЛ с применением PLA2 является представление воздействия указанного фермента на липидный бислой, организованный молекулами ФЛ на границе раздела фаз «ФЛ– вода» (рис. 2) [14].
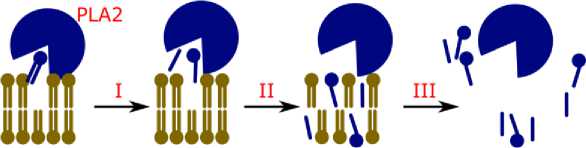
Рис. 2. Схематичное изображение механизма гидролиза ФЛ в бислое с применением PLA2: I – первая стадия: фермент связывается с липидным бислоем, захватывает и гидролизует ФЛ с высвобождением продуктов реакции – лизоФЛ и жирной кислоты; II – вторая стадия: продукты гидролиза распределяются в липидном бислое; III – третья стадия: разрушение бислоя в результате накопления продуктов гидролиза
Schematic representation of the mechanism of PL hydrolysis in the bilayer using PLA2: I – first stage: the enzyme binds to the lipid bilayer, captures and hydrolyzes PL with the release of reaction products – lysoPL and fatty acid; II – second stage: second stage: hydrolysis products are distributed in the lipid bilayer; III – third stage: destruction of the bilayer as a result of accumulation of hydrolysis products
Однако имеются исследования, показывающие, что на активность PLA2 влияет вид надмолекулярной организации, заряд и упорядоченность упаковки молекул ФЛ на границе раздела фаз «ФЛ – вода» [15]. Кроме того, скорость гидролиза для разных групп ФЛ может отличаться, что также является особенностью фосфолипаз, в том числе PLA2 (субстратная специфичность) [15].
Помимо этого, большинство PLA2 являются кальцийзависимыми ферментами, однако в настоящее время имеется обширная группа ферментов внутри семейства PLA2, на активность которых не оказывают влияние ионы кальция [10].
Температура, дозировка фермента, рН реакционной среды, а также ее состав, например, введение в реакционную смесь органических растворителей для лучшего растворения ФЛ, и продолжительность ферментативной реакции являются определяющими факторами для получения гидролизованных лецитинов с различным содержанием лизоФЛ.
Следует отметить, что в пищевых технологиях наиболее широко применяются частично гидролизованные лецитины со степенью конверсии (гидролиза) ФЛ от 30 до 60 %, гидролиз ФЛ в лецитине менее 30 % не будет оказывать существенного влияния на изменение значения ГЛБ лецитина, а следовательно, является нецелесообразным [8].
Таким образом, учитывая, что в России промышленный выпуск гидролизованных лецитинов отсутствует, в связи с чем в технологиях продуктов питания используются только импортные гидролизованные лецитины, исследования в области разработки технологий получения пищевых добавок – гидролизованных лецитинов с заданной степенью конверсии ФЛ, а следовательно, и с различным содержанием лизоФЛ, являются перспективными и актуальными в настоящее время.
Цель исследования – разработка технологии получения пищевых добавок – гидролизованных жидких лецитинов с заданным содержанием лизофосфолипидов.
Задачи: выявить эффективность применения ферментного препарата ROHALASE PL-XTRA, содержащего PLA2, для получения гидролизованных лецитинов с различным содержанием лизоФЛ; изучить влияние основных факторов на эффективность гидролиза ФЛ, содержащихся в обезжиренном лецитине; разработать технологические режимы получения гидролизованных жидких лецитинов.
Объекты и методы. Объекты исследования: гидролизованные жидкие лецитины, полученные из обезжиренного лецитина.
Обезжиренный лецитин, полученный в лабораторных условиях из подсолнечного жидкого лецитина по разработанной нами технологии [16], представляет собой порошок светложелтого цвета с массовой долей веществ, нерастворимых в ацетоне, – 96,9 %, в том числе ФЛ – 76,4, из них фосфатидилхолинов (ФХ) – 22,1; фосфатидилинозитолов (ФИ) – 16,2; фос-фатидилэтаноламинов (ФЭА) – 9,7; фофатид-ных кислот (ФК) – 7,5 %.
Ферментативный гидролиз ФЛ, содержащихся в обезжиренном лецитине, осуществляли с помощью выпускаемого в промышленных объемах и широко применяемого для ферментативной гидратации растительных масел пищевого ферментного препарата ROHALASE PL-XTRA (AB Enzymes, Германия), содержащего фосфолипазу А2 (PLA2) микробного происхождения с активностью 10 000 ед/г, представляющего собой жидкость светло-коричневого цвета. Отличительной особенностью данного ферментного препарата является проявление его активности при низких значениях рН (от 3,5 до 4,5).
Процесс гидролиза ФЛ, содержащихся в обезжиренном лецитине, проводили следующим образом: обезжиренный лецитин и дистиллированную воду, предварительно нагретую до 50 °С, в соотношении, равном 1 : 4 (по массе), интенсивно перемешивали с применением верхнеприводной мешалки Eurostar 200 Control P4 в течение 15 мин. В эту смесь вносили расчетное количество буферного раствора с получением реакционной среды с заданным значением рН. Затем в реакционную среду вносили ферментный препарат ROHALASE PL-XTRA, дозировку которого рассчитывали с учетом содержания ФЛ в лецитине (т. е. субстрата) и заявленной производителем активности фермента. Процесс гидролиза осуществляли при постоянном перемешивании и поддержании температуры на заданном уровне.
После проведения процесса гидролиза инактивацию фермента, содержащегося в ферментированной массе, проводили путем нагревания образцов до температуры 100 °С в течение 15 мин. Затем ферментированную массу сушили при температуре 60 °С под вакуумом до содержания влаги в высушенном продукте, представляющем собой гидролизованный жидкий лецитин, не более 1 %.
Эффективность процесса гидролиза оценивали по степени конверсии субстрата, т. е. ФЛ, содержащихся в обезжиренном лецитине, при этом учитывали степень конверсии индивиду- альных групп ФЛ, а именно ФХ, ФЭА, ФИ и ФК, (КФЛi), в %, по формуле (1), а также степень суммарной конверсии указанных индивидуальных групп ФЛ (К∑ФЛ), в %, по формуле (2)
КФЛ. = СФЛих^Ф^ ,100,(1)
где СФЛ – содержание i-й индивидуальной группы ФЛ в лецитине до гидролиза, %; СФЛ – содер жание i-й индивидуальной группы ФЛ в лецитине после гидролиза, %.
к = (СФХисх^ЗАжСИм^ 100,.
^ ФЛ ( СФХисх + СФЭАисх + СФИисх + СФКисх )
где С фхис х, С фЭАис х, С фИис х>С фКис - содержание ФХ, ФЭА, ФИ и ФК соответственно в лецитине до гидролиза, %; С фХги ,с С фЭАги ,с С фИги СС фкги—- содержание ФХ, ФЭА, ФИ и ФК соответственно в лецитине после гидролиза, %.
Определение содержания индивидуальных групп ФЛ в лецитинах до и после гидролиза осуществляли методом тонкослойной хроматографии (ТСХ) с обработкой полученных хроматограмм с помощью денситометра SORBFIL (Россия) в программе Sorbfil TLC View, при этом в качестве неподвижной среды использовали пластинки «Sorbfil», а в качестве подвижной фазы – систему растворителей хлороформ : метанол : вода (65 : 25 : 4). Идентификацию индивидуальных групп ФЛ (ФХ, ФИ, ФЭА и ФК), а также лизоФЛ (лизоФХ, лизоФИ, лизоФЭА и лизоФК) на хроматограммах осуществляли по стандартам-метчикам (производитель Larodan).
Экспериментальные данные обрабатывали с применением пакета программ MS Excel и Statistica 9.0.
Результаты и их обсуждение. На первом этапе исследовали степень конверсии основных индивидуальных групп ФЛ, содержащихся в лецитине, а именно ФХ, ФЭА, ФИ и ФК, в результате гидролиза с применением ферментного препарата ROHALASE PL-XTRA. На рисунке 3 приведены полученные данные.
Следует отметить, что гидролиз проводили при температуре 50 °С, значении рН реакционной среды 4,0 и дозировке ферментного препарата 0,2 % к массе лецитина в течение 60 мин. Через каждые 15 мин осуществляли отбор ферментированной массы с последующим ее нагреванием для инактивации фермента и сушкой под вакуумом до содержания влаги не более 1,0 %.
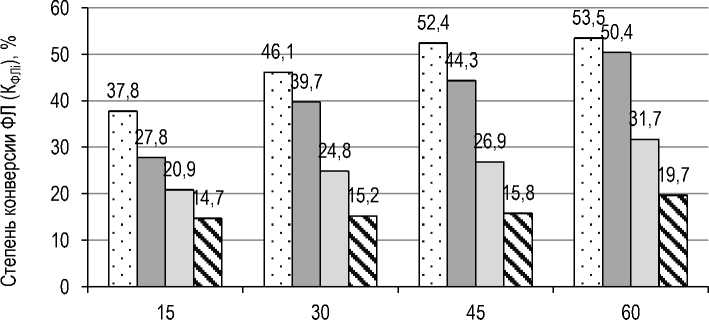
Продолжительность гидролиза, мин
Рис. 3. Степень конверсии ФЭА ( ), ФХ ( ), ФК ( ) и ФИ ( ), содержащихся в лецитине, в результате гидролиза с применением ROHALASE PL-XTRA в течение 60 минут
The degree of conversion of PE ( ), PC ( ), PA ( ) and PI ( ) contained in lecithin as a result of hydrolysis using ROHALASE PL-XTRA for 60 minutes
Из приведенных данных видно, что наибольшей конверсии в течение исследуемой продолжительности гидролиза подвергаются ФЭА. Степень конверсии ФХ в результате гидролиза в течение 60 мин несколько ниже по сравнению с ФЭА. Степень конверсии ФК практически в 2 раза ниже степени конверсии ФЭА на каждом временном участке процесса гидролиза.
Наиболее низкая степень конверсии по сравнению с ФЭА, ФХ и ФК наблюдается у ФИ. Полученные результаты согласуются с данными, приведенными в работе [17], в которой гидролиз подсолнечного лецитина осуществляли с применением ферментного препарата LysoMax Oil (Danisco), содержащего PLA2 микробного происхождения.
Различную степень конверсии основных индивидуальных групп ФЛ, содержащихся в лецитине, а именно ФХ, ФЭА, ФИ и ФК, в результате гидролиза с применением ферментных препаратов, содержащих PLA2, можно объяснить из- бирательностью (специфичностью) PLA2 по отношению к полярной группе молекулы ФЛ.
Учитывая, что на степень конверсии ФЛ, содержащихся в лецитине, а следовательно, и на эффективность гидролиза лецитина будут оказывать влияние такие факторы, как рН реакционной среды, температура, продолжительность гидролиза, а также, в случае PLA2, наличие в реакционной среде кофактора – ионов кальция, то исследовали влияние указанных факторов.
На этапе исследования влияния значения рН реакционной среды на степень конверсии индивидуальных групп ФЛ, а именно на степень конверсии ФЭА, ФХ, ФК и ФИ, содержащихся в лецитине, а также на степень их суммарной конверсии, значения рН реакционной среды образцов обезжиренного лецитина с дистиллированной водой варьировали в диапазоне от 3,0 до 5,0, при этом процесс гидролиза проводили при дозировке ферментного препарата 0,2 % к массе лецитина и температуре 50 °С в течение 60 мин. Полученные данные приведены в таблице 2.
Таблица 2
Влияние значения рН реакционной среды на степень конверсии индивидуальных групп ФЛ и на степень их суммарной конверсии в процессе гидролиза, %
The influence of the pH value of the reaction medium on the degree of conversion of individual PL groups and on the degree of their total conversion during hydrolysis
|
Значение рН реакционной среды |
Степень конверсии |
Степень суммарной конверсии ФЛ (К Ʃ ФЛ ), % |
|||
|
ФЭА (К ФЭА ) |
ФХ (К ФХ ) |
ФК (К ФК ) |
ФИ (К ФИ ) |
||
|
3,0 |
38,8±0,9 |
33,8±0,7 |
30,4±1,1 |
21,0±0,9 |
30,5±1,0 |
|
3,5 |
48,7±0,7 |
45,7±0,9 |
34,9±0,8 |
20,9±1,2 |
38,0±0,9 |
|
4,0 |
53,5±0,8 |
50,4±1,0 |
31,7±0,7 |
19,7±0,7 |
38,1±0,8 |
|
4,5 |
31,3±0,9 |
34,6±0,8 |
18,7±1,0 |
17,8±0,9 |
27,0±0,7 |
|
5,0 |
26,0±0,9 |
26,3±0,7 |
11,2±0,9 |
11,4±0,8 |
20,0±1,2 |
Из приведенных данных видно, что значения рН реакционной среды в диапазоне от 3,0 до 4,5 оказывают влияние на степень конверсии ФЭА, ФХ и ФК, а степень конверсии ФИ в указанном диапазоне значений рН практически не изменяется. Наибольшая степень суммарной конверсии ФЛ в лецитине в процессе гидролиза наблюдается в диапазоне значений рН реакционной среды от 3,5 до 4,0, при этом повышение значений рН реакционной среды до 4,5 и более приводит к снижению степени конверсии как индивидуальных групп ФЛ, так и степени их суммарной конверсии.
Таким образом, оптимальным диапазоном значений рН реакционной среды для проведе- ния процесса гидролиза обезжиренного лецитина с применением исследуемого ферментного препарата является диапазон от 3,5 до 4,0. Дальнейшие исследования проводили при значении рН реакционной среды, равном 4,0.
На следующем этапе исследования изучали влияние внесения в реакционную среду хлорида кальция на степень суммарной конверсии ФЛ, содержащихся в лецитине.
Для этого было подготовлено два экспериментальных образца гидролизованного жидкого лецитина. Для подготовки 1-го образца гидролизованного жидкого лецитина обезжиренный лецитин и 0,1 М раствор хлорида кальция в дистиллированной воде, предварительно нагретый до 50 °С, в соотношении, равном 1 : 4 (по массе), интенсивно перемешивали с последующим доведением значения рН полученной реакционной среды до 4,0 и проводили процесс гидролиза при дозировке ферментного препарата 0,2 % к массе обезжиренного лецитина и температуре 50 °С в течение 60 мин.
Подготовку 2-го образца гидролизованного жидкого лецитина осуществляли аналогичным образом, с единственным отличием в том, что для получения реакционной среды вместо 0,1 М раствора хлорида кальция в дистиллированной воде брали 0,4 М раствора хлорида кальция в дистиллированной воде.
В качестве объекта сравнения служил контрольный образец гидролизованного жидкого лецитина, полученный без внесения в реакционную среду хлорида кальция.
На рисунке 4 приведены данные по влиянию хлорида кальция в реакционной среде на степень суммарной конверсии ФЛ, содержащихся в экспериментальных образцах лецитина, по сравнению со степенью суммарной конверсии ФЛ в контрольном образце лецитина.
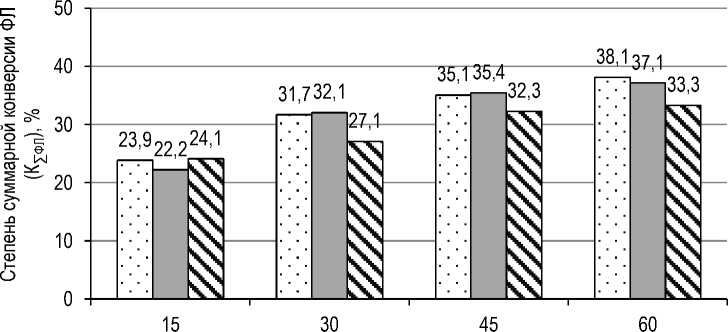
Продолжительность гидролиза, мин
Рис. 4. Влияние хлорида кальция в реакционной среде на степень суммарной конверсии ФЛ, содержащихся в лецитине: □ – контрольный образец; п – 1-й образец ; к – 2-й образец The effect of calcium chloride in the reaction medium on the degree of total conversion of PL contained in lecithin: □ – control sample; п – 1st sample; – 2nd sample
Из приведенных данных видно, что внесение в реакционную среду хлорида кальция в виде его водного раствора различной концентрации не оказывает значимого влияния на эффективность гидролиза ФЛ с применением ферментного препарата ROHALASE PL-XTRA.
Кроме того, внесение в реакционную среду раствора хлорида кальция в избыточной концентрации (0,4 М водный раствор) приводит к некоторому расслоению реакционной среды, а также к увеличению времени сушки ферментированной массы после окончания процесса гидролиза.
Учитывая, что в спецификации ферментного препарата ROHALASE PL-XTRA конкретно не указана группа PLА2, можно сделать вывод о том, что входящая в ферментный препарат PLА2 является кальций-независимой.
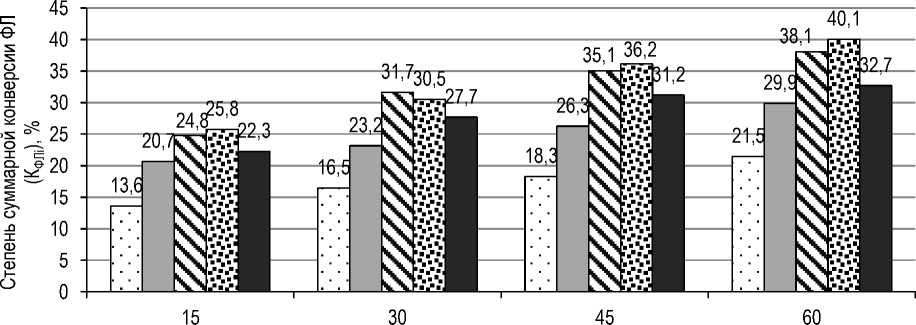
На следующем этапе изучали влияние температуры на степень суммарной конверсии ФЛ в процессе гидролиза обезжиренного лецитина при значении рН реакционной среды 4,0, дозировке ферментного препарата 0,2 % к массе лецитина в течение 60 мин. Полученные экспериментальные данные приведены на рисунке 5.
Из данных рисунка 5 видно, что температура играет важную роль в процессе ферментативного гидролиза. Так, повышение температуры с 40 до 50 °С способствует повышению степени суммарной конверсии ФЛ, что, по-видимому, обусловлено увеличением растворимости субстрата, т. е. ФЛ, и снижению вязкости среды, лучшему ее перемешиванию, а следовательно, и увеличению межмолекулярного контакта ФЛ с ферментом. Однако при повышении температуры до 60 °С фермент становится более восприимчивым к термической дезактивации, что приводит к снижению его каталитической активности.
Продолжительность гидролиза, мин
Рис. 5. Влияние температуры на степень суммарной конверсии ФЛ, содержащихся в лецитине: □ – 40 °С; ■ – 45 °С; s – 50 °С; ea – 55 °С; ■ – 60 °С Measuring the temperature by the degree of total conversion of PL contained in lecithin: □ – 40 °С; ■ – 45 °С; – 50 °С; ^ – 55 °С; П – 60 °С
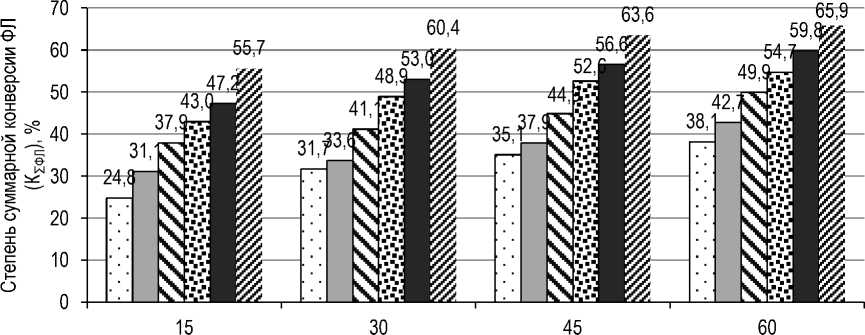
Для исследования влияния дозировки ферментного препарата ROHALASE PL-XTRA на степень суммарной конверсии ФЛ, содержащихся в обезжиренном лецитине, проводили процесс гидролиза образцов лецитина при следующих дозировках ферментного препарата: 0,2; 0,4; 0,8; 1,2; 1,6 и 2,0 % к массе лецитина, при этом значение рН реакционной среды – 4,0, температура – 50 °С и продолжительность гидролиза – 60 мин были одинаковыми для всех образцов лецитина.
На рисунке 6 приведены полученные данные по влиянию дозировки ферментного препарата на степень суммарной конверсии ФЛ, содержащихся в лецитине.
Продолжительность гидролиза, мин
Рис. 6. Влияние дозировки ферментного препарата ( % к массе лецитина) на степень суммарной конверсии ФЛ, содержащихся в лецитине: о – 0,2; ■ – 0,4; – 0,8; – 1,2; – 1,6; – 2,0
The effect of the dosage of the enzyme preparation in % of the mass of lecithin, on the degree of total conversion of PL contained in lecithin: □ – 0.2; ■ – 0.4; к – 0.8; л – 1.2; ■ – 1.6; – 2.0
Из данных рисунка 6 видно, что в течение 15 минут гидролиза увеличение дозировки ферментного препарата ROHALASE PL-XTRA с 0,2 до 2,0 % к массе лецитина обеспечивает повышение степени суммарной конверсии ФЛ, содержащихся в лецитине, в 2,2 раза. Дальней- шее увеличение продолжительности процесса гидролиза образца лецитина (30 мин и более) при дозировке ферментного препарата 2,0 % к массе лецитина не приводит к значительному росту степени суммарной конверсии ФЛ, содержащихся в лецитине.
Это, по-видимому, связано с высоким содержанием в реакционной среде продуктов гидролиза, а именно – свободных жирных кислот и лизоФЛ, затрудняющих захват PLA2 молекул ФЛ (см. рис. 2), в отличие от образцов лецитина с внесением ферментного препарата в меньших дозировках, в которых для увеличения содержания в реакционной среде продуктов гидролиза требуется большая продолжительность процесса гидролиза (рис. 7).
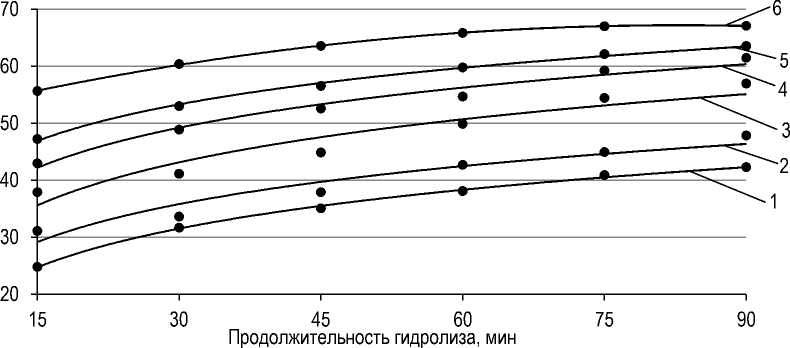
Рис. 7. Влияние продолжительности процесса гидролиза на степень суммарной конверсии ФЛ, содержащихся в лецитине, при дозировке ферментного препарата, % к массе лецитина:
1 – 0,2; 2 – 0,4; 3 – 0,8; 4 – 1,2; 5 – 1,6; 6 – 2,0
The influence of the duration of the hydrolysis process on the degree of total conversion of PL contained in lecithin at a dosage of the enzyme preparation in % of the lecithin mass:
1 – 0.2; 2 – 0.4; 3 – 0.8; 4 – 1.2; 5 – 1.6; 6 – 2.0
Таким образом, установлено, что наиболее значимыми факторами для проведения эффективного процесса гидролиза обезжиренного лецитина с применением ферментного препарата ROHALASE PL-XTRA являются дозировка ферментного препарата, температура и продолжительность процесса гидролиза. Варьирование значений рН реакционной среды в диапазоне от 3,5 до 4,0 и внесение в реакционную среду хлорида кальция в виде 0,1 и 0,4 М водных растворов не оказывают значимого влияния на сте- пень суммарной конверсии ФЛ, содержащихся в лецитине, а следовательно, и на эффективность процесса гидролиза.
Для получения гидролизованных лецитинов с различной степенью конверсии ФЛ, а следовательно, и с различным содержанием лизоФЛ, был проведен полный факторный эксперимент с варьированием основных факторов, а именно – дозировки ферментного препарата, температуры и продолжительности гидролиза – на трех уровнях (табл. 3).
Таблица 3
|
Фактор и его код |
Уровень варьирования факторов |
||
|
нижний |
средний |
верхний |
|
|
Дозировка ферментного препарата, % к массе лецитина (C фп ) |
0,8 |
1,0 |
1,2 |
|
Продолжительность гидролиза, мин (т) |
15 |
60 |
90 |
|
Температура гидролиза, °С (t) |
45 |
50 |
55 |
Переменные факторы и уровни их варьирования
Variable factors and their levels of variation
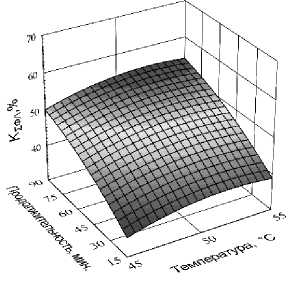
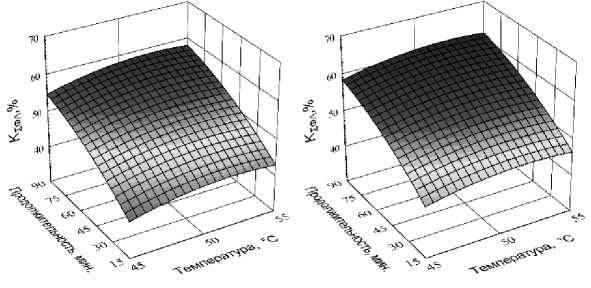
Функцией отклика в данном эксперименте Экспериментальные данные по влиянию пе- являлась степень суммарной конверсии ФЛ, со- ременных факторов на функцию отклика пред- держащихся в лецитине (КƩФЛ). ставлены в таблице 4, а их графическая интер претация – на рисунке 8.
Таблица 4
Рис. 8. Влияние температуры и продолжительности гидролиза на степень суммарной конверсии ФЛ, содержащихся в лецитине (К Ʃ ФЛ ), при дозировке ферментного препарата 0,8 % (а), 1,0 % (б) и 1,2 % (в) к массе лецитина
The effect of temperature and duration of hydrolysis on the degree of total conversion of PL contained in lecithin (K Ʃ PL) at a dosage of enzyme preparation of 0.8 % (a), 1.0 % (б) and 1.2 % (в) to the mass of lecithin
Влияние переменных факторов на функцию отклика The influence of variable factors on the response function
В результате математической обработки экспериментальных данных нами получено уравнение, адекватно описывающие процесс гидролиза обезжиренного лецитина с применением фер ментного препарата ROHALASE PL-XTRA:
K XФЛ = 10,235 СФП - 0,11022 С ФП т + 0,083601 СФ Пt - 38,746 СФ П - 0,0010338 с ФП т2 + +0,00084464 С ФП Tt + 0,30108 С ФП т + 0,053275 С ФП t2 - 5,797 С ФП t + 203,28 с ФП + +6,2054 ⋅ 10“7т3 -6,139⋅10 “5T2t + 0,002568т2-7,6516⋅10 -5Tt2 + +0,013911Tt - 0,33346т - 0,0027431t3 + 0,28201t2 - 6,9718t - 0,41701
где t – температура гидролиза, °С; т – продолжительность гидролиза, мин; С фп – дозировка ферментного препарата, % к массе обезжиренного лецитина.
Коэффициент детерминации (R2) уравнения (3) – 0,9957. С учетом уравнения (3) получено уравнение (4), характеризующее зависимость продолжительности процесса гидролиза от температуры и степени суммарной конверсии ФЛ, содержащихся в лецитинею:
т= ( С ФП 0, иб^1,9⋅10 10t5, 13 + 0,0141Kг ФЛ 0, 35+22 +
+1,575 С ФП 0, не ) (С ФП 0, 458(5,2⋅10“5t4 , 184 - 1,787) - 223,478)+ + С ФП ° ,458 (ес ФП 0, ,9⋅ 10-10!5 , 13+0 , 0141Кг ФЛ ° , 35+22 , 081)+1 , 57523С ФП ° ,116( -1,53976 ×
×10 -6С ФП ° , 036087-1,14474⋅10 -6t° , 04647+1,04⋅10 -10 K X ФЛ 1,2 + 2,692161 ⋅ 10 -6 ) - 3,2787t2 + 224,21t + 224,207)С ФП ° , 458
Коэффициент детерминации (R2) уравнения (4) – 0,9668.
На основании уравнения (4) была определена продолжительность процесса гидролиза обезжиренного лецитина с применением ферментного препарата ROHALASE PL-XTRA при его дозировке 1,0 % к массе обезжиренного лецитина и температуре процесса гидролиза 50 °С для получения гидролизованных жидких леци- тинов с заданной степенью суммарной конверсии ФЛ, а именно – 40 и 60 %.
В результате реализации разработанных эффективных режимов гидролиза обезжиренного лецитина получены гидролизованные жидкие лецитины с заданной степенью суммарной конверсии ФЛ, соответствующей 40 и 60 %, и содержанием в готовых продуктах – гидролизованных жидких лецитинах лизоФЛ (22,4 ± 1,0) % и (32,9 ± 1,0) %, соответственно (табл. 5).
Таблица 5
Эффективные технологические режимы гидролиза ФЛ, содержащихся в обезжиренном лецитине, с применением ферментного препарата ROHALASE PL-XTRA* Effective technological modes of hydrolysis of PL contained in deoiled lecithin using the enzyme preparation ROHALASE PL-XTRA*
|
Заданное значение степени суммарной конверсии ФЛ (К Ʃ ФЛ ), % |
Дозировка Ферментного препарата, % к массе обезжиренного лецитина |
Температура процесса гидролиза, °С |
Продолжительность процесса гидролиза, мин |
Фактическое содержание лизоФЛ в полученном гидролизованном жидком лецитине, % |
|
40 |
1,0 |
50 |
14 |
22,4±1,0 |
|
60 |
100 |
32,9±1,0 |
(*) – при значении рН реакционной среды, равном 4,0.
Заключение. В результате комплекса проведенных исследований показана эффективность применения ферментного препарата ROHALASE PL-XTRA, содержащего PLА2, для получения пищевых добавок – гидролизованных лецитинов с различным содержанием лизоФЛ. Установлено, что индивидуальные группы ФЛ, содержащиеся в обезжиренном лецитине, по степени конверсии в результате гидролиза с применением ROHA-LASE PL-XTRA можно расположить в ряд по убыванию: ФЭА→ФХ→ФК→ФИ.
Установлены наиболее значимые факторы, оказывающие влияние на степень суммарной конверсии ФЛ, содержащихся в обезжиренном лецитине, а именно: дозировка ферментного препарата, температура и продолжительность процесса гидролиза. Варьирование значений рН реакционной среды в диапазоне от 3,5 до 4,0 и внесение в реакционную среду хлорида кальция в виде 0,1 М и 0,4 М водных растворов не оказывают значимого влияния на степень суммарной конверсии ФЛ, содержащихся в обезжиренном лецитине, а следовательно, и на эффективность процесса гидролиза.
В результате трехфакторного эксперимента и математической обработки экспериментальных данных получены уравнения, позволяющие определить эффективные режимы процесса гидролиза обезжиренного лецитина с применением ферментного препарата ROHALASE PL-XTRA для получения гидролизованного жидкого лецитина с заданной степенью суммарной конверсии ФЛ.
При реализации разработанных эффективных режимов гидролиза обезжиренного лецитина получены гидролизованные жидкие лецитины со степенью суммарной конверсии ФЛ, соответствующей 40 и 60 %, и содержанием в готовых продуктах – гидролизованных жидких лецитинах лизоФЛ (22,4 ± 1,0) % и (32,9 ± 1,0) %, соответственно.
Дальнейшими перспективными исследованиями являются исследования в области оценки эффективности и особенностей проявления свойств полученными пищевыми добавками – гидролизованными лецитинами со степенью суммарной конверсии ФЛ, соответствующей 40 и 60 %, для обоснования их эффективного применения в технологиях продуктов питания.


