Теоретические и практические подходы к созданию и применению новых протезирующих материалов на биологической основе для герниопластики способом IPOM
Автор: Пономарева Ю.В., Сарбаева Н.Н., Королев М.В., Милякова М.Н., Столяров С.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
В современной герниологии синтетические протезы активно применяют для восстановления дефектов передней брюшной стенки. Большая доля таких имплантаций приходится на способ IPOM, который применяется более 20 лет, при этом осложнения в виде формирования спаек и миграции ранее имплантированного протеза остаются нерешенной проблемой. Это стимулирует поиск новых протезирующих материалов, способных минимизировать риски и улучшить результаты лечения пациентов с послеоперационными вентральными грыжами. Цель исследования – оценка безопасности и функциональных характеристик ацеллюлярного дермального матрикса ксеногенного происхождения при длительной имплантации в брюшную полость in vivo. Материалы и методы. Матрикс был получен из дермы человека путем последовательного удаления клеточных элементов, липидов и ДНК. Осуществлена оценка полноты элиминации различных компонентов, оказывающих непосредственное влияние на безопасность. Стерильные образцы имплантированы лабораторным крысам на переднюю стенку желудка после полного иссечения серозной оболочки. Через 28, 45 и 90 сут проведены гистологические и иммуногистохимические исследования адгезивных свойств, интеграции в окружающие ткани и особенностей ремезотелизации. Результаты. Матрикс продемонстрировал отсутствие адгезивных свойств и высокую биосовместимость при сохранении структуры и целостности коллагеновых фибрилл. Восстановление слоя мезотелия на его поверхности произошло только к 90-м сут. Выводы. Полученные результаты позволяют рассматривать матрикс как перспективную альтернативу синтетическим протезам, однако для подтверждения этого необходимы дальнейшие исследования.
Герниопластика, интраперитонеальная имплантация, протезирующий материал для герниопластики, брюшина, ацеллюлярный дермальный матрикс, интраперитонеальные спайки
Короткий адрес: https://sciup.org/14132987
IDR: 14132987 | УДК: 617.55:617-089:615.47:611.95:616-089.844:616.3457.053.2 | DOI: 10.34014/2227-1848-2025-2-67-77
Текст научной статьи Теоретические и практические подходы к созданию и применению новых протезирующих материалов на биологической основе для герниопластики способом IPOM
Введение. Синтетические протезы несколько десятилетий подряд прочно занимают свою нишу при выполнении широкого перечня реконструктивно-восстановительных и пластических операций. Стремительное развитие лапароскопических и роботических технологий не только упрочили их позицию, но и способствовали появлению целой индустрии, занимающейся усовершенствованием и созданием новых протезирующих материалов, вплоть до персонифицированных [1, 2]. В гер-ниологии использование имплантируемых протезов стало золотым стандартом ненатяжного закрытия дефектов передней брюшной стенки [3]. Однако поиски лучшего для этих целей материала и места для его имплантации относительно слоев передней брюшной стенки привели к разработке множества способов герниопластики, которых к настоящему времени насчитывается около 200 [4, 5]. Лидирующие позиции по числу выполняемых операций занимают IPOM и IPOM Plus, которые предполагают интраперитонеальное или ретромускулярное размещение протезирую- щего материала в проекции грыжевых ворот [6, 7]. Не менее 9 рандомизированных многоцентровых исследований убедительно обосновывают преимущества данных методов в связи с относительной технической простотой их выполнения, низкой частотой развития раневых осложнений, сером, послеоперационного болевого синдрома, рецидивов, более короткими сроками реабилитации при удовлетворительном качестве жизни пациентов в отдаленные сроки [8]. Возможными негативными последствиями остаются осложнения: свищи, адгезия или формирование спаек, миграция протеза и др. Большинство из них обусловлено специфическими свойствами поверхности протеза.
Эволюция IPOM началась с использования монофиламентных неабсорбирующих материалов на основе полипропилена, полиэстера, политетрафторэтилена, продолжилась разработкой композитных материалов (полипропилен + полидиоксанон + окисленная регенерированная целлюлоза, полипропилен + политетрафторэтилен и др.) и достигла этапа создания биологических материалов в виде специально обработанного подслизистого слоя тонкой кишки, мочевого пузыря, брюшины, дермы, как правило, ксеногенного происхождения [9, 10]. Опыт применения биологических протезов для герниопластики в клинике небольшой, а результаты противоречивы, поэтому при всей своей технологичности и перспективности они остаются наименее изученными [11].
Цель исследования. Получить, оценить безопасность, адгезивные свойства и ремезо-телизирующий потенциал ацеллюлярного дермального матрикса (АДМ) ксеногенного происхождения в условиях долгосрочной интраперитонеальной имплантации in vivo .
Материалы и методы. Получение АДМ. Образцы кожи человека получали при иссечении кожно-подкожного лоскута в ходе реконструктивно-восстановительных операций на органах брюшной полости и передней брюшной стенке. Кожные лоскуты отслаивали от подлежащей подкожно-жировой клетчатки и погружали в 0,9 % раствор натрия хлорида для предотвращения их высыхания. Для удаления эпидермиса использовали гипертонический раствор, содержащий 0,605 г основания Трис, 4 г NaCl, 0,202 г ЭДТА в 100 мл буферного фосфатно-солевого раствора (ФСР). Децеллюляри-зацию дермы человека проводили 2 % раствором дезоксихолата натрия (ДХН) (АppliChem) на дистиллированной воде в течение 48 ч со сменой раствора каждые 12 ч. Затем АДМ обезжиривали 0,07 % раствором липазы (Sigma-Aldrich), приготовленным на трис-HCl-соле-вом буферном растворе (ТСБ, рН 7,7) с добавлением 2 % раствора ДХН. Для удаления остаточного хроматина материал обрабатывали раствором ДНК-азы (Sigma-Aldrich) с активностью 40 ед./мл на ТСБ (рН 7.4) с добавлением 10 мМ МgCl2 при 37 °С. В течение 24 ч АДМ отмывали дистиллированной водой, а затем в течение 60 ч – ФСР. Деэпителизацию, децел-люляризацию и делипидизацию, за исключением удаления ДНК, проводили на орбитальном шейкере PSU-20i (Biosan, Латвия) в режиме 250 уд./мин при комнатной температуре. Полученные лабораторные образцы АДМ подвергали стерилизации в 3 сменах 70 % этилового спирта, который отмывали стерильным 0,9 % раствором хлорида натрия.
Анализ АДМ. Количество остаточной ДНК определяли на многофункциональном планшетном ридере Infinite 200 PRO (Tecan) согласно протоколу (DNA Quantitation Kit, Sigma-Aldrich, кат. № DNAQF).
Для определения остаточного количества нейтральных липидов в АДМ использовали унифицированный метод определения триглицеридов по глицерину после проведения пробоподготовки материала протеиназой К (Sigma-Aldrich) при 60 °С.
Для оценки содержания белков в составе АДМ в камере для вертикального электрофореза VE-20 (Helicon) проводили электрофорез в полиакриламидном геле по системе Лэммли. Полученные гели окрашивали кумасси G-250. В качестве стандартов молекулярной массы использовали Thermo ScientificTM Rage-RulerTM Brad Range Unstained Protein Laddеrs.
Идентификацию β-актина проводили методом вестерн-блоттинга c использованием мышиных моноклональных антител соответствующей специфичности (Clone AC-15, Sigma-Aldrich) и вторых антител (CloneA-5906, Sigma-Aldrich), меченных пероксидазой хрена, согласно стандартному протоколу (General Protocol for Western Blotting, Bulletin 6376, Bio-Rad). Перенос белков на нитроцеллюлозную мембрану осуществляли с помощью Trans-Blot Turbo Transfer System (BioRad). В качестве положительного стандарта для β-актина использовали культуру фибробластов человека.
Морфологическую структуру полученного биологического протезирующего материала изучали на гистологических срезах, окрашенных гематоксилином и эозином, при помощи световой и поляризационной микроскопии.
Имплантация АДМ выполнена лабораторным крысам (n=18) обоего пола массой 250±30 г. Исследование соответствовало всем этическим принципам и нормам проведения биомедицинских экспериментов с участием животных и одобрено локальным этическим комитетом ЧУО ОВО «Медицинский университет «Реавиз» (протокол № 1 от 23.09.2022). Содержание лабораторных животных осуществляли в полном соответствии с действующими регламентами, при свободном доступе к воде и полнорационному корму. Для анестезии и аналгезии применяли тилетамина гидрохлорид и золазепама гидрохлорид в соотношении 1:1 из расчета 3 мкг/кг, вводимые парентерально на фоне предварительной седации кси-лазина гидрохлоридом в дозировке 2 мкг/кг. Эвтаназию осуществляли путем введения летальной дозы (с превышением в 2–2,5 раза средней дозы с учетом массы животного) тех же препаратов.
Ремезотелизирующий потенциал АДМ изучен путем оценки экспрессии HBME-1 – маркера мезотелиальных клеток после постановки иммуногистохимических реакций (ИГХ) при помощи моноклональных мышиных антител (клон HBME-1, Dako), которым предшествовал процесс восстановления антигена в 10 мМ цитратном буфере (рН 6,0). Для иммуногистохимической детекции была выбрана система DAKO EnVision™ + HRP (Dako North America, Inc. Carpinteria).
Результаты. Структура и состав АДМ. АДМ полностью повторял фибриллярную структуру дермы человека. При этом коллагеновые волокна сосочкового слоя дермы были тонкими, но плотно переплетенными, а сетчатый слой представлен различающимися по толщине фибриллами. Клетки и их компоненты в структуре АДМ отсутствовали (рис. 1).
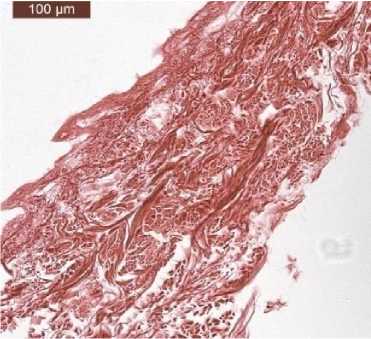
Рис. 1. Морфологическая структура АДМ человека.
Окраска гематоксилином и пикросириусом красным, ×10
Fig. 1. Morphological structure of human ADM. Hematoxylin and picrosirius red staining, ×10
По данным биохимического исследования, нейтральные липиды в составе образцов АДМ отсутствовали. Электрофоретическое разделение белков матрикса показало, что основным его компонентом является коллаген (белковые фракции с молекулярной массой около и более 150 кДа). Других полос на электрофореграммах, свидетельствующих о наличии иных белков в составе образцов, выявлено не было (рис. 2а). вестерн-блоттинг демонстрировал отсутствие белка цитоскелета фибробластов – β-актина (рис. 2б).
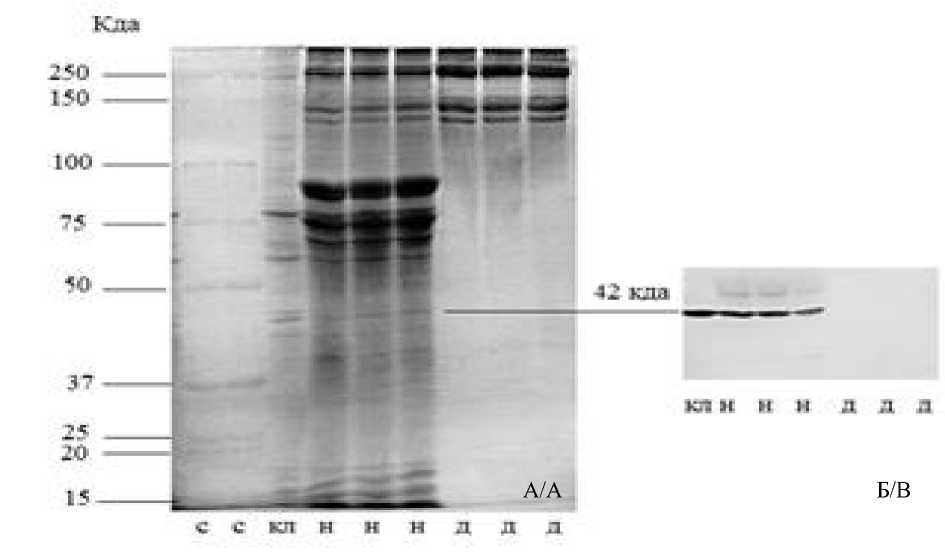
Рис. 2. Состав АДМ: а) электрофореграмма белков нативной дермы (н) и АДМ (д) в полиакриламидном геле, стандарты молекулярной массы (с) и культуры фибробластов (кл); б) вестерн-блоттинг на β-актин нативной дермы (н), АДМ (д) и культуры фибробластов человека (кл)
Fig. 2. ADM composition: a) electrophoresis of proteins of native dermis (н) and ADM (д) in polyacrylamide gel, molecular weight standards (c) and fibroblast culture (кл); b) Western Blot for β-actin of native dermis (н), ADM (д) and human fibroblast culture (кл)
Гистологическое исследование АДМ вместе с окружающими тканями показало, что к этому сроку коллагеновые волокна исследуемых образцов полностью сохранялись, а их межфибриллярные пространства содержали в умеренном количестве мигрирующие к центру клетки – лимфоциты, макрофаги, тучные клетки и фибробласты, при этом на периферии присутствовали многочисленные тонкостенные капилляры с эритроцитами в просвете.
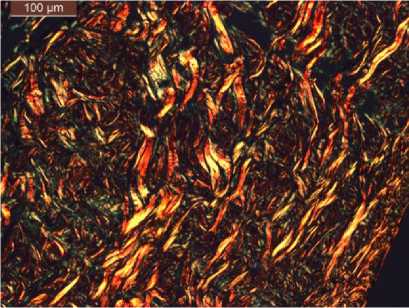
Рис. 3. Структура коллагеновых волокон АДМ после эксплантации на 90-е сут.
Окраска гематоксилином-пикросириусом красным. Поляризационная микроскопия, ×40
Fig. 3. Structure of ADM collagen fibers after 90-day explantation. Hematoxylin-picrosirius red staining.
Polarization microscopy, ×40
На противоположной стороне АДМ, ориентированной в полость брюшины, только к 90-м сут было идентифицировано формирова- ние слоя мезотелиальных клеток, определяемого по выраженной цитоплазматической и мембранной экспрессии ими HBME-1 (рис. 4).
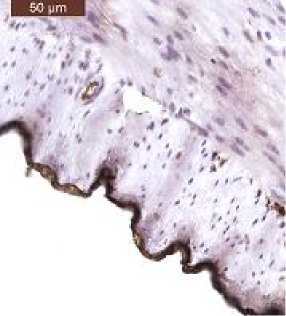
А/А
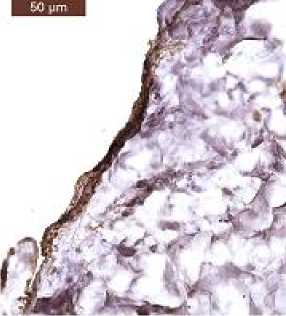
Б/B
Fig. 4. HBME-1 expression by mesothelial cell membranes: a) in intact mesothelial cells of the serous membrane of the rat stomach. x40; b) on the surface of implanted xenogeneic ADM (90 days), ×10
Обсуждение. У 14 % пациентов в течение двух лет после IPOM-герниопластики развивается спаечная кишечная непроходимость, из них у 2,6 % она требует проведения экстренной операции, во время которой возникает до 11 % непреднамеренных энтеротомий, при этом у 53 % пациентов после адгезиолизиса спайки развиваются вновь [12]. У 83 % пациентов симптомы спаечной болезни брюшной полости приобретают хронический характер, что значительно ухудшает качество их жизни [13]. Причиной адгезивных процессов в брюшной полости является в том числе имплантированный материал, представляющий собой обширную поверхность, лишенную мезотелия. В целях компенсации в организме инициируется каскад процессов, ведущих либо к формированию неоперитонеума, либо к развитию спаек.
Особенностью регенеративных процессов на поверхности имплантированных материалов является восстановление слоев брюшины (в большей степени не с краев, а диффузно) за счет флотирующих мезотелиальных клеток, которые способны прикрепляться к поверхности протеза [14]. Большинство применяемых в настоящее время синтетических имплантов для герниопластики имеет гидрофобную ан-тиадгезивную поверхность, на которую дополнительно может наноситься антиадгезив- ное покрытие в виде мембран или вязких гелей, что сдерживает либо препятствует формированию неоперитонеума. Основной проблемой остается краткосрочность создаваемых антиадгезивных барьеров в связи с короткими сроками их биорезорбции и более длительным периодом полного восстановления мезотелиального слоя брюшины. Поэтому большинство антиадгезивных гелей или покрытий в составе материала может быть рассмотрено как временная профилактическая и далеко не всегда эффективная мера при IPOM-герниопластике.
Комплексным решением проблемы могут стать биологические протезы на основе аллогенных и ксеногенных тканей. В последние годы произошел значительный прогресс в технологиях создания биологических материалов для герниопластики [15].
В ходе экспериментального исследования был получен ксеногенный протез на основе дермы человека. Для клинического применения предполагается создание идентичного материала из дермы свиней. Обязательным условием безопасности в настоящем исследовании являлось полное удаление всех клеток и их фрагментов, а также нейтральных липидов и значимое снижение количества ДНК. При этом контроль полноты удаления всех клеточных компонентов осуществлен при помощи комплекса методов, включая морфологический, а оценка целостности коллагеновых фибрилл и их организация изучена при помощи поляризационной микроскопии. Данные электрофореграмм подтвердили, что основным компонентом АДМ был коллаген при отсутствии белка цитоскелета фибробластов β-актина, который известен как мощный индуктор аутоиммунных процессов [16].
Таким образом, полученный по разработанной технологии АДМ является безопасным, не проявляет адгезивных свойств при интраперитонеальной имплантации и обладает достаточным ремезотелизирующим потенциалом in vivo, что позволяет рассматривать его в качестве перспективного биологического протеза для герниопластики способом IPOM.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Пономарева Ю.В., Сарбаева Н.Н.
Литературный поиск, участие в исследовании, обработка материала: Королев М.В.,
Милякова М.Н., Столяров С.А.
Анализ и интерпретация данных: Пономарева Ю.В., Королев М.В.
Написание и редактирование текста: Пономарева Ю.В., Сарбаева Н.Н., Королев М.В.,
Милякова М.Н., Столяров С.А.


