Термолиз карбоната и гидрокарбоната аммония как твёрдых охладителей продуктов сгорания топлива
Автор: Авдин Вячеслав Викторович, Кириллов Валерий Владимирович, Лымарь Андрей Анатольевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Аналитическая химия
Статья в выпуске: 12 (229), 2011 года.
Бесплатный доступ
Проведена совместная аппроксимация кривых дифференциальной сканирующей калориметрии и дифференциальной термогравиметрии кривыми Гаусса. Показано, что такая аппроксимация позволяет определить стадии термолиза, вычислить массы продуктов термодеструкции и найти соответствие продуктов стадиям термического разложения. Определено, что термолиз карбоната и гидрокарбоната аммония протекает в три стадии с последовательным отщеплением воды, углекислого газа и аммиака. Получено, что гидрокарбонат аммония является более энергоёмким охладителем, чем карбонат аммония, но последний дольше поддерживает процесс охлаждения.
Термолиз, аппроксимация термолитических кривых, термическое разложение карбоната аммония, термическое разложение гидрокарбоната аммония
Короткий адрес: https://sciup.org/147160186
IDR: 147160186 | УДК: 543.573+543.572.3+536.24
Текст научной статьи Термолиз карбоната и гидрокарбоната аммония как твёрдых охладителей продуктов сгорания топлива
Для охлаждения продуктов сгорания топлива применяются вещества, термическое разрушение которых протекает с большим поглощением энергии и образованием только газообразных продуктов. К таким веществам относятся карбонат и гидрокарбонат аммония. Стадийность процесса термолиза и сравнение эффективности данных веществ как охладителей длительное время оставались неизученными, вероятно, вследствие недостаточной точности термических анализаторов.
В настоящей работе высокая точность термолитических данных обеспечена использованием современного синхронного термического анализатора и усреднением результатов четырёх съёмок. Путём аппроксимации кривыми Гаусса кривых дифференциальной сканирующей калориметрии (ДСК) и дифференциальной термогравиметрии (ДТГ) карбоната и гидрокарбоната аммония определена схема термолиза данных соединений и сделано сравнение их эффективности как охладителей продуктов сгорания топлива.
Эксперимент
Для исследования термолиза карбоната и гидрокарбоната аммония использовали соли квалификации ХЧ. Термолитические кривые записали на синхронном термическом анализаторе Netzsch STA-449C «Jupiter» в корундовых тиглях со скоростью нагрева 10 °С/мин, в воздушной среде, с интервалом температур от комнатной до 200 °C. Для каждого образца записали не менее 4 термограмм с массой навесок 70-72 мг. Кривые ТГА и ДСК (или дифференциального термического анализа - ДТА) нормировали на массу навески 75 мг и усреднили. Кривые ДТГ получили численным дифференцированием усреднённой кривой ТГА.
Нагревание вещества сопровождается разнообразными эндо- и экзотермическими эффектами, связанными с термической деструкцией и протеканием фазовых переходов. Различные термолитические процессы могут протекать в близких температурных интервалах, что значительно усложняет профиль термолитических кривых: эффекты на кривых уширяются, появляются плечи, удвоения и пр. Если эндоэффект на термолитических кривых соответствует отщеплению одного типа продуктов термолиза, то профиль такого эндоэффекта хорошо аппроксимируется куполообразными зависимостями [1-3]. Данный подход не позволяет создать физическую модель процесса термического разложения, которая однозначно определила бы функцию (или набор функций) для аппроксимации, но позволяет выявить ряд особенностей термолиза неорганиче- ских веществ. В частности, определить число стадий, температурные интервалы процессов и др. Наиболее универсальной функцией, позволяющей успешно аппроксимировать большинство кривых, является функция Гаусса. При термолизе стехиометрических соединений: гидроксида алюминия, пятиводного сульфата меди, семиводного сульфата кобальта - число гауссианов на кривых ДТА (ДСК) равно числу молекул воды в брутго-формуле соединения [3], несмотря на кристаллографическую равноценность некоторых молекул.
В работах [1-3] аппроксимировали только кривые ДСК (ДТА), поскольку кривая ДТГ, как правило, сильно зашумлена. Усреднение результатов четырёх и более термограмм, снятых с одного образца (с соответствующей нормировкой на массу и учётом базовой линии), позволяет получить незашумленную кривую ДТГ, пригодную для аппроксимации. В этом случае площадь под гауссианами, полученными при аппроксимации кривых ДСК (ДТА), имеет физический смысл количества энергии, потраченной (или выделившейся) при протекании данного процесса. Физический смысл площади под гауссианами, полученными при аппроксимации кривых ДТГ - масса вещества, удалённого на данной стадии термолиза.
Аппроксимацию выполнили при помощи компьютерной программы, написанной к.х.н. А.А. Лымарем на языке Borland C++ Builder 6.0. В качестве минимизируемого функционала в программе используется сумма квадратов отклонений от экспериментальной кривой. Переменными аппроксимации являются: положение вершины гауссиана, его среднеквадратическое отклонение и площадь под кривой. Таким образом, при аппроксимации кривой п пиками, количество переменных равно Зи, количество экспериментальных точек - около 10 000. Начальными условиями аппроксимации служит примерное расположение кривых Гаусса. Для минимизации функционала используется метод покоординатного спуска Гаусса-Зейделя [4]. Качество аппроксимации оценивается по значению суммы квадратов отклонений, коэффициенту корреляции и по линии разности между экспериментальной кривой и суммой гауссианов.
Аппроксимация кривыми Гаусса только одной из кривых ДСК или ДТА не позволяет найти однозначного набора параметров (положения вершин Ть значений полуширины АД и площадей кривых Гаусса S,), поскольку функции Гаусса не образуют ортогональный базис. Как правило, получается несколько равновероятных вариантов, в которых, например, температуры вершин гауссианов, соответствующих одной и той же стадии термолиза, могут отличаться на 10 °C. Применение совместной аппроксимации кривых ДСК и ДТГ позволяет найти наборы функций Гаусса, температуры максимумов которых для ДСК и ДТГ будут наиболее близки.
Начальные параметры гауссианов для кривых ДСК и ДТГ задавали независимо по линии разности между экспериментальной кривой и суммой гауссианов. Затем проводили аппроксимацию каждой кривой независимо, выполняя, таким образом, нулевую итерацию. В полученных параметрах меняли температуры положения вершин в кривых ДСК и ДТГ, получая исходные параметры для первой итерации, после чего вновь проводили аппроксимацию. Итерации повторяли до тех пор, пока расхождения между Д кривой ДСК и соответствующими Д кривой ДТГ переставали уменьшаться.
Результаты и их обсуяедение
Карбонат и гидрокарбонат аммония претерпевают деструкцию по схемам:
(NH4)2CO3 -> 2NH3 + СО2 + Н2О; (1)
NH4HCO3 -+ NH3 + СО2 + Н2О. (2)
Все три продукта образуются в газообразном виде и выделяются почти одновременно. Существует ли приоритетность отщепления от молекул исходных веществ одного из трёх продуктов? Термограммы карбоната и гидрокарбоната аммония приведены на рис. 1. Как видно из термограмм, при данной скорости нагрева термическая деструкция начинается при температуре около 35, а полностью завершается при температуре около 180 °C. Эндоэффекты несимметричны относительно вершины, причём профили соответствующих термолитических кривых для данных веществ отличаются. Это может означать, что не все три продукта термолиза удаляются одновременно.
Аналитическая химия
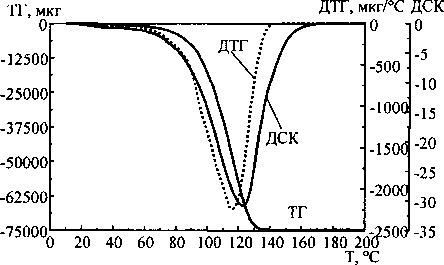
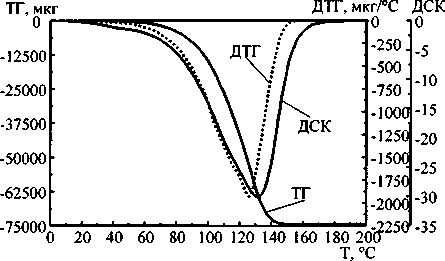
Рис. 1. Термограммы карбоната (а) и гидрокарбоната (б) аммония
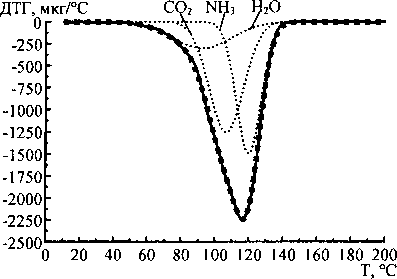
Аппроксимация кривых ДСК и ДТГ карбоната и бикарбоната аммония показала, что наиболее удовлетворительные результаты получаются при использовании трёх кривых Гаусса для каждой экспериментальной термолитической кривой. На рис. 2 и 3 показаны результаты аппроксимации кривых ДСК и ДТГ карбоната и гидрокарбоната аммония.
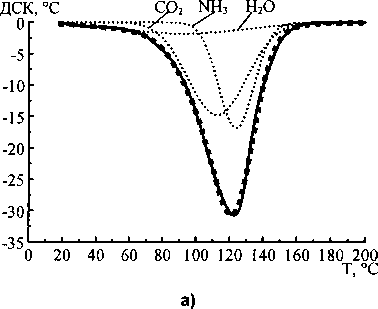
Рис. 2. Аппроксимация кривых ДСК и ДТГ карбоната аммония: - экспериментальная кривая,............- кривые Гаусса, ■ ■ ■ ■ ■ - сумма кривых Гаусса
б)
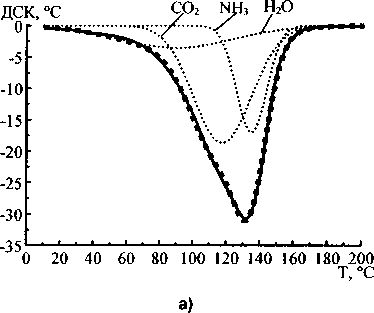
Рис. 3. Аппроксимация кривых ДСК и ДТГ гидрокарбоната аммония: - экспериментальная кривая,............- кривые Гаусса, ■■■•■ - сумма кривых Гаусса
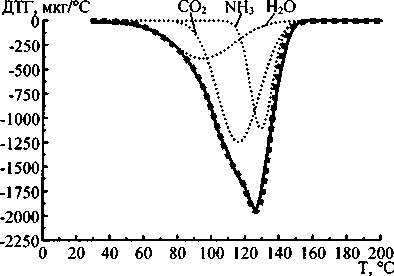
б)
Отнесение гауссианов, полученных при аппроксимации к воде, углекислому газу и аммиаку, было сделано на основании сопоставления молекулярных масс данных веществ с площадями под гауссианами, аппроксимирующими кривые ДТГ. Данные, полученные при аппроксимации, приведены в таблице. Как следует из уравнений (1) и (2), соотношение молекулярных масс продуктов реакций термолиза должно быть следующим:
-
- для карбоната аммония молекулярные массы одной молекулы воды к одной молекуле углекислого газа и к двум молекулам аммиака относятся как 1:2,44:1,89;
-
- для гидрокарбоната аммония молекулярные массы одной молекулы воды к одной молекуле углекислого газа и к одной молекуле аммиака относятся как 1:2,44:0,94.
Соотношения площадей под гауссианами, полученными при аппроксимации кривых ДТГ:
-
- для карбоната аммония 1:2,33:1,91;
-
- для гидрокарбоната аммония 1:2,43.0,94.
Таблица
|
Карбонат аммония |
Гидрокарбонат аммония |
||||||||||
|
ДТГ |
дек |
ДТГ |
ДСК |
||||||||
|
Ть °C |
Sj, мкг |
АП °C |
т„ °C |
Si, °C2 |
АП °C |
Ti, °C |
Sj, мкг |
Мь °C |
И °C |
Si, °C2 |
АП °C |
|
92,5 |
14,3 |
17,4 |
92,2 |
165,8 |
36,4 |
94,6 |
17,1 |
18,2 |
89,8 |
305,4 |
34,2 |
|
106,8 |
33,3 |
10,1 |
112,5 |
644,1 |
17,4 |
115,9 |
41,7 |
12,3 |
117,6 |
813,6 |
17,3 |
|
120,0 |
27,4 |
7,3 |
123,9 |
444,0 |
10,5 |
129,3 |
16,1 |
6,5 |
135 |
384,7 |
9,0 |
Таким образом, экспериментальное соотношение масс очень близко к теоретическому, что позволяет предположить соответствие гауссианов (в порядке возрастания температуры положения вершин) воде, углекислому газу и аммиаку. Следовательно, совместная аппроксимация кривых ДСК (ДТА) и ДТГ позволяет не только определить стадии термолиза, но и вычислить массы продуктов термодеструкции и соотнести продукты со стадиями термического разложения. Вероятно, при термолизе исследованных веществ первой стадией является отщепление от молекул карбоната и гидрокарбоната аммония молекулы воды. При этом углекислый газ и аммиак могут быть адсорбированы на оставшихся кристаллах исходных веществ. Аммиак, по-видимому, адсорбирован сильней, чем углекислый газ, поэтому второй стадией термолиза является десорбция и удаление углекислого газа, а третьей стадией - аммиака.
Сопоставление соотношения площадей под гауссианами, полученными при аппроксимации кривых ДСК показывает, что для разложения гидрокарбоната аммония в целом требуется больше энергии, следовательно, он является более эффективным охладителем, однако карбонат аммония дольше поддерживает процесс охлаждения.
Выводы
Термолиз карбоната и гидрокарбоната аммония протекает в три стадии с последовательным отщеплением воды, углекислого газа и аммиака. Гидрокарбонат аммония является более энергоёмким охладителем, чем карбонат аммония, но последний дольше поддерживает процесс охлаждения.
Совместная аппроксимация кривых ДСК (ДТА) и ДТГ кривыми Гаусса позволяет для двух типов кривых найти параметры гауссианов, имеющие наиболее близкие значения положения вершин. Это даёт возможность более детально исследовать процесс термической деструкции, в частности, определить стадии термолиза, вычислить массы продуктов термодеструкции и найти соответствие продуктов стадиям термического разложения.
Работа выполнена в рамках Федеральной целевой программы «Научные и научнопедагогические кадры инновационной России» на 2009-2013 годы, г/к № 14.740.11.0718.
Список литературы Термолиз карбоната и гидрокарбоната аммония как твёрдых охладителей продуктов сгорания топлива
- Van Reeuwijk, L.P. The thermal dehydration of natural zeolites./L.P. Van Reeuwijk. -Wageningen: H. Weenman & B.V. Zonen, 1974. -320 p.
- Leitão, M.L.P. Study of polymorphism from DSC melting curves/M.L.P. Leitão, J. Canotilho, M.S.C. Cruz et al.//Journal of Thermal Analysis and Calorimetry, 2002. -Vol. 68. -P. 397-412.
- Авдин, В.В. Новый способ обработки данных дифференциального термического анализа/В.В. Авдин, A.A. Лымарь, A.B. Батист//Вестник ЮУрГУ. -Серия «Математика, физика, химия». -2006. -Вып. 7. -№ 7(62). -С. 211-214.
- Васильев, Ф.П. Численные методы решения экспериментальных задач/Ф.П. Васильев. -М.: Наука, 1988. -552 с.


