"Трудный" пациент с Т2-ассоциированными заболеваниями в общеврачебной практике
Автор: Григорьева Е.В., Григорьева Н.В.
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Рубрика: Медицина
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
В статье освещен механизм Т2-воспаления, описаны основные цитокины, опосредующие тяжелые эозинофильные болезни, представлена частота выявления коморбидных Т2-опосредованных заболеваний: бронхиальной астмы, аллергического ринитам, хронического полипозного риносинусита, атопического дерматита и эозинофильного эзофагита. Более подробно описаны симптомы, методы диагностики с акцентом на правильность гистологической верификации эозинофилии в биоптатах слизистой пищевода, современные алгоритмы терапии, включающие немедикаментозные диетические рекомендации и фармакотерапию с применением ингибиторов протонной помпы и топических глюкокортикостероидов. Особое внимание уделено современному методу лечения Т2-опосредованных заболеваний - иммунобиологической терапии генно-инженерными препаратами. Показаны преимущества препарата «Дупилумаб», ингибирующего ключевые цитокины Т2-воспаления ИЛ-4 и ИЛ-13 и имеющего наиболее широкие показания к применению.
Т2-воспаление, интерлейкины ил-4 и ил-13, бронхиальная астма, атопический дерматит, хронический полипозный риносинусит, эозинофильный эзофагит, дупилумаб
Короткий адрес: https://sciup.org/148329395
IDR: 148329395 | УДК: 632.938 | DOI: 10.18101/2306-1995-2024-1-19-25
Текст научной статьи "Трудный" пациент с Т2-ассоциированными заболеваниями в общеврачебной практике
Григорьева Е. В., Григорьева Н. В. «Трудный» пациент с Т2-ассоциированными заболеваниями в общеврачебной практике // Вестник Бурятского государственного университета. Медицина и фармация. 2024. № 1. С. 19‒25.
В последние десятилетия многие специалисты здравоохранения все чаще наблюдают у одного пациента коморбидные хронические заболевания, различные по клиническим проявлениям, но объединенные единообразным механизмом развития. Получены убедительные научные факты о наличии иммунного воспаления, приводящего к ремоделированию тканей органов у пациентов с бронхиальной астмой (БА), аллергическим ринитом (АР), хроническим полипозным риносинуситом (ХПРС), атопическим дерматитом (АтД) и эозинофильным эзофагитом (ЭоЭ) [1;
-
2]. Своевременное определение сходных патогенетических факторов у пациентов с указанными заболеваниями позволяет оптимизировать фармакотерапию и уменьшить полипрагмазию за счет применения генно-инженерных иммунобиологических препаратов (ГИБП) — моноклональных антител, блокирующих ключевые цитокины патологического иммуновоспалительного процесса, и достичь устойчивого контроля над болезнями.
Большинство случаев развития АтД, АР, ХПРС, БА и ЭоЭ связано с формированием в органах-мишенях Т2-воспаления (T2-опосредованного воспаления = воспаления 2-го типа = Th2-воспаления) — патологическим иммуноопосредованным процессом, обусловленным активацией T-хелперов 2-го типа (Th2-клеток) и врожденных лимфоидных клеток 2-го типа (ILC2= ВЛК2). Дисрегуляция иммунного ответа 2-го типа с участием также B-клеток, клеток Лангерганса, эозинофилов и некоторых других клеток иммунной системы сопровождается продукцией таких Т2-цитокинов, как интерлейкины ИЛ-4 (IL-4), ИЛ-5(IL-5), ИЛ-13(IL-13) и другие, что приводит к развитию системного воспалительного процесса. Эффекты данных цитокинов разнообразны. В частности, ИЛ-5 способствует активации, выживанию и миграции эозинофилов в кровеносное русло; ИЛ-4 и ИЛ-13 стимулируют хе-мокин-опосредованную миграцию эозинофилов в ткани, переключение В-лимфо-цитов на синтез иммуноглобулинов Е (IgE), что приводит к прямой активации эффекторных клеток — эозинофилов, базофилов и тучных клеток — и высвобождению провоспалительных медиаторов, например, гистамина, гепарина, главного основного белка, и цитокинов [3]. Поиск биомаркеров Т2-опосредованных заболеваний и новых терапевтических мишеней важен для выбора лекарственных препаратов, контроля эффективности терапии, прогнозирования результатов и разработки стратегий модификации течения процесса [4].
Сложность выбора ГИБП в общеврачебной практике обусловлена взаимоотя-гощающим влиянием коморбидных Т2-воспалительных заболеваний. Известно, например, что БА нередко сочетается с поражением верхних дыхательных путей и кожи: аллергический ринит в 44‒69%, ХПРС — в 30‒45%, АИРЗ — в 15‒22%, АтД — у 15‒25 % пациентов. Одновременное наличие у пациентов с АтД не только пищевой аллергии в 17‒38 % случаев, но и респираторной патологии регистрируется у 34–51% пациентов — аллергический ринит, у 8‒47% — БА. Пациенты, имеющие ХПРС, в 46‒76 % случаев страдают также аллергическим ринитом, астмой — в 48‒66 %, АтД — 9%. Нередко ХПРС выявляется у 10‒21% пациентов с аспирин-индуцированным заболеванием (АИРЗ) [5].
Относительно новым направлением исследований Т2-ассоциированных заболеваний является изучение эозинофильных гастроинтестинальных заболеваний (ЭГИЗ) — воспалительных состояний ЖКТ, которые характеризуются эозинофилией тканей и дисфункцией или повреждением конечных органов с грубым нарушением функции, приводящим к инвалидизации. Наиболее распространенным и изученным в этой группе сегодня является эозинофильный эзофагит (ЭоЭ), диагностировать который зачастую нелегко из-за неярко выраженных симптомов и отсутствия у врачей широкого профиля настороженности по отношению к этому заболеванию [6]. Данные об истинной заболеваемости и распространенности ЭоЭ в мире отсутствуют. Но в последние годы наблюдается значительный рост числа выявленных случаев ЭоЭ в США и в некоторых странах Европы, что возможно связано как с истинным увеличением заболеваемости, так с повышением информированности врачей о патологии и улучшением методов диагностики. Первичная заболеваемость в настоящее время оценивается как 5‒10 пациентов на 100 000 населения в год. ЭоЭ может возникнуть в любом возрасте, однако большинство новых случаев регистрируется у детей, подростков и лиц младше 50 лет. У взрослых пациентов пик заболеваемости ЭоЭ приходится на период между 30‒50 годами. К факторам риска относятся мужской пол, атопические заболевания [7].
ЭоЭ — это хроническое медленно прогрессирующее Th2-ассоциированное заболевание пищевода. В основе патогенеза ЭоЭ лежит развитие эозинофильного воспаления в слизистой оболочке пищевода и подслизистого фиброза, что клинически проявляется дисфагией [8]. Диагностические критерии ЭоЭ основываются на данных клинической картины заболевания (дисфагия, эпизоды вклинения пищи в пищевод, боль в грудной клетке без связи с глотанием), а также на совокупности эндоскопических и гистологических признаков. Критерием установления диагноза служит эозинофильная инфильтрация слизистой оболочки пищевода с плотностью эозинофилов ≥ 15 в поле зрения микроскопа при большом увеличении (×400) по крайней мере в одном из биоптатов (около 60 эозинофилов в мм2). Вспомогательное значение для диагноза имеют исследование общего IgE, эозинофилия периферической крови, результаты кожных аллергопроб. Диагностика ЭоЭ нередко затруднена из-за вариабельности эндоскопической картины у разных пациентов. Характерными патологическими изменениями, определяемыми при эндоскопическом исследовании, являются кольца (гофрированные кольца, округлые края), борозды (продольные линии), отек (отсутствие или нечеткость сосудистого рисунка), экссудат (белые бляшки или поражения), стриктура (сужения просвета пищевода) [9].
В 93% наблюдений заболевание характеризуется наличием патогномоничных эндоскопических признаков, однако только эндоскопическая картина без последующей гистологической верификации не является основанием для установления диагноза ЭоЭ. Биопсия должна быть взята как минимум из 6 различных участков слизистой оболочки пищевода, особенно из тех, где эндоскопические изменения наиболее выражены. Взятие биопсии необходимо из различных участков слизистой оболочки пищевода, так как воспалительные изменения при ЭоЭ носят мультифокальный характер. Приоритет должен отдаваться участкам с патологическими изменениями при эндоскопическом обследовании (пищеводные кольца, борозды и белесоватые бляшки). Диагностическая чувствительность возрастает с увеличением количества взятого гистологического материала [9].
Цель лечения ЭоЭ — уменьшение клинических симптомов и улучшение гистологической картины, а также коррекция или профилактика таких осложнений, как стриктуры пищевода или застревание пищи, которые могут привести к разрывам пищевода [10]. Принципы терапии и алгоритм лечения опубликованы в Рекомендациях Британского гастроэнтерологического общества по диагностике и ве- дению детей и взрослых с ЭоЭ — при подтвержденном диагнозе ЭоЭ следует оценить симптомы, пищевые привычки, сопутствующие жалобы, обусловленные аллергическими/ атопическими расстройствами, естественное течение болезни. При значительной выраженности симптомов/стриктур требуется рассмотреть возможность дилатации пищевода. Одним из основных методов лечения является диета (с привлечением врача-диетолога). К медикаментозному лечению относится применение ингибиторов протонной помпы (ИПП), например, омепразол 20 мг дважды в день, или топических глюкокортикостроидов (ГКС), например, будесонид 1 мг дважды в день. Лекарственные препараты (омепразол и будесонид) не зарегистрированы в Российской Федерации для лечения ЭоЭ. Через 8‒12 недель после начала лечения рекомендуется сделать эзофагогастродуоденоскопию (ЭГДС) с биопсией пищевода (⩾6 биоптатов из разных участков пищевода) для оценки эффективности проводимой терапии. При наличии эозинофилов < 15 /0,3 мм2 рекомендована поддерживающая терапия, возможно снижение дозы препарата до минимально эффективной, постоянное наблюдение врачом-гастроэнтерологом. По данным ЭГДС при обнаружении эозинофилов более 15 /0,3 мм2 рекомендовано исключить наличие другой патологии, сосуществующей с эозинофилией пищевода, рассмотреть необходимость дилатации пищевода, произвести смену препарата (например, ИПП на топические ГКС), использовать комбинацию препаратов (например, ИПП и топические ГКС), рассмотреть возможность применения биологических препаратов [11].
В проекте Российских клинических рекомендаций по диагностике и лечению эозинофильного эзофагита (2022 г.) в качестве первой линии предлагается немедикаментозная терапия с применением элиминационных диет. Длительное исключение пищевых продуктов-триггеров ЭоЭ может привести к клинической и гистологической ремиссии без применения медикаментозной терапии. В основе медикаментозной терапии рекомендованы ИПП, которые приводят к индукции клинической и гистологической ремиссии у части пациентов с ЭоЭ. В качестве эффективной поддерживающей терапии для сохранения ремиссии заболевания у пациентов с положительным эффектом от инициальной терапии ИПП служит длительное назначение ИПП. В то же время системные ГКС не рекомендованы для лечения ЭоЭ. Долгосрочное назначение топических стероидов эффективно для поддержания ремиссии заболевания у части пациентов, у которых топические стероиды ранее привели к индукции ремиссии 1 .
Еще одной стратегией лечения ЭоЭ является применение препарата «Дупилу-маб», представляющего собой человеческие моноклональные антитела к субъеди- нице альфа рецептора IL-4Rα — общей для ИЛ-4 и ИЛ-13. По результатам опубликованных исследований препарат «Дупилумаб», подавляющий сигнальные пути ИЛ-4 и ИЛ-13, показал высокую эффективность в лечении АтД и БА. Применение дупилумаба для лечения основного заболевания (БА, АтД или ХПРС) у пациентов с ЭоЭ способствует улучшению симптомов и гистологической ремиссии заболевания, а также снижает потребность в терапии, принимаемой пациентами для лечения ЭоЭ [12].
Ингибирование функций Т2-цитокинов открывает новые возможности для пациентов с коморбидными Т2-ассоциированными заболеваниями. В Российской Федерации Т2-таргетные биологические препараты одобрены по следующим показаниям: бронхиальная астма: дупилумаб 6+, омализумаб, меполизумаб 6+ ,бе-нрализумаб, реслизумаб 18+. Атопический дерматит: дупилумаб 6 мес.+. Полипозный риносинусит: дупилумаб 18+, омализумаб 18+, меполизумаб 18+. Узловатая почесуха: дупилумаб 18+. Хроническая идиопатическая крапивница: омализу-маб 12+. Аллергический ринит: омализумаб 12+. Эозинофильный эзофагит: дупи-лумаб 12+. Эозинофильный гранулематоз с полиангиитом: меполизумаб 18+. Гиперэозинофильный синдром: меполизумаб 18+.
В Республике Бурятия используются все 4 зарегистрированные молекулы ГИБП для лечения Т2-ассоциированных заболеваний (рис. 1) с положительной динамикой состояния пациентов.
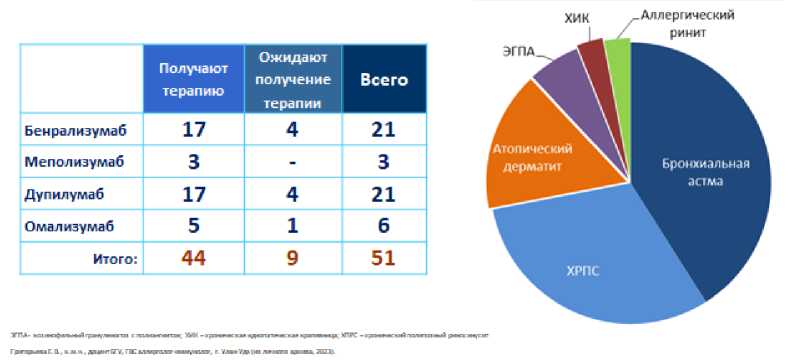
Рис.1. Опыт назначения ГИБП при Т2-ассоциированных заболеваниях в Республике Бурятия на 01.01.2024
Таким образом, пациент с коморбидными Т2-ассоциированными заболеваниями действительно представляет трудности для определения оптимальной тактики ведения в общеврачебной практике. Но знание ключевых цитокинов иммунного Т2-воспаления позволяет выбрать эффективный ГИБП, ингибирующий эози- нофильный патологический процесс. Во многих случаях тяжелых Т2-опосредо-ванных заболеваний предпочтительным для терапии выглядит препарат «Дупилу-маб» — человеческое рекомбинантное моноклональное IgG4 антитело, ингибирующее ИЛ-4 и ИЛ-13, имеющий наиболее широкий зарегистрированный спектр показаний (АтД, БА, ХПРС, ЭоЭ, узловатая почесуха) и открывающий новые возможности для пациентов с Т2-ассоциированными заболеваниями.
Список литературы "Трудный" пациент с Т2-ассоциированными заболеваниями в общеврачебной практике
- Новые возможности терапии Т2-ассоциированных заболеваний / С. Х. Хутуева, М. С. Шогенова, И. З. Алиева, Л. С. Шогенова // Consilium Medicum. 2021. № 23(8). С. 662–667. DOI: 10.26442/20751753.2021.8.201183. Текст: непосредственный.
- C. A. Akdis, P. D. Arkwright, M. C. Brüggen et al. / Type 2 immunity in the skin and lungs. Allergy. 2020. 75(7):1582–1605. DOI: 10.1111/all.143182022.
- Ненашева Н. М. Т2-бронхиальная астма: характеристика эндотипа и биомаркеры // Пульмонология. 2019. № 29(2). С. 216–228. Текст: непосредственный.
- Дупилумаб: новые возможности в терапии бронхиальной астмы и полипозного ри-носинусита / М. Е. Дынева, Г. Э. Аминова, О. М. Курбачева, Н. И. Ильина // Российский аллергологический журнал. 2021. Т. 18, № 1. С. 18‒31. Текст: непосредственный.
- Khan A., Gouia I, Kamat S. et al. Type 2 inflammation-related comorbidities among pa-tients with asthma, chronic rhinosinusitis with nasal polyps, and atopic dermatitis. Eur Respir J. 2020. 56:232. doi:10.1183/13993003.congress-2020.232
- Чеченкова Е. В., Саванович И. И. Анализ клинических согласованных рекомендаций по лечению пациентов с эозинофильным эзофагитом // Проблемы здоровья и экологии. 2020. № 4. С. 12–22. Текст: непосредственный.
- Wąsik J., Małecka-Wojciesko E. J. Eosinophilic Esophagitis-What Do We Know So Far? Clin Med. 2023; Mar 14;12(6):2259.
- Эозинофильный эзофагит: современный взгляд на проблему и собственные клинические наблюдения / В. О. Кайбышева, С. В. Кашин, Л. М. Михалева [и др.] // Доказательная гастроэнтерология. 2019. № 8(1). С. 58‒83. Текст: непосредственный.
- Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению эозинофильного эзофагита, 2018 год / В. Т. Ивашкин, И. В. Маев [и др.]. URL: https://doi.org/10.22416/1382-4376-2018-28-6-84-98. Текст: непосредственный.
- Lucendo A. J., Molina-Infante J., Arias Á. et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J. 2017. 5(3):335–58.
- Dhar A., Haboubi H. N., Attwood S. E., Auth M. K. H., Dunn J. M., Sweis R., Morris D., Epstein J., Novelli M. R., Hunter H. et al. (2022) British Society of Gastroenterology (BSG) and British Society of Paediatric Gastroenterology, Hepatology and Nutrition (BSPGHAN) joint con-sensus guidelines on the diagnosis and management of eosinophilic oesophagitis in children and adults. Gut, 71 (8). P. 1459‒1487.
- Spergel B. L., Ruffner M. A., Godwin B. C. et al. Improvement in eosinophilic esophagitis when using dupilumab for other indications or compassionate use. Ann Allergy Asthma Immunol. 2022. May.128(5):589‒593. doi: 10.1016/j.anai.2022.01.019. Epub 2022 Jan 25. PMID: 3508581


