Углеродные наночастицы с ковалентно функционализированной поверхностью: синтез, физико-химические свойства, использование в клинической диагностике и перспективы применения
Автор: Раев М.Б., Храмцов П.В., Бочкова М.С.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Биотехнология
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
На основе разработанных технологий ковалентной функционализации поверхности углеродных наночастиц биологически активными соединениями (антителами, бактериальными белками и т.д.) получены стабильные оптически контрастные суспензии модифицированных наночастиц. Синтезированные реагенты использованы для создания высокоэффективных неинструментальных систем клинической и внеклинической диагностики в форматах дот-иммуноанализа, иммунохромато-графии, иммунофильтрации. Технологическая схема синтеза углеродных конъюгатов адаптирована для промышленного производства и легко масштабируется. Изучены физико-химические свойства ковалентно функционализированных наночастиц: размеры (98±17 нм), форма, стабильность при хранении, спектр поглощения и т.д. На основании полученных данных сформулированы принципы контроля качества функционализации, описаны методы мониторинга процесса синтеза. Показана перспективность применения конъюгатов углеродных наночастиц не только для разработки тест-систем, но и адресной доставки лекарственных средств, а также для изучения поверхностных структур клеток.
Углеродные наночастицы, функционализация
Короткий адрес: https://sciup.org/147204713
IDR: 147204713 | УДК: 602.68:57.083.3
Текст научной статьи Углеродные наночастицы с ковалентно функционализированной поверхностью: синтез, физико-химические свойства, использование в клинической диагностике и перспективы применения
Уникальные свойства наноматериалов привле кают повышенное к ним внимание с точки зрения for test-system designing, but for target drug delivery применения в различных областях прикладных наук, в том числе в медицине и биотехнологии. Модифицированные наночастицы уже применяются для создания биосенсоров, препаратов адресной
доставки лекарственных средств, систем неинструментальной визуализации [Aldus, 2003; Lau, 2006; Cui, 2008; Li, 2011; An, 2012]. Золотые, латексные, углеродные наночастицы с функционализированной поверхностью используются в системах оперативного анализа, получение результата в которых требует минимальных временных затрат. Подобные тесты просты, наглядны, их использование доступно неспециалисту. Наиболее показательным примером являются иммунохроматогра-фические тесты на беременность.
Как правило, принципиальной основой экспресс-тестов является использование наночастиц в качестве окрашенных меток, сенсибилизированных аффинными соединениями (анти-аналитами), способными специфично взаимодействовать с соответствующими аналитами. Результат анализа при этом может быть оценен невооруженным взглядом по наличию окрашивания в аналитической зоне теста.
Активно использовать углеродные наночастицы в создании тест-систем стали в начале 90-х гг. прошлого века. Интерес к ним определялся несколькими факторами: более высокой интенсивностью окраски по сравнению с традиционными метками (частицами золота и латекса), относительной инертностью и устойчивостью к изменениям рН, простотой и многообразием способов синтеза, доступностью коммерческих наночастиц (крупнейшие производители: «Evonik-Degussa», «Cabot»), наличием нетрудоемких методов их нековалетной функционализации [van Amerongen, 1993; Bogdanovic, 2006; Blazkova, 2009; He, 2011; Noguera, 2011;Posthuma-Trumpie, 2012] .
Несмотря на перечисленные достоинства, примеры применения углеродных наночастиц в системах экспресс-диагностики весьма немногочисленны. Достаточно сложно объяснить отсутствие повышенного интереса к углеродной метке у разработчиков неинструментальных иммуноаналитиче-ских систем. Возможно, это связано с относительной сложностью получения стабильных суспензий углеродных частиц или трудностью их ковалентной функционализации без предварительной химической или термической обработки [PosthumaTrumpie, 2012].
В нашей лаборатории (экологической иммунологии) была разработана технология получения ковалентно функционализированных аффинными соединениями углеродных наночастиц. Данная технология представляет собой оригинальный и эффективный подход к синтезу конъюгатов углеродных наночастиц с различными биологически активными соединениями. Ее преимуществами являются высокая гибкость, заключающаяся в простоте масштабирования до промышленных объемов без необходимости внесений существенных изменений в процедуру синтеза, а также универсальность, позволяющая модифицировать углеродные наночастицы любым соединением, имеющим в своем составе аминогруппы.
Разработка технологии, ориентированной на массовое крупномасштабное практическое применение, определяет необходимость создания системы мониторинга синтеза и стандартизации получаемых продуктов. Контроль может осуществляться путем исследования либо их функциональных свойств, либо структурных параметров. Первый способ заключается в оценке аналитических свойств готовых диагностикумов в модельных тест-системах. Он применим к конечному продукту синтеза, однако для полноценного мониторинга технологического процесса более удобен второй путь. В качестве параметров поэтапного контроля синтеза были выбраны распределение частиц по размеру и оптическая плотность их суспензий. Размер во многом определяет стратегию разработки диагностических систем, поскольку он влияет не только на интенсивность аналитического сигнала, но и на формат анализа, а также на подбор пористого твердофазного реагента.
Цель настоящей работы – изучение физикохимических свойств функционализированных углеродных наночастиц, подбор оптимального метода контроля технологического процесса синтеза и наилучших условий его реализации.
Материалы и методы
Материалы
Толуол, гептан, гексан «Экрос» (Россия), ацетон, этанол, метанол, диметилформамид, диметилсульфоксид «Вектон» (Россия), белок G, бычий сывороточный альбумин (БСА) «Sigma» (США), стрептавидин «Prospec Bio» (Израиль), глутаральдегид «AppliChem» (Германия), хлорид натрия, гидрофосфат натрия, дигидрофосфат натрия, глицерин «Panreac» (Испания), азид натрия, фиколл 400 «Fluka» (Германия), диализные мешки «Serva» (Германия), сефароза CL-6B, хроматографическая колонка XK 16/40 «Pharmacia Fine Chemicals» (Швеция), проводящая углеродная липкая лента шириной 6 мм для сканирующей электронной микроскопии (СЭМ) «Ted Pella Inc» (США), кремниевые пластины для СЭМ, 5 x 5 мм «SPI Supplies» (США), кантилеверы Medium-soft Silicon Cantilever Classic, «Olympus» (Япония).
Приборы: спектрофотометр Shimadzu UV-VIS UVmini 1240 (Япония), сканирующий электронный микроскоп FEI NOVAsem 600 (США), атомно-силовой микроскоп Asylum Research (США), ультразвуковой дезинтегратор MSE Soniprep 150 (Великобритания), анализатор частиц Malvern ZetaSizer NanoZS (Великобритания), планшетный спектрофотометр Biohit PB 800 (Финляндия).
Буферный раствор: 0.15М раствор NaCl, забу-ференный 0.015М Na-фосфатами, содержащий 0.1% азида натрия рН 7.25 (ЗФР).
Методы
Технология получения ковалентно структурированных конъюгатов углеродных наночастиц с аффинными соединениями. Синтез конъюгатов углеродных частиц с G белком и стрептавидином проводили, по методике, описанной в работе [Храмцов, 2014]. Синтезированные конъюгаты хранили при температуре +4°С.
Структура поверхности функционализированных углеродных частиц в настоящее время изучена недостаточно, существует лишь ее гипотетическая схема (рис. 1).
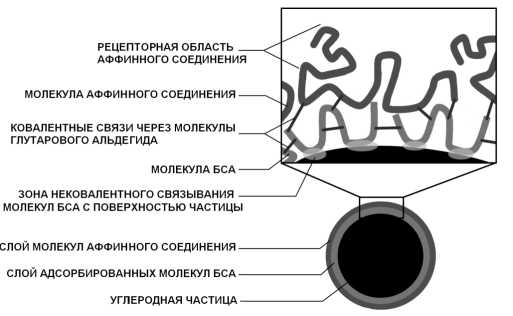
Рис. 1 . Гипотетическая схема строения функционализированной углеродной частицы
Спектроскопия . Регистрацию спектра поглощения модифицированных углеродных наночастиц и определение оптической плотности их растворов на разных этапах синтеза проводили на спектрофотометре Shimadzu UV-VIS UVmini 1240.
Сканирующая электронная микроскопия (СЭМ) . Исследование размеров углеродных частиц проводили на микроскопе FEI NOVAsem 600. Образцы суспензий разводили в воде до концентрации 0.0001%, наносили на кремниевую подложку и высушивали. Частицы аморфного углерода перед сканированием закрепляли на проводящей углеродной ленте.
Атомно-силовая микроскопия (АСМ) . Размеры углеродных частиц определяли при помощи микроскопа Asylum Research. Образцы суспензий разводили в воде до концентрации углерода 0.0001%, наносили на стекло и высушивали. Измерения проводили в контактном режиме, скорость сканирования составляла 0.4 Гц, разрешение 512 x 512 пикселей. Для измерения использовали кантилеверы Medium-soft Silicon Cantilever Classic, «Olympus» (Япония). Размер частиц был определен как средняя величина, полученная при суммарном измерении 89 частиц в трех различных полях зрения.
Измерение обратного динамического светорассеяния . Для определения диаметра частиц использовали метод измерения обратного динамического рассеяния света (ОДРС) водных растворов суспензий углеродных частиц под углом 173° при помощи программно-аппаратного комплекса Malvern ZetaSizer NanoZS. Массовая доля углеродных наночастиц в исследуемом образце составляла 0.0001%.
Исследование функциональных свойств конъюгатов . Функциональные свойства конъюгатов углерод-стрептавидин определяли в модельных тест-системах, сравнивая показатели их чувствительности и специфичности. В качестве модели использовали метод прямого дот-иммуноаналити-ческого определения биотинилированного белка, иммобилизированного на нитроцеллюлозной мембране.
На диски нитроцеллюлозной мембраны диаметром 5 мм дотами из капель по 3.5 мкл наносили двукратные серийные разведения биотинилированного БСА (биотинилирование антител проводили по Gosling [Gosling, 2000, с. 123]), начиная с концентрации 0.01 мг/мл в ЗФР. Затем диски трехкратно промывали ЗФРТ, детекцию проводили четырьмя конъюгатами стрептавидин-углерод, хранившимися в течение 1 года, 3, 11 и 22 лет. При взаимодействии конъюгата с биотинилированным белком формировались зоны темного окрашивания в форме точек в области сорбции антилиганда. Чувствительность системы определяли по последней визуализируемой точке в ряду серийных разведений биотинилированного БСА.
Результаты
При измерении конъюгата углерод – G белок с использованием АСМ (рис. 2) средний размер частиц составил 98±17 нм (min=56 нм, max=142 нм, стандартное отклонение 17.36, стандартная ошибка среднего 1.84). Также было отмечено наличие отдельных агрегатов с размерами 0.3–1 мкм. Присутствие последних может объясняться как наличием их в исходной суспензии, так и следствием процедуры подготовки пробы. Результаты расходятся с данными, полученными Linares с соавт. [Linares, 2012]. В указанной работе размер частиц составил 150±50, однако полученные результаты не могут быть экстраполированы на описываемую нами технологию. Это связано с модификациями, которые были введены авторами в технологический процесс, а именно заменой хроматографического разделения конъюгата и не связавшихся компонентов на ультрацентрифугирование.
Для визуализации частиц аморфного углерода и функционализированных белком G углеродных частиц была использована СЭМ. Этот метод является наиболее удобным для исследования формы и размеров частиц сухого аморфного углерода благодаря простой и быстрой подготовке пробы. Исследование образца аморфного углерода показало, что он представляет собой частицы сферической или близкой к сферической формы, линейные размеры которых лежат в диапазоне 40–70 нм (рис. 3).
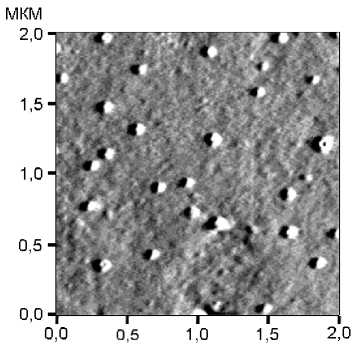
Рис. 2. АСМ-изображение функционализированных G белком углеродных наночастиц

Рис. 3 . СЭМ-изображение частиц аморфного углерода
Результаты исследования образца суспензии конъюгата углерод – G белок соответствуют данным АСМ. Частицы имеют сферическую форму, также отмечена тенденция к формированию агрегатов (рис. 4).
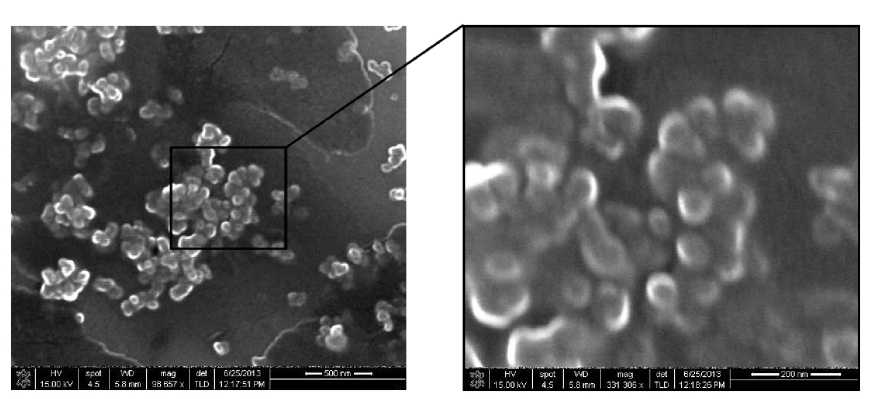
Рис. 4 . СЭМ-изображение функционализированных G белком углеродных наночастиц
Полученные результаты демонстрируют идентичный характер распределения частиц по размерам для конъюгатов, хранившихся в течение 1, 11 и 22 лет, пики на графиках распределения приходятся на частицы диаметром 90–100 нм. Для
Помимо АСМ и СЭМ, линейные размеры частиц исследовали методом измерения ОДРС. Измерение ОДРС частиц дает возможность оценить их распределение в растворе по размерам за несколько минут; метод удобен благодаря своей простоте и оперативности. Число измеренных частиц на несколько порядков выше, чем при использовании АСМ или СЭМ [Bootz, 2004]. Кроме того, единственное требование при подготовке пробы – разведение частиц до требуемой концентрации, а значит, частицы сохраняют свое нативное состояние. При высушивании частиц на подложке для микроскопии высока вероятность их агрегации, кристаллизации солей и стабилизаторов, что может негативно повлиять на ход исследования образцов.
Для измерения ОДРС функционализированных углеродных частиц были подготовлены растворы конъюгата углерод-стрептавидин в различных растворителях для определения степени его влияния на результат исследования. Были протестированы вода, ЗФР, ЗФР с 20% глицерина и 1% БСА. Анализ всех проб привел к идентичным результатам, что позволило в качестве растворителя в дальнейшем использовать деионизированную воду.
Для измерения ОДРС функционализированных углеродных частиц были подготовлены растворы конъюгата углерод-стрептавидин в различных растворителях для определения степени его влияния на результат исследования. Были протестированы вода, ЗФР, ЗФР с 20% глицерина и 1% БСА. Анализ всех проб привел к идентичным результатам, что позволило в качестве растворителя в дальнейшем использовать деионизированную воду.
Метод измерения ОДРС использовали для сравнения распределения по размерам конъюгатов углерод-стрептавидин с различным сроком хранения, а также мониторинга изменения размеров углеродных частиц на различных стадиях синтеза.
функционализированных углеродных частиц, хранившихся 3 года, пик распределения приходится на частицы размером 110–120 нм. Такое отклонение, видимо, связано с особенностями проведения синтеза конкретной партии частиц (рис. 5).
Исследование распределения частиц продемонстрировало увеличение среднего размера функционализированных белком G углеродных частиц (средний диаметр 165 нм) по сравнению с гидро-филизированными БСА частицами (средний диаметр 134 нм). Таким образом, продемонстрирова-
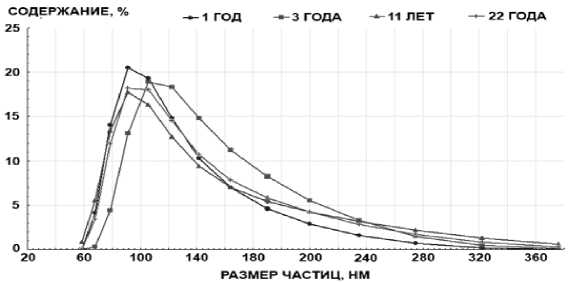
Рис. 5 . График распределения по размерам функционализированных стрептавидином углеродных наночастиц с различным сроком хранения (метод измерения ОДРС)
но увеличение диаметра частиц в ходе их функционализации G белком (рис. 6). По всей вероятности, это связано с ковалентной пришивкой к поверхности гидрофилизированных частиц молекул G белка, диаметр глобулы которого составляет порядка 5–6 нм.
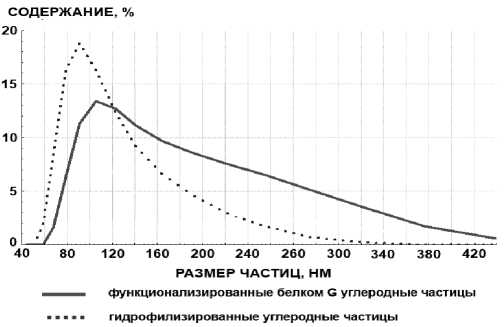
Рис. 6 . График распределения по размерам функционализированных G белком углеродных наночастиц на разных стадиях синтеза (метод измерения ОДРС)
Функциональную стабильность диагностикумов оценивали в модельных тест-системах. Тестированию подвергали указанные выше четыре конъюгата углерод-стрептавидин. Согласно имеющимся данным, чувствительность детекции конъюгатом углерод-стрептавидин в год синтеза (1991) состав- ляла 80 нг/мл. Проведенные испытания показали, что чувствительность всех модельных тест-систем составила 78 нг/мл, т.е. функциональная активность диагностикумов является одинаковой (рис. 7).
ВОЗРАСТ КОНЪЮГАТА
22 ГОДА
11 ЛЕТ
3 ГОДА
1 ГОД
КОНЦЕНТРАЦИЯ БИОТИНИЛИРОВАННОГО БСА, НГ/ИЛ
2500 1250 625 312 156 78 39 БСА
О О О О О 0080# О О • • • О©®#®
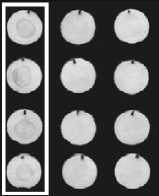
Рис. 7 . Сравнение функциональной активности конъюгатов углерод-стрептавидин с различным
сроком хранения.
Примечание. Описание эксперимента приведено в разделе «Методы», слева указана длительность хранения конъюгата в годах, сверху – концентрации биотинилированного БСА в нг/мл, БСА – отрицательный контроль: диски, сенсибилизированные БСА. Последние визуализируемые точки в рядах серийных разведений антител выделены рамкой
Сохранение функциональных свойств конъюгатов, хранившихся более 20 лет, а также идентичность структурных и аналитических характеристик конъюгатов, синтезированных с интервалом в 22 года, свидетельствуют о высокой стабильности готовых суспензий функционализированных наночастиц и высоком уровне стандартизации процесса их синтеза.
В качестве метода мониторинга количественных параметров синтеза использовали метод спектрофотометрии, позволяющий оперативно оценить содержание частиц углерода в пробах, отобранных на разных стадиях синтеза.
Полученный спектр поглощения суспензии углеродных частиц в диапазоне длин волн 200–900 нм показал, что наибольшее поглощение наблюдается в диапазоне 260–280 нм, что связано с наличием адсорбированного на поверхности частиц белка (рис. 8). В качестве референсной была выбрана длина волны 450 нм. При этой длине волны наблюдалась относительно линейная зависимость поглощения раствора от концентрации углеродных частиц. Такая зависимость сохраняется при поглощения раствора от 0.2 до 2.0 оптических единиц, что соответствует диапазону концентраций углеродных частиц 0.0004–0.004%.
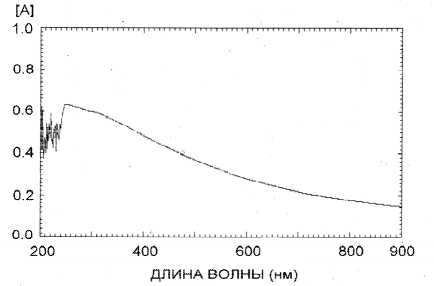
Рис. 8 . Спектр поглощения функционализированных углеродных наночастиц
Для мониторинга процесса синтеза и определения рабочего титра полученного конъюгата было введено понятие условной оптической плотности (УОП). Под оптической плотностью раствора суспензии частиц углерода на различных стадиях синтеза понимается величина поглощения раствора в линейном диапазоне регистрации спектрофотометра, умноженная на разведение. Так, поглощение при длине волны 450 нм 5%-ной суспензии частиц при разведении в 5000 раз равно 0.46 оптических единицы. УОП этой суспензии, таким образом, составит 0.46 х 5000 = 2300. Величина УОП используется также для определения рабочего титра конъюгата. Оптимальная диагностическая концентрация конъюгата составляет 0.03%. Отношение величины поглощения суспензий конъюгатов при длине волны 450 нм к их концентрации является постоянной величиной и не зависит от того, какой белок использовался для функционализации и на какой стадии синтеза происходит измерение. Так, при концентрации функционализированных частиц 0.03%, УОП раствора равна 14. Таким образом, для определения рабочего разведения углеродного конъюгата необходимо разделить его оптическую плотность на 14.
Спектрофотометрический контроль позволяет оценивать содержание частиц углерода в пробах на различных стадиях синтеза, производить сравнения между отдельными сериями синтеза, а также оперативно выявлять возможные нарушения хода процесса. Так, резкое падение содержания углеродных частиц в пробе может свидетельствовать об утечке реагента, либо об интенсивной агрегации, ведущей к удалению значительных объемов углеродных частиц в ходе центрифугирования.
Результатом создания технологии получения ковалентно функционализированных наночастиц углерода является разработка разнообразных как по своему назначению, так и по форматным аранжировкам диагностических систем. В частности, были сконструированы системы оперативного тестирования в форматах иммунофильтрации, иммунохроматографии, реализующие преимущества углеродной метки – высокий уровень интенсивности сигнала, оптимальный для создания неинструментальных тест-наборов. Технология ковалентной функционализации наночастиц углерода стала основой для синтеза диагностических реагентов, представляющих собой конъюгаты углеродных наночастиц с бактериальными белками A и G, стрептавидином, моноклональными антителами [Раев, 2008, Rayev, 2008].
Область применения углеродных диагностику-мов чрезвычайно велика. Один из ярких примеров – серологический анализ, направленный на выявление антител к различным патогенам. Для создания таких систем достаточно синтезировать лишь один конъюгат, а затем, варьируя антигены, подбирая их концентрации и материалы твердой фазы, создавать системы обнаружения антител к любым доступным антигенам. Примерами являются разработанные системы детекции антител к столбняку, псевдотуберкулезу, ВИЧ и т.д. Также были сконструированы системы качественной и полуко-личественной детекции гормонов беременности: альфа-фетопротеина и хорионического гонадотропина, позволяющие осуществлять мониторинг процесса гестации (рис. 9) [Раев, 2012].
Привлекательные для создания экспресс-тестов аналитические свойства углеродных диагностику- мов, синтезированных согласно нашей технологии, были подтверждены в работе [Linares, 2012]. Авторы сравнивали наиболее распространенные в сфере неинструментальной диагностики цветные метки (углеродные наночастицы, коллоидное золото, латексные частицы). Углеродный диагностикум продемонстрировал наилучшую чувствительность по сравнению с диагностикумами на основе традиционных меток. Он был признан авторами перспективным для применения в клинической практике, а на его основе была сконструирована мо- дельная дот-аналитическая система выявления возбудителя лихорадки денге.

Рис. 9. Иммунофильтрационная система качественного определения хорионического гонадотропина
Важнейшим следствием получения углеродных наночастиц с ковалентно модифицированной поверхностью является решение задачи по сохранению функциональных свойств диагностикумов при хранении. В нашей работе четко продемонстрировано сохранение как структурных, так и функциональных свойств углеродных диагностикумов в течение 20 лет.
Другая особенность описанной технологии – ее независимость от поставщиков реагентов и лабораторного оборудования. Большинство используемых реагентов являются относительно дешевыми и широко распространенными на рынке. Это же касается и оборудования, необходимого для осуществления синтеза и контрольных измерений. Таким образом, созданная технологическая схема изначально адаптирована для промышленного применения и объективно не зависит от уникального или дорогостоящего оборудования.
Потенциал применения углеродных наночастиц, функционализированных при помощи ковалентных связей, не ограничивается лишь системами неинструментальной диагностики. Полуколиче-ственные системы анализа на основе углеродных конъюгатов могут быть сконструированы и в инструментальном варианте, при использовании методов измерения интенсивности окрашивания поверхности. Подобные системы описаны в работе [Lonnberg, 2008]. Однако разработка инструментальных тест-систем не является приоритетным направлением, поскольку основные преимущества функционализированных углеродных наночастиц проявляются именно в экспресс-тестах.
Одним их возможных направлений использования функционализированных углеродных наночастиц является исследование наличия и плотности расположения антигенных групп на поверхности клеток и изучение динамики перемещения по поверхности при помощи АСМ и СЭМ, направленные на визуализацию поверхностных молекулярных структур клеток бакЕтещреийоиднэоуйкапроитоетн. циальной сферой применения ковалентно функционализированных углеродных наночастиц является адресная доставка лекарственных средств (ЛС). Прочность ковалентной связи может обеспечить стабильную «пришивку» целевого ЛС к частицам и предотвратить его десорбцию с их поверхности при попадании во внутреннюю среду организма, обеспечить устойчивость к химическому окружению в районе доставки, которое может отличаться от химических условий в периферической крови.
Работа выполнена при финансовой поддержке Программы Президиума РАН 12-П-4-1004 «Фундаментальные науки – медицине».
Список литературы Углеродные наночастицы с ковалентно функционализированной поверхностью: синтез, физико-химические свойства, использование в клинической диагностике и перспективы применения
- Раев М.Б. Нанобиотехнологии в неинструментальной иммуноаналитике. Екатеринбург: УрО РАН, 2012. 140 с
- Раев М.Б. Частицы коллоидного углерода в системах неинструментальной диагностики//Клиническая лабораторная диагностика. 2008. № 2. С. 45 -48
- Храмцов П.В., Бочкова М.С., Раев М.Б. Исследование функциональных свойств иммуносорбен-тов неинструментальных дот-иммуноанали-тических тест-систем на основе антигенов Treponema pallidum//Вестник Пермского университета. Серия Биология. 2014. Вып. 1. С. 57-62
- Aldus, C.F. et al. Principles of Some Novel Rapid Dipstick Methods for Detection and Characterization of Verotoxigenic Escherichia Coli//Journal of Applied Microbiology. 2003. Vol. 95, № 2 P. 380-389
- An Hongjie, Jin Bo. Prospects of Nanoparticle-DNA Binding and Its Implications in Medical Biotechnology//Biotechnology Advances. 2012. Vol. 30, № 6. P. 1721-1732
- Blazkova M. et al. Immunochromatographic Colloidal Carbon-Based Assay for Detection of Methiocarb in Surface Water//Biosensors and Bioelectronics. 2009. Vol. 25, № 4. P. 753-758
- Bogdanovic J. et al. Rapid Detection of Fungal alpha-Amylase in the Work Environment With a Lateral Flow Immunoassay//Journal of Allergy and Clinical Immunology. 2006. Vol. 118, № 5. P. 1157-1163
- Bootz A. et al. Comparison of scanning electron microscopy, dynamic light scattering and analytical ultracentrifugation for the sizing of poly (butyl cyanoacrylate) nanoparticles//European Journal of Pharmaceutics and Biopharmaceutics. 2004. Vol. 57, № 2. P. 369-375.
- Cui Rongjing et al. Gold Nanoparticle-Colloidal Carbon Nanosphere Hybrid Material: Preparation, Characterization, and Application for an Amplified Electrochemical Immunoassay//Advanced Functional Materials. 2008. Vol. 18, № 15. P. 2197-2204
- Gosling J. Immunoassays: Л Practical Approach. New York: Oxford University Press, 2000. 304 p
- He Xiaodie et al. Water Soluble Carbon Nanoparticles: Hydrothermal Synthesis and Excellent Pho-toluminescence Properties//Colloids and Surfaces B: Biointerfaces. 2011. Vol. 87, № 2. P. 326-332
- Lau B.W. et al. Biocompatible, Hydrophilic, Su-pramolecular Carbon Nanoparticles for Cell Delivery//Advanced Materials. 2006. Vol. 18, № 18. P. 2373-2378
- Li Hailong et al. Nucleic Acid Detection Using Carbon Nanoparticles As a Fluorescent Sensing Platform//Chemical Communications. 2011. Vol. 47, № 3. P. 961-963
- Linares E.M. et al. Enhancement of the Detection Limit for Lateral Flow Immunoassays: Evaluation and Comparison of Bioconjugates//Journal of Immunological Methods. 2012. Vol. 375, № 1-2. P. 264-270
- Lonnberg M., Drevin M., Carlsson J. Ultra-Sensitive Immunochromatographic Assay for Quantitative Determination of Erythropoietin//J. Immunologi-cal Methods. 2008. Vol. 339, № 2. P. 236-244
- Noguera P.S. et al. Carbon Nanoparticles As Detection Labels in Antibody Microarrays. Detection of Genes Encoding Virulence Factors in Shiga Toxin-Producing Escherichia Coli//Analytical Chemistry. 2011. Vol. 83, № 22. P. 8531-8536
- Posthuma-Trumpie G.A. et al. Amorphous Carbon Nanoparticles: a Versatile Label for Rapid Diagnostic (Immuno)Assays//Analytical and Bioana-lytical Chemistry. 2012. Vol. 402, № 2. P. 593600
- Rayev M., Shmagel K. Carbon-protein covalent conjugates in noninstrumental immunodiagnostic systems//Journal of Immunological Methods. 2008. Vol. 336, № 1. P. 9-15
- van Amerongen A. et al. Colloidal Carbon Particles As a New Label for Rapid Immunochemical Test Methods: Quantitative Computer Image Analysis of Results//Journal of Biotechnology. 1993. Vol. 30, № 2. P. 185-195


