Управление аммиаком в бройлерном птицеводстве как инструмент для поддержания высокого уровня благополучия птицы
Автор: Ксенофонтова А.А., Буряков Н.П., Ксенофонтов Д.А., Заикина А.С.
Журнал: АгроЗооТехника @azt-journal
Рубрика: Кормопроизводство, кормление сельскохозяйственных животных и технология кормов
Статья в выпуске: 2 т.7, 2024 года.
Бесплатный доступ
Для поддержания высокого стабильного уровня продуктивности интенсивные технологии выращивания бройлеров требуют глубоких знаний в области кормления и содержания птицы. Многочисленные исследования отечественных и зарубежных ученых свидетельствуют о необходимости понимания специалистами-зоотехниками взаимосвязи различных показателей микроклимата птичника, состава рациона и технологических аспектов, используемых при выращивании птицы, и их влияния на здоровье и комфорт поголовья. Одной из актуальных проблем при напольном выращивании бройлеров является высокий уровень аммиака в птичниках. В работе рассмотрены механизмы развития патологических процессов в разных тканях, системах и органах организма цыплят-бройлеров при воздействии этого высокотоксичного соединения, которые негативно влияют на благополучие птицы и закономерно приводят к снижению ее продуктивности. Перечислены факторы, обусловленные составом рациона, технологиями кормления и содержания птицы, а также качеством управления микроклиматом в помещениях для выращивания бройлеров, приводящие к накоплению газа, которое превышает санитарно-гигиенические нормы. Рассмотрены способы снижения токсичной концентрации аммиака в птичниках, включающие управление вентиляцией и температурой в птичнике, влажностью и рН подстилки, а также уровнем азота, выделяемого птицей с пометом.
Цыплята-бройлеры, аммиак, контактный дерматит, патологии глаз, патологии дыхательной системы, контроль уровня аммиака, благополучие
Короткий адрес: https://sciup.org/147243866
IDR: 147243866 | УДК: 636.5.033:636.083.1 | DOI: 10.15838/alt.2024.7.2.1
Текст научной статьи Управление аммиаком в бройлерном птицеводстве как инструмент для поддержания высокого уровня благополучия птицы
Рост численности населения увеличивает потребность в продуктах питания, в том числе в мясе. Мясо птицы – один из основных источников животного белка для человека, в настоящее время по объему производства и потреблению в мире занимает второе место (Güz, 2022). В связи с этим, птицеводство является одной из наиболее эффективных отраслей животноводства, обеспечивающих продовольственную безопасность значительной части населения планеты. Спрос на мясо кур растет, и это приводит к повышению эффективности и устойчивой интенсификации производства. Большая часть промышленного бройлерного птицеводства использует интенсивные технологии производства, благодаря чему мировое производство мяса птицы в 2021 году достигло 137,8 млн т (Трухачев и др., 2022; Gržinić et al., 2023), что соответствует более чем 60 млрд бройлеров. Однако интенсивные системы выращивания птицы, основанные на экономически важных производственных характеристиках, приводят к снижению уровня благополучия бройлеров. Цыплята-бройлеры нередко подвергаются негативному воздействию комплекса факторов, приводящих к ухудшению их самочувствия и, как следствие, к значительному снижению продуктив- ных качеств (Mottet, 2017; Bessei, 2018). Благополучие сельскохозяйственной птицы имеет важное значение как с этической, так и с практической точки зрения. С этической точки зрения птицы, наравне с млекопитающими, обладают достаточной степенью осознанности или «чувствительности», чтобы ощущать боль и испытывать страдания, обусловленные проблемами со здоровьем или несоответствием условий содержания их потребностям, что подтверждается Кембриджской декларацией о сознании, подписанной в 2012 году в Кембриджском университете (Великобритания) группой нейробиологов на конференции «Сознание человека и животных» (Walter, 2022). Также существует очевидная экономическая выгода при использовании систем управления, которые концентрируются на улучшении здоровья птицы и, таким образом, приносят прямую прибыль за счет большего количества здоровых животных и меньших потерь из-за выбраковки и падежа (Dawkins, 2016). Продуктивность сельскохозяйственных животных зависит от полноценного кормления, их генетического потенциала, качества селекционно-племенной работы и от условий микроклимата. Поскольку селекционные программы и системы кормления в птицеводстве достигли практически абсолютной эффек- тивности, благополучие животных, связанное с качеством условий содержания, в настоящее время является основным требованием для интенсивного птицеводства (Moura et al., 2006). Оценка и контроль многих аспектов жизни продуктивных животных могут в будущем произвести революцию в отрасли и установить баланс между благополучием животных и эффективностью производства (Dawkins, 2016).
Благополучие животных определяется «пятью свободами», также известными как «пять свобод» Брамбелла (Brambell, 1965), в которых суммируются важные показатели, необходимые для их комфорта. В бройлерном птицеводстве одна из пяти свобод – «Свобода от боли, травм и болезней» (Meseret, 2016) – поставлена под угрозу в связи с тем, что при интенсивных технологиях выращивания большое количество факторов, таких как высокая плотность посадки, ухудшение состояния окружающей среды, неподходящая социальная среда, термический стресс или трудности с доступом к основным ресурсам, являются основными источниками стресса для птицы (Dawkins et al., 2004; Jones et al., 2005; Meluzzi et al., 2009).
Среда в птичнике представляет собой сочетание физических и биологических компонентов, которые взаимодействуют как сложная динамическая система (Sainsbury, 2000), и одним из основных факторов экологического стресса, существенно снижающим уровень благополучия цыплят-бройлеров, их рост и конверсию корма, выступает повышенный уровень аммиака в птичниках (Wang et al., 2010; Wang et al., 2022).
Цель настоящего обзора состоит в анализе актуальных научных публикаций и систематизации информации о негативном влиянии аммиака на благополучие и продуктивность цыплят-бройлеров, механизмах развития патологических процессов в органах и тканях птицы, факто- рах, способствующих увеличению уровня аммиака в производственных помещениях птичников и методах его контроля.
Задачи исследования:
– охарактеризовать механизмы развития патологических процессов в организме цыплят-бройлеров при воздействии токсичных доз аммиака;
– определить факторы, приводящие к образованию избыточного количества аммиака в бройлерных птичниках;
– проанализировать методы контроля уровня аммиака при выращивании цыплят-бройлеров.
Результаты исследования
Аммиак – бесцветный токсичный газ с характерным резким запахом, который признан одним из наиболее распространенных загрязнителей животноводческих помещений. Его выбросам уделяется все больше внимания из-за потенциально негативного воздействия на сельскохозяйственную среду, экосистему планеты, а также здоровье людей и животных. Газообразный аммиак образуется в результате разложения отходов животноводства и, в той или иной концентрации, присутствует в большинстве животноводческих помещений. Животноводство вносит существенный вклад в выбросы аммиака. В 1996 году причиной более 70% антропогенных выбросов аммиака была признана деятельность животноводческих предприятий (McCubbin et al., 2002). Аммиак при высоких концентрациях в окружающей среде вреден для животных, вызывает раздражение глаз и дыхательных путей, поражение копыт у млекопитающих и контактный дерматит у птиц, обладает мощным нейротоксичным действием, у домашней птицы также приводит к активации апоптоза и окислительного стресса в селезенке (Chen et al., 2022), вызывает иммуносупрессию, о чем свидетельствует увеличение массы сумки Фабрициуса (Wei et al., 2015), при- водит к снижению титров специфических антител (Wang et al., 2010), повышению восприимчивости к болезням (Beker et al., 2004), увеличению уровня цитокинов IL6 и IL10 в плазме и усилению экспрессии генов различных цитокинов в селезенке (Wu et al., 2017), что способствует снижению показателей продуктивности.
Аммиак образуется в результате метаболических процессов в клетках животного организма в процессе дезаминирования аминокислот, при распаде пуриновых, пиримидиновых оснований и биогенных аминов. В то же время аммиак является молекулой-предшественником включения азота в ткани животных и, следовательно, служит важным субстратом для биосинтеза аминокислот, белков и нуклеиновых кислот (Dimski, 1994). Тем не менее очень важно, чтобы циркулирующий аммиак использовался в биохимических процессах, а его избыток метаболизировался для выведения из организма в виде нетоксичных соединений, поскольку высокие концентрации аммиака приводят к крайне негативным последствиям. Млекопитающие и птицы имеют эффективные механизмы его использования и детоксикации: у млекопитающих конечным продуктом азотистого обмена является мочевина, образующаяся в серии последовательных реакций орнитинового цикла, а у птиц – мочевая кислота, имеющая сложное строение, в связи с чем ее синтез происходит поэтапно и требует значительных затрат энергии (Murphy et al., 2012; Costa, 2017).
Белок является важной пищевой потребностью животных, его использование зависит от количества, состава и усвояемости аминокислот, входящих в его состав. Кормовые белки, в отличие от углеводов или липидов, не имеют специального механизма хранения в организме, в процессе ферментативного расщепления они распадаются на аминокислоты (Vilela et al., 2020).
У птиц неиспользованный азот выводится из организма через желудочно-кишечный тракт с пометом преимущественно в виде мочевой кислоты, а также аммиака и мочевины. В результате разложения азотосодержащие вещества помета во влажной среде подстилки при участии аэробных микроорганизмов превращаются в аммиак, который можно рассматривать как один из побочных продуктов птицеводства (Schefferle, 1965). По зоогигиениче-ским требованиям предельно допустимая концентрация аммиака в воздухе составляет 15 ppm, однако при нарушении технологий кормления и содержания уровень аммиака в птичниках обычно превышает данное значение, и это распространено во всем мире. Когда концентрация аммиака достаточно высока, ее может обнаружить с помощью одоральной сенсорной системы даже персонал фермы. В тот момент, когда можно почувствовать запах аммиака, его концентрация достаточно высока, чтобы повлиять на здоровье и продуктивность животных, поскольку предполагается, что при обнаружении человеком она превышает 25–30 ppm. Уровни аммиака, которые не обнаруживаются человеком, уже могут оказывать негативное воздействие на животное, хотя трудно измерить степень неблагоприятного воздействия в зависимости от конкретной концентрации аммиака. Выбросы аммиака выше на более поздних стадиях производства (Kristensen et al., 2000). Для контроля уровня аммиака в бройлерных птичниках необходимо измерять его концентрацию несколько раз в день в разных точках помещения на уровне пола (Gates et al., 2005).
Аммиак легче воздуха и хорошо растворяется в воде. Гидрат аммиака в водной среде диссоциирует на катион аммония NH4+ и гидроксид-ион OH–, благодаря чему водный раствор аммиака имеет щелочную среду, в связи с чем может поражать дыхательную систему, глаза, кожу лап и груди бройлеров. Газообразный аммиак при взаимодействии со слизистыми оболочками легко реагирует с водой с образованием ионов аммония. Этот процесс экзотермичен и вызывает существенное термическое повреждение окружающих тканей. Кроме того, образующийся щелочной раствор вызывает некроз тканей за счет денатурации белков и омыления жиров, а извлечение воды из тканей инициирует воспалительную реакцию (Jarudi et al., 1973; Arwood et al., 1985; Amshel et al., 2000).
Газообразный аммиак в высоких концентрациях является сильным раздражителем для дыхательных путей и способен снижать эффективность дыхательной системы (Smith et al., 1996), вызывая нарушения как в структуре, так и в функции ресничек дыхательного эпителия. Трахея, выстланная мукоцилиарным эпителием, выполняет защитную функцию при воздействии токсичных ингаляционных веществ, при этом, являясь верхней частью дыхательных путей, она наиболее уязвима к воздействию амми- ака. У птицы, содержащейся в птичниках с низкой концентрацией этого газа, до 10 ppm, наблюдалось обильное выделение слизи и потеря ресничек эпителия трахеи (Al-Mashhadani et al., 1985; Nagaraja et al., 1983). Воздействие атмосферного аммиака повышает уровни цитокинов IL-1 β и IL-6 в трахее, которые обладают мощными противовоспалительными и иммуномодулирующими свойствами (Xiong et al., 2016), вызывая воспалительную реакцию (Zhou et al., 2020) и повышая восприимчивость птицы к инфекционным агентам (Caveny, 1981). Влияние аммиака на поверхность слизистой оболочки трахеи варьирует от паралича ресничек мерцательного эпителия и децилиации (утраты ресничек) эпителиальных клеток до повреждения (некроза) самого эпителия слизистой оболочки (рис. 1).
В результате может наблюдаться снижение эффективности мукоцилиарного клиренса, являющегося основным врожденным защитным механизмом легких, и развитие мукоцилиарной недостаточности, а также нарушение эпителиально-
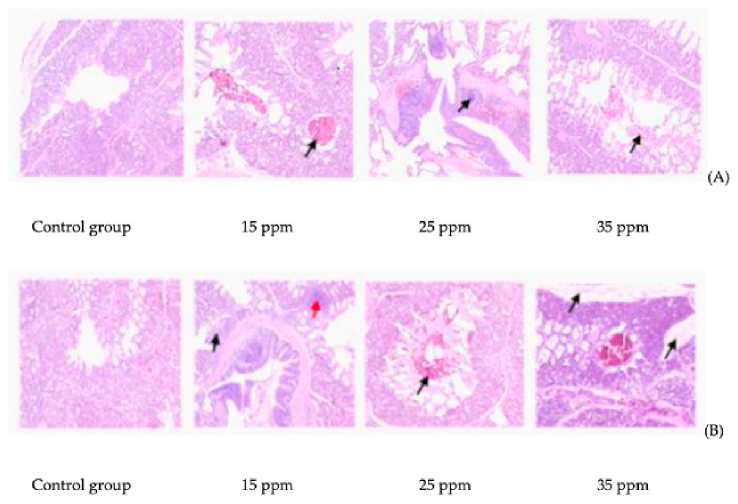
Рис. 1. Влияние различных концентраций аммиака на слизистую оболочку легочной ткани при воздействии 7-суточного (A) и 21-суточного (B) аммиака
Источник: (Wang et al., 2022).
го гомеостаза. Нарушение механизмов очищения бронхов и развитие мукоста-за в значительной степени способствуют развитию воспаления в дыхательных путях (Seedorf, 2013; Bustamante-Marin et al., 2017). Мукоцилиарный поток также является важным защитным механизмом в легких, обеспечивающим эвакуацию вдыхаемых патогенов и загрязняющих веществ, и его снижение вследствие воздействия экзогенных факторов может привести к рецидивирующим респираторным инфекциям, увеличению заболеваемости и падежу птицы (Gamm et al., 2017). Воздействие аммиака в концентрации 15 ppm вызывает умеренное повышение pH трахеи, что приводит к нарушению стабильности видового состава микрофлоры трахеи бройлеров, отмечается доминирование некоторых видов патогенных бактерий и ингибирование симбиотической микробиоты, что может вызвать воспаление, в результате которого «провоспалительная реакция» будет сильнее, чем противовоспалительный ответ (Zhou et al., 2021). Действие высоких концентраций аммиака (35 ppm) на организм бройлеров вызывает воспаление легочной ткани путем активации инфламмасомы NLRP3, участвующей в иммунном ответе при воздействии бактериальных, вирусных и других агентов (Liu et al., 2020). Таким образом, аммиак может действовать как неинфекционный триггер для инициирования воспалительного процесса, активируя воспалительные пути.
Аммиак также обладает кардиотоксич-ным действием и может выступать как неинфекционный триггер, инициирующий окислительный стресс и вызывающий у кур воспалительное поражение сердца (Wang et al., 2020). Кроме того, ингаляционное воздействие этого токсичного газа вызывает нарушение качественного и количественного состава микробиоты кишечника, инициируя тем самым воспале- ние, а также может приводить к структурным и функциональным нарушениям в этом отделе желудочно-кишечного тракта (Zhou et al., 2021).
В связи с хорошей способностью растворяться в воде газообразный аммиак при попадании на роговицу глаза растворяется в водянистой влаге с образованием гидроксида аммония, что вызывает развитие патологий глаз разной степени тяжести. Поражения включают кератит, конъюнктивит и помутнение роговицы с возможным последующим изъязвлением. Воспаление век, возникающее при относительно невысоких концентрациях аммиака в атмосфере птичника, увеличивает вероятность заражения птицы вторичными инфекциями, что также приводит к повреждению роговицы. При концентрации газа в атмосфере птичника 25 и 50 ppm клинические признаки поражения глаз появляются начиная с 7-го дня воздействия (Olanrewaju et al., 2007; Miles et al., 2006). Воздействие высоких концентраций аммиака (> 50 ppm) вызывает у кур кератоконъюнктивит с такими симптомами, как слезотечение, закрытые веки, трение глаз крыльями и слепота (аммиачная слепота), вследствие чего птицы не могут найти корм и воду, что приводит к их падежу. Аммиак не повреждает непосредственно эпителий роговицы, он вызывает повреждение базальной мембраны, на которой лежит эпителий, и ответственен за отслоение эпителиального слоя, что является характерным поражением глаз, возникающим в результате избыточного воздействия аммиака. Поражение представляет собой почти круглую, серо-белую, непрозрачную, шероховатую на вид область в центре роговицы (Bullis, 1950).
Аммиак оказывает существенное влияние на развитие контактного дерматита у бройлеров, вызывая поражение участков кожи, которые подвергаются длительному контакту с подстилкой: подушечки лап, область скакательных суставов и, в тяжелых случаях, область груди. Перья и кожа у птиц являются первой линией защиты, они также важны для поддержания стабильной внутренней температуры, облегчения общей подвижности и обеспечения успешного спаривания у некоторых видов. Для домашней птицы физическое состояние перьев и кожи является важным барометром для оценки качества управления и обеспечения здоровья и благополучия (van Emous et al., 2019). Контактный дерматит обычно выявляют при оценке общего состояния организма кур: от отдельных поверхностных поражений кожи до глубоких язв разных размеров на разных стадиях и тяжести течения, влияющих на степень дискомфорта и болевого шока (de Jong et al., 2014). В Европе при аудите благополучия домашней птицы ожоги подушечек лап, скакательных суставов и груди часто используются в качестве индикатора условий содержания и общего благополучия птиц (Haslam et al., 2007). В настоящее время наличие у поголовья контактного дерматита применяется в качестве критерия аудита при оценке благополучия систем птицеводства в Европе и США (Berg, 2004; Berg et al., 2004). Кератиновый слой эпидермиса образует защитный слой для расположенной ниже дермы, но при длительном контакте поверхности кожи с влажной подстилкой аммиак раздражает дерму, что приводит к развитию патологического процесса. Данная патология определяется как дегенеративный воспалительный процесс, который может вызывать глубокие инфекции, включая поражения сухожилий и остеомиелит плюсневых костей и фаланг (McCluggage, 1997).
Первыми признаками пододерматита являются ишемия и некроз мягких тканей, приводящие к высвобождению медиаторов воспаления, что усугубляет поражение и вызывает тромбоз мелких сосудов. На начальной стадии могут наблюдаться воспаление, эритема, струпья и мокнущие поражения. Гиперкератоз появляется, когда поражение становится хроническим, уменьшается толщина эпителия с последующим изъязвлением тканей (рис. 2). В дерме, прилегающей к
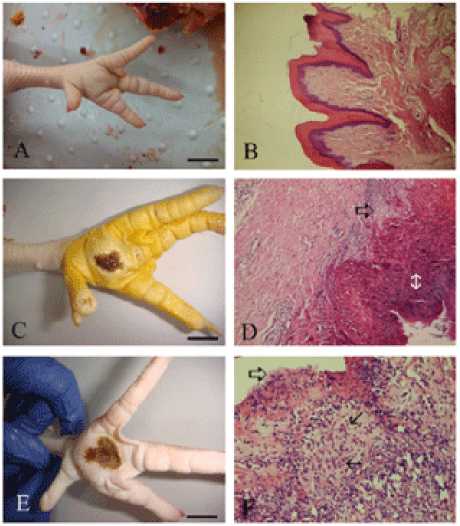
Рис. 2. Макроскопические и микроскопические особенности подушечек лап у здоровых и больных птиц
Источник: (Çavuşoğlu et al., 2018).
очагам поражения, увеличиваются популяции лимфоцитов, гранулоцитов и лимфатических фолликулов (Platt et al., 2001). Эти поражения на подушечках не имеют бактериального происхождения, но могут служить входными воротами для патогенных микроорганизмов (Hester, 1994), обеспечивая путь бактериальной инвазии, в связи с тем что патогенные микроорганизмы, проникнув в кровеносную систему, способны вызвать воспаление в различных органах и тканях (Shepherd et al., 2010). Наиболее распространенными микроорганизмами, вызывающими вторичные инфекции, являются представители семейства Psittacidae Staphylococcus spp.
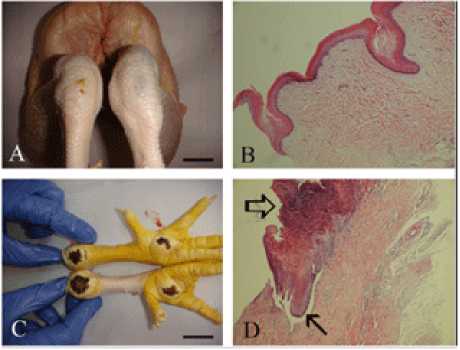
Рис. 3. Общая и гистопатологическая оценка скакательных суставов здоровых и больных птиц
Источник: (Çavuşoğlu et al., 2018).
(Bauck, 1997). Если не проводить лечебные мероприятия, то это может привести к развитию остеомиелита, тендинопатий и артрита. На этой стадии прогноз неблагоприятный, поскольку приводит к системным патологиям, таким как эндокардит и полиартрит (Stoute et al., 2009).
Частью синдрома контактного дерматита является «ожог скакательных суставов», гистологически характеризующийся областями эпидермального некроза, окруженными эпидермальной гиперплазией, с застоем капилляров, лейкоцитозом и диффузной гетерофильной ин- фильтрацией под ними (рис. 3). Данная патология проявляется в виде черных или коричневых поражений кожи (Greene et al., 1985; Martland, 1985; Haslam et al., 2007; Hepworth et al., 2011).
Перечисленные выше патологические процессы, обусловленные поражением кожных покровов птицы, сопровождаются болевым синдромом, что, безусловно, оказывает влияние на поведение птицы. Чтобы уменьшить боль, пораженные по-додерматитом птицы проявляют меньшую активность и демонстрируют низкое разнообразие в моделях поведения (Hocking et al., 2013; Weber Wyneken et al., 2015). Установлено, что хромые птицы, у которых был диагностирован контактный дерматит, потребляли больше корма, содержащего обезболивающие препараты, чем здоровые бройлеры (Danbury, 2000).
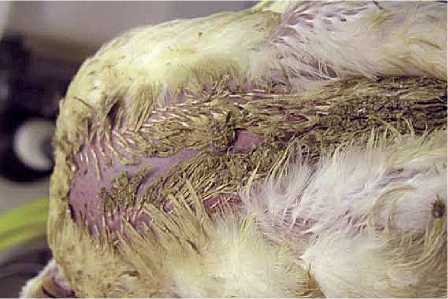
а
Рис. 4. а) Контактный дерматит области киля у цыпленка-бройлера; б) Поражение кожи эрозивно-некротического типа у 38-дневного цыпленка-бройлера после переработки на бойне

б
Источник: (Dinev et al., 2019).
Отклонения в поведении и здоровье могут привести к снижению потребления корма и в конечном итоге снижению скорости роста и массы тела. Более продолжительные периоды нахождения бройлеров в положении лежа увеличивают время контакта с пометом, что усугубляет дальнейшее развитие контактного дерматита и снижает сохранность поголовья (Martland, 1985; Mayne, 2005).
Частота дерматита подушечек лап в быстрорастущих стадах бройлеров перед убоем достигает 65%, а частота тяжелых «ожогов скакательных суставов» – 41% (Haslam et al., 2007; de Jong et al., 2012; Bassler et al., 2013), в связи с чем контактный дерматит, вызванный воздействием аммиака, содержащегося в подстилке, становится серьезной угрозой для здоровья бройлеров (Kyvsgaard et al., 2013). Таким образом, накопление аммиака в птичниках является серьезной проблемой для птицеводческой отрасли, требующей поиска путей для ее решения (Bailey et al., 2021), поскольку оптимальные показатели микроклимата в птичниках способствуют более полной реализации генетического потенциала бройлеров, профилактике заболеваний и повышению естественной резистентности (Агеечкин и др., 2010).
В настоящее время существует перечень рекомендаций, позволяющих снизить концентрацию аммиака в птицеводческих помещениях.
Методы сокращения выбросов аммиака при напольном содержании бройлеров основываются на одном или нескольких из перечисленных ниже принципов: управление вентиляцией, управление подстилкой и управление питанием.
Вентиляция имеет решающее значение для накопления аммиака, поскольку позволяет устранить избыточную влажность. Хорошее управление вентиляцией может способствовать удалению газа из бройлерного птичника, но не предотвра- щает его образование. Использование эффективной вентиляции для оптимизации внутренней среды птичника и предотвращения конденсации может увеличить содержание сухого вещества в подстилке и снизить выбросы аммиака (Alloui et al., 2013).
Подстилочный субстрат и состав корма являются одними из основных факторов, влияющих на тяжесть течения контактного дерматита.
Стратегии питания при выращивании бройлеров выступают главным инструментом снижения концентрации аммиака в птичниках за счет уменьшения количества азота, выделяемого бройлерами с пометом, так как экскреция азота тесно связана с его потреблением (Буряков и др., 2008). Избыток пищевого азота имеет большое экологическое и экономическое бремя. Рационы бройлеров с пониженным содержанием сырого протеина (с добавлением синтетических аминокислот для поддержания их оптимального соотношения) снижают экскрецию азота и, как следствие, образование аммиака. Снижение содержания сырого протеина в рационах бройлеров на 2% приводит к уменьшению концентрации азота в помете на 17,6% (Such et al., 2021). Образцы помета бройлеров, получавших рацион с низким уровнем сырого протеина, содержали на 8% меньше общего азота, что привело к снижению концентрации аммиака на 9% (Emous et al., 2019). Более низкое содержание мочевой кислоты в помете бройлеров приводит к меньшему потреблению воды, т. е. подстилка становится более сухой, тем самым снижается заболеваемость контактным дерматитом. Еще один подход к снижению потребления белка бройлерами – это введение фазового кормления, которое предполагает корректировку содержания питательных веществ в рационе в соответствии с потребностями бройлеров во избежание перекармливания белком и аминокислотами. В результате применения 6-фазной программы кормления вместо 4-фазной потребление азота снизилось на 5,1%, а его содержание в помете – на 16,6% (Angel et al., 2006). Сравнение 3-х и 5-фазного кормления бройлеров показало, что использование 5-фазного кормления обеспечивает более низкое выделение азота с пометом при сохранении продуктивности и выхода мяса. Пятифазное кормление уменьшает концентрацию аммиака в подстилке на 37,95 и 20,81% в возрасте бройлеров 23 и 37 суток соответственно (Brink et al., 2022).
Включение ряда кормовых ферментов и добавок является стандартной практикой в коммерческих кормах для бройлеров. Поскольку такие ферменты, как амилаза, ксиланаза, протеаза и фитаза, улучшают использование питательных веществ, в том числе протеина, выделение азота уменьшается, как результат, снижается образование и улетучивание аммиака из подстилки. Кроме того, добавление ферментов в корма для бройлеров способствует снижению содержания сырого протеина в рационе.
Водосвязывающая способность глин, таких как цеолиты, увеличивает содержание сухого вещества в экскрементах и в подстилке. Цеолиты обладают высокой емкостью катионного обмена, поэтому введение его в рацион улучшает здоровье кишечника и позволяет предотвратить испарение аммиака из помета бройлеров (Schneider et al., 2017). Включение в рацион бройлеров цеолитов в количестве 15 и 25 г/кг позволило снизить уровень аммиака в птичниках с 21,15 (контроль) до 17,25 ppm и 17,75 ppm соответственно (Cabuk et al., 2004). Введение в рацион птицы 0,5% клиноптилолит-цеолита привело к снижению pH и влажности экскрементов (Schneider et al., 2017). Для снижения выбросов аммиака используют экстракты растений (например, Юкки Шидигера), содержащих сапонин, который связывает аммиак, улучшает усвояемость белка или ингибирует ферменты, участвующие в превращении мочевой кислоты в аммиак (Ayoub et al., 2019).
Качество подстилочного материала в бройлерном птичнике может оказать существенное влияние на здоровье, благополучие и продуктивность цыплят-бройлеров, а также на экономическую устойчивость хозяйства. Ключом к контролю уровня аммиака в птичнике является управление влажностью подстилки, зависящей от ряда факторов, в том числе плотности посадки бройлеров, качества вентиляции и конструкции поилок. Влажность подстилки в птичниках следует поддерживать на уровне от 15 до 25%. При постоянном нахождении на влажной подстилке происходит мацерация (переувлажнение) кожи, что увеличивает риск проникновения патогенной микрофлоры в ее более глубокие слои, способствуя развитию пододерматита у птицы (Mayne, 2005; Swelum et al., 2021). Так, у бройлеров, выращиваемых на влажной подстилке, дерматит подушечек лап впервые был диагностирован в возрасте 14 дней, к 21 дню клинические признаки резко усилились, достигнув максимума к концу периода откорма. У птиц, выращиваемых на сухой подстилке, данная патология впервые была зафиксирована в возрасте 28 дней, а к 42 дню была отмечена незначительная динамика развития заболевания. При переводе 21-дневных бройлеров, выращенных на влажной подстилке, на сухую подстилку прогрессирование заболевания замедлялось или купировалось (Taira et al., 2014). На данный показатель влияют качественные характеристики субстрата, в частности размер частиц, глубина подстилки, текстура и источник подстилочного материала, а также ее абсорбционная способность и время высыхания (de Jong et al., 2012; Shepherd et al., 2010).
На влажность подстилки негативно влияет высокая плотность стада, так как увеличивается количество экскрементов, что приводит к ее намоканию (Vieira et al., 2011). В стадах бройлеров, содержащихся с высокой плотностью посадки (< 0,15 м2/гол.), было зафиксировано на 10% больше поражений скакательных суставов и на 20% чаще встречались повреждения в области киля по сравнению со стадами с более низкой плотностью посадки (≥ 0,15 м2/гол.) (Bruce et al., 1990).
На влажность подстилки, а следовательно, и на конверсию мочевой кислоты до аммонийного азота влияет управление системой поения. Чтобы избежать чрезмерного попадания воды в подстилку, необходимо регулировать высоту поилки и давление воды по мере роста птицы. Если происходят протечки или разливы и появляются мокрые пятна, намокший субстрат необходимо сразу убрать из птичника и заменить чистой сухой подстилкой (Liu et al., 2006).
Чрезмерное намокание подстилки также может быть вызвано неправильным питанием за счет увеличения выделения мочи (полиурия) или повышения влажности фекалий (диарея). Многолетний интенсивный отбор по скорости роста в бройлерном птицеводстве косвенно увеличил потребление корма и воды и, следовательно, количество эндогенной воды. В среднем бройлерном птичнике, содержащем 20000 голов, ежедневно в подстилку выделяется около 2,5 т экскреторной воды, и даже незначительные изменения объема мочи или влажности фекалий могут быстро поднять влажность подстилки. В современных интенсивных производственных системах даже относительно незначительные нарушения осморегуляции, вызванные питанием, могут привести к переувлажнению подстилки. Увеличение объема мочи происходит при высоком содержании в питьевой воде электролитов (натрий, магний, сульфаты и др.), при этом в качестве компенсаторного механизма для поддержания гомеостаза птица увеличивает потребление воды (Coetzee, 2005). Так, при превышении концентрации электролитов в питьевой воде 1,5 г/кг возникает осмотический стресс, вызывающий полиурию, а при превышении 3 г/кг происходит нарушение осморегуляторно-го гомеостаза, что приводит к развитию патологических процессов в организме птицы (Goldstein, 2000).
Влажная подстилка также является частым следствием включения в рационы для птицы злаков, таких как пшеница, ячмень, овес, рожь и тритикале, а также шротов масличных культур. Эти компоненты содержат большое количество водорастворимых некрахмалистых полисахаридов, которые повышают влажность помета (Bedford, 1996), благодаря их способности увеличивать вязкость водной фазы кишечника за счет образования сложных полимеров, которые нарушают процессы переваривания в кишечнике, увеличивая объем секретируемой слизи, ограничивая всасывание питательных веществ и изменяя состав микробного сообщества в его тонком отделе. Низкая эффективность переваривания и всасывания, в том числе белков, обеспечивает микробитоту слепой кишки питательной базой, что приводит к росту популяции протеолетических микроорганизмов, нарушая тем самым стабильность видового состава микрофлоры (Sacranie et al., 2007). Доминирование условно-патогенных микроорганизмов в этом отделе желудочно-кишечного тракта также нарушает микробное равновесие в тонком отделе кишечника, вызывая дисбактериоз, сопровождающийся воспалением кишечного эпителия, и инициирует самовоспроизводящийся каскад событий: воспаление приводит к секреции слизи и увеличению парацеллюлярной проницаемости, что ставит под угрозу переваривание и абсорбцию, способствуя бы- строму размножению муколитических/ протеолитических организмов, таких как Clostridium perfringens, токсичное действие которых приводит к дальнейшему развитию воспалительного процесса. Воспаление кишечника может изменить водный баланс, что приведет к переувлажнению подстилки, однако не менее серьезной проблемой является гиперсекреция слизи, которая выделяется с экскрементами бройлеров, образуя водонепроницаемый слой на поверхности субстрата, препятствуя впитыванию и испарению экскреторной воды (Collett, 2012). Введение в рационы бройлеров с высоким содержанием зерновых экзогенных ферментов стало стандартной практикой, чтобы избежать проблемы с мокрой подстилкой (Leeson et al., 2005).
Добавление в рационы бройлеров жиров в качестве эффективных компонентов, повышающих питательную ценность, за счет содержания большего количества метаболизируемой энергии увеличивает вероятность намокания подстилки, так как часто приводит к стеаторее (повышенное выведение жира с пометом). Это влияет на влажность подстилки напрямую – за счет увеличения влажности помета и опосредованно – за счет снижения водоудерживающих свойств подстилки. Риск, связанный с включением липидов, зависит от их количества, типа и качества. Стеаторея может возникнуть из-за слишком большого количества жиров в рационе или вследствие нарушения процессов переваривания и всасывания липидов, обусловленных введением в рационы птиц липидов низкого качества (окислительное прогоркание), а также без учета эффективности усвоения птицей разных видов жиров, что приводит к развитию воспаления в кишечнике (энтерит) и диарее (Collett, 2012).
Наличие в кормах нефротоксичных микотоксинов, таких как охратоксин А, ци-тринин и оспорин, служит предиктором проблем мокрой подстилки. Охратоксин А также вызывает развитие катарального энтерита, нарушение всасывания и диарею (Hoer, 2003). Воспаление почек или желудочно-кишечного тракта нарушает транспорт воды и питательных веществ, что увеличивает количество воды, слизи и непереваренных питательных веществ в экскрементах. Здоровье кишечника птицы также играет ключевую роль в предотвращении пододерматита, поскольку любое нарушение в функционировании желудочно-кишечного тракта способствует повышению влажности подстилки. Большое количество слизи и непереваренные липиды в помете бройлеров снижают ее водоудерживающую способность, усугубляя ситуацию тем, что увеличивается время контакта с водой за счет прилипания субстрата к коже птицы (Collett, 2012).
Некоторыми рычагами для управления потреблением воды и правильного функционирования пищеварительного тракта птицы также является размер частиц при размоле зерновых кормов: чем меньше их размер, тем выше скорость прохождения по желудочно-кишечному тракту (Amerah et al., 2007).
Помимо влажности подстилки на содержание аммиака в ней также влияют такие показатели, как температура и рН (García-González et al., 2007). В птицеводстве при управлении подстилкой для снижения ее pH часто используют так называемые «улучшатели», что позволяет контролировать концентрацию аммиака в птичнике. Наиболее распространенным типом добавок для подстилки являются подкислители, например бисульфат натрия и сульфат алюминия. Эти соединения снижают pH подстилки, подавляя рост бактерий, которые производят аммиак как побочный продукт метаболизма (Nagaraj et al., 2007). Так, обработка подстилки в бройлерных птичниках бисульфатом натрия в количестве 0,95–1,46 кг/м2, 0,73 кг/м2 и 0,37–0,49 кг/м2 позволила снизить коэффициент выброса аммиака на единицу количества животных (500 кг живой массы) на 27, 13 и 5% соответственно (Shah et al., 2014).
Для снижения эмиссии аммиака из подстилки возможно внесение в нее адсорбентов, таких как цеолиты, торф или бентониты (Вербицкий, 2019), а также различных химических соединений, вступающих в реакцию с аммиаком с образованием безвредных веществ, например хлористого алюминия, уксусной кислоты, водного раствора гипохлорита натрия и др. (Рябинина и др., 2021).
Таким образом, управление уровнем аммиака в бройлерных птичниках является необходимым инструментом для сохранения здоровья птицы и экономического благополучия производства (Davis, 2020), требуя комплексного подхода, который включает идентификацию многочисленных потенциальных факторов, прямо или косвенно способствующих избыточному образованию этого высокотоксичного соединения, понимание спектра негативных последствий при его воздействии на организм птиц, что позволит использовать в качестве превентивных мер различные способы контроля образования газа (Swelum et аl., 2021).
Выводы
В качестве методов, используемых для снижения концентрации аммиака в птичниках, можно предложить корректировку рационов бройлеров в сторону снижения содержания сырого протеина (с добавлением синтетических аминокислот для поддержания их оптимального соотношения), уменьшая тем самым экскрецию азота: снижение содержания сырого протеина в рационах бройлеров на 2% способствует уменьшению концентрации азота в помете на 17,6%; введение фазового кормления (применение 6-фазной программы кормления вместо 4-фазной снижает потребление азота на 5,1%, а его содержание в помете – на 16,6%; использование 5-фазного кормления обеспечивает более низкое выделение азота с пометом при сохранении продуктивности и выхода мяса по сравнению с 3-фазным); контроль количества, типа и качества жиров; включение кормовых ферментов амилазы, кси-ланазы, протеазы и фитазы, за счет повышения конверсии питательных веществ, в том числе протеина, снижает выделение азота и, как следствие, образование аммиака в подстилке. Также для управления уровнем аммиака в бройлерных птичниках необходимо поддерживать влажность подстилки не более 25%, снижать значение рН и эмиссию газа, используя при этом такие инструменты, как внесение адсорбентов и подкислителей (бисульфат натрия в количестве 0,95–1,46 кг/м2, 0,73 кг/м2 и 0,37–0,49 кг/м2 снижает коэффициент выброса аммиака на единицу количества животных (500 кг живой массы) на 27, 13 и 5% соответственно); осуществлять регулярный контроль герметичности системы поения, контролировать высоту поилок и давление с учетом роста и массы птицы; избегать высокой плотности посадки (поражение скакательных суставов в области киля в стадах бройлеров, содержащихся с плотностью посадки < 0,15 м2/гол., фиксировалось на 10 и 20 % чаще по сравнению со стадами, где плотность посадки составляла ≥ 0,15 м2/гол.); при выборе подстилки необходимо учитывать ее адсорбционные свойства и следить за здоровьем кишечника цыплят-бройлеров.
Управление уровнем аммиака в бройлерных птичниках является необходимым инструментом для сохранения здоровья птицы и экономического благополучия производства (Davis, 2020), требуя комплексного подхода, который включает идентификацию многочисленных потенциальных факторов, прямо или косвенно способствующих избыточному образованию этого высокотоксичного соединения, понимание спектра негативных последствий при его воздействии на организм птиц, что позволит использовать в качестве превентивных мер различные способы контроля образования газа (Swelum et аl., 2021). Проведенный анализ многочисленных исследований отечественных и зарубежных авторов, посвященных проблеме, вызванной содержанием токсичных доз аммиака в помещениях для выращивания цыплят-бройлеров, дал возможность обобщить и сконцентрировать в работе научно-обоснованные сведения, которые могут использоваться производителями в качестве инструментов для управления уровнем газа в птичниках, а также как превентивные меры, направленные на поддержание высокого уровня благополучия птицы.
Список литературы Управление аммиаком в бройлерном птицеводстве как инструмент для поддержания высокого уровня благополучия птицы
- Агеечкин А.П., Алексеев Ф.Ф., Аралов А.В. [и др.] (2010). Промышленное птицеводство / под общ. ред. В.И. Фисинина. Сергиев Посад: ВНИТИП. 600 с.
- Буряков Н.П., Банников В.Н., Иванов А.С. (2008). Актуальные вопросы птицеводства. Ярославль: Хитон. 76 с.
- Вербицкий С. (2019). Использование подстилки в птичнике // Животноводство России. № 11. С. 17–21.
- Рябинина Е.В., Мельник В.А., Рудая С.В. (2021). Влияние различных способов обработки подстилки на содержание в воздухе птичника вредных газов // Актуальные проблемы интенсивного развития животноводства. № 24 (2). С. 292–298.
- Трухачев В.И., Юлдашбаев Ю.А., Свинарев И.Ю. [и др.] (2022). Современное состояние и перспективы развития животноводства России и стран СНГ. Москва: Мегаполис. 337 с.
- Alloui N., Allou M.N., Bennoune O., Bouhentala S. (2013). Effect of ventilation and atmospheric ammonia on the health and performance of broiler chickens in summer. Journal of World’s Poultry Research, 3 (2), 54–56.
- Al-Mashhadani E.H., Beck M.M. (1985). Effect of atmospheric ammonia on the surface ultrastructure of the lung and trachea of broiler chicks. Poultry Science, 64, 2056–2061.
- Amerah A.M., Ravindran V., Lentle R.G., Thomas D.G. (2007). Feed particle size: Implications on the digestion and performance of poultry World’s Poultry Science Journal, 63, 439–451. DOI: 10.1017/S0043933907001560
- Amshel C.E., Fealk M.H., Phillips B.J., Caruso D.M. (2000). Anhydrous ammonia burns case report and review of the literature. Burns, 26 (5), 493–497.
- Angel R., Powers W., Zamzow S., Applegate T. (2006). Dietary modifications to reduce nitrogen consumption and excretion in broilers. Poultry Science, 85, 25–25.
- Arwood R., Hammond J., Ward G.G. (1985). Ammonia inhalation. The Journal of Trauma, 25 (5), 444–447.
- Ayoub M.M., Ahmed H.A., Sadek K.M. [et al.] (2019). Effects of liquid yucca supplementation on nitrogen excretion, intestinal bacteria, biochemical and performance parameters in broilers. Animals (Basel), 9, 9 (12), 1097. DOI: 10.3390/ani9121097
- Bailey M.A., Hess J.B., Krehling J.T., Macklin K.S. (2021). Broiler performance and litter ammonia levels as affected by sulfur added to the bird’s diet. Journal of Applied Poultry Research, 30 (2), 100159. DOI: 10.1016/j.japr.2021.100159
- Bassler A.W., Arnould C., Butterworth A. [et al.] (2013). Potential risk factors associated with contact dermatitis, lameness, negative emotional state, and fear of humans in broiler chicken flocks. Poultry Science, 92, 2811–2826. DOI: 10.3382/ps.2013-03208
- Bedford M. (1996). Interaction between ingested feed and the digestive system in poultry. Journal of Applied Poultry Research, 5, 86–95.
- Beker A., Vanhooser S.L., Swartzlander J.H., Teeter R.G. (2004). Atmospheric ammonia concentration effects on broiler growth and performance. Journal of Applied Poultry Research, 13, 5–9.
- Berg C. (2004). Pododermatitis and hock burn in broiler chickens. In: Weeks C.A., Butterworth A. (eds.). Measuring and Auditing Broiler Welfare. Wallingford, UK: CABI Publishing.
- Berg C., Algers B. (2004). Using welfare outcomes to control intensification: The Swedish model. In: Weeks C.A., Butterworth A. (eds.). Measuring and Auditing Broiler Welfare. Wallingford, UK: CABI Publishing.
- Bessei W. (2018). Impact of animal welfare on worldwide poultry production. World’s Poultry Science Journal, 74 (2), 211–224. DOI: 10.1017/S0043933918000028
- Brambell R. (1965). Report of the Technical Committee to Enquire Into the Welfare of Animals Kept Under Intensive Livestock Husbandry Systems. London, UK: Her Majesty’s Stationery Office.
- Brink M., Janssens G.P.J., Delezie E. (2022). Does feeding more phases reduce ammonia concentrations from broiler litter? Animal Nutrition, 12 (11), 152–159. DOI: 10.1016/j.aninu.2022.06.020
- Bruce D.W., Mcilroy S.G., Goodall E.A. (1990). Epidemiology of a contact-dermatitis of broilers. Avian Pathol, 19, 523–537.
- Bullis K.L., Snoeyenbos G.H., van Roekel H. (1950). A keratoconjunctivitis in chickens. Poultry Science, 29, 386–389.
- Bustamante-Marin X.M., Ostrowski L.E. (2017). Cilia and mucociliary clearance. Cold Spring Harb Perspect Biol., 9 (4), a028241. DOI: 10.1101/cshperspect.a028241
- Cabuk M., Alcicek A., Bozkurt M., Akkan S. (2004). Effect of Yucca schidigera and natural zeolite on broiler performance. International Journal of Poultry Science, 3, 651–654. DOI: 10.3923/ijps.2004.651.654S
- Caveny D.D., Quarles C.L., Greathouse G.A. (1981). Atmospheric ammonia and broiler cockerel performance. Poultry Science, 60, 513–516.
- Çavuşoğlu E., Petek M., Abdourhamane I.M., Akkoc A., Topal E. (2018). Effects of different floor housing systems on the welfare of fast-growing broilers with an extended fattening period. Archives Animal Breeding, 61, 9–16. DOI: 10.5194/aab-61-9-2018
- Chen L., Cai T., Zhao C. [et al.] (2022). Atmospheric ammonia causes histopathological lesions, cell cycle blockage, and apoptosis of spleen in chickens. Canadian Journal of Animal Science, 102 (3), 448–456. DOI: 10.1139/cjas–2021-0084
- Coetzee C.B. (2005). The Development of Water Quality Guidelines for Poultry in Southern Africa. PhD Thesis. Animal and Wildlife Sciences. University of Pretoria, South Africa.
- Collett S.R. (2012). Nutrition and wet litter problems in poultry. Animal Feed Science and Technology, 173 (1–2), 65–75. DOI: 10.1016/j.anifeedsci.2011.12.013
- Costa A. (2017). Ammonia concentrations and emissions from finishing pigs reared in different growing rooms. Journal of Environmental Quality, 46 (2), 255–260. DOI: 10.2134/jeq2016.04.0134
- Danbury T.C., Weeks C.A., Chambers J.P., Kestin S.C. (2000). Self-selection of the analgesic drug carprofen by lame broiler chickens. The Veterinary Record, 146, 307–311.
- Davis M.J. (2020). How to control foot-pad dermatitis in broiler flocks. WATTPoultry International, November, 26–28.
- Dawkins M.S. (2016). Animal welfare and efficient farming: Is conflict inevitable? Animal Production Science, 57. DOI: 10.1071/AN15383
- Dawkins M.S., Donnelly C.A., Jones T.A. (2004). Chicken welfare is influenced more by housing conditions than by stocking density. Nature, 427 (6972), 342–344. DOI: 10.1038/nature02226
- De Jong I.C., Gunnink H., van Harn J. (2014). Wet litter not only induces footpad dermatitis but also reduces overall welfare, technical performance, and carcass yield in broiler chickens. Journal of Applied Poultry Research, 23 (1), 51–58. DOI: 10.3382/japr.2013-00803
- De Jong I.C., van Harn J., Gunnink H., Hindle V.A., Lourens A. (2012). Footpad dermatitis in Dutch broiler flocks: Prevalence and factors of influence. Poultry Science, 91, 1569–1574. DOI: 10.3382/ps.2012-02156
- Dimski D.S. (1994). Ammonia metabolism and the urea cycle: Function and clinical implications. Journal of Veterinary Internal Medicine, 8, 73–78. DOI: 10.1111/j.1939-1676.1994.tb03201.x
- Dinev I., Denev S., Vashin I., Kanakov D., Rusenova N. (2019). Pathomorphological investigations on the prevalence of contact dermatitis lesions in broiler chickens. Journal of Applied Animal Research, 47, 129–134. DOI: 10.1080/09712119.2019.1584105
- Emous R.A., Winkel A., Aarnink A.J.A. (2019). Effects of dietary crude protein levels on ammonia emission, litter and manure composition, N losses, and water intake in broiler breeders. Poultry Science, 98 (12), 6618–6625. DOI: 10.3382/ps/pez508
- Gamm U.A., Huang B.K., Mis E.K., Khokha M.K., Choma M.A. (2017). Visualization and quantification of injury to the ciliated epithelium using quantitative flow imaging and speckle variance optical coherence tomography. Scientific Reports, 7, 15115. DOI: 10.1038/s41598-017-14670-9
- García-González M.C., Del Mar Delgado M. (2007). Characteristics of broiler litter using different types of materials. International Symposium on Air Quality and Waste Management for Agriculture. DOI: 10.13031/2013.23910
- Gates R.S., Xin H., Casey K.D., Liang Y., Wheeler E.F. (2005). Method for measuring ammonia emissions from poultry houses. Journal of Applied Poultry Research, 14 (3), 622–634. DOI: 10.1093/japr/14.3.622
- Goldstein D., Skadhauge E. (2000). Renal and Extrarenal Regulation of Body Fluid Composition. DOI: 10.1016/B978-012747605-6/50012-2
- Greene J.A., McCracken R.M., Evans R.T. (1985). A contact dermatitis of broilers – clinical and pathological findings. Avian Pathology, 14, 23–38.
- Gržinić G., Piotrowicz-Cieślak A., Klimkowicz-Pawlas A. [et al.] (2023). Intensive poultry farming: A review of the impact on the environment and human health. The Science of the Total Environment, 858 (3), 160014. DOI: 10.1016/j.scitotenv.2022.160014
- Güz B.C. (2022). Healthy Bones for Broiler Chickens. Wageningen University. DOI: 10.18174/553659
- Haslam S.M., Knowles T.G., Brown S.N. [et al.] (2007). Factors affecting the prevalence of foot pad dermatitis, hock burn and breast burn in broiler chicken. British Poultry Science, 48, 264–275. DOI: 10.1080/00071660701371341
- Hepworth P.J., Nefedov A.V., Muchnik I.B., Morgan K.L. (2011). Hock burn: An indicator of broiler flock health. The Veterinary Record, 168 (11), 303–303. DOI: 10.1136/vr.c6897
- Hester P.Y. (1994). The role of environment and management on leg abnormalities in meat type fowl. Poultry Science, 73, 904–915.
- Hocking. P.M., Wu K. (2013). Traditional and commercial turkeys show similar susceptibility to footpad dermatitis and behavioural evidence of pain. British Poultry Science, 54, 281–288. DOI: 10.1080/00071668.2013.781265
- Hoer F.J. (2003). Mycotoxicoses. In: Saif Y.M. (eds.). Diseases of Poultry. Ames, Iowa: Iowa State University Press.
- Jarudi N.I., Golden B. (1973). Ammonia eye injuries. Journal of the Iowa Medical Society, 63 (6), 260–263.
- Jones T.A., Donnelly C., Dawkins M.S. (2005). Environmental and management factors affecting the welfare of chickens on commercial farms in the United Kingdom and Denmark stocked at different densities. Poultry Science, 84 (8), 1155–1165. DOI: 10.1093/ps/84.8.1155
- Kristensen H.H., Wathes C.M. (2000). Ammonia and poultry welfare: A review. World’s Poultry Science Journal, 56 (3), 235–245. DOI: 10.1079/WPS20000018
- Kyvsgaard N.C., Jensen H.B., Ambrosen T., Toft N. (2013). Temporal changes and risk factors for foot-pad dermatitis in Danish broilers. Poultry Science, 92 (1), 26–32. DOI: 10.3382/ps.2012–02433
- Leeson S., Summers J.D. (2005). Commercial Poultry Nutrition. University Books.
- Liu Q.X., Zhou Y., Li X.M. [et al.] (2020). Ammonia induce lung tissue injury in broilers by activating NLRP3 inflammasome via Escherichia/Shigella. Poultry Science, 99 (7), 3402–3410. DOI: 10.1016/j.psj.2020.03.019
- Liu Z., Wang L., Beasley D. [et al.] (2006). Effect of litter moisture content on ammonia emissions from broiler operations. In: Workshop on Agricultural Air Quality. Washington, USA.
- Martland M.F. (1985). Ulcerative dermatitis dm broiler chickens: The effects of wet litter. Avian Pathol, 14 (3), 353–364. DOI: 10.1080/03079458508436237
- Mayne R.K. (2005). A review of the aetiology and possible causative factors of foot pad dermatitis in growing turkeys and broilers. World’s Poultry Science Journal, 61, 256–267. DOI: 10.1079/WPS200458
- McCluggage D. (1997). Avian Medicine and Surgery. 1st ed. Saunders.
- McCubbin D.R., Apelberg B.J., Roe S., Divita F. (2002). Livestock ammonia management and particulate-related health benefits. Environmental Science and Technology, 36 (6), 1141–1146. DOI: 10.1021/es010705g
- Meluzzi A., Sirri F. (2009). Welfare of broiler chicken. Italian Journal of Animal Science, 8, 161–173.
- Meseret S. (2016). A review of poultry welfare in conventional production system. Livestock Research for Rural Development, 28 (12), 234. Available at: http://www.lrrd.org/lrrd28/12/mese28234.html
- Miles D.M., Miller W.W., Branton S.L., Maslin W.R., Lott B.D. (2006). Ocular responses to ammonia in broiler chickens. Avian Diseases, 50 (1), 45–49. DOI: 10.1637/7386-052405R.1
- Mottet A., Tempio G. (2017). Global poultry production: Current state and future outlook and challenges. World’s Poultry Science Journal, 73 (2), 245–256. DOI: 10.1017/S0043933917000071
- Moura D.J., Nääs I.A., Pereira D.F., Silva R.B.T.R., Camargo G.A. (2006). Animal welfare concepts and strategy for poultry production: A review. Brazilian Journal of Poultry Science, 8 (3), 137–148. DOI: 10.1590/S1516-635X2006000300001
- Murphy T., Cargill C., Rutley D., Stott P. (2012). Pig-shed air polluted by α-haemolytic cocci and ammonia causes subclinical disease and production losses. The Veterinary Record, 171 (5), 123. DOI: 10.1136/vr.100413
- Nagaraj M., Wilson C.A.P, Saenmahayak B., Hess J.B., Bilgili S.F. (2007). Efficacy of a litter amendment to reduce pododermatitis in broiler chickens. Journal of Applied Poultry Research, 16, 255–261.
- Nagaraja K.V., Emery D.A., Jordan K.A., Newman J.A., Pomeroy B.S. (1983). Scanning electron microscopic studies of adverse effects of ammonia on tracheal tissues of turkeys. American Journal of Veterinary Research, 44, 1530–1536.
- Olanrewaju H.A., Thaxton J.P., Dozier W.A. [et al.] (2008). Interactive effects of ammonia and light intensity on hematochemical variables in broiler chickens. Poultry Science, 87 (7), 1407–1414. DOI: 10.3382/ps.2007-00486
- Platt S., Buda S., Budras K.D. (2001). The influence of Biotin on foot pad lesions in turkey poults. In: Proceedings 8th Symposium: Vitamine und Zusatzstoffe in der Ernahrung von Mensch und Tier. Germany.
- Sacranie A., Paul I., Mikkelsen L., Mingan C. (2007). Occurrence of reverse peristalsis in broiler chickens. Australian Poultry Science Symposium, 19, 161–164.
- Sainsbury D. (2000). Poultry Health and Management: Chickens, Ducks, Turkeys, Geese, Quail. 4th ed. London: Blackwell Science Ltd.
- Schefferle H.E. (1965). The decomposition of uric acid in built up poultry litter. Journal of Applied Bacteriology, 28 (3), 412–420. DOI: 10.1111/j.1365-2672.1965.tb02171.x
- Schneider A.F. et al. (2017). Zeólitas naturais na dieta de frangos de corte. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 69 (1), 191–197. DOI: 10.1590/1678-4162-8717
- Schneider A.F., Zimmermann O.F., Gewehr C.E. (2017). Zeolites in poultry and swine production. Ciência Rural, 47, 1–8. DOI: 10.1590/0103-8478cr20160344
- Seedorf J. (2013). Impact of atmospheric ammonia on livestock animals – a mini-review. Berliner und Münchener tierärztliche Wochenschrift, 126, 96–103. DOI: 10.2376/0005-9366-126-96
- Shah S.B., Grimes J.L., Oviedo-Rondón E.O., Westerman P.W. (2014). Acidifier application rate impacts on ammonia emissions from US roaster chicken houses. Atmospheric Environment, 92, 576–583. DOI: 10.1016/j.atmosenv.2013.01.044
- Shepherd E.M., Fairchild B.D. (2010). Footpad dermatitis in poultry. Poultry Science, 89 (10), 2043–2051. DOI: 10.3382/ps.2010-00770
- Smith J.H., Wathes C.M., Baldwin B.A. (1996). The preference of pigs for fresh air over ammoniated air. Applied Animal Behaviour Science, 49, 417–424. DOI: 10.1016/0168-1591(96)01048-9
- Stoute S.T., Bickford A.A., Walker R.L., Charlton B.R. (2009). Mycotic pododermatitis and mycotic pneumonia in commercial turkey poults in northern California. Journal of Veterinary Diagnostic Investigation, 21 (4), 554–557. DOI: 10.1177/104063870902100424
- Such N., Pál L., Strifler P., Horváth B. et al. (2021). Effect of feeding low protein diets on the production traits and the nitrogen composition of excreta of broiler chickens. Agriculture, 11 (8), 781. DOI: 10.3390/agriculture11080781
- Swelum A.A., El-Saadony M.T., Abd El-Hack M.E. et al. (2021). Ammonia emissions in poultry houses and microbial nitrification as a promising reduction strategy. Science of the Total Environment, 781, 146978. DOI: 10.1016/j.scitotenv.2021.146978
- Taira K., Nagai T., Obi T., Takase K. (2014). Effect of litter moisture on the development of footpad dermatitis in broiler chickens. Journal of Veterinary Medical Science, 76 (4), 583–586. DOI: 10.1292/jvms.13-0321
- Van Emous R.A., van Krimpen M.M. (2019). Effects of nutritional interventions on feathering of poultry – a review. In: Olukosi O.A. [et al.]. Poultry Feathers and Skin: The Poultry Integument in Health and Welfare. DOI: 10.1079/9781786395115.0133
- Vieira A.M.C., Leandro R.A., Demétrio C.G.B., Molenberghs G. (2011). Double generalized linear model for tissue culture proportion data: A Bayesian perspective. Journal of Applied Statistics, 38, 1717–1731.
- Vilela M.d.O., Gates R.S., Souza C.D.F., Teles Junior C.G.d.S., Sousa F.C. (2020). Nitrogen transformation stages into ammonia in broiler production: Sources, deposition, transformation and emission to environment. DYNA, 87, 221–228. DOI: 10.15446/dyna.v87n214.83318
- Walter V. (2022). Towards a comparative study of animal consciousness. Biological Theory, 17 (12). DOI: 10.1007/s13752-022-00409-x
- Wang G., Liu Q., Zhou Y., Feng J., Zhang M. (2022). Effects of different ammonia concentrations on pulmonary microbial flora, lung tissue mucosal morphology, inflammatory cytokines, and neurotransmitters of broilers. Animals, 12 (3), 261. DOI: 10.3390/ani12030261
- Wang H., Zhang Y., Qi H. [et al.] (2020). The inflammatory injury of heart caused by ammonia is realized by oxidative stress and abnormal energy metabolism activating inflammatory pathway. Science of The Total Environment, 742. 140532. DOI: 10.1016/j.scitotenv.2020.140532
- Wang Y.M., Meng Q.P., Guo Y.M. [et al.] (2010). Effect of atmospheric ammonia on growth performance and immunological response of broiler chickens. Journal of Animal and Veterinary Advances, 9 (22), 2802–2806. DOI: 10.3923/javaa.2010.2802.2806
- Weber Wyneken C.W., Sinclair A., Veldkamp T., Vinco L.J., Hocking P.M. (2015). Footpad dermatitis and pain assessment in turkey poults using analgesia and objective gait analysis. British Poultry Science, 56, 522–530. DOI: 10.1080/00071668.2015.1077203
- Wei F.X., Hu X.F., Xu B. [et al.] (2015). Ammonia concentration and relative humidity in poultry houses affect the immune response of broilers. Genetics and Molecular Research, 14 (2), 31603169. DOI: 10.4238/2015.April.10.27
- Wu Y.N., Yan F.F., Hu J.Y. [et al.] (2017). The effect of chronic ammonia exposure on acute-phase proteins, immunoglobulin, and cytokines in laying hens. Poultry Science, 96, 1524–1530.
- Xiong Y., Tang X.F., Meng Q.S., Zhang H.F. (2016). Differential expression analysis of the broiler tracheal proteins responsible for the immune response and muscle contraction induced by high concentration of ammonia using iTRAQ-coupled 2D LC-MS/MS. Science China. Life Sciences, 59, 1166–1176.
- Zhou Y., Liu Q.X., Li X.M. [et al.] (2020). Effects of ammonia exposure on growth performance and cytokines in the serum, trachea, and ileum of broilers. Poultry Science, 99 (5), 2485–2493. DOI: 10.1016/j.psj.2019.12.063
- Zhou Y., Zhang M., Liu Q., Feng J. (2021). The alterations of tracheal microbiota and inflammation caused by different levels of ammonia exposure in broiler chickens. Poultry Science, 100 (2), 685–696. DOI: 10.1016/j.psj.2020.11.026
- Zhou Y., Zhang M., Zhao X., Feng J. (2021). Ammonia exposure induced intestinal inflammation injury mediated by intestinal microbiota in broiler chickens via TLR4/TNF-α signaling pathway. Ecotoxicology and Environmental Safety, 226, 112832. DOI: 10.1016/j.ecoenv.2021.112832


